6.5 : Variations périodiques des propriétés des éléments
- Page ID
- 193931
- Décrire et expliquer les tendances observées en termes de taille atomique, d'énergie d'ionisation et d'affinité électronique des éléments
Les éléments des groupes (colonnes verticales) du tableau périodique présentent un comportement chimique similaire. Cette similitude se produit parce que les membres d'un groupe ont le même nombre et la même distribution d'électrons dans leurs couches de valence. Cependant, il existe également d'autres modèles de propriétés chimiques sur le tableau périodique. Par exemple, lorsque nous descendons dans un groupe, le caractère métallique des atomes augmente. L'oxygène, au sommet du groupe 16 (6A), est un gaz incolore ; au milieu du groupe, le sélénium est un solide semi-conducteur ; et, vers le bas, le polonium est un solide gris argenté qui conduit l'électricité.
Au fur et à mesure que nous parcourons une période de gauche à droite, nous ajoutons un proton au noyau et un électron à la couche de valence avec chaque élément successif. Lorsque nous descendons les éléments d'un groupe, le nombre d'électrons dans la couche de valence reste constant, mais le nombre quantique principal augmente d'un à chaque fois. La compréhension de la structure électronique des éléments nous permet d'examiner certaines des propriétés qui régissent leur comportement chimique. Ces propriétés varient périodiquement à mesure que la structure électronique des éléments change. Ce sont (1) la taille (rayon) des atomes et des ions, (2) les énergies d'ionisation et (3) les affinités électroniques.
Variation du rayon covalent
Le tableau de la mécanique quantique rend difficile l'établissement de la taille précise d'un atome. Cependant, il existe plusieurs manières pratiques de définir le rayon des atomes et, par conséquent, de déterminer leurs tailles relatives qui donnent des valeurs à peu près similaires. Nous utiliserons le rayon de covalence (Figure\(\PageIndex{1}\)), qui est défini comme la moitié de la distance entre les noyaux de deux atomes identiques lorsqu'ils sont joints par une liaison covalente (cette mesure est possible car les atomes contenus dans les molécules conservent encore une grande partie de leur identité atomique).
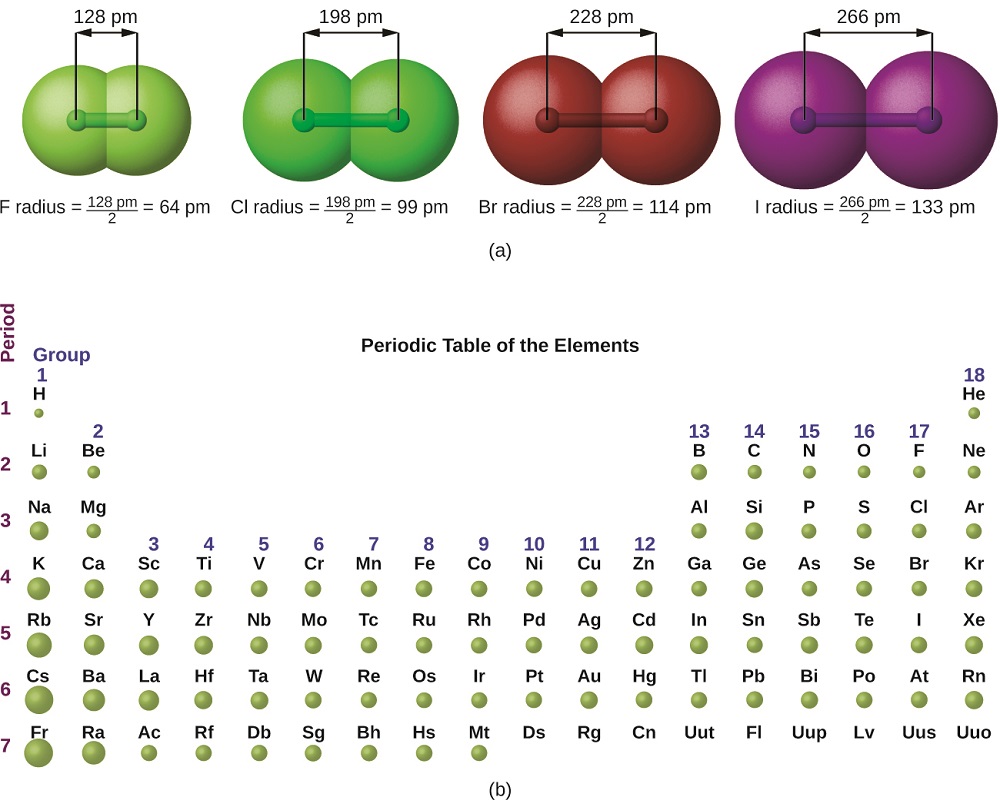
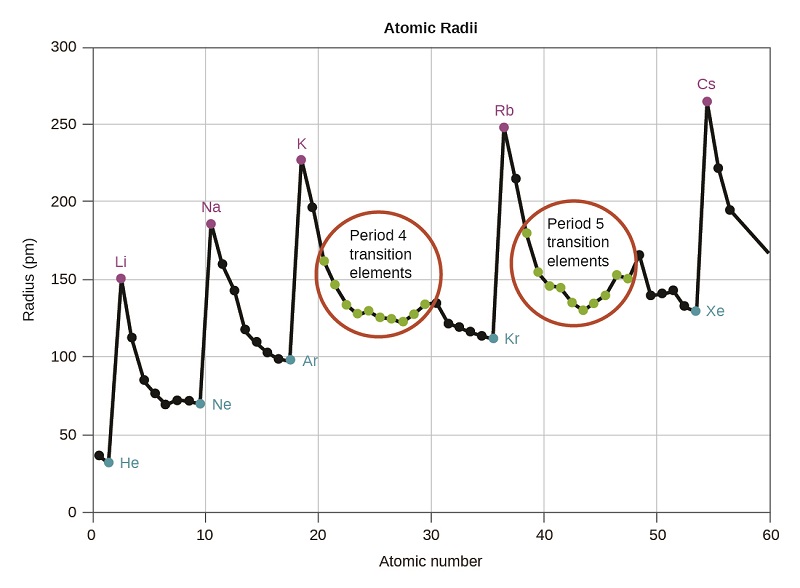
Nous savons que lorsque nous parcourons un groupe, le nombre quantique principal, n, augmente d'un pour chaque élément. Ainsi, les électrons sont ajoutés à une région de l'espace de plus en plus éloignée du noyau. Par conséquent, la taille de l'atome (et son rayon de covalence) doit augmenter à mesure que l'on augmente la distance entre les électrons les plus extérieurs et le noyau. Cette tendance est illustrée pour les rayons de covalence des halogènes dans le tableau\(\PageIndex{1}\) et la figure\(\PageIndex{1}\). Les tendances pour l'ensemble du tableau périodique peuvent être vues sur la figure\(\PageIndex{2}\).
| Atome | Rayon de covalence (pm) | Charge nucléaire |
|---|---|---|
| F | 64 | +9 |
| Cl | 99 | +17 |
| Bar | 114 | +35 |
| JE | 133 | +53 |
| À | 148 | +85 |
Comme le montre la figure\(\PageIndex{2}\), lorsque nous nous déplaçons sur une période de gauche à droite, nous constatons généralement que chaque élément a un rayon de covalence plus petit que celui de l'élément qui le précède. Cela peut sembler contre-intuitif car cela implique que les atomes contenant plus d'électrons ont un rayon atomique plus petit. Cela peut s'expliquer par le concept de charge nucléaire efficace,\(Z_{eff}\). Il s'agit de l'attraction exercée sur un électron spécifique par le noyau, en tenant compte de toute répulsion électron—électron. Pour l'hydrogène, il n'y a qu'un seul électron, donc la charge nucléaire (Z) et la charge nucléaire effective (Z eff) sont égales. Pour tous les autres atomes, les électrons internes protègent partiellement les électrons extérieurs de l'attraction du noyau, et donc :
\[Z_\ce{eff}=Z−shielding \nonumber \]
Le blindage est déterminé par la probabilité qu'un autre électron se trouve entre l'électron d'intérêt et le noyau, ainsi que par les répulsions électron—électron que rencontre l'électron d'intérêt. Les électrons du noyau sont habiles à se protéger, tandis que les électrons de la même couche de valence ne bloquent pas l'attraction nucléaire subie les uns par les autres de manière aussi efficace. Ainsi, chaque fois que nous passons d'un élément à l'autre au cours d'une période, Z augmente d'un, mais le blindage n'augmente que légèrement. Ainsi, Z eff augmente lorsque nous nous déplaçons de gauche à droite au cours d'une période. La plus forte attraction (charge nucléaire effective plus élevée) subie par les électrons du côté droit du tableau périodique les rapproche du noyau, réduisant ainsi les rayons covalents.
Ainsi, comme on peut s'y attendre, les électrons les plus externes ou de valence sont les plus faciles à éliminer parce qu'ils ont les énergies les plus élevées, sont mieux protégés et sont les plus éloignés du noyau. En règle générale, lorsque les éléments représentatifs forment des cations, ils le font par la perte des électrons ns ou np ajoutés en dernier lors du processus d'Aufbau. Les éléments de transition, quant à eux, perdent les électrons ns avant de commencer à perdre les électrons (n — 1) d, même si les électrons ns sont ajoutés en premier, selon le principe d'Aufbau.
Prédisez l'ordre d'augmentation du rayon de covalence pour Ge, Fl, Br, Kr.
Solution
Le rayon augmente à mesure que nous descendons dans un groupe, donc Ge < Fl (Remarque : Fl est le symbole du flérovium, de l'élément 114, PAS du fluor). Le rayon diminue à mesure que nous nous déplaçons sur une période, donc Kr < Br < Ge. En regroupant les tendances, nous obtenons Kr < Br < Ge < Fl.
Donnez l'exemple d'un atome dont la taille est inférieure à celle du fluor.
- Réponse
-
Nouveau ou Lui
Variation des rayons ioniques
Le rayon ionique est la mesure utilisée pour décrire la taille d'un ion. Un cation possède toujours moins d'électrons et le même nombre de protons que l'atome parent ; il est plus petit que l'atome dont il est dérivé (Figure\(\PageIndex{3}\)). Par exemple, le rayon de covalence d'un atome d'aluminium (1 s 2, 2, s 2, 2, p 6, 3, s 2, 3, p 1) est de 11,8 pm, alors que le rayon ionique d'un Al 3 + (1 s) 2 (2 s 2, p 6) est 18 h 8. Au fur et à mesure que les électrons sont retirés de la couche de valence externe, les électrons du noyau restants occupant des couches plus petites subissent une charge nucléaire effective Z eff plus importante (comme indiqué) et sont attirés encore plus près du noyau.

Les cations ayant des charges plus importantes sont plus petits que les cations ayant des charges plus faibles (par exemple, le V 2+ a un rayon ionique de 79 pm, tandis que celui du V 3+ est de 64 pm). En descendant les groupes du tableau périodique, nous constatons que les cations d'éléments successifs ayant la même charge ont généralement des rayons plus grands, ce qui correspond à une augmentation du nombre quantique principal, n.
Un anion (ion négatif) est formé par l'ajout d'un ou de plusieurs électrons à la couche de valence d'un atome. Il en résulte une plus grande répulsion entre les électrons et une diminution du nombre\(Z_{eff}\) par électron. Les deux effets (l'augmentation du nombre d'électrons et la diminution de Z eff) font que le rayon d'un anion est plus grand que celui de l'atome parent (Figure\(\PageIndex{3}\)). Par exemple, un atome de soufre ([Ne] 3 s 2 3 p 4) a un rayon covalent de 104pm, alors que le rayon ionique de l'anion sulfure ([Ne] 3 s 2 3 p 6) est de 170pm. Pour les éléments consécutifs qui descendent dans n'importe quel groupe, les anions ont des nombres quantiques principaux plus élevés et, par conséquent, des rayons plus grands.
Les atomes et les ions qui ont la même configuration électronique sont dits isoélectroniques. Des exemples d'espèces isoélectroniques sont N 3—, O 2—, F —, Ne, Na +, Mg 2 + et Al 3 + (1 s 2 2 s 2 2 p 6). Une autre série isoélectronique est P 3—, S 2—, Cl —, Ar, K +, Ca 2 + et Sc 3 + ([Ne] 3 s 2 3 p 6). Pour les atomes ou les ions isoélectroniques, le nombre de protons détermine la taille. Plus la charge nucléaire est importante, plus le rayon d'une série d'ions et d'atomes isoélectroniques est petit.
Variation des énergies d'ionisation
La quantité d'énergie requise pour éliminer l'électron le plus faiblement lié d'un atome gazeux à l'état fondamental est appelée énergie de première ionisation (IE 1). La première énergie d'ionisation pour un élément, X, est l'énergie requise pour former un cation avec +1 charge :
\[\ce{X}(g)⟶\ce{X+}(g)+\ce{e-}\hspace{20px}\ce{IE_1} \nonumber \]
L'énergie requise pour éliminer le deuxième électron le plus faiblement lié est appelée deuxième énergie d'ionisation (IE 2).
\[\ce{X+}(g)⟶\ce{X^2+}(g)+\ce{e-}\hspace{20px}\ce{IE_2} \nonumber \]
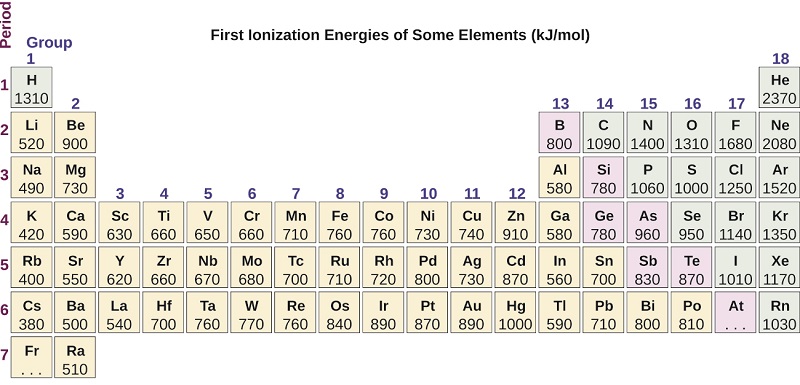
L'énergie requise pour éliminer le troisième électron est la troisième énergie d'ionisation, et ainsi de suite. L'énergie est toujours nécessaire pour éliminer les électrons des atomes ou des ions. Les processus d'ionisation sont donc endothermiques et les valeurs IE sont toujours positives. Pour les gros atomes, l'électron le plus faiblement lié est situé plus loin du noyau et est donc plus facile à éliminer. Ainsi, à mesure que la taille (rayon atomique) augmente, l'énergie d'ionisation devrait diminuer. En reliant cette logique à ce que nous venons d'apprendre sur les rayons, nous pouvons nous attendre à ce que les énergies de première ionisation diminuent dans un groupe et augmentent au fil d'une période.
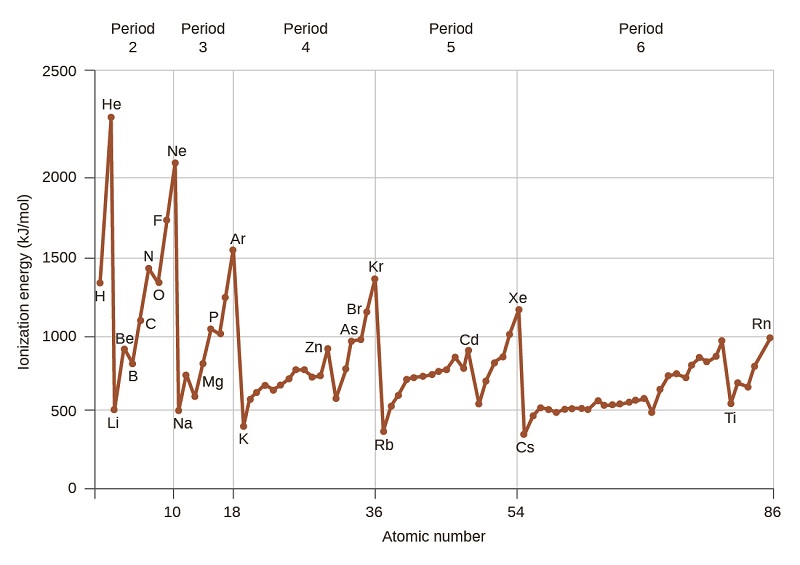
La\(\PageIndex{4}\) figure montre la relation entre la première énergie d'ionisation et le numéro atomique de plusieurs éléments. Au cours d'une période, les valeurs de l'énergie de première ionisation des éléments (IE 1) augmentent généralement avec l'augmentation de Z. Dans un groupe, la valeur IE 1 diminue généralement avec l'augmentation de Z. Il existe toutefois des écarts systématiques par rapport à cette tendance. Notez que l'énergie d'ionisation du bore (numéro atomique 5) est inférieure à celle du béryllium (numéro atomique 4) même si la charge nucléaire du bore est supérieure d'un proton. Cela s'explique par le fait que l'énergie des sous-couches augmente à mesure que l augmente, en raison de la pénétration et du blindage (comme indiqué précédemment dans ce chapitre). Dans n'importe quelle couche, les électrons s ont une énergie inférieure à celle des électrons p. Cela signifie qu'un électron s est plus difficile à retirer d'un atome qu'un électron p dans la même couche. L'électron retiré lors de l'ionisation du béryllium ([He] 2 s 2) est un électron s, tandis que l'électron retiré lors de l'ionisation du bore ([He] 2 s 2 2 p 1) est un électron p ; il en résulte un énergie de première ionisation plus faible pour le bore, même si sa charge nucléaire est supérieure d'un proton. Ainsi, nous constatons qu'un léger écart par rapport à la tendance prévue se produit chaque fois qu'un nouveau sous-shell commence.
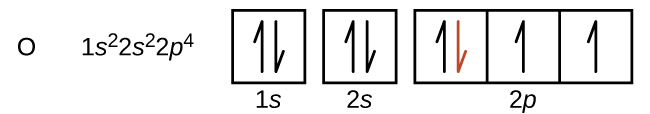
Un autre écart se produit lorsque les orbitales sont remplies à plus de la moitié. La première énergie d'ionisation de l'oxygène est légèrement inférieure à celle de l'azote, malgré la tendance à la hausse des valeurs d'IE 1 sur une période donnée. En examinant le diagramme orbital de l'oxygène, nous pouvons voir que l'élimination d'un électron éliminera la répulsion électron—électron provoquée par l'appariement des électrons sur l'orbitale 2p et aboutira à une orbitale à moitié remplie (ce qui est favorable sur le plan énergétique). Des changements analogues se produisent au cours des périodes suivantes (notez la baisse du soufre après le phosphore sur la Figure\(\PageIndex{4}\).
Il est plus difficile de retirer un électron d'un cation que de retirer un électron d'un atome neutre en raison de la plus grande attraction électrostatique exercée sur le cation. De même, il est plus difficile de retirer un électron d'un cation ayant une charge positive plus élevée que d'éliminer un électron d'un ion de charge plus faible. Ainsi, les énergies d'ionisation successives d'un élément augmentent toujours. Comme le montre le tableau\(\PageIndex{2}\), il y a une forte augmentation des énergies d'ionisation (changement de couleur) pour chaque élément. Ce saut correspond à l'élimination des électrons du noyau, qui sont plus difficiles à éliminer que les électrons de valence. Par exemple, Sc et Ga possèdent tous deux trois électrons de valence, de sorte que l'augmentation rapide de l'énergie d'ionisation se produit après la troisième ionisation.
| Elément | IE 1 | IE 2 | IE 3 | IE 4 | IE 5 | IE 6 | IE 7 |
|---|---|---|---|---|---|---|---|
| K | 418,8 | 3051,8 | 4419,6 | 5876,9 | 79 75,5 | 9590,6 | 11343 |
| Californie | 589,8 | 1145,4 | 4912,4 | 6490,6 | 8153,0 | 10495,7 | 12 27 2,9 |
| SC | 633,1 | 1235,0 | 2388,7 | 7090,6 | 8842,9 | 10 679,0 | 13315,0 |
| Ga | 578,8 | 1979,4 | 296 4,6 | 6180 | 8298,7 | 10873,9 | 135 94,8 |
| Ge | 762,2 | 1537,5 | 3302,1 | 4410,6 | 9021,4 | Non disponible | Non disponible |
| Comme | 944,5 | 1793,6 | 2735,5 | 4836,8 | 6042,9 | 12311,5 | Non disponible |
Prédisez l'ordre d'augmentation de l'énergie pour les processus suivants : IE 1 pour Al, IE 1 pour Tl, IE 2 pour Na, IE 3 pour Al.
Solution
Il est plus facile de retirer l'électron 6 p 1 de Tl que de retirer l'électron 3 p 1 de Al car l'orbitale n la plus élevée est plus éloignée du noyau, donc IE 1 (Tl) < IE 1 (Al). Ionisation du troisième électron de
\[\ce{Al}\hspace{20px}\ce{(Al^2+⟶Al^3+ + e- )} \nonumber \]
nécessite plus d'énergie car le cation Al 2 + exerce une plus forte attraction sur l'électron que l'atome d'Al neutre, donc IE 1 (Al) < IE 3 (Al). La deuxième énergie d'ionisation du sodium élimine un électron central, ce qui représente un processus énergétique beaucoup plus élevé que l'élimination des électrons de valence. En rassemblant tout cela, nous obtenons :
IE 1 (Tl) < IE 1 (Al) < IE 3 (Al) < IE 2 (Na).
Lequel a la valeur la plus faible pour IE 1 : O, Po, Pb ou Ba ?
- Réponse
-
Ba
Variation des affinités électroniques
L'affinité électronique [EA] est le changement d'énergie dû au processus d'ajout d'un électron à un atome gazeux pour former un anion (ion négatif).
\[\ce{X}(g)+\ce{e-}⟶\ce{X-}(g)\hspace{20px}\ce{EA_1} \nonumber \]
Ce processus peut être endothermique ou exothermique, selon l'élément. L'évaluation environnementale de certains éléments est présentée dans la figure\(\PageIndex{6}\). Vous pouvez voir que bon nombre de ces éléments ont des valeurs négatives d'EA, ce qui signifie que de l'énergie est libérée lorsque l'atome gazeux accepte un électron. Cependant, pour certains éléments, de l'énergie est nécessaire pour que l'atome se charge négativement et la valeur de leur EA est positive. Tout comme pour l'énergie d'ionisation, les valeurs EA ultérieures sont associées à la formation d'ions plus chargés. Le second EA est l'énergie associée à l'ajout d'un électron à un anion pour former un ion -2, et ainsi de suite.

Comme on peut le prévoir, il devient plus facile d'ajouter un électron à travers une série d'atomes à mesure que la charge nucléaire effective des atomes augmente. Nous constatons qu'à mesure que nous allons de gauche à droite au cours d'une période, les évaluations environnementales ont tendance à devenir plus négatives. Les exceptions constatées parmi les éléments du groupe 2 (2A), du groupe 15 (5A) et du groupe 18 (8A) peuvent être comprises sur la base de la structure électronique de ces groupes. Les gaz rares, groupe 18 (8A), ont une enveloppe complètement remplie et l'électron entrant doit être ajouté à un niveau de n plus élevé, ce qui est plus difficile à faire. Le groupe 2 (2A) possède une sous-couche ns remplie, de sorte que le prochain électron ajouté entre dans l'énergie p la plus élevée, donc, encore une fois, la valeur EA observée n'est pas celle que la tendance prédirait. Enfin, le groupe 15 (5A) possède une sous-couche np à moitié remplie et l'électron suivant doit être apparié à un électron np existant. Dans tous ces cas, la stabilité relative initiale de la configuration électronique perturbe la tendance de l'EA.
On peut également s'attendre à ce que l'atome situé au sommet de chaque groupe ait la plus grande EA ; leurs premiers potentiels d'ionisation suggèrent que ces atomes possèdent les charges nucléaires effectives les plus importantes. Cependant, au fur et à mesure que nous descendons d'un groupe, nous constatons que le deuxième élément du groupe possède le plus souvent l'évaluation environnementale la plus importante. La réduction de l'EA du premier membre peut être attribuée à la petite taille de la couche n = 2 et aux grandes répulsions électrons—électrons qui en résultent. Par exemple, le chlore, dont la valeur EA est de —348 kJ/mol, a la valeur la plus élevée de tous les éléments du tableau périodique. L'EA du fluor est de —322 kJ/mol. Lorsque nous ajoutons un électron à un atome de fluor pour former un anion fluorure (F —), nous ajoutons un électron à la couche n = 2. L'électron est attiré par le noyau, mais il y a également une répulsion importante provenant des autres électrons déjà présents dans cette petite couche de valence. L'atome de chlore a la même configuration électronique dans la couche de valence, mais comme l'électron entrant entre dans la couche n = 3, il occupe une région spatiale considérablement plus grande et les répulsions électron—électron sont réduites. L'électron entrant ne subit pas autant de répulsion et l'atome de chlore accepte plus facilement un électron supplémentaire.
Les propriétés abordées dans cette section (taille des atomes et des ions, charge nucléaire effective, énergies d'ionisation et affinités électroniques) sont essentielles à la compréhension de la réactivité chimique. Par exemple, comme le fluor possède un EA énergétiquement favorable et une grande barrière énergétique à l'ionisation (IE), il est beaucoup plus facile de former des anions fluorés que des cations. Les propriétés métalliques, y compris la conductivité et la malléabilité (capacité à se transformer en plaques), dépendent de la facilité avec laquelle les électrons peuvent être retirés. Ainsi, le caractère métallique augmente à mesure que nous descendons dans un groupe et diminue au cours d'une période selon la même tendance observée pour la taille atomique, car il est plus facile de retirer un électron plus éloigné du noyau.
Résumé
Les configurations électroniques nous permettent de comprendre de nombreuses tendances périodiques. Le rayon de covalence augmente à mesure que nous descendons dans un groupe parce que le niveau n (taille de l'orbite) augmente. Le rayon de covalence diminue principalement lorsque nous nous déplaçons de gauche à droite sur une période donnée, car la charge nucléaire effective subie par les électrons augmente et les électrons sont attirés plus étroitement vers le noyau. Les rayons anioniques sont plus grands que l'atome parent, tandis que les rayons cationiques sont plus petits, car le nombre d'électrons de valence a changé alors que la charge nucléaire est restée constante. L'énergie d'ionisation (l'énergie associée à la formation d'un cation) diminue vers le bas d'un groupe et augmente principalement au cours d'une période donnée, car il est plus facile de retirer un électron d'une orbitale plus grande et plus énergétique. L'affinité électronique (énergie associée à la formation d'un anion) est plus favorable (exothermique) lorsque les électrons sont placés sur des orbitales de faible énergie, plus près du noyau. Par conséquent, l'affinité électronique devient de plus en plus négative lorsque nous nous déplaçons de gauche à droite dans le tableau périodique et diminue lorsque nous descendons dans un groupe. Pour les données relatives à l'IE et à l'affinité électronique, il existe des exceptions aux tendances relatives aux sous-couches complètement ou à moitié remplies.
Lexique
- rayon de covalence
- la moitié de la distance entre les noyaux de deux atomes identiques lorsqu'ils sont reliés par une liaison covalente
- charge nucléaire efficace
- charge qui entraîne la force de Coulomb exercée par le noyau sur un électron, calculée comme la charge nucléaire moins le blindage
- affinité électronique
- énergie requise pour ajouter un électron à un atome gazeux afin de former un anion
- énergie d'ionisation
- énergie nécessaire pour retirer un électron d'un atome ou d'un ion gazeux. Le nombre associé (par exemple, deuxième énergie d'ionisation) correspond à la charge de l'ion produit (X 2+)
- isoélectronique
- groupe d'ions ou d'atomes ayant des configurations électroniques identiques


