6.4 : Structure électronique des atomes (configurations électroniques)
- Page ID
- 193929
- Déterminer les configurations électroniques des atomes à l'état fondamental prédites
- Identifier et expliquer les exceptions aux configurations électroniques prévues pour les atomes et les ions
- Associer les configurations électroniques aux classifications des éléments dans le tableau périodique
Après avoir introduit les bases de la structure atomique et de la mécanique quantique, nous pouvons utiliser notre compréhension des nombres quantiques pour déterminer comment les orbitales atomiques sont liées les unes aux autres. Cela nous permet de déterminer quelles orbitales sont occupées par les électrons dans chaque atome. La disposition spécifique des électrons dans les orbitales d'un atome détermine de nombreuses propriétés chimiques de cet atome.
Energies orbitales et structure atomique
L'énergie des orbitales atomiques augmente à mesure que le nombre quantique principal augmente.\(n\) Dans tout atome contenant deux électrons ou plus, la répulsion entre les électrons fait\(l\) varier les énergies des sous-couches ayant des valeurs différentes, de sorte que l'énergie des orbitales augmente au sein d'une couche dans l'ordre s < p < d < f. Figure \(\PageIndex{1}\)décrit la relation entre ces deux tendances en matière d'augmentation de l'énergie. L'orbitale de 1 s au bas du diagramme est celle où les électrons ont la plus faible énergie. L'énergie augmente à mesure que nous nous dirigeons vers les orbitales 2 s, puis 2 p, 3 s et 3 p, ce qui montre que la valeur n croissante a plus d'influence sur l'énergie que la valeur l croissante pour les petits atomes. Toutefois, ce schéma ne vaut pas pour les gros atomes. L'orbitale 3d est plus énergétique que l'orbitale 4s. De tels chevauchements continuent de se produire fréquemment à mesure que nous montons dans le graphique.

Les électrons des atomes successifs du tableau périodique ont tendance à remplir les orbitales de basse énergie en premier. Ainsi, de nombreux étudiants trouvent confus que, par exemple, les orbitales 5 p se remplissent immédiatement après les 4 jours et immédiatement avant les 6 s. L'ordre de remplissage est basé sur les résultats expérimentaux observés et a été confirmé par des calculs théoriques. À mesure que le nombre quantique principal, n, augmente, la taille de l'orbite augmente et les électrons passent plus de temps à s'éloigner du noyau. Ainsi, l'attraction pour le noyau est plus faible et l'énergie associée à l'orbite est plus élevée (moins stabilisée). Mais ce n'est pas le seul effet que nous devons prendre en compte. À l'intérieur de chaque couche, à mesure que la valeur de l augmente, les électrons sont moins pénétrants (ce qui signifie qu'il y a moins de densité électronique à proximité du noyau), dans l'ordre s > p > d > f. Les électrons les plus proches du noyau repoussent légèrement les électrons les plus éloignés, compensant ainsi légèrement l'attraction la plus dominante entre les électrons et le noyau (rappelons que tous les électrons ont des charges -1, mais que les noyaux ont des charges + Z). Ce phénomène est appelé blindage et sera discuté plus en détail dans la section suivante. Les électrons des orbites qui sont plus blindées sont moins stabilisés et donc plus énergétiques. Pour les petites orbitales (1 s à 3 p), l'augmentation de l'énergie due à n est plus significative que l'augmentation due à l ; toutefois, pour les orbitales plus grandes, les deux tendances sont comparables et ne peuvent pas être simplement prédites. Nous discuterons des méthodes pour mémoriser l'ordre observé.
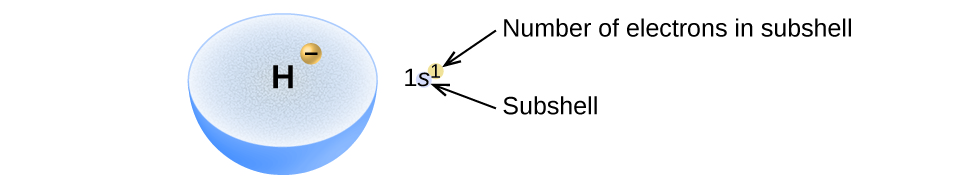
La disposition des électrons dans les orbitales d'un atome est appelée configuration électronique de l'atome. Nous décrivons une configuration électronique avec un symbole qui contient trois informations (Figure\(\PageIndex{2}\)) :
- Le numéro de la couche quantique principale, n,
- La lettre qui désigne le type d'orbite (la sous-coque, l), et
- Un numéro en exposant qui désigne le nombre d'électrons dans cette sous-couche particulière.
Par exemple, la notation 2 p 4 (lire « deux—p—quatre ») indique quatre électrons dans une sous-couche p (l = 1) avec un nombre quantique principal (n) de 2. La notation 3 d 8 (lire « trois—d—huit ») indique huit électrons dans la sous-couche d (c'est-à-dire, l = 2) de la couche principale pour laquelle n = 3.
Le principe d'Aufbau
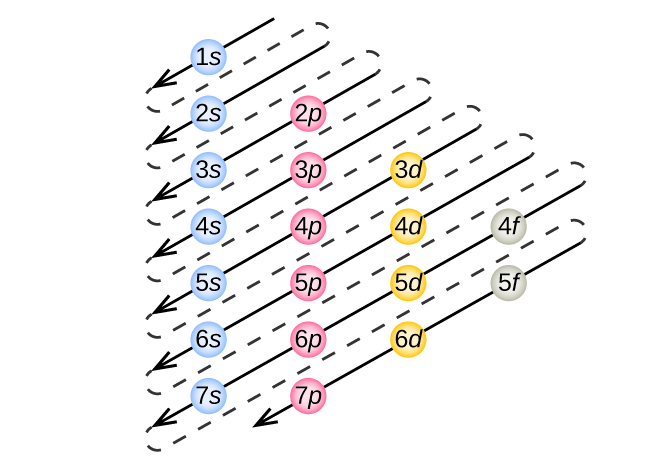
Pour déterminer la configuration électronique d'un atome en particulier, nous pouvons « construire » les structures dans l'ordre des numéros atomiques. En commençant par l'hydrogène et en poursuivant les périodes du tableau périodique, nous ajoutons un proton à la fois au noyau et un électron à la sous-couche appropriée jusqu'à ce que nous ayons décrit les configurations électroniques de tous les éléments. Cette procédure s'appelle le principe d'Aufbau, du mot allemand Aufbau (« construire »). Chaque électron ajouté occupe la sous-couche de la plus faible énergie disponible (dans l'ordre indiqué sur la figure\(\PageIndex{3}\)), sous réserve des limites imposées par les nombres quantiques autorisés selon le principe d'exclusion de Pauli. Les électrons ne pénètrent dans les sous-couches de haute énergie qu'une fois que les sous-couches de faible énergie ont été remplies à pleine capacité. La figure\(\PageIndex{3}\) illustre la méthode traditionnelle de mémorisation de l'ordre de remplissage pour les orbitales atomiques.
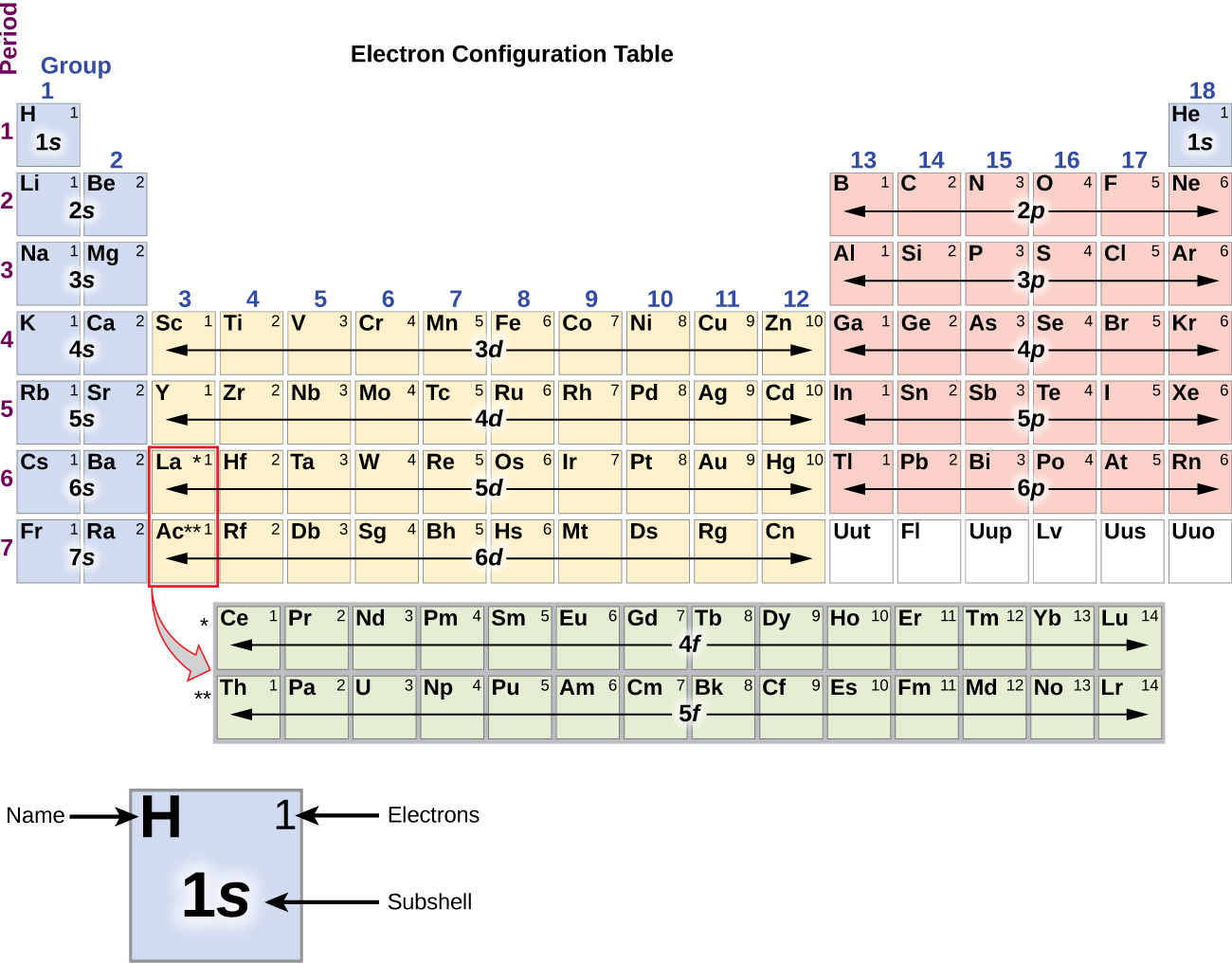
Puisque la disposition du tableau périodique est basée sur les configurations électroniques, la figure\(\PageIndex{4}\) fournit une méthode alternative pour déterminer la configuration électronique. L'ordre de remplissage commence simplement à l'hydrogène et inclut chaque sous-coque au fur et à mesure que vous passez à l'ordre Z croissant. Par exemple, après avoir rempli le bloc 3 p jusqu'à Ar, nous voyons que l'orbitale sera de 4 s (K, Ca), suivie des orbitales 3 d.
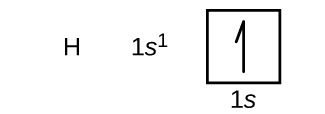
Nous allons maintenant construire la configuration électronique de l'état fondamental et le diagramme orbital pour une sélection d'atomes dans les première et deuxième périodes du tableau périodique. Les diagrammes orbitaux sont des représentations picturales de la configuration des électrons, montrant les orbitales individuelles et l'arrangement d'appariement des électrons. Nous commençons avec un seul atome d'hydrogène (numéro atomique 1), composé d'un proton et d'un électron. En nous référant à la figure\(\PageIndex{3}\) 2\(\PageIndex{4}\), nous nous attendons à trouver l'électron sur l'orbitale de 1 s. Par convention, la\(m_s=+\dfrac{1}{2}\) valeur est généralement remplie en premier. La configuration électronique et le diagramme orbital sont les suivants :
Après l'hydrogène se trouve l'hélium, un gaz rare, dont le numéro atomique est 2. L'atome d'hélium contient deux protons et deux électrons. Le premier électron possède les mêmes quatre nombres quantiques que l'électron de l'atome d'hydrogène (n = 1, l = 0, m l = 0,\(m_s=+\dfrac{1}{2}\)). Le deuxième électron entre également dans l'orbitale 1 s et remplit cette orbitale. Le deuxième électron possède les mêmes nombres quantiques n, l et m l, mais doit avoir le nombre quantique de spin opposé,\(m_s=−\dfrac{1}{2}\). Cela est conforme au principe d'exclusion de Pauli : deux électrons d'un même atome ne peuvent pas avoir le même ensemble de quatre nombres quantiques. Pour les diagrammes orbitaux, cela signifie que deux flèches apparaissent dans chaque case (représentant deux électrons sur chaque orbitale) et que les flèches doivent pointer dans des directions opposées (représentant des spins appariés). La configuration électronique et le diagramme orbital de l'hélium sont les suivants :
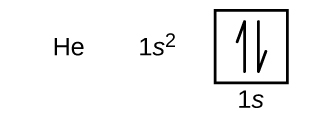
La coque n = 1 est complètement remplie d'un atome d'hélium.
L'atome suivant est le lithium, métal alcalin, dont le numéro atomique est 3. Les deux premiers électrons du lithium remplissent l'orbitale des 1 s et possèdent les mêmes ensembles de quatre nombres quantiques que les deux électrons de l'hélium. L'électron restant doit occuper l'orbitale de l'énergie la plus faible suivante, l'orbitale 2 s (Figure\(\PageIndex{3}\) ou\(\PageIndex{4}\)). Ainsi, la configuration électronique et le diagramme orbital du lithium sont les suivants :
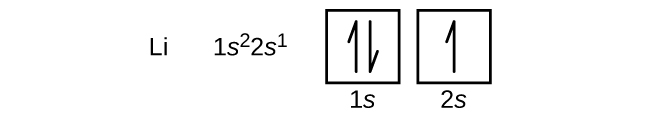
Un atome de béryllium, un métal alcalino-terreux, dont le numéro atomique est 4, contient quatre protons dans le noyau et quatre électrons entourant le noyau. Le quatrième électron remplit l'espace restant sur l'orbitale de 2 s.
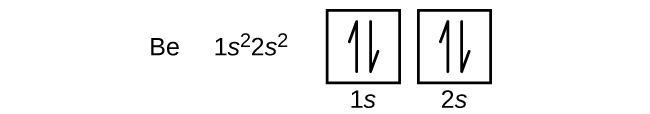
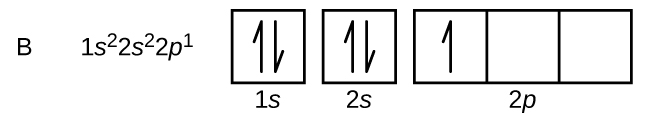
Un atome de bore (numéro atomique 5) contient cinq électrons. La couche n = 1 est remplie de deux électrons et trois électrons occuperont la couche n = 2. Comme toute sous-couche s ne peut contenir que deux électrons, le cinquième électron doit occuper le niveau d'énergie suivant, qui sera une orbitale de 2 p. Il existe trois orbitales 2 p dégénérées (m l = -1, 0, +1) et l'électron peut occuper n'importe laquelle de ces orbitales p. Lorsque nous dessinons des diagrammes orbitaux, nous incluons des cases vides pour représenter toutes les orbitales vides dans la même sous-couche que celle que nous remplissons.
Le carbone (numéro atomique 6) possède six électrons. Quatre d'entre elles remplissent les orbitales de 1 s et 2 s. Les deux électrons restants occupent la sous-couche 2p. Nous avons maintenant le choix de remplir l'une des 2 orbitales p et d'apparier les électrons ou de laisser les électrons non appariés sur deux orbitales p différentes mais dégénérées. Les orbitales sont remplies comme le décrit la règle de Hund : la configuration énergétique la plus faible pour un atome dont les électrons se situent au sein d'un ensemble d'orbitales dégénérées est celle qui possède le maximum d'électrons non appariés. Ainsi, les deux électrons des orbitales du carbone 2 p ont des nombres quantiques n, l et m s identiques et diffèrent quant à leur nombre quantique m l (conformément au principe d'exclusion de Pauli). La configuration électronique et le diagramme orbital du carbone sont les suivants :
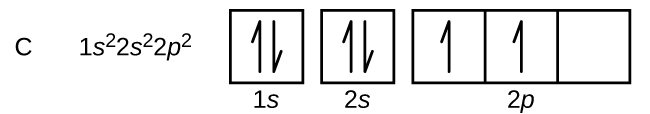
L'azote (numéro atomique 7) remplit les sous-couches 1 s et 2 s et possède un électron dans chacune des trois orbitales 2 p, conformément à la règle de Hund. Ces trois électrons ont des spins non appariés. L'oxygène (numéro atomique 8) possède une paire d'électrons sur l'une des 2 orbitales p (les électrons ont des spins opposés) et un seul électron dans chacune des deux autres. Le fluor (numéro atomique 9) n'a qu'une seule orbitale 2 p contenant un électron non apparié. Tous les électrons du néon de gaz rare (numéro atomique 10) sont appariés, et toutes les orbitales des couches n = 1 et n = 2 sont remplies. Les configurations électroniques et les diagrammes orbitaux de ces quatre éléments sont les suivants :
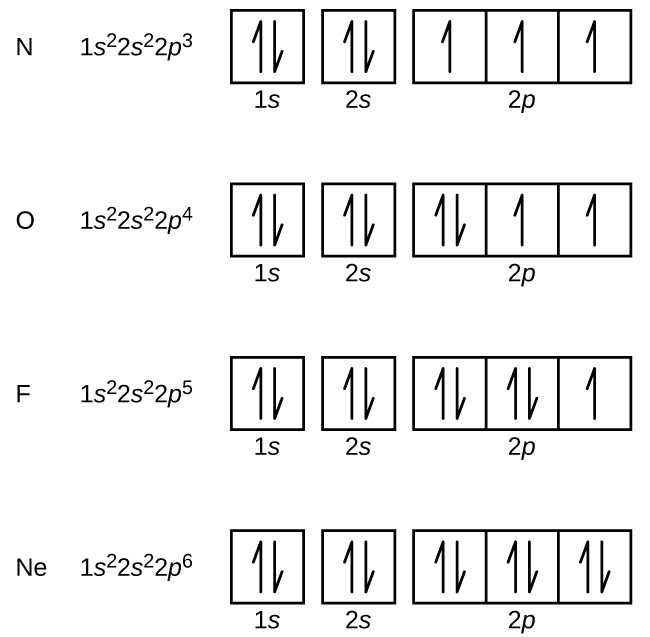
Le sodium, métal alcalin (numéro atomique 11), possède un électron de plus que l'atome de néon. Cet électron doit entrer dans la sous-couche d'énergie la plus faible disponible, l'orbitale 3 s, ce qui donne a 1 s 2 2 2 2 p 6 3 s 1 configuration. Les électrons qui occupent les orbitales de la coque la plus externe (valeur la plus élevée de n) sont appelés électrons de valence, et ceux qui occupent les orbitales de la coque intérieure sont appelés électrons du noyau (Figure \ PageIndex5 \ PageIndex5). Puisque les couches électroniques du noyau correspondent aux configurations électroniques des gaz rares, nous pouvons abréger les configurations électroniques en écrivant le gaz noble qui correspond à la configuration électronique du noyau, ainsi que les électrons de valence dans un format condensé. Pour notre exemple de sodium, le symbole [Ne] représente les électrons du noyau (1 s 2 2 s 2 2 p 6) et notre configuration abrégée ou condensée est [Ne] 3 s 1 .

De même, la configuration abrégée du lithium peut être représentée par [He] 2 s 1, où [He] représente la configuration de l'atome d'hélium, qui est identique à celle de la coque interne remplie de lithium. L'écriture des configurations de cette manière met en évidence la similitude des configurations du lithium et du sodium. Les deux atomes, qui appartiennent à la famille des métaux alcalins, n'ont qu'un seul électron dans une sous-couche de valence s à l'extérieur d'un ensemble rempli de couches internes.
\[\ce{Li:[He]}\,2s^1\\ \ce{Na:[Ne]}\,3s^1 \nonumber \]
Le magnésium, métal alcalino-terreux (numéro atomique 12), avec ses 12 électrons dans une configuration [Ne] 3 s 2, est analogue au béryllium, un membre de la famille, [He] 2 s 2. Les deux atomes ont une sous-couche s remplie à l'extérieur de leur enveloppe intérieure remplie. L'aluminium (numéro atomique 13), avec 13 électrons et la configuration électronique [Ne] 3 s 2 3 p 1, est analogue au bore, membre de sa famille, [He] 2 s 2 2 p 1.
Les configurations électroniques du silicium (14 électrons), du phosphore (15 électrons), du soufre (16 électrons), du chlore (17 électrons) et de l'argon (18 électrons) sont analogues dans les configurations électroniques de leurs enveloppes extérieures à celles des membres de leur famille correspondants, le carbone, l'azote, l'oxygène, le fluor et le néon, respectivement, sauf que le nombre quantique principal de l'enveloppe extérieure des éléments les plus lourds a augmenté de un pour atteindre n = 3. La figure\(\PageIndex{6}\) montre la configuration électronique la plus faible en énergie, ou état fondamental, pour ces éléments ainsi que celle des atomes de chacun des éléments connus.
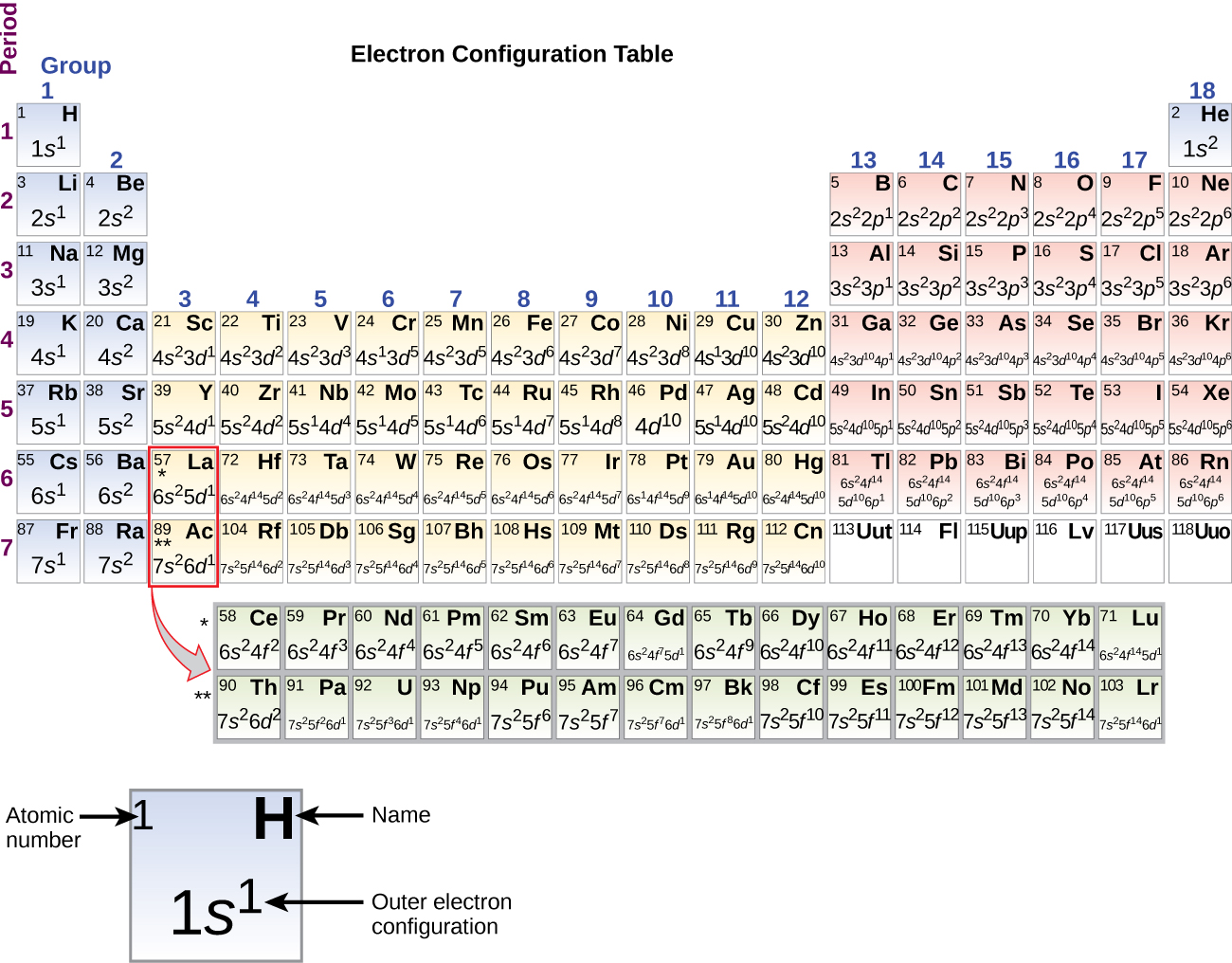
Lorsque nous en viendrons à l'élément suivant du tableau périodique, le potassium, un métal alcalin (numéro atomique 19), nous pouvons nous attendre à commencer à ajouter des électrons à la sous-couche 3D. Cependant, toutes les preuves chimiques et physiques disponibles indiquent que le potassium est comme le lithium et le sodium, et que l'électron suivant n'est pas ajouté au niveau 3 d mais est ajouté au niveau 4 s (Figure\(\PageIndex{3}\) or\(\PageIndex{4}\)). Comme indiqué précédemment, l'orbitale 3D sans nœuds radiaux est plus énergétique parce qu'elle est moins pénétrante et plus protégée du noyau que l'orbitale 4 s, qui possède trois nœuds radiaux. Ainsi, le potassium a une configuration électronique de [Ar] 4 s 1. Le potassium correspond donc au Li et au Na dans sa configuration de couche de valence. L'électron suivant est ajouté pour compléter la sous-couche de 4 s et le calcium a une configuration électronique de [Ar] 4 s 2. Cela donne au calcium une configuration électronique de la couche externe correspondant à celle du béryllium et du magnésium.
En commençant par le scandium, un métal de transition (numéro atomique 21), des électrons supplémentaires sont ajoutés successivement à la sous-couche 3D. Cette sous-couche est remplie à sa capacité de 10 électrons (rappelez-vous que pour l = 2 [d orbitales], il y a 2 l + 1 = 5 valeurs de m l, ce qui signifie qu'il existe cinq orbitales d qui ont une capacité combinée de 10 électrons). Le sous-shell 4 p se remplit ensuite. Notez que pour trois séries d'éléments, le scandium (Sc) en passant par le cuivre (Cu), l'yttrium (Y) en passant par l'argent (Ag) et le lutétium (Lu) en passant par l'or (Au), un total de 10 électrons d sont ajoutés successivement à la couche (n — 1) à côté de la couche n pour obtenir que (n — 1) ) enveloppe de 8 à 18 électrons. Pour deux séries, du lanthane (La) au lutécium (Lu) et de l'actinium (Ac) à travers le lawrencium (Lr), 14 électrons f (l = 3, 2 l + 1 = 7 m l ; ainsi, sept orbitales d'une capacité combinée de 14 électrons) sont ajoutés successivement au ( n — 2) coque pour faire passer cette couche de 18 électrons à un total de 32 électrons.
Quels sont la configuration électronique et le diagramme orbital d'un atome de phosphore ? Quels sont les quatre nombres quantiques du dernier électron ajouté ?
Solution
Le numéro atomique du phosphore est 15. Ainsi, un atome de phosphore contient 15 électrons. L'ordre de remplissage des niveaux d'énergie est de 1 s, 2 s, 2 p, 3 s, 3 p, 4 s,. Les 15 électrons de l'atome de phosphore se rempliront jusqu'à l'orbite 3 p, qui contiendra trois électrons :
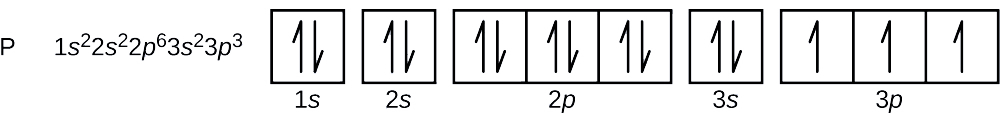
Le dernier électron ajouté est un électron 3 p. Par conséquent, n = 3 et, pour une orbitale de type p, l = 1. La valeur m l peut être —1, 0 ou +1. Les trois orbitales p étant dégénérées, chacune de ces valeurs m l est correcte. Pour les électrons non appariés, la convention attribue la valeur de\(+\dfrac{1}{2}\) for the spin quantum number; thus, \(m_s=+\dfrac{1}{2}\).
Identify the atoms from the electron configurations given:
- [Ar]4s23d5
- [Kr]5s24d105p6
- Answer a
-
Mn
- Answer b
-
Xe
The periodic table can be a powerful tool in predicting the electron configuration of an element. However, we do find exceptions to the order of filling of orbitals that are shown in Figure \(\PageIndex{3}\) or \(\PageIndex{4}\). For instance, the electron configurations of the transition metals chromium (Cr; atomic number 24) and copper (Cu; atomic number 29), among others, are not those we would expect. In general, such exceptions involve subshells with very similar energy, and small effects can lead to changes in the order of filling.
In the case of Cr and Cu, we find that half-filled and completely filled subshells apparently represent conditions of preferred stability. This stability is such that an electron shifts from the 4s into the 3d orbital to gain the extra stability of a half-filled 3d subshell (in Cr) or a filled 3d subshell (in Cu). Other exceptions also occur. For example, niobium (Nb, atomic number 41) is predicted to have the electron configuration [Kr]5s24d3. Experimentally, we observe that its ground-state electron configuration is actually [Kr]5s14d4. We can rationalize this observation by saying that the electron–electron repulsions experienced by pairing the electrons in the 5s orbital are larger than the gap in energy between the 5s and 4d orbitals. There is no simple method to predict the exceptions for atoms where the magnitude of the repulsions between electrons is greater than the small differences in energy between subshells.
Electron Configurations and the Periodic Table
As described earlier, the periodic table arranges atoms based on increasing atomic number so that elements with the same chemical properties recur periodically. When their electron configurations are added to the table (Figure \(\PageIndex{6}\)), we also see a periodic recurrence of similar electron configurations in the outer shells of these elements. Because they are in the outer shells of an atom, valence electrons play the most important role in chemical reactions. The outer electrons have the highest energy of the electrons in an atom and are more easily lost or shared than the core electrons. Valence electrons are also the determining factor in some physical properties of the elements.
Elements in any one group (or column) have the same number of valence electrons; the alkali metals lithium and sodium each have only one valence electron, the alkaline earth metals beryllium and magnesium each have two, and the halogens fluorine and chlorine each have seven valence electrons. The similarity in chemical properties among elements of the same group occurs because they have the same number of valence electrons. It is the loss, gain, or sharing of valence electrons that defines how elements react.
It is important to remember that the periodic table was developed on the basis of the chemical behavior of the elements, well before any idea of their atomic structure was available. Now we can understand why the periodic table has the arrangement it has—the arrangement puts elements whose atoms have the same number of valence electrons in the same group. This arrangement is emphasized in Figure \(\PageIndex{6}\), which shows in periodic-table form the electron configuration of the last subshell to be filled by the Aufbau principle. The colored sections of Figure \(\PageIndex{6}\) show the three categories of elements classified by the orbitals being filled: main group, transition, and inner transition elements. These classifications determine which orbitals are counted in the valence shell, or highest energy level orbitals of an atom.
- Main group elements (sometimes called representative elements) are those in which the last electron added enters an s or a p orbital in the outermost shell, shown in blue and red in Figure \(\PageIndex{6}\). This category includes all the nonmetallic elements, as well as many metals and the intermediate semimetallic elements. The valence electrons for main group elements are those with the highest n level. For example, gallium (Ga, atomic number 31) has the electron configuration [Ar]4s23d104p1, which contains three valence electrons (underlined). The completely filled d orbitals count as core, not valence, electrons.
- Transition elements or transition metals. These are metallic elements in which the last electron added enters a d orbital. The valence electrons (those added after the last noble gas configuration) in these elements include the ns and (n – 1) d electrons. The official IUPAC definition of transition elements specifies those with partially filled d orbitals. Thus, the elements with completely filled orbitals (Zn, Cd, Hg, as well as Cu, Ag, and Au in Figure \(\PageIndex{6}\)) are not technically transition elements. However, the term is frequently used to refer to the entire d block (colored yellow in Figure \(\PageIndex{6}\)), and we will adopt this usage in this textbook.
- Inner transition elements are metallic elements in which the last electron added occupies an f orbital. They are shown in green in Figure \(\PageIndex{6}\). The valence shells of the inner transition elements consist of the (n – 2)f, the (n – 1)d, and the ns subshells. There are two inner transition series:
- The lanthanide series: lanthanide (La) through lutetium (Lu)
- The actinide series: actinide (Ac) through lawrencium (Lr)
Lanthanum and actinium, because of their similarities to the other members of the series, are included and used to name the series, even though they are transition metals with no f electrons.
Electron Configurations of Ions
We have seen that ions are formed when atoms gain or lose electrons. A cation (positively charged ion) forms when one or more electrons are removed from a parent atom. For main group elements, the electrons that were added last are the first electrons removed. For transition metals and inner transition metals, however, electrons in the s orbital are easier to remove than the d or f electrons, and so the highest ns electrons are lost, and then the (n – 1)d or (n – 2)f electrons are removed. An anion (negatively charged ion) forms when one or more electrons are added to a parent atom. The added electrons fill in the order predicted by the Aufbau principle.
What is the electron configuration and orbital diagram of:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
Solution
First, write out the electron configuration for each parent atom. We have chosen to show the full, unabbreviated configurations to provide more practice for students who want it, but listing the core-abbreviated electron configurations is also acceptable.
Next, determine whether an electron is gained or lost. Remember electrons are negatively charged, so ions with a positive charge have lost an electron. For main group elements, the last orbital gains or loses the electron. For transition metals, the last s orbital loses an electron before the d orbitals.
- Na: 1s22s22p63s1. Sodium cation loses one electron, so Na+: 1s22s22p63s1 = Na+: 1s22s22p6.
- P: 1s22s22p63s23p3. Phosphorus trianion gains three electrons, so P3−: 1s22s22p63s23p6.
- Al: 1s22s22p63s23p1. Aluminum dication loses two electrons Al2+: 1s22s22p63s23p1 = Al2+: 1s22s22p63s1.
- Fe: 1s22s22p63s23p64s23d6. Iron(II) loses two electrons and, since it is a transition metal, they are removed from the 4s orbital Fe2+: 1s22s22p63s23p64s23d6 = 1s22s22p63s23p63d6.
- Sm: 1s22s22p63s23p64s23d104p65s24d105p66s24f6. Samarium trication loses three electrons. The first two will be lost from the 6s orbital, and the final one is removed from the 4f orbital. Sm3+: 1s22s22p63s23p64s23d104p65s24d105p66s24f6 = 1s22s22p63s23p64s23d104p65s24d105p64f5.
- Which ion with a +2 charge has the electron configuration 1s22s22p63s23p63d104s24p64d5?
- Which ion with a +3 charge has this configuration?
- Answer a
-
Tc2+
- Answer b
-
Ru3+
Summary
The relative energy of the subshells determine the order in which atomic orbitals are filled (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, and so on). Electron configurations and orbital diagrams can be determined by applying the Pauli exclusion principle (no two electrons can have the same set of four quantum numbers) and Hund’s rule (whenever possible, electrons retain unpaired spins in degenerate orbitals).
Electrons in the outermost orbitals, called valence electrons, are responsible for most of the chemical behavior of elements. In the periodic table, elements with analogous valence electron configurations usually occur within the same group. There are some exceptions to the predicted filling order, particularly when half-filled or completely filled orbitals can be formed. The periodic table can be divided into three categories based on the orbital in which the last electron to be added is placed: main group elements (s and p orbitals), transition elements (d orbitals), and inner transition elements (f orbitals).
Glossary
- Aufbau principle
- procedure in which the electron configuration of the elements is determined by “building” them in order of atomic numbers, adding one proton to the nucleus and one electron to the proper subshell at a time
- core electron
- electron in an atom that occupies the orbitals of the inner shells
- electron configuration
- electronic structure of an atom in its ground state given as a listing of the orbitals occupied by the electrons
- Hund’s rule
- every orbital in a subshell is singly occupied with one electron before any one orbital is doubly occupied, and all electrons in singly occupied orbitals have the same spin
- orbital diagram
- pictorial representation of the electron configuration showing each orbital as a box and each electron as an arrow
- valence electrons
- electrons in the outermost or valence shell (highest value of n) of a ground-state atom; determine how an element reacts
- valence shell
- outermost shell of electrons in a ground-state atom; for main group elements, the orbitals with the highest n level (s and p subshells) are in the valence shell, while for transition metals, the highest energy s and d subshells make up the valence shell and for inner transition elements, the highest s, d, and f subshells are included


