6.E : Structure électronique et propriétés périodiques (exercices)
- Page ID
- 193926
6.1 : Énergie électromagnétique
Q6.1.1
La lumière produite par un néon rouge est due à l'émission de lumière par des atomes de néon excités. Décrivez qualitativement le spectre produit en faisant passer la lumière d'une lampe au néon à travers un prisme.
S6.1.1
Le spectre est constitué de raies colorées, dont au moins une (probablement la plus brillante) est rouge.
Q6.1.2
Une station de radio FM située à 103,1 sur le cadran FM diffuse à une fréquence de 1,031 × 10 8 s −1 (103,1 MHz). Quelle est la longueur d'onde de ces ondes radio en mètres ?
ARTICLE 6.1.2
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{1.031 \times10^{8}\: \dfrac{1}{s}} = 2.908\:m\)
Q6.1.3
FM-95, une station de radio FM, diffuse à une fréquence de 9,51 × 10 7 s −1 (95,1 MHz). Quelle est la longueur d'onde de ces ondes radio en mètres ?
ARTICLE 6.1.3
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{9.51 \times10^{7}\: \dfrac{1}{s}} = 3.15 \:m\)
Q6.1.4
Une raie violette brillante apparaît à 435,8 nm dans le spectre d'émission de vapeur de mercure. Quelle quantité d'énergie, en joules, doit être libérée par un électron d'un atome de mercure pour produire un photon de cette lumière ?
ARTICLE 6.1.4
\(E= \dfrac{hc}{λ}\)
\(E= \dfrac{(2.998 \times 10^{8} \dfrac{m}{s})\: (6.6262 \times 10^{-34} Js)}{4.358 \times 10^{-7} m}\)
\(=4.56\times 10^{-19}J\)
Q6.1.5
La lumière d'une longueur d'onde de 614,5 nm semble orange. Quelle est l'énergie, en joules, par photon de cette lumière orange ? Quelle est l'énergie en eV (1 eV = 1,602 × 10 −19 J) ?
ARTICLE 6.1.5
1.) Convertissez d'abord 614,5 nm en mètres
\(6.145 nm\)=\(6.145 \times10^{-7} m\)
2.) Calculez ensuite la quantité d'énergie que contient cette longueur d'onde de lumière en utilisant les équations suivantes :
\(E = hν\)et\(ν=\dfrac{c}{λ}\) qui peut être manipulée algébriquement pour :\(E=\dfrac{hc}{λ}\)
- h = constante de Plancks →\(6.6262 \times10^{-34} Js\)
- c = Vitesse de la lumière →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = longueur d'onde du photon →\(6.145 \times10^{-7} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {6.145 \times 10^{−7}m \ } =3.233 \times 10^{-19} J\]
3.) Convertissez ensuite les joules en eV :
\[=(3.233 \times 10^{−19}J) \times\dfrac{1eV}{1.602\times 10^{-19}J} \]\[=2.018 eV\]
Les atomes de lithium chauffés émettent des photons de lumière d'une énergie de 2,961 × 10 −19 J. Calculez la fréquence et la longueur d'onde de l'un de ces photons. Quelle est l'énergie totale d'une mole de ces photons ? Quelle est la couleur de la lumière émise ?
S6.1.6
1.) \(E = hν\)et\(ν=\dfrac{E}{h}\)
- h = constante de Plancks →\(6.6262 \times10^{-34} Js\)
Fréquence :\(ν=\dfrac{ 2.961\times 10^{-19}J}{6.6262\times 10^{-34}Js}\ = 4.469\times 10^{14} Hz\)
2.) \(λ=\dfrac{c}{ν}\)
c = Vitesse de la lumière →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
Longueur d'onde :\(λ=\dfrac{ 2.998\times 10^{8}\dfrac {m}{s}}{4.469\times 10^{14}\dfrac {1}{s}}\ = 6.709\times 10^{-7} m\) = lumière rouge
Énergie totale :
\(E= \dfrac{2.961 \times 10^{-19}J}{1\: photon}\times\dfrac{6.022\times 10^{23}\: photons}{1\: mole} = 1.783\times 10^{5} J \)
Q6.1.7
Un photon de lumière produit par un laser chirurgical possède une énergie de 3,027 × 10 −19 J. Calculez la fréquence et la longueur d'onde du photon. Quelle est l'énergie totale d'une mole de photons ? Quelle est la couleur de la lumière émise ?
6.1.7
ν= 4,568 × 10 14 s ; λ = 656,3 nm ; énergie mol −1 = 1,823 × 10 5 J mol −1 ; rouge
Q6.1.8
Lorsque les ions rubidium sont chauffés à haute température, deux raies sont observées dans son spectre de raies aux longueurs d'onde (a) 7,9 × 10 −7 m et (b) 4,2 × 10 −7 m. Quelles sont les fréquences des deux raies ? Quelle couleur voyons-nous lorsque nous chauffons un composé de rubidium ?
Q6.1.9
Le spectre d'émission du césium contient deux raies dont les fréquences sont (a) 3,45 × 10 14 Hz et (b) 6,53 × 10 14 Hz. Quelles sont les longueurs d'onde et les énergies par photon des deux raies ? De quelle couleur sont les lignes ?
ARTICLE 6.1.9
(a) λ = 8,69 × 10 −7 m ; E = 2,29 × 10 −19 J ; (b) λ = 4,59 × 10 −7 m ; E = 4,33 × 10 −19 J ; La couleur de (a) est le rouge ; (b) est le bleu.
Q6.1.10
Les photons du rayonnement infrarouge sont responsables d'une grande partie de la chaleur que nous ressentons lorsque nous nous tenons les mains devant un incendie. Ces photons réchaufferont également d'autres objets. Combien de photons infrarouges d'une longueur d'onde de 1,5 × 10 −6 m doivent être absorbés par l'eau pour réchauffer une tasse d'eau (175 g) entre 25,0 °C et 40° C
S6.1.10
1.) Nous devons d'abord utiliser l'équation : Q=MCΔt ° pour calculer la quantité d'énergie en joules (J) pour chauffer 175 g de H 2 O, soit un total de 15 ° Celsius
- m = masse en grammes (g) → 175 g
- C = Chaleur spécifique de H 2 O (l) →\(\dfrac {4.184 J}{g°C}\)
- ΔT ° = Différence de température → 40 - 25 = 15°
\[q = 175g\times \dfrac {4.184 J}{g°C}\times 15° C\]
q= 11 000 J
2.) Nous devons maintenant calculer la quantité d'énergie en joules (J) que contient un photon d'une longueur d'onde de 1,5 x 10 -6 m. Nous utiliserons les équations suivantes :
\(E = hν\)et\(ν=\dfrac{c}{λ}\) qui peut être manipulée algébriquement pour :\(E=\dfrac{hc}{λ}\)
- h = constante de Plancks →\(6.6262 \times10^{-34} Js\)
- c = Vitesse de la lumière →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = longueur d'onde du photon →\(1.5 \times10^{-6} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {1.5 \times 10^{−6}m \ } =1.3 \times 10^{-19} J\]
Il s'agit de l'énergie d'un photon, donc maintenant nous devons voir combien de fois 1,3x10 -19 J correspond aux 11 000 J de notre premier calcul :
\[= \dfrac{11,000\;J} {1.3 \times 10^{−19}\; \dfrac {J}{photon} } =8.3\times 10^{22} photons\]
\[= 8.3\times 10^{22} photons\]
Q6.1.11
L'un des appareils de radiographie utilisés dans le cabinet du dentiste émet un rayon X d'une longueur d'onde de 2,090 × 10 −11 m. Quelles sont l'énergie, en joules, et la fréquence de ce rayon X ?
S6.1.11
E = 9,502 × 10 −15 J ; ν= 1,434 × 10 19 s −1
Q6.1.12
Les yeux de certains reptiles transmettent un signal visuel unique au cerveau lorsque les récepteurs visuels sont frappés par des photons d'une longueur d'onde de 850 nm. Si une énergie totale de 3,15 × 10 −14 J est requise pour déclencher le signal, quel est le nombre minimum de photons qui doivent frapper le récepteur ?
S6.1.12
1.) Nous devons d'abord convertir les nanomètres en mètres
850 nm = 8,5 x 10 -7 m
2. Calculez ensuite l'énergie en joules qu'un photon de cette longueur d'onde (λ) produit :
\[(E=\dfrac{hc}{λ}) = \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {8.5 \times 10^{−7}m \ } = 2.3 \times 10^{-19} \dfrac {J}{photon}\]
3.) Ensuite, nous devons savoir combien de ces photons il faudra pour envoyer le signal visuel au cerveau :
\[ \begin{align} &= \dfrac{3.15\times 10^{-14}\;\cancel{J}} {2.3 \times 10^{−19}\; \dfrac {\cancel{J}}{photon} } \\[5pt] &=1.3\times 10^{5}\, photons \end{align}\]
Q6.1.13
Les téléviseurs couleur RGB et les écrans d'ordinateur utilisent des tubes cathodiques qui produisent des couleurs en mélangeant des lumières rouge, verte et bleue. Si nous regardons l'écran avec une loupe, nous pouvons voir des points individuels s'allumer et s'éteindre à mesure que les couleurs changent. À l'aide d'un spectre de lumière visible, déterminez la longueur d'onde approximative de chacune de ces couleurs. Quelles sont la fréquence et l'énergie d'un photon de chacune de ces couleurs ?
S6.1.13
- Rouge : 660 nm ; 4,54 × 10 14 Hz ; 3,01 × 10 −19 J.
- Vert : 520 nm ; 5,77 × 10 14 Hz ; 3,82 × 10 −19 J.
- Bleu : 440 nm ; 6,81 × 10 14 Hz ; 4,51 × 10 −19 J.
Des nombres légèrement différents sont également possibles.
Q6.1.14
Répondez aux questions suivantes concernant un laser Blu-ray :
- Le laser d'un lecteur Blu-ray a une longueur d'onde de 405 nm. Dans quelle région du spectre électromagnétique se trouve ce rayonnement ? Quelle est sa fréquence ?
- Un laser Blu-ray a une puissance de 5 milliwatts (1 watt = 1 J s -1). Combien de photons de lumière sont produits par le laser en 1 heure ?
- La résolution idéale d'un lecteur utilisant un laser (tel qu'un lecteur Blu-ray), qui détermine la proximité des données pouvant être stockées sur un disque compact, est déterminée à l'aide de la formule suivante : Résolution = 0,60 (λ /NA), où λ est la longueur d'onde du laser et NA est le numérique ouverture. L'ouverture numérique est une mesure de la taille du point lumineux sur le disque ; plus le NA est grand, plus le point est petit. Dans un système Blu-ray classique, NA = 0,95. Si le laser 405 nm est utilisé dans un lecteur Blu-ray, quelle est la plus proche des informations pouvant être stockées sur un disque Blu-ray ?
- La densité de données d'un disque Blu-ray utilisant un laser 405 nm est de 1,5 × 10 7 bits mm -2. Les disques ont un diamètre extérieur de 120 mm et un trou de 15 mm de diamètre. Combien de bits de données peuvent être contenus sur le disque ? Si un disque Blu-ray peut contenir 9 400 000 pages de texte, combien de bits de données sont nécessaires pour une page saisie ? (Conseil : Déterminez la zone du disque qui est disponible pour contenir des données. L'aire à l'intérieur d'un cercle est donnée par A = πr 2, où le rayon r représente la moitié du diamètre.)
Q6.1.15
Quelle est la fréquence seuil pour le sodium métallique si un photon de fréquence 6,66 × 10 14 s −1 éjecte un photon avec une énergie cinétique de 7,74 × 10 −20 J ? L'effet photoélectrique sera-t-il observé si le sodium est exposé à une lumière orange ?
S6.1.15
5,49 × 10 14 s −1 ; non
6.2 : Le modèle de Bohr
Q6.2.1
Pourquoi l'électron d'un atome d'hydrogène de Bohr est-il moins étroitement lié lorsqu'il a un nombre quantique de 3 que lorsqu'il a un nombre quantique de 1 ?
Q6.2.2
Que signifie dire que l'énergie des électrons d'un atome est quantifiée ?
ARTICLE 6.2.2
L'énergie quantifiée signifie que les électrons ne peuvent posséder que certaines valeurs d'énergie discrètes ; les valeurs comprises entre ces valeurs quantifiées ne sont pas autorisées.
Q6.2.3
À l'aide du modèle de Bohr, déterminez l'énergie, en joules, nécessaire pour ioniser un atome d'hydrogène à l'état fondamental. Montrez vos calculs.
Q6.2.4
L'électronvolt (eV) est une unité d'énergie pratique pour exprimer les énergies à l'échelle atomique. C'est la quantité d'énergie qu'un électron gagne lorsqu'il est soumis à un potentiel de 1 volt ;\(1 \;eV = 1.602 \times 10^{-19}\; J\). À l'aide du modèle de Bohr, déterminez l'énergie, en électronvolts, du photon produit lorsqu'un électron d'un atome d'hydrogène se déplace de l'orbite avec\(n = 5\) à l'orbite avec\(n = 2\). Montrez vos calculs.
ARTICLE 6.2.4
\[E=E_2−E_5=2.179 \times 10^{−18} \left (\dfrac{1}{n_2^2}−\dfrac{1}{n^2_5}\right) \; J\]
\[ = 2.179 \times 10^{-18} \left (\dfrac{1}{2^2}−\dfrac{1}{5^2}\right)=4.576 \times 10^{−19}\; J\]
\[= \dfrac{4.576\times 10^{−19}\;J} {1.602 \times 10^{−19}\;J \; eV^{−1} } =2.856\; eV\]
Q6.2.5
À l'aide du modèle de Bohr, déterminez l'énergie la plus faible possible pour l'électron dans l'\(He^+\)ion.
Q6.2.6
À l'aide du modèle de Bohr, déterminez l'énergie d'un électron avec\(n = 6\) un atome d'hydrogène.
S6.2.6
−8,716 × 10−18 M
Q6.2.7
À l'aide du modèle de Bohr, déterminez l'énergie d'un électron avec\(n = 8\) un atome d'hydrogène.
Q6.2.8
À quelle distance du noyau en angstroms (1 angström =\(1 \times 10^{–10}\; \ce m\)) se trouve l'électron d'un atome d'hydrogène s'il a une énergie de\(-8.72 \times 10^{-20}\; \ce J\) ?
ARTICLE 6.2.8
\(−3.405 \times 10^{−20} J\)
Q6.2.9
Quel est le rayon, en angströms, de l'orbitale d'un électron avec n = 8 dans un atome d'hydrogène ?
Q6.2.10
À l'aide du modèle de Bohr, déterminez l'énergie en joules du photon produit lorsqu'un électron d'un\(\ce{He^{+}}\) ion se déplace de l'orbite avec n = 5 vers l'orbite avec n = 2.
Q6.2.11
À l'aide du modèle de Bohr, déterminez l'énergie en joules du photon produit lorsqu'un électron d'un ion Li2+ se déplace de l'orbite avec n = 2 vers l'orbite avec n = 1.
S6.2.11
1,471 × 10−17 M
Q6.2.12
Considérons un grand nombre d'atomes d'hydrogène dont les électrons sont répartis de manière aléatoire sur les orbites n = 1, 2, 3 et 4
- Combien de longueurs d'onde différentes de lumière sont émises par ces atomes lorsque les électrons tombent sur des orbitales de faible énergie ?
- Calculez les énergies les plus faibles et les plus élevées de la lumière produite par les transitions décrites dans la partie (a).
- Calculez les fréquences et les longueurs d'onde de la lumière produite par les transitions décrites dans la partie (b).
Q6.2.13
En quoi le modèle de Bohr et le modèle de Rutherford de l'atome sont-ils similaires ? En quoi sont-ils différents ?
Q6.2.14
Les spectres de l'hydrogène et du calcium sont présentés dans [lien]. Quelle est la cause des raies dans ces spectres ? Pourquoi les couleurs des lignes sont-elles différentes ? Suggérer la raison de l'observation selon laquelle le spectre du calcium est plus complexe que celui de l'hydrogène
S6.2.14
Les deux impliquent un noyau relativement lourd entouré d'électrons, bien qu'à proprement parler, le modèle de Bohr ne fonctionne que pour des atomes ou des ions à un seul électron. Selon la mécanique classique, le modèle de Rutherford prédit un « système solaire » miniature dans lequel les électrons se déplacent autour du noyau sur des orbites circulaires ou elliptiques confinées dans des plans. Si les exigences de la théorie électromagnétique classique selon lesquelles les électrons sur de telles orbites émettent un rayonnement électromagnétique sont ignorées, ces atomes seraient stables, auraient une énergie et un moment cinétiques constants, mais n'émettraient aucune lumière visible (contrairement à l'observation). Si la théorie électromagnétique classique est appliquée, l'atome de Rutherford émettrait un rayonnement électromagnétique de fréquence croissante (contrairement aux spectres discrets observés), perdant ainsi de l'énergie jusqu'à ce que l'atome s'effondre en un temps absurdement court (contrairement à la stabilité à long terme observée de atomes). Le modèle de Bohr conserve la vision mécanique classique des orbites circulaires confinées à des plans ayant une énergie et un moment cinétique constants, mais les limite à des valeurs quantifiées dépendant d'un seul nombre quantique, n. L'électron orbital dans le modèle de Bohr est supposé ne pas émettre de rayonnement électromagnétique tandis que se déplace autour du noyau sur ses orbites fixes, mais l'atome peut émettre ou absorber un rayonnement électromagnétique lorsque l'électron passe d'une orbite à l'autre. En raison des orbites quantifiées, ces « sauts quantiques » produiront des spectres discrets, en accord avec les observations.
6.3 : Développement de la théorie quantique
Q6.3.1
En quoi le modèle de Bohr et le modèle mécanique quantique de l'atome d'hydrogène sont-ils similaires ? En quoi sont-ils différents ?
ARTICLE 6.3.1
Les deux modèles ont un noyau central chargé positivement dans lequel les électrons se déplacent en fonction du potentiel électrostatique de Coulomb. Le modèle de Bohr suppose que les électrons se déplacent sur des orbites circulaires dont les énergies, le moment cinétique et les rayons quantifiés sont spécifiés par un seul nombre quantique, n = 1, 2, 3,..., mais cette quantification est une hypothèse ad hoc faite par Bohr pour intégrer la quantification dans un description essentiellement mécanique classique de l'atome. Bohr a également supposé que les électrons en orbite autour du noyau n'émettent ni n'absorbent normalement de rayonnement électromagnétique, mais qu'ils le font lorsque l'électron passe sur une autre orbite. Dans le modèle de mécanique quantique, les électrons ne se déplacent pas sur des orbites précises (de telles orbites violent le principe d'incertitude de Heisenberg) et, à la place, une interprétation probabiliste de la position de l'électron à un instant donné est utilisée, avec une fonction mathématique φ appelée fonction d'onde qui peut être utilisé pour déterminer la distribution de probabilité spatiale de l'électron. Ces fonctions d'onde, ou orbitales, sont des ondes stationnaires tridimensionnelles qui peuvent être spécifiées par trois nombres quantiques qui découlent naturellement de leurs mathématiques sous-jacentes (aucune hypothèse ad hoc n'est requise) : le nombre quantique principal, n (le même que celui utilisé par Bohr), qui spécifie des couches telles que que les orbitales ayant le même n ont toutes la même énergie et approximativement la même étendue spatiale ; le nombre quantique du moment cinétique l, qui est une mesure du moment cinétique de l'orbitale et correspond aux formes générales des orbitales, ainsi que la spécification de sous-couches telles que les orbitales ayant le même l (et n) ont toutes la même énergie ; et le nombre quantique d'orientation m, qui est une mesure de la composante z du moment cinétique et correspond aux orientations des orbitales. Le modèle de Bohr donne la même expression à l'énergie que l'expression mécanique quantique et, par conséquent, les deux tiennent correctement compte du spectre discret de l'hydrogène (un exemple d'obtention des bonnes réponses pour de mauvaises raisons, ce à quoi de nombreux étudiants en chimie peuvent comprendre), mais donne la mauvaise expression du moment cinétique (les orbitales de Bohr ont nécessairement toutes un moment cinétique différent de zéro, mais certaines orbitales quantiques [orbitales] peuvent avoir un moment cinétique nul).
Q6.3.2
Quelles sont les valeurs autorisées pour chacun des quatre nombres quantiques : n, l, m l et m s ?
Q6.3.3
Décrivez les propriétés d'un électron associé à chacun des quatre nombres quantiques suivants : n, l, m l et m s.
ARTICLE 6.3.3
n détermine la plage générale de valeur de l'énergie et les distances probables entre l'électron et le noyau. l détermine la forme de l'orbite. m l détermine l'orientation des orbitales d'une même valeur l les unes par rapport aux autres. m s détermine le spin d'un électron.
Q6.3.4
Répondez aux questions suivantes :
- Sans utiliser de nombres quantiques, décrivez les différences entre les couches, les sous-couches et les orbitales d'un atome.
- En quoi les nombres quantiques des couches, des sous-couches et des orbitales d'un atome diffèrent-ils ?
Q6.3.5
Identifiez la sous-couche dans laquelle se trouvent des électrons ayant les nombres quantiques suivants :
- n = 2, l = 1
- n = 4, l = 2
- n = 6, l = 0
ARTICLE 6.3.5
a) 2 p ; b) 4 d ; c) 6 s
Q6.3.6
Laquelle des sous-couches décrites à la question 5 contient des orbitales dégénérées ? Combien d'orbitales dégénérées y a-t-il dans chacune ?
Q6.3.7
Identifiez la sous-couche dans laquelle se trouvent des électrons ayant les nombres quantiques suivants :
- n = 3, l = 2
- n = 1, l = 0
- n = 4, l = 3
ARTICLE 6.3.7
a) 3 d ; b) 1 s ; c) 4 f
Q6.3.8
Laquelle des sous-couches décrites à la question 7 contient des orbitales dégénérées ? Combien d'orbitales dégénérées y a-t-il dans chacune ?
Q6.3.9
Esquissez la surface limite des orbitales a\(d_{x^2−y^2}\) et p y. Assurez-vous d'afficher et d'étiqueter les axes.
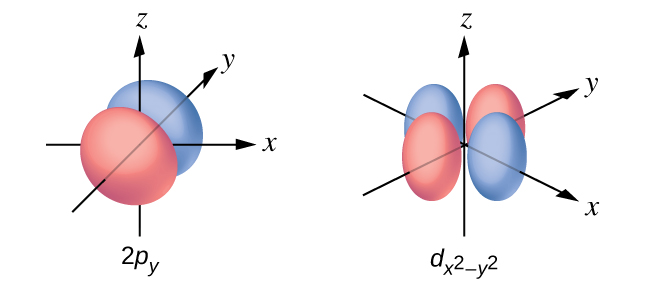
Q6.3.10
Esquissez les orbitales p x et d xz. Assurez-vous d'afficher et d'étiqueter les coordonnées.
Q6.3.11
Considérez les orbitales présentées ici dans leurs grandes lignes.
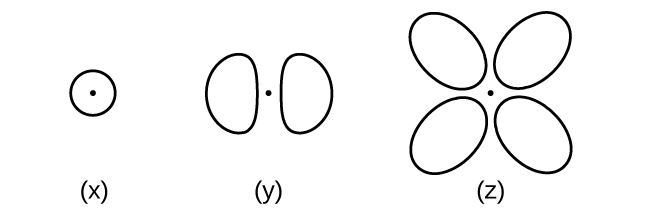
- Quel est le nombre maximum d'électrons contenus dans une orbitale de type (x) ? De type (y) ? De type (z) ?
- Combien d'orbitales de type (x) trouve-t-on dans une coque avec n = 2 ? Combien de caractères de type (y) ? Combien de caractères de type (z) ?
- Ecrivez un ensemble de nombres quantiques pour un électron sur une orbitale de type (x) dans une couche avec n = 4. D'une orbitale de type (y) dans une coque avec n = 2. D'une orbitale de type (z) dans une coque avec n = 3.
- Quelle est la plus petite valeur n possible pour une orbitale de type (x) ? De type (y) ? De type (z) ?
- Quelles sont les valeurs l et m l possibles pour une orbitale de type (x) ? De type (y) ? De type (z) ?
S6.3.11
(a) x. 2, y. 2, z. 2 ; (b) x. 1, y. 3, z. 0 ; (c) x 4 0 0\(\dfrac{1}{2}\), y. 2 1 0 \(\dfrac{1}{2}\), z. 3 2 0 \(\dfrac{1}{2}\); (d) x. 1, y. 2, z. 3; (e) x. l = 0, ml = 0, y. l = 1, ml = –1, 0, or +1, z. l = 2, ml = –2, –1, 0, +1, +2
Q6.3.12
State the Heisenberg uncertainty principle. Describe briefly what the principle implies.
Q6.3.13
How many electrons could be held in the second shell of an atom if the spin quantum number ms could have three values instead of just two? (Hint: Consider the Pauli exclusion principle.)
S6.3.13
12
Q6.3.14
Which of the following equations describe particle-like behavior? Which describe wavelike behavior? Do any involve both types of behavior? Describe the reasons for your choices.
- \(c = λν\)
- \(E=\dfrac{mν^2}{2}\)
- \(r=\dfrac{n^2a_0}{Z}\)
- \(E = hν\)
- \(λ=\dfrac{h}{mν}\)
Q6.3.15
Write a set of quantum numbers for each of the electrons with an n of 4 in a Se atom.
S6.3.15
| n | l | ml | s |
|---|---|---|---|
| 4 | 0 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 0 | 0 | \(−\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 1 | +1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(−\dfrac{1}{2}\) |
6.4: Electronic Structure of Atoms (Electron Configurations)
Q6.4.1
Read the labels of several commercial products and identify monatomic ions of at least four transition elements contained in the products. Write the complete electron configurations of these cations.
Q6.4.2
Read the labels of several commercial products and identify monatomic ions of at least six main group elements contained in the products. Write the complete electron configurations of these cations and anions.
S6.4.2
For example, Na+: 1s22s22p6; Ca2+: 1s22s22p6; Sn2+: 1s22s22p63s23p63d104s24p64d105s2; F–: 1s22s22p6; O2–: 1s22s22p6; Cl–: 1s22s22p63s23p6.
Q6.4.3
Using complete subshell notation (not abbreviations, 1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- C
- P
- V
- Sb
- Sm
S6.4.3
a.) 1s22s22p2
b.) 1s22s22p63s23p3
c.) 1s22s22p63s23p63d34s2
d.) 1s22s22p63s23p63d104s24p64d105s25p3
e.) 1s22s22p63s23p63d104s24p64d104f65s25p66s2
Q6.4.4
Using complete subshell notation (1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- N
- Si
- Fe
- Te
- Tb
S6.4.4
- 1s22s22p3;
- 1s22s22p63s23p2;
- 1s22s22p63s23p64s23d6;
- 1s22s22p63s23p64s23d104p65s24d105p4;
- 1s22s22p63s23p64s23d104p65s24d105p66s24f9
Q6.4.5
Is 1s22s22p6 the symbol for a macroscopic property or a microscopic property of an element? Explain your answer.
Q6.4.6
What additional information do we need to answer the question “Which ion has the electron configuration 1s22s22p63s23p6”?
S6.4.6
The charge on the ion.
Q6.4.7
Draw the orbital diagram for the valence shell of each of the following atoms:
- C
- P
- V
- Sb
- Ru
Q6.4.8
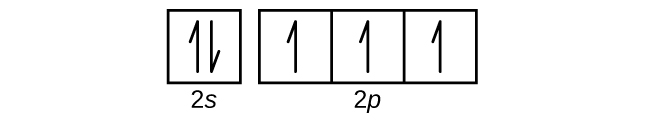
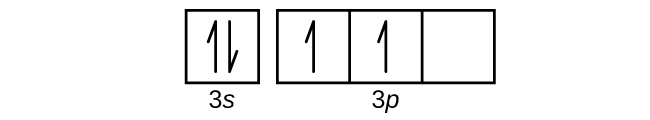
Use an orbital diagram to describe the electron configuration of the valence shell of each of the following atoms:
- N
- Si
- Fe
- Te
- Mo
S6.4.8
(a)
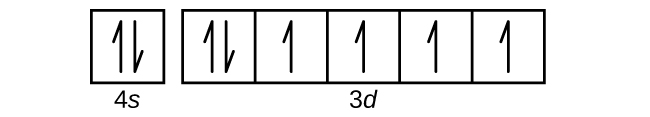
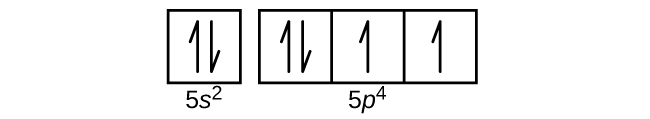

Q6.4.9
À l'aide de la notation complète des sous-couches (1 s 2 2 s 2 2 p 6, etc.), prédisez les configurations électroniques des ions suivants.
- N° 3—
- Ca 2+
- S —
- Cs 2+
- Cr 2+
- Dieu 3+
Q6.4.10
Quel atome a la configuration électronique : 1 s 2 2 2 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 x 2 ?
S6.4.10
Zr
Q6.4.11
Quel atome a la configuration électronique : 1 s 2 2 2 2 2 p 6 3 s 2 3 p 6 3 d 7 4 s 2 ?
S6.4.11
Co ; Cobalt
Q6.4.12
Quel ion avec une charge +1 a la configuration électronique 1 s 2 2 s 2 2 2 p 6 3 s 2 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 ? Quel ion avec une charge de -2 a cette configuration ?
S6.4.12
Rb +, Se 2−
Q6.4.13
Lequel des atomes suivants ne contient que trois électrons de valence : Li, B, N, F, Ne ?
S6.4.13
B ; Bore
Q6.4.14
Lequel des éléments suivants possède deux électrons non appariés ?
- Mg
- Monsieur
- S
- Mg et S
- Si et S.
ARTICLE 6.4.14
Bien que les points (b) et (c) soient tous deux corrects, (e) englobe les deux et constitue la meilleure réponse.
Q6.4.15
Quel atome devrait avoir une sous-couche de 6 p à moitié remplie ?
ARTICLE 6.4.15
Bismuth ; Bismuth
Q6.4.16
Quel atome devrait avoir une sous-couche de 4 s à moitié remplie ?
S6.4.16
K
Q6.4.17
Dans une région d'Australie, le bétail ne s'est pas développé malgré la présence d'un fourrage approprié. Une enquête a montré que la cause était l'absence de cobalt en quantité suffisante dans le sol. Le cobalt forme des cations dans deux états d'oxydation, le Co 2+ et le Co 3+. Ecrivez la structure électronique des deux cations.
Q6.4.18
Le thallium a été utilisé comme poison dans l'histoire mystérieuse d'Agatha Christie « The Pale Horse ». Le thallium a deux formes cationiques possibles, +1 et +3. Les composés +1 sont les plus stables. Ecrivez la structure électronique du cation +1 du thallium.
ARTICLE 6.4.18
1 s 2 2 2 p 6 3 s 2 3 p 6 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p. 6 x 6 x 2 4 de 14 5 x 10
Q6.4.19
Écrivez les configurations électroniques des atomes ou des ions suivants :
- B 3+
- O —
- Cl 3+
- Ca 2+
- Ti
Q6.4.20
Le cobalt 60 et l'iode 131 sont des isotopes radioactifs couramment utilisés en médecine nucléaire. Combien de protons, de neutrons et d'électrons se trouvent dans les atomes de ces isotopes ? Écrivez la configuration électronique complète pour chaque isotope.
ARTICLE 6.4.20
Le Co possède 27 protons, 27 électrons et 33 neutrons : 1 s 2 2 2 2 p 6 3 s 2 3 p 6 4 s 2 3 p 6 4 s 2 3 d 7.
Il possède 53 protons, 53 électrons et 78 neutrons : 1 s 2 2 2 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 p 6 4 d 10 5 x 2 5 p. 5.
Q6.4.21
Écrivez un ensemble de nombres quantiques pour chacun des électrons avec un n de 3 dans un atome Sc.
6.5 : Variations périodiques des propriétés des éléments
Q6.5.1
Sur la base de leurs positions dans le tableau périodique, prédisez lequel a le plus petit rayon atomique : Mg, Sr, Si, Cl, I.
ARTICLE 6.5.1
Cl
Q6.5.2
Sur la base de leurs positions dans le tableau périodique, prédisez lequel possède le plus grand rayon atomique : Li, Rb, N, F, I.
Q6.5.3
Sur la base de leur position dans le tableau périodique, déterminez laquelle possède la plus grande énergie de première ionisation : Mg, Ba, B, O, Te.
ARTICLE 6.5.3
O
Q6.5.4
Sur la base de leur position dans le tableau périodique, déterminez laquelle possède la plus faible énergie de première ionisation : Li, Cs, N, F, I.
Q6.5.5
En fonction de leur position dans le tableau périodique, classez les atomes suivants par ordre croissant d'énergie de première ionisation : F, Li, N, Rb
ARTICLE 6.5.5
Rb < Li < N < F
Q6.5.6
En fonction de leur position dans le tableau périodique, classez les atomes ou composés suivants par ordre croissant d'énergie de première ionisation : Mg, O, S, Si
Q6.5.7
Quel groupe du tableau périodique a une configuration électronique de la couche de valence de ns 2 np 3 ?
ARTICLE 6.5.7
15 (5A)
Q6.5.8
Quel groupe du tableau périodique a une configuration électronique de la couche de valence de ns 2 ?
Q6.5.9
Sur la base de leur position dans le tableau périodique, énumérez les atomes suivants par ordre croissant de rayon : Mg, Ca, Rb, Cs.
ARTICLE 6.5.9
Mg < Ca < Rb < Cs
Q6.5.10
Sur la base de leur position dans le tableau périodique, énumérez les atomes suivants par ordre croissant de rayon : Sr, Ca, Si, Cl.
Q6.5.11
Sur la base de leur position dans le tableau périodique, énumérez les ions suivants par ordre croissant de rayon : K +, Ca 2+, Al 3+, Si 4+.
ARTICLE 6.5.11
Si 4+ < Al 3+ < Ca 2+ < K +
Q6.5.12
Énumérez les ions suivants par ordre de rayon croissant : Li +, Mg 2+, Br —, Te 2—.
Q6.5.13
Quels atomes et/ou ions sont isoélectroniques avec Br + : Se 2+, Se, As —, Kr, Ga 3+, Cl — ?
ARTICLE 6.5.13
Voir, As −
Q6.5.14
Lequel des atomes et ions suivants est (sont) isoélectronique avec S 2+ : Si 4+, Cl 3+, Ar, As 3+, Si, Al 3+ ?
Q6.5.15
Comparez le nombre de protons et d'électrons présents dans chacun d'eux pour classer les ions suivants par ordre croissant de rayon : As 3—, Br —, K +, Mg 2+.
ARTICLE 6.5.15
Mg 2+ < K + < Br — < Comme 3—
Q6.5.16
Parmi les cinq éléments Al, Cl, I, Na, Rb, lequel a la réaction la plus exothermique ? (E représente un atome.) Quel est le nom donné à l'énergie de la réaction ? Conseil : notez que le processus décrit ne correspond pas à l'affinité électronique
\(\ce{E+}(g)+\ce{e-}⟶\ce{E}(g)\)
Q6.5.17
Of the five elements Sn, Si, Sb, O, Te, which has the most endothermic reaction? (E represents an atom.) What name is given to the energy for the reaction?
\[\ce{E}(g)⟶\ce{E+}(g)+\ce{e-}\]
S6.5.17
O, IE1
Q6.5.18
The ionic radii of the ions S2–, Cl–, and K+ are 184, 181, 138 pm respectively. Explain why these ions have different sizes even though they contain the same number of electrons.
Q6.5.19
Which main group atom would be expected to have the lowest second ionization energy?
S6.5.19
Ra
Q6.5.20
Explain why Al is a member of group 13 rather than group 3?


