5.1 : Les bases de l'énergie
- Page ID
- 194046
- Définir l'énergie, distinguer les types d'énergie et décrire la nature des changements énergétiques qui accompagnent les changements chimiques et physiques
- Distinguer les propriétés connexes de la chaleur, de l'énergie thermique et de la température
- Définir et distinguer la chaleur et la capacité calorifique spécifiques, et décrire les implications physiques des deux
- Effectuer des calculs impliquant la chaleur, la chaleur spécifique et le changement de température
Les changements chimiques et les changements énergétiques qui les accompagnent sont des éléments importants de notre vie quotidienne (Figure\(\PageIndex{1}\)). Les macronutriments contenus dans les aliments (protéines, lipides et glucides) subissent des réactions métaboliques qui fournissent l'énergie nécessaire au bon fonctionnement de notre corps. Nous brûlons divers combustibles (essence, gaz naturel, charbon) pour produire de l'énergie pour le transport, le chauffage et la production d'électricité. Les réactions chimiques industrielles utilisent d'énormes quantités d'énergie pour produire des matières premières (telles que le fer et l'aluminium). L'énergie est ensuite utilisée pour transformer ces matières premières en produits utiles, tels que des voitures, des gratte-ciel et des ponts.

Plus de 90 % de l'énergie que nous consommons provient du soleil. Chaque jour, le soleil fournit à la Terre près de 10 000 fois la quantité d'énergie nécessaire pour répondre à tous les besoins énergétiques de la planète pour cette journée. Notre défi consiste à trouver des moyens de convertir et de stocker l'énergie solaire entrante afin qu'elle puisse être utilisée dans des réactions ou des processus chimiques à la fois pratiques et non polluants. Les plantes et de nombreuses bactéries captent l'énergie solaire par photosynthèse. Nous libérons l'énergie stockée dans les plantes lorsque nous brûlons du bois ou des produits végétaux tels que l'éthanol. Nous utilisons également cette énergie pour alimenter notre corps en mangeant des aliments qui proviennent directement de plantes ou d'animaux qui ont obtenu leur énergie en mangeant des plantes. La combustion du charbon et du pétrole libère également de l'énergie solaire stockée : ces combustibles sont des matières végétales et animales fossilisées.
Ce chapitre présente les idées de base d'un domaine scientifique important qui concerne la quantité de chaleur absorbée ou libérée lors de changements chimiques et physiques, un domaine appelé thermochimie. Les concepts présentés dans ce chapitre sont largement utilisés dans presque tous les domaines scientifiques et techniques. Les scientifiques de l'alimentation les utilisent pour déterminer le contenu énergétique des aliments. Les biologistes étudient l'énergie des organismes vivants, comme la combustion métabolique du sucre en dioxyde de carbone et en eau. Les industries du pétrole, du gaz et des transports, les fournisseurs d'énergie renouvelable et bien d'autres s'efforcent de trouver de meilleures méthodes pour produire de l'énergie pour nos besoins commerciaux et personnels. Les ingénieurs s'efforcent d'améliorer l'efficacité énergétique, de trouver de meilleurs moyens de chauffer et de refroidir nos maisons, de réfrigérer nos aliments et nos boissons et de répondre aux besoins en énergie et en refroidissement des ordinateurs et des appareils électroniques, entre autres applications. Comprendre les principes de la thermochimie est essentiel pour les chimistes, les physiciens, les biologistes, les géologues, tous les types d'ingénieurs et à peu près tous ceux qui étudient ou pratiquent n'importe quel type de science.
Énergie
L'énergie peut être définie comme la capacité de fournir de la chaleur ou de travailler. Un type de travail (w) est le processus qui consiste à faire bouger la matière contre une force opposée. Par exemple, nous travaillons lorsque nous gonflons un pneu de vélo : nous déplaçons de la matière (l'air contenu dans la pompe) à l'encontre de la force opposée de l'air qui entoure le pneu.
Comme la matière, l'énergie se décline en différents types. Un schéma classe l'énergie en deux types : l'énergie potentielle, l'énergie dont dispose un objet en raison de sa position, de sa composition ou de sa condition relative, et l'énergie cinétique, l'énergie qu'un objet possède en raison de son mouvement. L'eau au sommet d'une cascade ou d'un barrage possède de l'énergie potentielle en raison de sa position ; lorsqu'elle s'écoule vers le bas à travers des générateurs, elle produit de l'énergie cinétique qui peut être utilisée pour effectuer des travaux et produire de l'électricité dans une centrale hydroélectrique (Figure\(\PageIndex{2}\)). Une batterie possède de l'énergie potentielle car les produits chimiques qu'elle contient peuvent produire de l'électricité qui peut fonctionner.

L'énergie peut être convertie d'une forme à une autre, mais toute l'énergie présente avant qu'un changement ne se produise existe toujours sous une forme ou une autre une fois le changement terminé. Cette observation s'exprime dans la loi de conservation de l'énergie : lors d'un changement chimique ou physique, l'énergie ne peut être ni créée ni détruite, bien que sa forme puisse être modifiée. (Il s'agit également d'une version de la première loi de la thermodynamique, comme vous l'apprendrez plus tard.)
Lorsqu'une substance est convertie en une autre, il y a toujours une conversion associée d'une forme d'énergie en une autre. La chaleur est généralement libérée ou absorbée, mais la conversion implique parfois de la lumière, de l'énergie électrique ou une autre forme d'énergie. Par exemple, l'énergie chimique (un type d'énergie potentielle) est stockée dans les molécules qui composent l'essence. Lorsque l'essence est brûlée dans les cylindres du moteur d'une voiture, les produits gazeux en expansion rapide résultant de cette réaction chimique génèrent de l'énergie mécanique (un type d'énergie cinétique) lorsqu'ils déplacent les pistons des cylindres.
Selon la loi de conservation de la matière (vue dans un chapitre précédent), il n'y a aucun changement détectable de la quantité totale de matière lors d'un changement chimique. Lorsque des réactions chimiques se produisent, les changements d'énergie sont relativement modestes et les changements de masse sont trop faibles pour être mesurés, de sorte que les lois de conservation de la matière et de l'énergie s'appliquent bien. Cependant, dans les réactions nucléaires, les changements d'énergie sont beaucoup plus importants (par des facteurs d'environ un million), les changements de masse sont mesurables et les conversions matière-énergie sont significatives. Ce point sera examiné plus en détail dans un chapitre ultérieur sur la chimie nucléaire. Pour englober à la fois les changements chimiques et nucléaires, nous combinons ces lois en une seule déclaration : la quantité totale de matière et d'énergie dans l'univers est fixe.
Énergie thermique, température et chaleur
L'énergie thermique est l'énergie cinétique associée au mouvement aléatoire des atomes et des molécules. La température est une mesure quantitative du « chaud » ou du « froid ». Lorsque les atomes et les molécules d'un objet se déplacent ou vibrent rapidement, ils ont une énergie cinétique moyenne (KE) plus élevée, et nous disons que l'objet est « chaud ». Lorsque les atomes et les molécules se déplacent lentement, leur KE est plus faible, et nous disons que l'objet est « froid » (Figure\(\PageIndex{3}\)). En supposant qu'aucune réaction chimique ou aucun changement de phase (tel que la fusion ou la vaporisation) ne se produise, l'augmentation de la quantité d'énergie thermique dans un échantillon de matière entraînera une augmentation de sa température. Et, en supposant qu'aucune réaction chimique ou aucun changement de phase (tel que condensation ou congélation) ne se produise, la diminution de la quantité d'énergie thermique d'un échantillon de matière entraînera une baisse de sa température.

La plupart des substances se dilatent lorsque leur température augmente et se contractent lorsque leur température diminue. Cette propriété peut être utilisée pour mesurer les variations de température, comme indiqué sur la figure\(\PageIndex{4}\). Le fonctionnement de nombreux thermomètres dépend de l'expansion et de la contraction des substances en réponse aux changements de température.


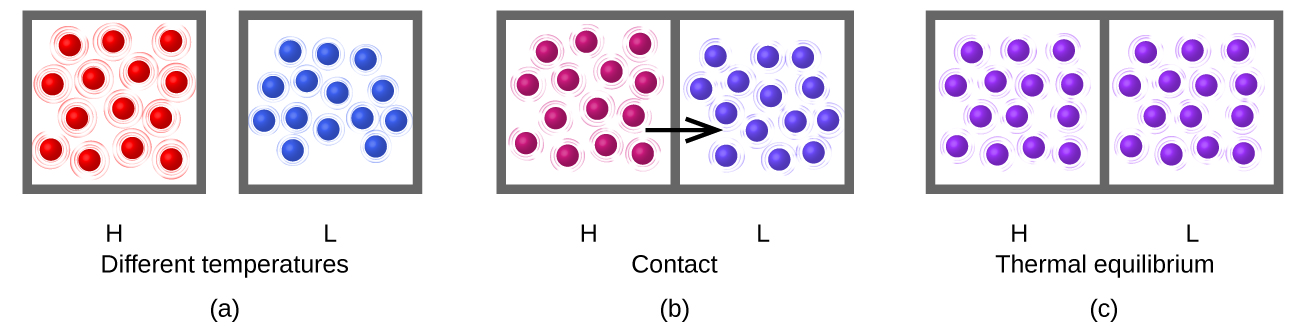
La chaleur (q) est le transfert d'énergie thermique entre deux corps à des températures différentes. Le flux de chaleur (terme redondant mais couramment utilisé) augmente l'énergie thermique d'un corps et diminue l'énergie thermique de l'autre. Supposons que nous ayons initialement une substance à haute température (et à haute énergie thermique) (H) et une substance à basse température (et à faible énergie thermique) (L). Les atomes et les molécules de H ont une KE moyenne plus élevée que ceux de L. Si nous mettons la substance H en contact avec la substance L, l'énergie thermique circulera spontanément de la substance H vers la substance L. La température de la substance H diminuera, tout comme la KE moyenne de ses molécules ; la température de la substance L augmentera, de même que la KE moyenne de ses molécules. Le flux de chaleur se poursuivra jusqu'à ce que les deux substances soient à la même température (Figure\(\PageIndex{5}\)).
Les matières soumises à des réactions chimiques et à des changements physiques peuvent libérer ou absorber de la chaleur. Un changement qui libère de la chaleur est appelé processus exothermique. Par exemple, la réaction de combustion qui se produit lors de l'utilisation d'une torche à oxyacétylène est un processus exothermique. Ce processus libère également de l'énergie sous forme de lumière, comme en témoigne la flamme de la torche (Figure\(\PageIndex{6a}\)). Une réaction ou un changement qui absorbe de la chaleur est un processus endothermique. Une compresse froide utilisée pour traiter les tensions musculaires fournit un exemple de processus endothermique. Lorsque les substances présentes dans la compresse froide (de l'eau et un sel tel que le nitrate d'ammonium) sont réunies, le processus qui en résulte absorbe la chaleur et crée une sensation de froid.

Mesure de la capacité énergétique et thermique
Historiquement, l'énergie était mesurée en unités de calories (cal). Une calorie est la quantité d'énergie nécessaire pour augmenter un gramme d'eau de 1 degré C (1 kelvin). Cependant, cette quantité dépend de la pression atmosphérique et de la température de départ de l'eau. La facilité de mesure des variations énergétiques des calories signifie que les calories sont encore fréquemment utilisées. La calorie (avec un C majuscule), ou grande calorie, couramment utilisée pour quantifier le contenu énergétique des aliments, est une kilocalorie. L'unité SI de chaleur, de travail et d'énergie est le joule. Un joule (J) est défini comme la quantité d'énergie utilisée lorsqu'une force de 1 newton déplace un objet d'un mètre. Il est nommé en l'honneur du physicien anglais James Prescott Joule. Un joule équivaut à 1 kg m 2 /s 2, également appelé 1 newton—mètre. Un kilojoule (kJ) est égal à 1000 joules. Pour normaliser sa définition, 1 calorie a été fixée à 4,184 joules.
Nous introduisons maintenant deux concepts utiles pour décrire le flux de chaleur et le changement de température. La capacité thermique (C) d'une masse de matière est la quantité de chaleur (q) qu'elle absorbe ou libère lorsqu'elle subit un changement de température (Δ T) de 1 degré Celsius (ou, de manière équivalente, de 1 kelvin)
\[C=\dfrac{q}{ΔT} \label{5.2.1} \]
La capacité calorifique est déterminée à la fois par le type et la quantité de substance qui absorbe ou libère de la chaleur. Il s'agit donc d'une propriété étendue : sa valeur est proportionnelle à la quantité de substance.
Par exemple, considérez les capacités calorifiques de deux poêles en fonte. La capacité calorifique de la grande poêle est cinq fois supérieure à celle de la petite casserole car, bien que les deux soient faites du même matériau, la masse de la grande poêle est cinq fois supérieure à celle de la petite casserole. Plus de masse signifie que plus d'atomes sont présents dans le grand plateau. Il faut donc plus d'énergie pour faire vibrer tous ces atomes plus rapidement. La capacité thermique de la petite poêle en fonte est déterminée en observant qu'il faut 18 150 J d'énergie pour augmenter la température de la poêle de 50,0 °C
\[C_{\text{small pan}}=\mathrm{\dfrac{18,140\; J}{50.0\; °C} =363\; J/°C} \label{5.2.2} \]
La grande poêle en fonte, bien que fabriquée avec la même substance, nécessite 90 700 J d'énergie pour augmenter sa température de 50,0 °C. La plus grande poêle a une capacité thermique (proportionnellement) plus grande parce que la plus grande quantité de matériau nécessite une quantité d'énergie (proportionnellement) plus grande pour obtenir la même température changement :
\[C_{\text{large pan}}=\mathrm{\dfrac{90,700\; J}{50.0\;°C}=1814\; J/°C} \label{5.2.3} \]
La capacité thermique spécifique (c) d'une substance, communément appelée « chaleur spécifique », est la quantité de chaleur requise pour élever la température d'un gramme d'une substance de 1 degré Celsius (ou 1 kelvin) :
\[c = \dfrac{q}{\mathrm{m\Delta T}} \label{5.2.4} \]
La capacité thermique spécifique dépend uniquement du type de substance qui absorbe ou dégage de la chaleur. Il s'agit d'une propriété intensive : le type, mais non la quantité, de la substance est tout ce qui compte. Par exemple, la petite poêle en fonte a une masse de 808 g. La chaleur spécifique du fer (le matériau utilisé pour fabriquer la poêle) est donc :
\[c_\ce{iron}=\mathrm{\dfrac{18,140\; J}{(808\; g)(50.0\;°C)} = 0.449\; J/g\; °C} \label{5.2.5} \]
La grande poêle a une masse de 40 à 40 g. À l'aide des données de cette poêle, nous pouvons également calculer la chaleur spécifique du fer :
\[c_\ce{iron}=\mathrm{\dfrac{90,700\; J}{(4,040\; g)(50.0\;°C)}=0.449\; J/g\; °C} \label{5.2.6} \]
Bien que la grande poêle soit plus massive que la petite, étant donné que les deux sont fabriquées dans le même matériau, elles donnent toutes deux la même valeur pour la chaleur spécifique (pour le matériau de construction, le fer). Il convient de noter que la chaleur spécifique est mesurée en unités d'énergie par température et par masse et qu'il s'agit d'une propriété intensive, dérivée d'un rapport entre deux propriétés étendues (chaleur et masse). La capacité calorifique molaire, également une propriété intensive, est la capacité thermique par mole d'une substance particulière et est exprimée en unités de J/mol °C (Figure\(\PageIndex{7}\)).

L'eau liquide possède une chaleur spécifique relativement élevée (environ 4,2 J/g °C) ; la plupart des métaux ont des chaleurs spécifiques beaucoup plus faibles (généralement inférieures à 1 J/g °C). La chaleur spécifique d'une substance varie quelque peu en fonction de la température. Cependant, cette variation est généralement suffisamment faible pour que nous puissions traiter la chaleur spécifique comme constante sur la plage de températures qui sera examinée dans ce chapitre. Les chaleurs spécifiques de certaines substances courantes sont répertoriées dans le tableau\(\PageIndex{1}\).
| Substance | Symbole (état) | Chaleur spécifique (J/g °C) |
|---|---|---|
| hélium | Il (g) | 5.193 |
| eau | H 2 O (l) | 4.184 |
| éthanol | C 2 H 6 O (l) | 2.376 |
| glace | H 2 O (s) | 2.093 (à −10 °C) |
| vapeur d'eau | H 2 O (g) | 1,864 |
| nitrogène | N 2 (g) | 1,040 |
| air | 1,007 | |
| oxygène | O 2 (g) | 0,918 |
| aluminium | Alle (s) | 0,897 |
| dioxyde de carbone | CO 2 (g) | 0,853 |
| argon | Arme (g) | 0,522 |
| fer | Taxe (s) | 0,449 |
| cuivre | Tasse (s) | 0,385 |
| plomb | Pb (s) | 0,130 |
| or | Australie (s) | 0,129 |
| silicium | Six (s) | 0,712 |
Si nous connaissons la masse d'une substance et sa chaleur spécifique, nous pouvons déterminer la quantité de chaleur, q, qui entre ou sort de la substance en mesurant le changement de température avant et après l'acquisition ou la perte de chaleur :
\[\begin{align*} q &= \ce{(specific\: heat)×(mass\: of\: substance)×(temperature\: change)}\label{5.2.7}\\q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial})\end{align*} \]
Dans cette équation,\(c\) est la chaleur spécifique de la substance, m est sa masse et Δ T (qui se lit « delta T ») est le changement de température, T final − T initial. Si une substance gagne en énergie thermique, sa température augmente, sa température finale est supérieure à sa température initiale, T final − T initial a une valeur positive et la valeur de q est positive. Si une substance perd de l'énergie thermique, sa température diminue, la température finale est inférieure à la température initiale, T final − T initial a une valeur négative et la valeur de q est négative.
Un flacon contenant\(\mathrm{8.0 \times 10^2\; g}\) de l'eau est chauffé et la température de l'eau augmente de 21 °C à 85 °C. Quelle quantité de chaleur l'eau a-t-elle absorbée ?
Solution
Pour répondre à cette question, considérez les facteurs suivants :
- la chaleur spécifique de la substance à chauffer (dans ce cas, de l'eau)
- la quantité de substance chauffée (dans ce cas, 800 g)
- l'ampleur du changement de température (dans ce cas, de 21 °C à 85 °C).
La chaleur spécifique de l'eau étant de 4,184 J/g °C, pour chauffer 1 g d'eau à 1 °C, il faut 4,184 J. Nous notons que puisque 4,184 J sont nécessaires pour chauffer 1 g d'eau à 1 °C, nous en aurons besoin 800 fois plus pour chauffer 800 g d'eau à 1 °C. Enfin, nous observons que puisque 4,184 J sont nécessaires pour chauffer 1 g d'eau à 1 °C, nous il en faudra 64 fois plus pour le chauffer à 64 °C (c'est-à-dire de 21 °C à 85 °C).
Cela peut être résumé à l'aide de l'équation suivante :
\[\begin{align*} q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial}) \\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°C)×(800\:\cancel{g})×(85−21)°C}\\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°\cancel{C})×(800\:\cancel{g})×(64)°\cancel{C}}\\[4pt] &=\mathrm{210,000\: J(=210\: kJ)} \end{align*} \nonumber \]
Comme la température a augmenté, l'eau a absorbé de la chaleur et\(q\) est positive.
Quelle quantité de chaleur, en joules, faut-il ajouter à une poêle\(\mathrm{5.00 \times 10^2 \;g}\) en fer pour augmenter sa température de 25 °C à 250 °C ? La chaleur spécifique du fer est de 0,451 J/g °C.
Réponse-
\(\mathrm{5.05 \times 10^4\; J}\)
Notez que la relation entre la chaleur, la chaleur spécifique, la masse et le changement de température peut être utilisée pour déterminer n'importe laquelle de ces quantités (et pas seulement la chaleur) si les trois autres sont connues ou peuvent être déduites.
Une pièce de métal inconnu pèse 348 g. Lorsque la pièce métallique absorbe 6,64 kJ de chaleur, sa température augmente de 22,4 °C à 43,6 °C. Déterminez la chaleur spécifique de ce métal (ce qui pourrait fournir un indice de son identité).
Solution
Comme la masse, la chaleur et les changements de température sont connus pour ce métal, nous pouvons déterminer sa chaleur spécifique à l'aide de la relation :
\[\begin{align*} q&=c \times m \times \Delta T \\[4pt] &=c \times m \times (T_\ce{final}−T_\ce{initial}) \end{align*} \nonumber \]
En remplaçant les valeurs connues :
\[6,640\; \ce J=c \times \mathrm{(348\; g) \times (43.6 − 22.4)\; °C} \nonumber \]
Résoudre :
\[c=\mathrm{\dfrac{6,640\; J}{(348\; g) \times (21.2°C)} =0.900\; J/g\; °C} \nonumber \]
En comparant cette valeur aux valeurs du tableau\(\PageIndex{1}\), cette valeur correspond à la chaleur spécifique de l'aluminium, ce qui suggère que le métal inconnu pourrait être l'aluminium.
Une pièce de métal inconnu pèse 217 g. Lorsque la pièce métallique absorbe 1,43 kJ de chaleur, sa température augmente de 24,5 °C à 39,1 °C. Déterminez la chaleur spécifique de ce métal et prédisez son identité.
- Réponse
-
\(c = \mathrm{0.45 \;J/g \;°C}\); le métal est susceptible d'être du fer en vérifiant la table\(\PageIndex{1}\).
Centrales à énergie solaire thermique
La lumière solaire qui atteint la Terre contient des milliers de fois plus d'énergie que ce que nous captons actuellement. Les systèmes solaires thermiques offrent une solution possible au problème de la conversion de l'énergie solaire en énergie utilisable. Les centrales solaires thermiques à grande échelle ont des caractéristiques de conception différentes, mais toutes concentrent la lumière solaire pour chauffer une substance ; la chaleur « stockée » dans cette substance est ensuite convertie en électricité.
La centrale de Solana, dans le désert de Sonora, en Arizona, produit 280 mégawatts d'électricité. Il utilise des miroirs paraboliques qui focalisent la lumière du soleil sur des tuyaux remplis d'un fluide caloporteur (HTF) (Figure\(\PageIndex{8}\)). Le HTF fait ensuite deux choses : il transforme l'eau en vapeur, qui fait tourner les turbines, qui produisent à leur tour de l'électricité, et il fait fondre et chauffer un mélange de sels, qui fonctionne comme un système de stockage d'énergie thermique. Après le coucher du soleil, le mélange de sels fondus peut libérer suffisamment de chaleur stockée pour produire de la vapeur nécessaire au fonctionnement des turbines pendant 6 heures. Les sels fondus sont utilisés parce qu'ils possèdent un certain nombre de propriétés bénéfiques, notamment des capacités thermiques et des conductivités thermiques élevées.

Le système de production solaire Ivanpah de 377 mégawatts, situé dans le désert de Mojave en Californie, est la plus grande centrale solaire thermique au monde (Figure\(\PageIndex{9}\)). Ses 170 000 miroirs concentrent d'énormes quantités de lumière solaire sur trois tours remplies d'eau, produisant de la vapeur à plus de 538 °C qui actionne des turbines produisant de l'électricité. Elle produit suffisamment d'énergie pour alimenter 140 000 foyers. L'eau est utilisée comme fluide de travail en raison de sa grande capacité calorifique et de sa chaleur de vaporisation.

Résumé
L'énergie est la capacité de travailler (appliquer une force pour déplacer la matière). L'énergie cinétique (KE) est l'énergie du mouvement ; l'énergie potentielle est l'énergie due à la position, à la composition ou à la condition relatives. Lorsque l'énergie est convertie d'une forme à une autre, l'énergie n'est ni créée ni détruite (loi de conservation de l'énergie ou première loi de la thermodynamique). La matière possède une énergie thermique due à la KE de ses molécules et à une température qui correspond à la KE moyenne de ses molécules. La chaleur est de l'énergie qui est transférée entre des objets à différentes températures ; elle passe d'une température élevée à une température basse. Les processus chimiques et physiques peuvent absorber de la chaleur (endothermie) ou libérer de la chaleur (exothermique). L'unité SI de l'énergie, de la chaleur et du travail est le joule (J). La chaleur et la capacité thermique spécifiques sont des mesures de l'énergie nécessaire pour modifier la température d'une substance ou d'un objet. La quantité de chaleur absorbée ou libérée par une substance dépend directement du type de substance, de sa masse et du changement de température qu'elle subit.
Équations clés
- \(q=c×m×ΔT=c×m×(T_\ce{final}−T_\ce{initial})\)
Lexique
- calorie (cal)
- unité de chaleur ou autre énergie ; la quantité d'énergie requise pour élever 1 gramme d'eau de 1 degré Celsius ; 1 cal est défini comme 4,184 J
- processus endothermique
- réaction chimique ou changement physique qui absorbe la chaleur
- énergie
- capacité à fournir de la chaleur ou à effectuer des travaux
- processus exothermique
- réaction chimique ou changement physique qui dégage de la chaleur
- chaleur (q)
- transfert d'énergie thermique entre deux corps
- capacité thermique (C)
- propriété étendue d'un corps de matière qui représente la quantité de chaleur requise pour augmenter sa température de 1 degré Celsius (ou 1 kelvin)
- joule (J)
- Unité d'énergie SI ; 1 joule est l'énergie cinétique d'un objet d'une masse de 2 kilogrammes se déplaçant à une vitesse de 1 mètre par seconde, 1 J = 1 kg m 2 /s et 4,184 J = 1 cal
- énergie cinétique
- énergie d'un corps en mouvement, en joules, égale à\(\dfrac{1}{2}mv^2\) (où m = masse et v = vitesse)
- énergie potentielle
- énergie d'une particule ou d'un système de particules dérivée de la position, de la composition ou de l'état relatifs
- capacité thermique spécifique (c)
- propriété intensive d'une substance qui représente la quantité de chaleur requise pour élever la température d'un gramme de la substance de 1 degré Celsius (ou 1 kelvin)
- température
- propriété intensive de la matière qui est une mesure quantitative de la « chaleur » et de la « froideur »
- énergie thermique
- énergie cinétique associée au mouvement aléatoire des atomes et des molécules
- thermochimie
- étude de la mesure de la quantité de chaleur absorbée ou libérée lors d'une réaction chimique ou d'un changement physique
- œuvre (w)
- transfert d'énergie dû à des modifications de variables macroscopiques externes telles que la pression et le volume ; ou au fait que la matière se déplace contre une force opposée


