1.4 : Mesures
- Page ID
- 194009
⋅
- Expliquez le processus de mesure et décrivez les trois éléments de base d'une quantité.
- Décrire les propriétés et les unités de longueur, de masse, de volume, de densité, de température et de temps.
- Reconnaissez les préfixes d'unités courants et utilisez-les pour décrire l'amplitude d'une mesure.
- Décrivez et calculez la densité d'une substance.
- Effectuez des calculs et des conversions d'unités de base dans le système métrique et d'autres systèmes d'unités.
Les mesures fournissent les informations macroscopiques qui sont à la base de la plupart des hypothèses, théories et lois qui décrivent le comportement de la matière et de l'énergie dans les domaines macroscopique et microscopique de la chimie. Chaque mesure fournit trois types d'informations : la taille ou l'amplitude de la mesure (un nombre) ; une norme de comparaison pour la mesure (une unité) ; et une indication de l'incertitude de la mesure. Alors que le nombre et l'unité sont explicitement représentés lorsqu'une quantité est écrite, l'incertitude est un aspect du résultat de mesure qui est représenté de manière plus implicite et qui sera discuté plus loin.
Le nombre figurant dans la mesure peut être représenté de différentes manières, y compris sous forme décimale et notation scientifique. Par exemple, la masse maximale au décollage d'un avion de ligne Boeing 777-200ER est de 298 000 kilogrammes, ce qui peut également être écrit comme 2,98\(\times\) 10 5 kg. La masse d'un moustique moyen est d'environ 0,0000025 kilogrammes, ce qui peut être écrit comme 2,5\(\times\) 10 −6 kg.
Les unités, telles que les litres, les livres et les centimètres, sont des normes de comparaison pour les mesures. Lorsque nous achetons une bouteille de 2 litres de boisson gazeuse, nous nous attendons à ce que le volume de la boisson ait été mesuré, il est donc deux fois plus grand que le volume que tout le monde accepte d'être de 1 litre. La viande utilisée pour préparer un hamburger de 0,25 livre est mesurée de telle sorte qu'elle pèse un quart de moins que 1 livre. Sans unités, un nombre peut être vide de sens, prêter à confusion ou mettre la vie en danger. Supposons qu'un médecin prescrive du phénobarbital pour contrôler les crises d'un patient et indique une dose de « 100 » sans spécifier d'unités. Non seulement cela créera de la confusion pour le professionnel de la santé qui administre la dose, mais les conséquences peuvent être désastreuses : 100 mg administrés trois fois par jour peuvent être efficaces comme anticonvulsivants, mais une dose unique de 100 g représente plus de 10 fois la quantité létale.
Nous rapportons généralement les résultats des mesures scientifiques en unités SI, une version mise à jour du système métrique, en utilisant les unités répertoriées dans le tableau\(\PageIndex{1}\). D'autres unités peuvent être dérivées de ces unités de base. Les normes de ces unités sont fixées par un accord international, et elles sont appelées Système international d'unités ou unités SI (du français, Le Système international d'unités). Les unités SI sont utilisées par le National Institute of Standards and Technology (NIST) des États-Unis depuis 1964.
| Propriété mesurée | Nom de l'unité | Symbole d'unité |
|---|---|---|
| longueur | mètre | m |
| masse | kilogramme | kg |
| temps | seconde | s |
| température | kelvin | K |
| courant électrique | ampère | UN |
| quantité de substance | taupe | mol |
| intensité lumineuse | candela | cd |
Parfois, nous utilisons des unités qui sont des fractions ou des multiples d'une unité de base. La crème glacée est vendue en pintes (une unité de base familière, sans SI), en pintes (0,5 pinte) ou en gallons (4 pintes). Nous utilisons également des fractions ou des multiples d'unités dans le système SI, mais ces fractions ou multiples sont toujours des puissances de 10. Les unités SI fractionnées ou multiples sont nommées à l'aide d'un préfixe et du nom de l'unité de base. Par exemple, une longueur de 1 000 mètres est également appelée kilomètre car le préfixe kilo signifie « mille », ce qui, en notation scientifique, est 10 3 (1 kilomètre = 1 000 m = 10 3 m). Les préfixes utilisés et les puissances auxquelles 10 sont augmentés sont répertoriés dans le tableau\(\PageIndex{2}\).
NG est égal à 4 fois dix à moins 9, soit 0,0000004 g. Le préfixe micro a pour symbole la lettre grecque mu et un facteur 10 pour la sixième puissance négative. Par conséquent, 1 microlitre, ou mu L, est égal à une fois dix au moins 6 ou 0,000001 L. Le préfixe milli a un M minuscule comme symbole et un facteur 10 à la troisième puissance négative. Par conséquent, 2 millimoles, ou M mol, sont égales à deux fois dix au moins 3 ou 0,002 mol. Le préfixe centi a pour symbole un C minuscule et un facteur 10 par rapport à la seconde puissance négative. Ainsi, 7 centimètres, ou C M, sont égaux à sept fois dix à moins 2 mètres ou 0,07 M O L. Le préfixe deci a un D minuscule comme symbole et un facteur 10 à la première puissance négative. Par conséquent, 1 décilitre, ou D majuscule L minuscule, est égal à une fois dix à moins 1 mètre ou 0,1 L. Le préfixe kilo a un K minuscule comme symbole et un facteur 10 à la troisième puissance. Par conséquent, 1 kilomètre, ou K M, est égal à une fois dix au troisième mètre ou 1000 M. Le préfixe méga a un M majuscule comme symbole et un facteur de 10 à la sixième puissance. Par conséquent, 3 mégahertz, ou M H Z, sont égaux à trois fois 10 au sixième hertz, soit 3 000 000 H Z. Le préfixe giga a un G majuscule comme symbole et un facteur 10 à la neuvième puissance. Par conséquent, 8 gigayears, ou G Y R, sont égaux à huit fois 10 à la neuvième année, soit 800000000 G Y R. Le préfixe tera a un T majuscule comme symbole et un facteur 10 à la douzième puissance. Ainsi, 5 térawatts, ou T W, sont égaux à cinq fois 10 à la douzième watts, soit 5000000000000 W. » data-quail-id="64" data-mt-width="1076">
| Préfixe | symbole | Facteur | Exemple |
|---|---|---|---|
| femto | f | 10 −15 | 1 nœud femtosec (fs) = 1\(\times\) 10 −15 s (0,00000000000000001 s) |
| pico | p | 10 −12 | 1 picomètre (pm) = 1\(\times\) 10 −12 m (0,00000000000001 m) |
| nano | n | 10 −9 | 4 nanogrammes (ng) = 4\(\times\) 10 −9 g (0,00000000004 g) |
| micro | µ | 10 −6 | 1 microlitre (μL) = 1\(\times\) 10 −6 L (0,000001 L) |
| milli | m | 10 −3 | 2 millimoles (mmol) = 2\(\times\) 10 -3 mol (0,002 mol) |
| centi | c | 10 −2 | 7 centimètres (cm) = 7\(\times\) 10 −2 m (0,07 m) |
| deci | d | 10 −1 | 1 décilitre (dL) = 1\(\times\) 10 −1 L (0,1 L) |
| kilo | k | 10 3 | 1 kilomètre (km) = 1\(\times\) 10 3 m (1 000 m) |
| méga | M | 10 6 | 3 mégahertz (MHz) = 3\(\times\) 10 6 Hz (3 000 000 Hz) |
| giga | G | 10 9 | 8 giga-années (Gyr) = 8\(\times\) 10 9 ans (8 000 000 000 Gyr) |
| tera | T | 10 12 | 5 térawatts (TW) = 5\(\times\) 10 12 W (5 000 000 000 000 W) |
Unités de base SI
Les unités initiales du système métrique, qui ont finalement évolué pour devenir le système SI, ont été établies en France pendant la Révolution française. Les normes originales pour le compteur et le kilogramme y ont été adoptées en 1799 et finalement par d'autres pays. Cette section présente quatre des unités de base du SI couramment utilisées en chimie. D'autres unités SI seront présentées dans les chapitres suivants.
Longueur
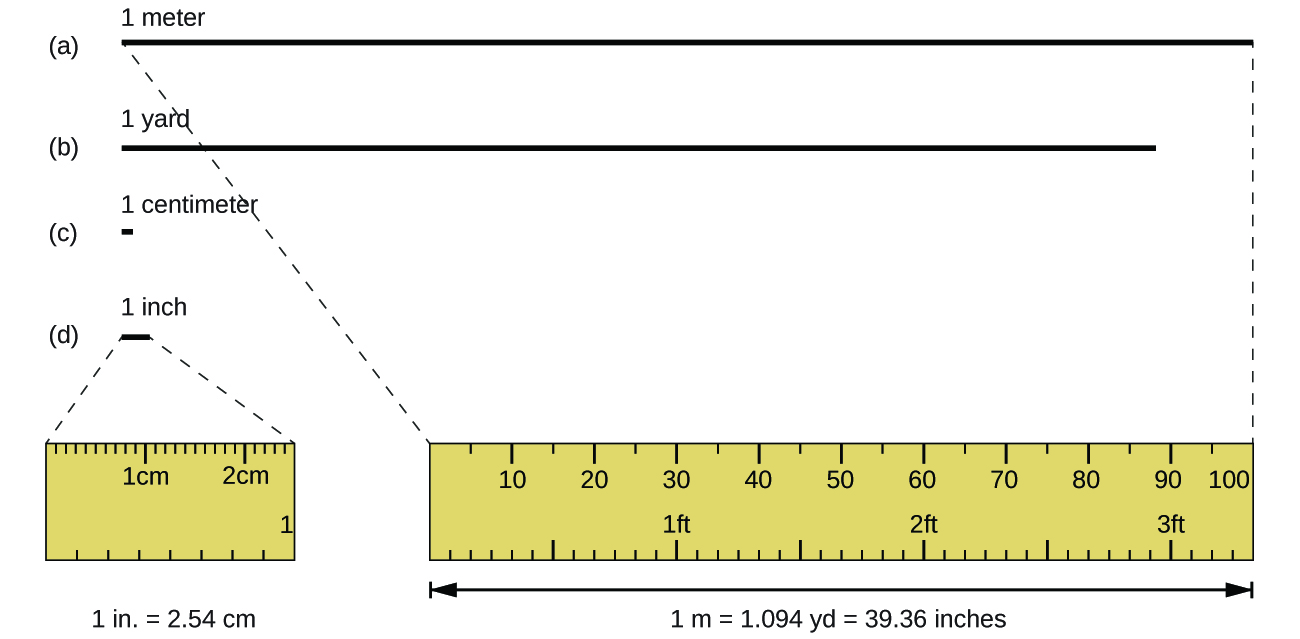
L'unité de longueur standard dans le SI et le système métrique d'origine est le mètre (m). Un mètre était initialement spécifié comme étant égal à 1/10 000 000 de la distance entre le pôle Nord et l'équateur. Elle est maintenant définie comme la distance parcourue par la lumière dans le vide en 1/299 792 458 de seconde. Un mètre mesure environ 3 pouces de plus qu'un mètre (Figure\(\PageIndex{1}\)) ; un mètre mesure environ 39,37 pouces ou 1,094 mètres. Les distances les plus longues sont souvent exprimées en kilomètres (1 km = 1 000 m = 10 3 m), tandis que les distances plus courtes peuvent être exprimées en centimètres (1 cm = 0,01 m = 10 −2 m) ou en millimètres (1 mm = 0,001 m = 10 -3 m).
Masse
L'unité de masse standard dans le système SI est le kilogramme (kg). À l'origine, un kilogramme était défini comme la masse d'un litre d'eau (un cube d'eau d'une longueur de bord d'exactement 0,1 mètre). Il est désormais défini par un certain cylindre en alliage platine-iridium, conservé en France (Figure 1.4.2). Tout objet ayant la même masse que ce cylindre est considéré comme ayant une masse de 1 kilogramme. Un kilogramme équivaut à environ 2,2 livres. Le gramme (g) est exactement égal à 1/1000 de la masse du kilogramme (10 -3 kg).

Température
La température est une propriété intensive. L'unité de température SI est le kelvin (K). La convention de l'IUPAC consiste à utiliser le kelvin (tout en minuscules) pour le mot, K (majuscule) pour le symbole de l'unité, et ni le mot « degré » ni le symbole du degré (°). Le degré Celsius (°C) est également autorisé dans le système SI, le mot « degré » et le symbole du degré étant utilisés pour les mesures en degrés Celsius. Les degrés Celsius ont la même magnitude que ceux du kelvin, mais les deux échelles placent leurs zéros à des endroits différents. L'eau gèle à 273,15 K (0 °C) et bout à 373,15 K (100 °C) par définition, et la température normale du corps humain est d'environ 310 K (37 °C). La conversion entre ces deux unités et l'échelle Fahrenheit sera abordée plus loin dans ce chapitre.
Heure
L'unité de temps de base du SI est la seconde (s). Des intervalles de temps petits et grands peuvent être exprimés avec les préfixes appropriés ; par exemple, 3 microsecondes = 0,000003 s = 3\(\times\) 10 −6 et 5 mégassecondes = 5 000 000 s = 5\(\times\) 10 6 s. Vous pouvez également utiliser des heures, des jours et des années.
Unités SI dérivées
Nous pouvons dériver de nombreuses unités à partir des sept unités de base du SI. Par exemple, nous pouvons utiliser l'unité de base de longueur pour définir une unité de volume et les unités de base de masse et de longueur pour définir une unité de densité.
Volume
Le volume est la mesure de l'espace occupé par un objet. L'unité de volume SI standard est définie par l'unité de base de longueur (Figure\(\PageIndex{3}\)). Le volume standard est un mètre cube (m 3), un cube dont la longueur d'arête est exactement d'un mètre. Pour distribuer un mètre cube d'eau, nous pourrions construire une boîte cubique dont les bords mesuraient exactement un mètre de long. Cette boîte pourrait contenir un mètre cube d'eau ou toute autre substance.
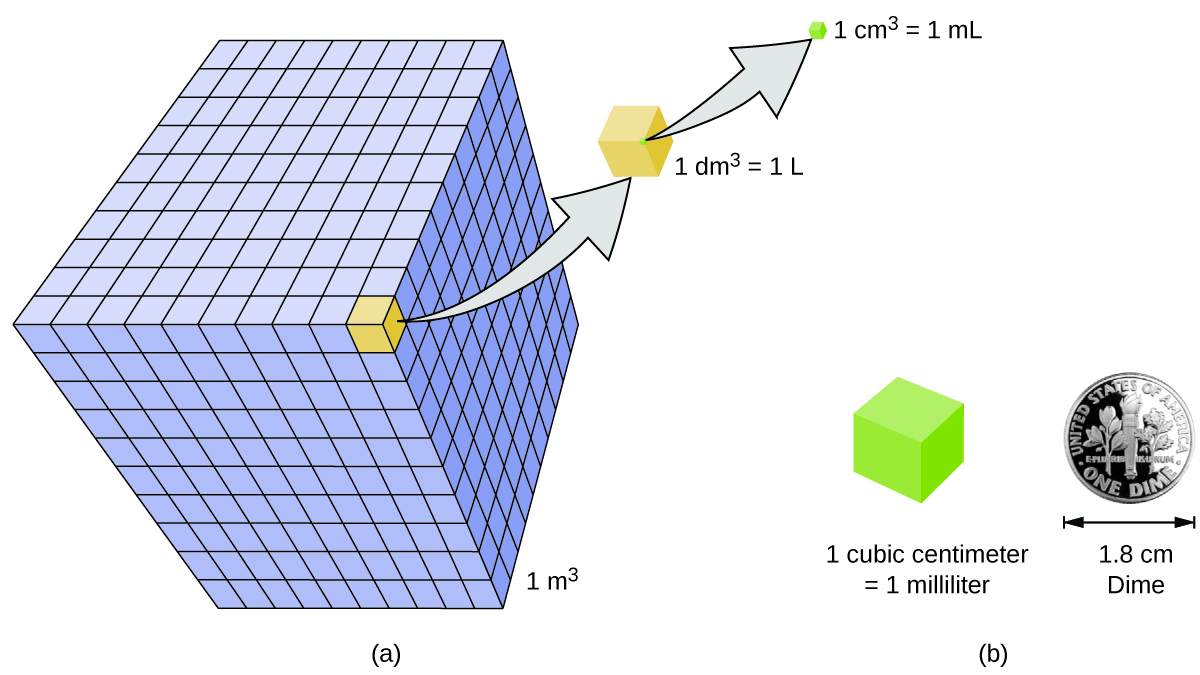
Une unité de volume plus couramment utilisée est dérivée du décimètre (0,1 m ou 10 cm). Un cube dont la longueur des arêtes est exactement d'un décimètre contient un volume d'un décimètre cube (dm 3). Un litre (L) est le nom le plus courant du décimètre cube. Un litre équivaut à environ 1,06 pintes. Un centimètre cube (cm 3) est le volume d'un cube dont la longueur d'arête est exactement d'un centimètre. L'abréviation cc (pour c ubic c entimeter) est souvent utilisée par les professionnels de santé. Un centimètre cube est également appelé millilitre (mL) et est égal à 1/1000 de litre.
Densité
Nous utilisons la masse et le volume d'une substance pour déterminer sa densité. Ainsi, les unités de densité sont définies par les unités de base de masse et de longueur.
La densité d'une substance est le rapport entre la masse d'un échantillon de la substance et son volume. L'unité SI pour la densité est le kilogramme par mètre cube (kg/m 3). Dans de nombreuses situations, cependant, il s'agit d'une unité peu pratique, et nous utilisons souvent des grammes par centimètre cube (g/cm 3) pour les densités des solides et des liquides, et des grammes par litre (g/L) pour les gaz. Bien qu'il y ait des exceptions, la plupart des liquides et des solides ont des densités comprises entre environ 0,7 g/cm 3 (la densité de l'essence) et 19 g/cm 3 (la densité de l'or). La densité de l'air est d'environ 1,2 g/L. Le tableau\(\PageIndex{3}\) montre les densités de certaines substances courantes.
| Solides | liquides | Gaz (à 25 °C et 1 atm) |
|---|---|---|
| glace (à 0 °C) 0,92 g/cm 3 | eau 1,0 g/cm 3 | air sec 1,20 g/L |
| chêne (bois) 0,60—0,90 g/cm 3 | éthanol 0,79 g/cm 3 | oxygène 1,31 g/L |
| fer 7,9 g/cm 3 | acétone 0,79 g/cm 3 | azote 1,14 g/L |
| cuivre 9,0 g/cm 3 | glycérine 1,26 g/cm 3 | dioxyde de carbone 1,80 g/L |
| plomb 11,3 g/cm 3 | huile d'olive 0,92 g/cm 3 | hélium 0,16 g/L |
| argent 10,5 g/cm 3 | essence 0,70—0,77 g/cm 3 | néon 0,83 g/L |
| or 19,3 g/cm 3 | mercure 13,6 g/cm 3 | radon 9,1 g/L |
Bien qu'il existe de nombreuses façons de déterminer la densité d'un objet, la méthode la plus simple consiste peut-être à déterminer séparément la masse et le volume de l'objet, puis à diviser la masse de l'échantillon par son volume. Dans l'exemple suivant, la masse est déterminée directement par pesée, mais le volume est trouvé indirectement par des mesures de longueur.
\[\mathrm{density=\dfrac{mass}{volume}} \nonumber \]
Calcul de la densité L'or, sous forme de briques, de barres et de pièces, est une forme de monnaie depuis des siècles. Afin d'inciter les gens à payer pour une brique d'or sans investir réellement dans une brique d'or, les gens ont envisagé de remplir le centre des briques creuses en or avec du plomb pour tromper les acheteurs en leur faisant croire que toute la brique est en or. Cela ne fonctionne pas : le plomb est une substance dense, mais sa densité n'est pas aussi grande que celle de l'or, 19,3 g/cm 3. Quelle est la densité du plomb si un cube de plomb a une longueur de bord de 2 cm et une masse de 90,7 g ?
Solution
La densité d'une substance peut être calculée en divisant sa masse par son volume. Le volume d'un cube est calculé en coupant la longueur de l'arête.
\[\mathrm{volume\: of\: lead\: cube=2.00\: cm\times2.00\: cm\times2.00\: cm=8.00\: cm^3} \nonumber \]
\[\mathrm{density=\dfrac{mass}{volume}=\dfrac{90.7\: g}{8.00\: cm^3}=\dfrac{11.3\: g}{1.00\: cm^3}=11.3\: g/cm^3} \nonumber \]
(Nous aborderons la raison de l'arrondissement à la première décimale dans la section suivante.)
- À trois décimales près, quel est le volume d'un cube (cm 3) dont l'arête a une longueur de 0,843 cm ?
- Si le cube de la partie (a) est en cuivre et a une masse de 5,34 g, quelle est la densité du cuivre à deux décimales ?
- Répondez à une
-
0,599 cm 3 ;
- Réponse b
-
8,91 g/cm 3
Cette simulation PhET illustre une autre façon de déterminer la densité en utilisant le déplacement de l'eau. Déterminez la densité des blocs rouges et jaunes.
Solution
Lorsque vous ouvrez la simulation de densité et que vous sélectionnez Même masse, vous pouvez choisir parmi plusieurs blocs colorés de 5 kg que vous pouvez déposer dans un réservoir contenant 100 L d'eau. Le bloc jaune flotte (il est moins dense que l'eau) et le niveau de l'eau s'élève à 105,00 L. Pendant qu'il flotte, le bloc jaune déplace 5,00 L d'eau, soit une quantité égale au poids du bloc. Le bloc rouge coule (il est plus dense que l'eau, qui a une densité = 1,00 kg/L) et le niveau de l'eau monte à 101,25 L.
Le bloc rouge déplace donc 1,25 L d'eau, soit une quantité égale au volume du bloc. La densité du bloc rouge est de :
\[\mathrm{density=\dfrac{mass}{volume}=\dfrac{5.00\: kg}{1.25\: L}=4.00\: kg/L} \nonumber \]
Notez que le bloc jaune n'étant pas complètement immergé, vous ne pouvez pas déterminer sa densité à partir de ces informations. Mais si vous maintenez le bloc jaune au fond du réservoir, le niveau de l'eau s'élève à 110,00 L, ce qui signifie qu'il déplace désormais 10,00 L d'eau, et sa densité peut être trouvée :
\[\mathrm{density=\dfrac{mass}{volume}=\dfrac{5.00\: kg}{10.00\: L}=0.500\: kg/L} \nonumber \]
Retirez tous les blocs de l'eau et ajoutez le bloc vert au réservoir d'eau en le plaçant approximativement au milieu du réservoir. Déterminez la densité du bloc vert.
- Réponse
-
2,00 kg/L
Résumé
Les mesures fournissent des informations quantitatives essentielles à l'étude et à la pratique de la chimie. Chaque mesure possède une quantité, une unité de comparaison et une incertitude. Les mesures peuvent être représentées en notation décimale ou scientifique. Les scientifiques utilisent principalement le SI (système international) ou les systèmes métriques. Nous utilisons des unités SI de base telles que les mètres, les secondes et les kilogrammes, ainsi que des unités dérivées, telles que les litres (pour le volume) et le g/cm 3 (pour la densité). Dans de nombreux cas, nous trouvons pratique d'utiliser des préfixes d'unités qui produisent des unités fractionnaires et multiples, telles que des microsecondes (10 −6 secondes) et des mégahertz (10 6 hertz), respectivement.
Équations clés
- \(\mathrm{density=\dfrac{mass}{volume}}\)
Lexique
- Celsius (°C)
- unité de température ; l'eau gèle à 0 °C et bout à 100 °C sur cette échelle
- centimètre cube (cm 3 ou cc)
- volume d'un cube d'une longueur d'arête d'exactement 1 cm
- mètre cube (m 3)
- Unité de volume SI
- densité
- rapport entre la masse et le volume d'une substance ou d'un objet
- kelvin (K)
- Unité de température SI ; 273,15 K = 0 ºC
- kilogramme (kg)
- unité de masse SI standard ; 1 kg = environ 2,2 livres
- longueur
- mesure d'une dimension d'un objet
- litre (L)
- (également, décimètre cube) unité de volume ; 1 L = 1 000 cm 3
- mètre (m)
- unité de longueur métrique et SI standard ; 1 m = environ 1 094 mètres
- millilitre (ml)
- 1/1 000 de litre ; égal à 1 cm 3
- seconde (s)
- Unité de temps SI
- Unités SI (Système international d'unités)
- normes fixées par un accord international dans le Système international d'unités (Le Système International d'Unités)
- unité
- norme de comparaison pour les mesures
- volume
- quantité d'espace occupé par un objet


