1.3 : Propriétés physiques et chimiques
- Page ID
- 194004
- Décrivez la différence entre les propriétés physiques et chimiques ou celles qui ont été modifiées.
- Identifiez une propriété ou une transformation comme étant physique ou chimique à l'aide de représentations symboliques, particulaires ou macroscopiques.
- Identifier les propriétés de la matière, qu'elles soient étendues ou intensives.
- Reconnaissez et décrivez les parties du diamant dangereux de la NFPA.
Les caractéristiques qui nous permettent de distinguer une substance d'une autre sont appelées propriétés. Une propriété physique est une caractéristique d'une matière qui n'est pas associée à une modification de sa composition chimique. Des exemples connus de propriétés physiques incluent la densité, la couleur, la dureté, les points de fusion et d'ébullition et la conductivité électrique. Nous pouvons observer certaines propriétés physiques, telles que la densité et la couleur, sans modifier l'état physique de la matière observée. D'autres propriétés physiques, telles que la température de fusion du fer ou la température de congélation de l'eau, ne peuvent être observées que lorsque la matière subit un changement physique. Un changement physique est un changement de l'état ou des propriétés d'une matière sans modification concomitante de sa composition chimique (identité des substances contenues dans la matière). Nous observons un changement physique lorsque la cire fond, lorsque le sucre se dissout dans le café et lorsque la vapeur se condense en eau liquide (Figure\(\PageIndex{1}\)). Parmi les autres exemples de modifications physiques, citons la magnétisation et la démagnétisation des métaux (comme c'est le cas avec les étiquettes de sécurité antivol courantes) et le broyage de solides en poudres (ce qui peut parfois provoquer des changements de couleur visibles). Dans chacun de ces exemples, il y a un changement dans l'état physique, la forme ou les propriétés de la substance, mais aucun changement dans sa composition chimique.

La transformation d'un type de matière en un autre (ou l'incapacité de changer) est une propriété chimique. Parmi les propriétés chimiques, citons l'inflammabilité, la toxicité, l'acidité, la réactivité (de nombreux types) et la chaleur de combustion. Le fer, par exemple, se combine à l'oxygène en présence d'eau pour former de la rouille ; le chrome ne s'oxyde pas (Figure\(\PageIndex{2}\)). La nitroglycérine est très dangereuse car elle explose facilement ; le néon ne présente pratiquement aucun danger car il est très peu réactif.

Pour identifier une propriété chimique, nous recherchons un changement chimique. Un changement chimique produit toujours un ou plusieurs types de matière qui diffèrent de la matière présente avant le changement. La formation de rouille est un changement chimique, car la rouille est une matière différente de celle du fer, de l'oxygène et de l'eau présents avant la formation de la rouille. L'explosion de nitroglycérine est un changement chimique car les gaz produits sont des matières très différentes de celles de la substance d'origine. Parmi les autres exemples de modifications chimiques, citons les réactions effectuées en laboratoire (comme la réaction du cuivre avec l'acide nitrique), toutes les formes de combustion (combustion) et la cuisson, la digestion ou la pourriture des aliments (Figure\(\PageIndex{3}\)).

Les propriétés de la matière se répartissent en deux catégories. Si la propriété dépend de la quantité de matière présente, il s'agit d'une propriété étendue. La masse et le volume d'une substance sont des exemples de propriétés étendues ; par exemple, un gallon de lait a une masse et un volume plus importants qu'une tasse de lait. La valeur d'une propriété étendue est directement proportionnelle à la quantité de matière en question. Si la propriété d'un échantillon de matière ne dépend pas de la quantité de matière présente, il s'agit d'une propriété intensive. La température est un exemple de propriété intensive. Si le gallon et la tasse de lait sont chacun à 20 °C (température ambiante), lorsqu'ils sont combinés, la température reste à 20 °C. Autre exemple, considérez les propriétés distinctes mais connexes de la chaleur et de la température. Une goutte d'huile de cuisson chaude éclaboussée sur votre bras provoque une gêne brève et mineure, tandis qu'une casserole d'huile chaude provoque de graves brûlures. La goutte et le pot d'huile sont tous deux à la même température (propriété intensive), mais le pot contient clairement beaucoup plus de chaleur (propriété étendue).
Diamant Hazard
Vous avez peut-être vu le symbole illustré à la figure\(\PageIndex{4}\) sur des récipients contenant des produits chimiques dans un laboratoire ou un lieu de travail. Parfois appelé « diamant de feu » ou « diamant dangereux », ce diamant chimique fournit des informations précieuses qui résument brièvement les différents dangers dont il faut être conscient lorsque l'on travaille avec une substance particulière.
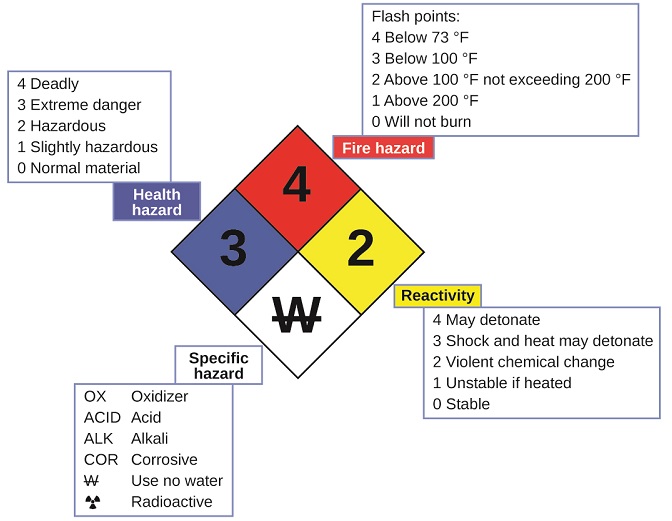
Le système d'identification des risques 704 de la National Fire Protection Agency (NFPA) a été développé par la NFPA pour fournir des informations de sécurité sur certaines substances. Le système détaille l'inflammabilité, la réactivité, la santé et les autres dangers. Dans le symbole global en forme de losange, le losange supérieur (rouge) indique le niveau de risque d'incendie (plage de température pour le point d'éclair). Le losange bleu (à gauche) indique le niveau de danger pour la santé. Le losange jaune (à droite) décrit les risques de réactivité, tels que la rapidité avec laquelle la substance va subir une détonation ou un changement chimique violent. Le losange blanc (en bas) indique les risques particuliers, par exemple s'il s'agit d'un oxydant (qui permet à la substance de brûler en l'absence d'air/d'oxygène), de subir une réaction inhabituelle ou dangereuse avec l'eau, d'être corrosif, acide, alcalin, de présenter un danger biologique, d'être radioactif, etc. Chaque danger est évalué sur une échelle de 0 à 4, 0 correspondant à l'absence de danger et 4 à l'extrême danger.
Bien que de nombreux éléments présentent des propriétés chimiques et physiques très différentes, certains ont des propriétés similaires. Nous pouvons identifier des ensembles d'éléments qui présentent des comportements communs. Par exemple, de nombreux éléments conduisent bien la chaleur et l'électricité, tandis que d'autres sont de mauvais conducteurs. Ces propriétés peuvent être utilisées pour classer les éléments en trois catégories : les métaux (éléments qui conduisent bien), les éléments non métalliques (éléments peu conducteurs) et les métalloïdes (éléments qui possèdent des propriétés à la fois métalliques et non métalliques).
Le tableau périodique est un tableau d'éléments qui place les éléments ayant des propriétés similaires à proximité les uns des autres (Figure\(\PageIndex{5}\)). Vous en apprendrez davantage sur le tableau périodique au fur et à mesure que vous poursuivrez vos études de chimie.
Résumé
Toutes les substances ont des propriétés physiques et chimiques distinctes et peuvent subir des modifications physiques ou chimiques. Les propriétés physiques, telles que la dureté et le point d'ébullition, et les modifications physiques, telles que la fusion ou la congélation, n'impliquent pas de modification de la composition de la matière. Les propriétés chimiques, telles que l'inflammabilité et l'acidité, ainsi que les modifications chimiques, telles que la rouille, impliquent la production de matière différente de celle présente auparavant.
Les propriétés mesurables entrent dans l'une des deux catégories suivantes. Les propriétés étendues dépendent de la quantité de matière présente, par exemple de la masse d'or. Les propriétés intensives ne dépendent pas de la quantité de matière présente, par exemple de la densité de l'or. La chaleur est un exemple de propriété étendue, et la température est un exemple de propriété intensive.
Lexique
- changement chimique
- changement produisant un type de matière différent du type de matière d'origine
- propriété chimique
- comportement lié à la transformation d'un type de matière en un autre
- vaste propriété
- propriété d'une substance qui dépend de la quantité de la substance
- propriété intensive
- propriété d'une substance qui est indépendante de la quantité de la substance
- changement physique
- modification de l'état ou des propriétés de la matière qui n'entraîne pas de modification de sa composition chimique
- propriété physique
- caractéristique d'une matière qui n'est associée à aucune modification de sa composition chimique


