1.2 : Phases et classification de la matière
- Page ID
- 194006
- Décrivez les propriétés de base de chaque état physique de la matière : solide, liquide et gazeux.
- Définissez et donnez des exemples d'atomes et de molécules.
- Classer la matière en tant qu'élément, composé, mélange homogène ou mélange hétérogène en fonction de son état physique et de sa composition.
- Utilisez des représentations symboliques, particulaires ou macroscopiques pour décrire ou classer les différents types de matière.
- Faites la distinction entre la masse et le poids.
- Appliquer la loi de conservation de la matière.
La matière est définie comme tout ce qui occupe l'espace et possède une masse, et qui est tout autour de nous. Les solides et les liquides sont plus évidemment de la matière : on voit qu'ils prennent de la place et que leur poids nous indique qu'ils ont de la masse. Les gaz sont également de la matière ; si les gaz ne prenaient pas de place, un ballon resterait affaissé au lieu de se gonfler lorsqu'il était rempli de gaz.
Les solides, les liquides et les gaz sont les trois états de la matière les plus courants sur Terre (Figure\(\PageIndex{1}\)). Un solide est rigide et possède une forme définie. Un liquide s'écoule et prend la forme d'un récipient, sauf qu'il forme une surface supérieure plane ou légèrement incurvée lorsqu'il est soumis à l'action de la gravité. (En apesanteur, les liquides prennent une forme sphérique.) Les échantillons liquides et solides ont des volumes pratiquement indépendants de la pression. Un gaz prend à la fois la forme et le volume de son contenant.
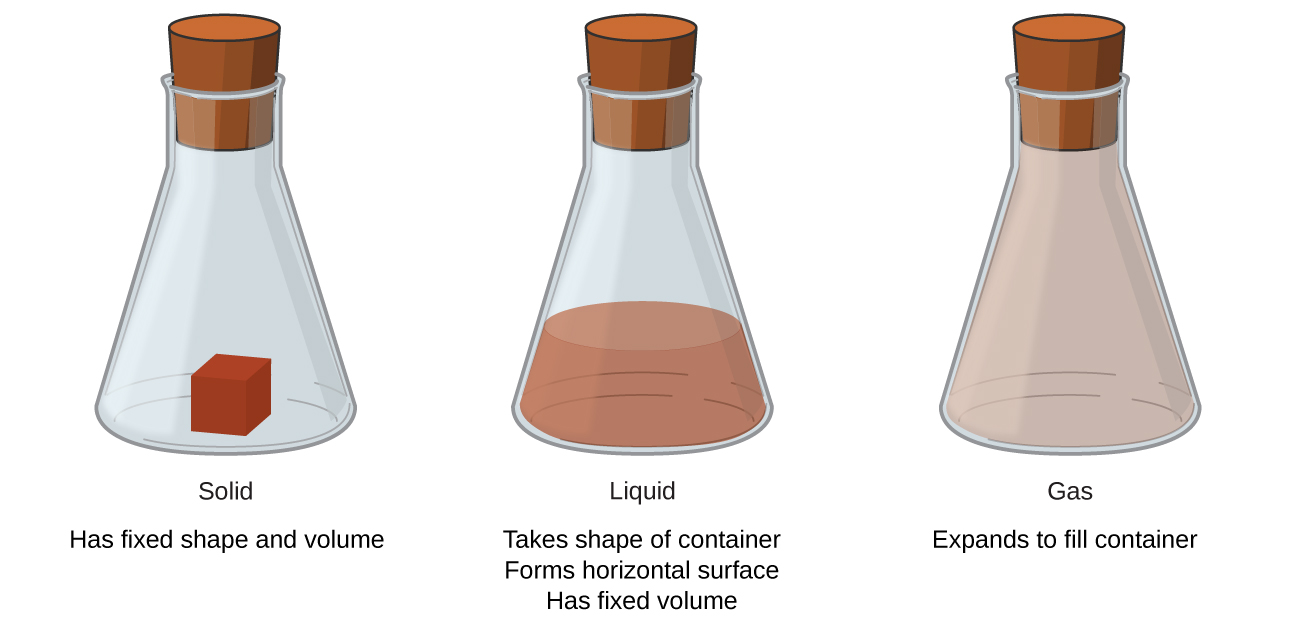
Un quatrième état de la matière, le plasma, se produit naturellement à l'intérieur des étoiles. Un plasma est un état gazeux de matière qui contient un nombre appréciable de particules chargées électriquement (Figure\(\PageIndex{2}\)). La présence de ces particules chargées confère aux plasmas des propriétés uniques qui justifient leur classification en tant qu'état de matière distinct des gaz. Outre les étoiles, les plasmas se trouvent dans d'autres environnements à haute température (naturels et artificiels), tels que les éclairs, certains écrans de télévision et des instruments d'analyse spécialisés utilisés pour détecter des traces de métaux.

Vidéo\(\PageIndex{1}\) : Dans une minuscule cellule d'un téléviseur plasma, le plasma émet de la lumière ultraviolette, ce qui donne à l'écran de cet endroit une couleur spécifique. Le composite de ces minuscules points de couleur constitue l'image que vous voyez. Regardez cette vidéo pour en savoir plus sur le plasma et les endroits où vous le rencontrez.
Certains échantillons de matière semblent avoir des propriétés de solides, de liquides et/ou de gaz à la fois. Cela peut se produire lorsque l'échantillon est composé de nombreux petits morceaux. Par exemple, on peut verser du sable comme s'il s'agissait d'un liquide car il est composé de nombreux petits grains de sable solide. La matière peut également avoir des propriétés de plusieurs états lorsqu'elle est un mélange, comme dans le cas des nuages. Les nuages semblent se comporter un peu comme des gaz, mais ils sont en fait des mélanges d'air (gaz) et de minuscules particules d'eau (liquide ou solide).
La masse d'un objet est une mesure de la quantité de matière qu'il contient. L'une des manières de mesurer la masse d'un objet consiste à mesurer la force nécessaire pour accélérer l'objet. Il faut beaucoup plus de force pour accélérer une voiture qu'un vélo car la voiture a beaucoup plus de masse. Une méthode plus courante pour déterminer la masse d'un objet consiste à utiliser une balance pour comparer sa masse à une masse standard.
Bien que le poids soit lié à la masse, ce n'est pas la même chose. Le poids fait référence à la force que la gravité exerce sur un objet. Cette force est directement proportionnelle à la masse de l'objet. Le poids d'un objet change en fonction de la force de gravité, mais sa masse ne change pas. La masse d'une astronaute ne change pas simplement parce qu'elle va sur la lune. Mais son poids sur la lune n'est que d'un sixième de son poids terrestre, car la gravité de la lune n'est que d'un sixième de celle de la Terre. Elle peut se sentir « en apesanteur » pendant son voyage lorsqu'elle subit des forces externes négligeables (gravitationnelles ou autres), bien qu'elle ne soit, bien entendu, jamais « sans masse ».
La loi de conservation de la matière résume de nombreuses observations scientifiques sur la matière : elle stipule qu'il n'y a aucun changement détectable dans la quantité totale de matière présente lorsque la matière passe d'un type à un autre (changement chimique) ou lorsque la matière passe d'un état solide, liquide ou gazeux ( un changement physique). Le brassage de la bière et le fonctionnement de batteries fournissent des exemples de conservation de la matière (Figure\(\PageIndex{4}\)). Lors du brassage de la bière, les ingrédients (eau, levure, céréales, malt, houblon et sucre) sont transformés en bière (eau, alcool, gazéification et substances aromatisantes) sans perte réelle de substance. Cela se voit le plus clairement lors du processus de mise en bouteille, lorsque le glucose se transforme en éthanol et en dioxyde de carbone et que la masse totale des substances ne change pas. Cela se voit également dans une batterie de voiture au plomb : les substances d'origine (plomb, oxyde de plomb et acide sulfurique), capables de produire de l'électricité, sont transformées en d'autres substances (sulfate de plomb et eau) qui ne produisent pas d'électricité, sans modification de la quantité réelle de matière.
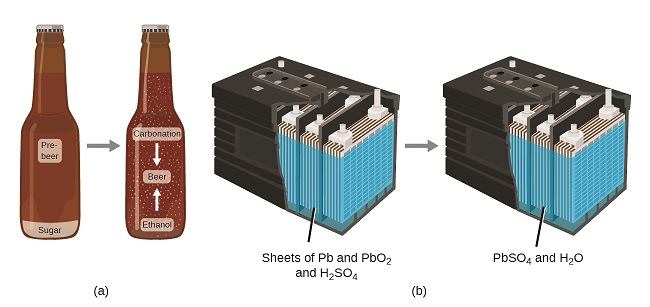
Bien que cette loi de conservation s'applique à toutes les conversions de matière, les exemples convaincants sont rares car, en dehors des conditions contrôlées en laboratoire, nous collectons rarement tout le matériel produit lors d'une conversion donnée. Par exemple, lorsque vous mangez, digérez et assimilez des aliments, toute la matière de l'aliment d'origine est préservée. Mais comme une partie de la matière est incorporée dans votre corps et qu'une grande partie est excrétée sous forme de divers types de déchets, il est difficile de le vérifier par des mesures.
Atomes et molécules
Un atome est la plus petite particule d'un élément qui possède les propriétés de cet élément et qui peut entrer dans une combinaison chimique. Prenons l'élément or, par exemple. Imaginez couper une pépite d'or en deux, puis l'une des moitiés en deux, et répéter ce processus jusqu'à ce qu'il reste une pièce d'or si petite qu'elle ne puisse pas être coupée en deux (quelle que soit la taille de votre couteau). Cette pièce d'or de taille minimale est un atome (du grec atomos, qui signifie « indivisible ») (Figure 1.2.4). Cet atome ne serait plus de l'or s'il était divisé davantage.

La première suggestion selon laquelle la matière est composée d'atomes est attribuée aux philosophes grecs Leucippe et Démocrite, qui ont développé leurs idées au Ve siècle avant notre ère. Cependant, ce n'est qu'au début du XIXe siècle que John Dalton (1766—1844), un instituteur britannique très intéressé par les sciences, a soutenu cette hypothèse par des mesures quantitatives. Depuis lors, des expériences répétées ont confirmé de nombreux aspects de cette hypothèse, qui est devenue l'une des théories centrales de la chimie. D'autres aspects de la théorie atomique de Dalton sont toujours utilisés, mais avec des révisions mineures (les détails de la théorie de Dalton sont fournis dans le chapitre sur les atomes et les molécules).
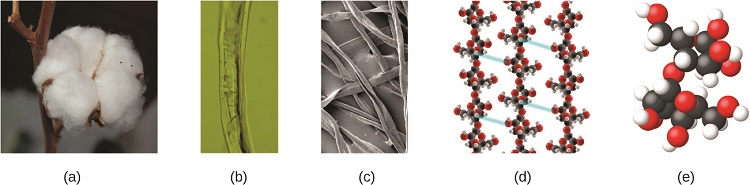
Un atome est si petit qu'il est difficile d'imaginer sa taille. L'une des plus petites choses que nous pouvons voir à l'œil nu est le fil d'une toile d'araignée : ces brins mesurent environ 1/10 000 de centimètre (0,0001 cm) de diamètre. Bien que la section transversale d'un brin soit presque impossible à voir sans microscope, elle est énorme à l'échelle atomique. Un seul atome de carbone dans la bande a un diamètre d'environ 0,000000015 centimètres, et il faudrait environ 7 000 atomes de carbone pour couvrir le diamètre du fil. Pour mettre les choses en perspective, si un atome de carbone avait la taille d'un centime, la section transversale d'un brin serait plus grande que celle d'un terrain de football, ce qui nécessiterait environ 150 millions de « centimes » d'atomes de carbone pour le recouvrir. (Figure\(\PageIndex{5}\)) montre des vues microscopiques et atomiques de plus en plus rapprochées du coton ordinaire.
Un atome est si léger que sa masse est également difficile à imaginer. Un milliard d'atomes de plomb (1 000 000 000 d'atomes) pèsent environ des\(3 \times 10^{−13}\) grammes, une masse bien trop légère pour être pesée, même sur les équilibres les plus sensibles du monde. Il faudrait peser plus de 300 000 000 000 000 d'atomes de plomb (300 billions, soit 3 × 10 14), et ils ne pèseraient que 0,0000001 gramme.
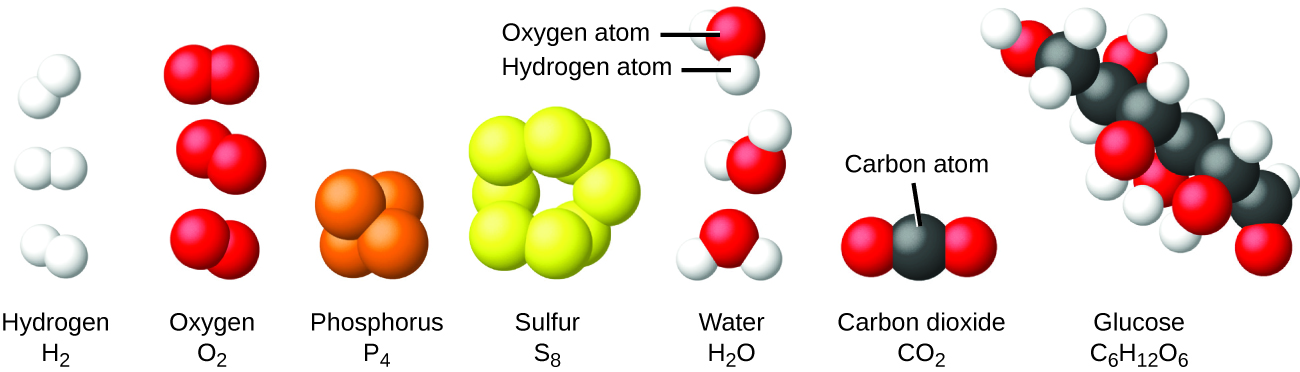
Il est rare de trouver des collections d'atomes individuels. Seuls quelques éléments, tels que les gaz hélium, néon et argon, sont constitués d'un ensemble d'atomes individuels qui se déplacent indépendamment les uns des autres. D'autres éléments, tels que les gaz hydrogène, azote, oxygène et chlore, sont composés d'unités constituées de paires d'atomes (Figure\(\PageIndex{6}\)). L'une des formes de l'élément phosphore est constituée d'unités composées de quatre atomes de phosphore. L'élément soufre existe sous différentes formes, dont l'une est constituée d'unités composées de huit atomes de soufre. Ces unités sont appelées molécules. Une molécule est constituée de deux atomes ou plus reliés par de fortes forces appelées liaisons chimiques. Les atomes d'une molécule se déplacent comme une unité, un peu comme les canettes de soda dans un pack de six ou un trousseau de clés réunies sur un seul porte-clés. Une molécule peut être constituée de deux atomes identiques ou plus, comme dans les molécules présentes dans les éléments hydrogène, oxygène et soufre, ou elle peut être constituée de deux atomes différents ou plus, comme dans les molécules présentes dans l'eau. Chaque molécule d'eau est une unité qui contient deux atomes d'hydrogène et un atome d'oxygène. Chaque molécule de glucose est une unité qui contient 6 atomes de carbone, 12 atomes d'hydrogène et 6 atomes d'oxygène. Comme les atomes, les molécules sont incroyablement petites et légères. Si un verre d'eau ordinaire était agrandi à la taille de la Terre, les molécules d'eau qu'il contient auraient à peu près la taille d'une balle de golf.
Classification de la matière
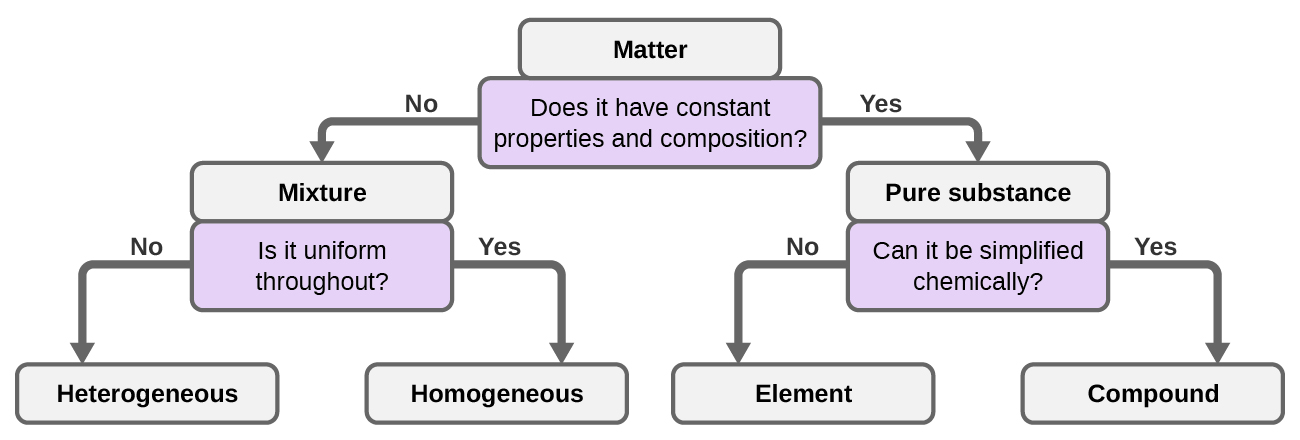
Nous pouvons classer la matière en plusieurs catégories. Deux grandes catégories sont les mélanges et les substances pures. Une substance pure a une composition constante. Tous les échantillons d'une substance pure ont exactement la même composition et les mêmes propriétés. Tout échantillon de saccharose (sucre de table) contient 42,1 % de carbone, 6,5 % d'hydrogène et 51,4 % d'oxygène en masse. Tout échantillon de saccharose possède également les mêmes propriétés physiques, telles que le point de fusion, la couleur et le goût sucré, quelle que soit la source d'où il est isolé.
On peut diviser les substances pures en deux classes : les éléments et les composés. Les substances pures qui ne peuvent pas être décomposées en substances plus simples par des modifications chimiques sont appelées éléments. Le fer, l'argent, l'or, l'aluminium, le soufre, l'oxygène et le cuivre sont des exemples familiers des plus de 100 éléments connus, dont environ 90 sont présents naturellement sur la Terre, et environ deux douzaines ont été créés en laboratoire.
Les substances pures qui peuvent être décomposées par des modifications chimiques sont appelées composés. Cette dégradation peut produire soit des éléments, soit d'autres composés, soit les deux. L'oxyde de mercure (II), un solide cristallin orange, peut être décomposé par la chaleur en éléments mercure et oxygène (Figure\(\PageIndex{7}\)). Lorsqu'il est chauffé en l'absence d'air, le saccharose se décompose en carbone et en eau composée. (L'étape initiale de ce processus, lorsque le sucre brunit, est connue sous le nom de caramélisation. C'est ce qui confère la saveur sucrée et noisette caractéristique aux pommes caramélisées, aux oignons caramélisés et au caramel). Le chlorure d'argent (I) est un solide blanc qui peut être décomposé en ses éléments, argent et chlore, par absorption de lumière. Cette propriété est à la base de l'utilisation de ce composé dans les films photographiques et les lunettes photochromiques (celles dont les verres s'assombrissent lorsqu'ils sont exposés à la lumière).

Les propriétés des éléments combinés sont différentes de celles de l'état libre ou non combiné. Par exemple, le sucre cristallin blanc (saccharose) est un composé résultant de la combinaison chimique de l'élément carbone, qui est un solide noir sous l'une de ses formes non combinées, et des deux éléments hydrogène et oxygène, qui sont des gaz incolores lorsqu'ils ne sont pas combinés. Le sodium libre, un élément qui est un solide métallique doux et brillant, et le chlore libre, un élément qui est un gaz jaune-vert, se combinent pour former du chlorure de sodium (sel de table), un composé qui est un solide cristallin blanc.
Un mélange est composé de deux ou plusieurs types de matières qui peuvent être présentes en quantités variables et peuvent être séparées par des changements physiques, tels que l'évaporation (vous en apprendrez plus à ce sujet plus tard). Un mélange dont la composition varie d'un point à l'autre est appelé mélange hétérogène. La vinaigrette italienne est un exemple de mélange hétérogène (Figure\(\PageIndex{1a}\)). Sa composition peut varier car nous pouvons la fabriquer à partir de quantités variables d'huile, de vinaigre et d'herbes. Il n'en va pas de même d'un point à l'autre du mélange : une goutte peut être principalement constituée de vinaigre, tandis qu'une autre goutte peut être composée principalement d'huile ou d'herbes, car l'huile et le vinaigre se séparent et les herbes se déposent. D'autres exemples de mélanges hétérogènes sont les biscuits aux pépites de chocolat (nous pouvons voir les morceaux séparés de chocolat, de noix et de pâte à biscuits) et le granit (nous pouvons voir le quartz, le mica, le feldspath, etc.).
Un mélange homogène, également appelé solution, présente une composition uniforme et apparaît visuellement de la même manière sur l'ensemble. Un exemple de solution est une boisson pour sportifs composée d'eau, de sucre, de colorants, d'arômes et d'électrolytes mélangés uniformément (Figure\(\PageIndex{1b}\)). Chaque goutte d'une boisson pour sportifs a le même goût, car chaque goutte contient les mêmes quantités d'eau, de sucre et d'autres composants. Notez que la composition d'une boisson pour sportifs peut varier : elle peut être préparée avec un peu plus ou moins de sucre, d'arômes ou d'autres composants, tout en restant une boisson pour sportifs. D'autres exemples de mélanges homogènes incluent l'air, le sirop d'érable, l'essence et une solution de sel dans de l'eau.

Bien qu'il y ait un peu plus de 100 éléments, des dizaines de millions de composés chimiques résultent de différentes combinaisons de ces éléments. Chaque composé a une composition spécifique et possède des propriétés chimiques et physiques précises qui nous permettent de le distinguer de tous les autres composés. Et, bien entendu, il existe d'innombrables façons de combiner des éléments et des composés pour former différents mélanges. Un résumé de la manière de distinguer les différentes principales classifications de la matière est présenté dans (Figure 1.2.8).
Onze éléments constituent environ 99 % de la croûte terrestre et de l'atmosphère (Tableau\(\PageIndex{1}\)). L'oxygène constitue près de la moitié et le silicium environ le quart de la quantité totale de ces éléments. La majorité des éléments de la planète se trouvent dans des combinaisons chimiques avec d'autres éléments ; environ un quart des éléments se trouvent également à l'état libre.
| Elément | symbole | Pourcentage de masse | Elément | symbole | Pourcentage de masse | |
|---|---|---|---|---|---|---|
| oxygène | O | 49,20 | chlore | Cl | 0,19 | |
| silicium | Monsieur | 25,67 | phosphore | P | 0,11 | |
| aluminium | Al | 7,50 | manganèse | Homme | 0,09 | |
| fer | Fe | 4,71 | carbone | C | 0,08 | |
| calcium | Californie | 3,39 | soufre | S | 0,06 | |
| sodium | Na | 2,63 | baryum | Ba | 0,04 | |
| potassium | K | 2,40 | nitrogène | N | 0,03 | |
| magnésium | Mg | 1,93 | fluor | F | 0,03 | |
| hydrogène | H | 0,87 | strontium | Sr | 0,02 | |
| titane | Ti | 0,58 | tous les autres | - | 0,47 |
Décomposition de l'eau/Production d'hydrogène
L'eau est constituée des éléments hydrogène et oxygène combinés dans un rapport de 2 pour 1. L'eau peut être décomposée en hydrogène et en oxygène gazeux par addition d'énergie. Pour ce faire, vous pouvez utiliser une batterie ou une alimentation, comme indiqué dans (Figure\(\PageIndex{9}\)).
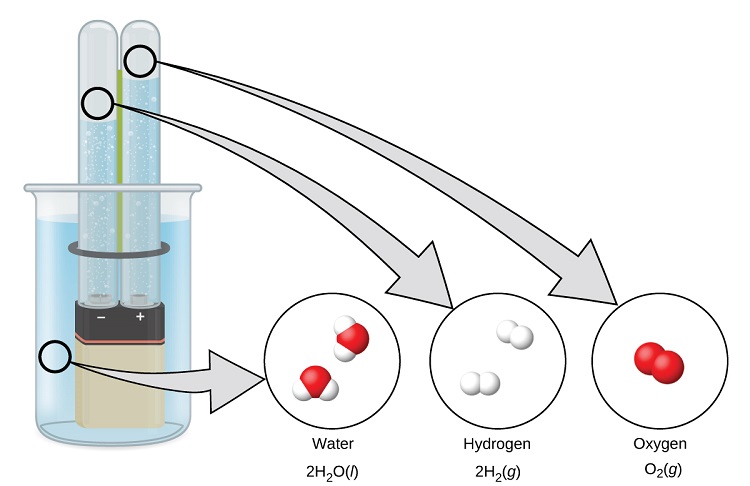
La décomposition de l'eau implique un réarrangement des atomes des molécules d'eau en différentes molécules, chacune composée de deux atomes d'hydrogène et de deux atomes d'oxygène, respectivement. Deux molécules d'eau forment une molécule d'oxygène et deux molécules d'hydrogène. La représentation de ce qui se passe sera explorée plus en profondeur dans les chapitres suivants.\(\ce{2H2O}(l)\rightarrow \ce{2H2}(g)+\ce{O2}(g)\)
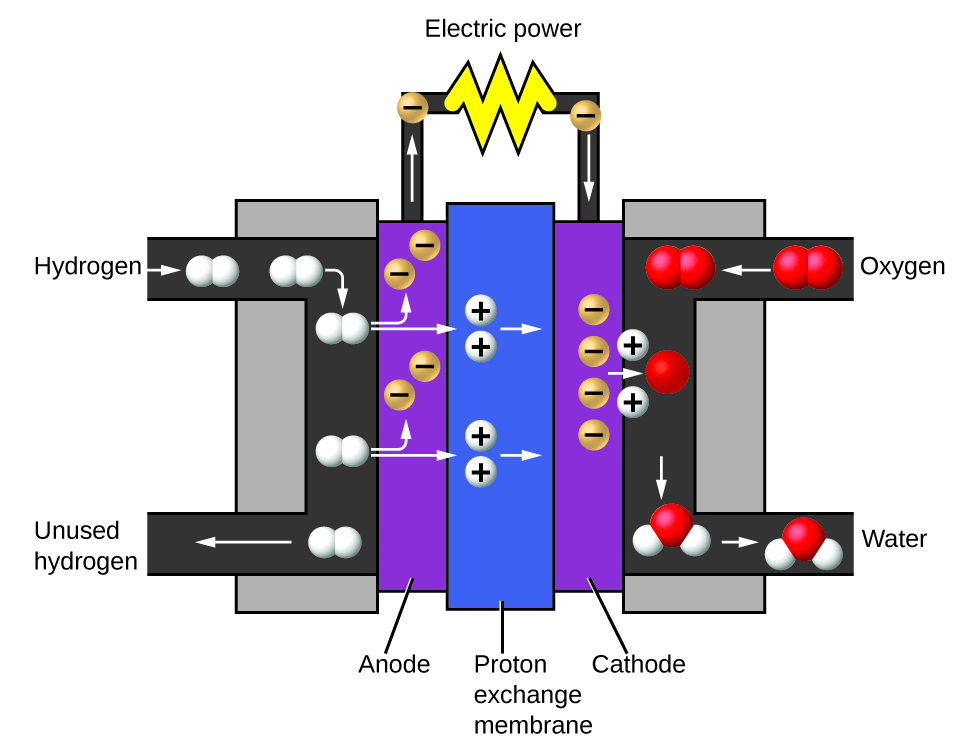
Les deux gaz produits ont des propriétés nettement différentes. L'oxygène n'est pas inflammable mais est nécessaire à la combustion d'un combustible, et l'hydrogène est hautement inflammable et constitue une puissante source d'énergie. Comment ces connaissances pourraient-elles être appliquées dans notre monde ? L'une des applications concerne la recherche de moyens de transport plus économes en carburant. Les véhicules à pile à combustible (FCV) fonctionnent à l'hydrogène plutôt qu'à l'essence (Figure\(\PageIndex{10}\)). Ils sont plus efficaces que les véhicules équipés de moteurs à combustion interne, sont non polluants et réduisent les émissions de gaz à effet de serre, ce qui nous rend moins dépendants des combustibles fossiles. Les véhicules à combustible nucléaire ne sont toutefois pas encore viables sur le plan économique et la production actuelle d'hydrogène dépend du gaz naturel. Si nous parvenons à mettre au point un procédé permettant de décomposer l'eau de manière économique ou de produire de l'hydrogène d'une autre manière respectueuse de l'environnement, les véhicules à combustion interne pourraient être la solution du futur.
Chimie des téléphones portables
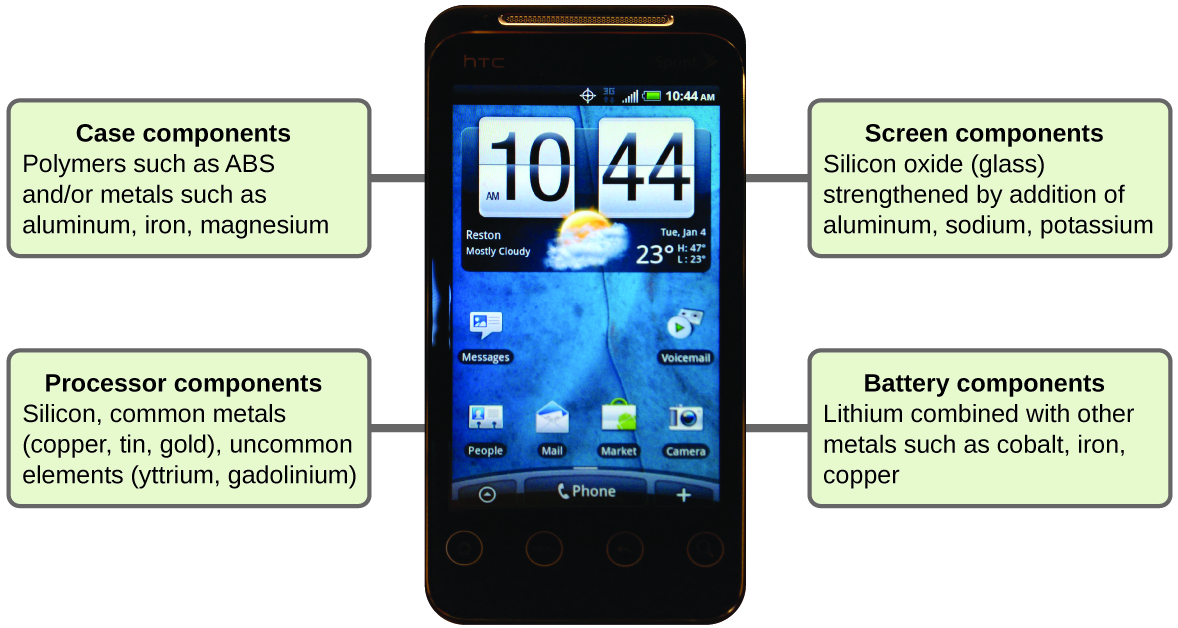
Imaginez à quel point votre vie serait différente sans les téléphones portables (Figure\(\PageIndex{11}\)) et les autres appareils intelligents. Les téléphones portables sont fabriqués à partir de nombreuses substances chimiques, qui sont extraites, raffinées, purifiées et assemblées grâce à une compréhension approfondie des principes chimiques. Environ 30 % des éléments que l'on trouve dans la nature se trouvent dans un téléphone intelligent classique. Le boîtier/corps/cadre est constitué d'une combinaison de polymères robustes et durables composés principalement de carbone, d'hydrogène, d'oxygène et d'azote [thermoplastiques à l'acrylonitrile-butadiène-styrène (ABS) et au polycarbonate] et de métaux structuraux légers et résistants, tels que l'aluminium, le magnésium et le fer. L'écran d'affichage est fabriqué à partir d'un verre spécialement trempé (verre de silice renforcé par l'ajout d'aluminium, de sodium et de potassium) et recouvert d'un matériau le rendant conducteur (tel que l'oxyde d'indium et d'étain). La carte de circuit utilise un matériau semi-conducteur (généralement du silicium), des métaux couramment utilisés comme le cuivre, l'étain, l'argent et l'or, et des éléments plus inconnus tels que l'yttrium, le praséodyme et le gadolinium. La batterie repose sur des ions lithium et divers autres matériaux, notamment le fer, le cobalt, le cuivre, l'oxyde de polyéthylène et le polyacrylonitrile.
Résumé
La matière est tout ce qui occupe l'espace et possède une masse. L'élément constitutif de base de la matière est l'atome, la plus petite unité d'un élément qui peut entrer en combinaison avec des atomes du même élément ou d'autres éléments. Dans de nombreuses substances, les atomes sont combinés en molécules. Sur Terre, la matière existe généralement sous trois états : les solides, de forme et de volume fixes ; les liquides, de forme variable mais de volume fixe ; et les gaz, de forme et de volume variables. Dans des conditions de température élevée, la matière peut également exister sous forme de plasma. La majeure partie de la matière est un mélange : elle est composée de deux types ou plus de matières qui peuvent être présentes en quantités variables et peuvent être séparées par des moyens physiques. La composition des mélanges hétérogènes varie d'un point à l'autre ; les mélanges homogènes ont la même composition d'un point à l'autre. Les substances pures ne sont constituées que d'un seul type de matière. Une substance pure peut être un élément constitué d'un seul type d'atome et ne pouvant pas être décomposé par un changement chimique, ou un composé composé de deux types d'atomes ou plus.
Lexique
- atome
- plus petite particule d'un élément pouvant entrer dans une combinaison chimique
- composé
- substance pure qui peut être décomposée en deux éléments ou plus
- élément
- substance composée d'un seul type d'atome ; substance qui ne peut pas être décomposée par un changement chimique
- gaz
- état dans lequel la matière n'a ni volume ni forme définis
- mélange hétérogène
- combinaison de substances dont la composition varie d'un point à l'autre
- mélange homogène
- (également, solution) combinaison de substances dont la composition est uniforme dans l'ensemble
- liquide
- état de la matière qui a un volume défini mais une forme indéfinie
- loi de conservation de la matière
- lorsque la matière passe d'un type à un autre ou change de forme, il n'y a aucun changement détectable dans la quantité totale de matière présente
- masse
- propriété fondamentale indiquant la quantité de matière
- problème
- tout ce qui occupe l'espace et a une masse
- mélange
- matière qui peut être séparée en ses composants par des moyens physiques
- molécule
- collection liée de deux atomes ou plus d'éléments identiques ou différents
- plasma
- état gazeux d'une matière contenant un grand nombre d'atomes et/ou de molécules chargés électriquement
- substance pure
- substance homogène ayant une composition constante
- solide
- état de matière rigide, de forme définie et de volume assez constant
- poids
- force que la gravité exerce sur un objet


