20.3: 凝集测定
- Page ID
- 200261
学习目标
- 比较直接凝集和间接凝集
- 确定血凝素在疾病诊断中的各种用途
- 解释血型是如何确定的
- 解释交叉匹配输血时使用的血液的步骤
除了导致可溶性分子沉淀和悬浮分子絮凝外,抗体还可以在称为凝集的过程中将细胞或颗粒(例如抗原包衣的乳胶珠)聚集在一起(图18.1.8)。 凝集可用作是否存在针对细菌或红细胞的抗体的指标。 凝集测定通常在玻璃载玻片或微量滴定板上快速简便地进行(图\(\PageIndex{1}\))。 微量滴定板有一系列孔,用于存放少量试剂,并通过目视或使用专门设计的分光光度计观察反应(例如凝集)。 这些井有许多不同的大小,用于涉及不同体积试剂的测定。
细菌和病毒的凝集
丽贝卡·兰斯菲尔德与她的同事 A.R. Dochez 和 Oswald Avery 在 20 世纪 20 年代开发了使用凝集测试来鉴定链球菌的技术。 1 她使用抗体鉴定 M 蛋白,这是链球菌的一种毒性因子,是细菌引起链球菌性喉炎所必需的。 产生针对 M 蛋白的抗体对于增强对细菌的保护反应至关重要。
兰斯菲尔德使用抗血清来证明相同种类的链球菌的不同菌株表达不同版本的M蛋白,这就解释了为什么孩子会反复患上链球菌性喉炎。 兰斯菲尔德根据位于细菌细胞壁中的群体特异性多糖的抗原差异将β-溶血性链球菌分为多组。 这些菌株之所以被称为血清病毒,是因为它们是使用抗血清进行分化的。 识别疾病暴发中存在的血清病毒很重要,因为有些血清病毒可能比其他血清病毒引起更严重的疾病。
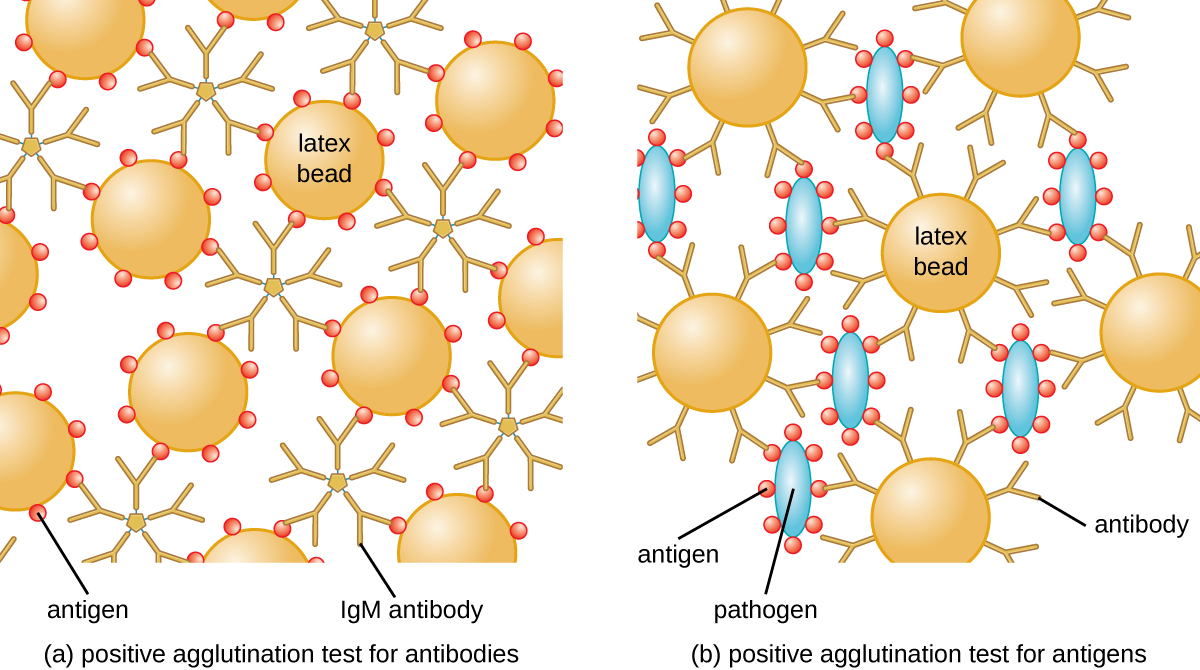
兰斯菲尔德开发的方法是一种直接凝集试验,因为细菌细胞本身会凝集。 如今,在鉴定细菌和病毒血清体时更常用类似的策略;但是,为了改善凝集的可视化,抗体可能会附着在惰性乳胶珠上。 这种技术被称为间接凝集试验(或乳胶固定试验),因为珠子的凝集是抗体与其他抗原结合的标志(图\(\PageIndex{2}\))。 间接测定可用于检测抗体或特异性抗原的存在。
为了识别患者血清中的抗体,将感兴趣的抗原附着在乳胶珠上。 当与患者血清混合时,抗体将结合抗原,交联乳胶珠并使胶珠间接凝集;这表明存在抗体(图\(\PageIndex{3}\))。 这种技术在寻找 IgM 抗体时最常使用,因为它们的结构提供了最大的交联。 该测定的一个广泛使用的例子是类风湿因子(RF)检测,以确认类风湿关节炎的诊断。 实际上,射频是指存在与患者自身的 IgG 结合的 IgM 抗体。 射频会凝集 IgG 涂层的乳胶珠。
在反向测试中,通过将特异性抗体(通常是单抗体)附着在乳胶珠上,然后将这种复合物与血清混合,可以在患者的血清中检测出可溶性抗原(图\(\PageIndex{3}\))。
凝集测试在可能缺乏适当细菌培养设施的欠发达国家被广泛使用。 例如,用于诊断伤寒的 Widal 测试可寻找患者血清中肠道沙门氏菌亚种伤寒的凝集情况。 Widal测试快速、廉价,可用于监测疫情的程度;但是,它不如涉及细菌培养的测试准确。 Widal 检测经常在以前感染过其他沙门氏菌亚种的患者中产生误报,而在高蛋白血症或免疫缺陷患者中则产生假阴性。
此外,凝集测试受到以下事实的限制:患者在感染的第一周(或更长时间)内通常无法产生可检测的抗体水平。 据说当抗体水平达到检测阈值时,患者已经进行了血清转化。 通常,血清转化与疾病体征和症状的出现相吻合。 但是,例如,在HIV感染中,血清转化通常需要3周才能发生,在某些情况下,可能需要更长的时间。
与沉淀素环试验和斑块测定技术类似,常规做法是连续制备患者血清的两倍稀释剂并确定存在的凝集抗体的滴度。 由于原发和继发免疫反应中的抗体水平会随着时间的推移而变化,因此通过检查样本随时间推移可以检测出抗体滴度的变化。 例如,将感染急性期的滴度与恢复期的滴度进行比较,可以区分感染是当前的还是过去发生的。 还可以监测患者的免疫系统对病原体的反应情况。
观看这段视频,该视频演示了乳胶珠的凝集反应。
练习\(\PageIndex{1}\)
- 凝集是如何用来区分血清病毒的?
- 在测试患者血清中是否有抗体的乳胶珠测定中,珠子涂了什么?
- 患者接受血清转化后会发生什么?
血凝作用
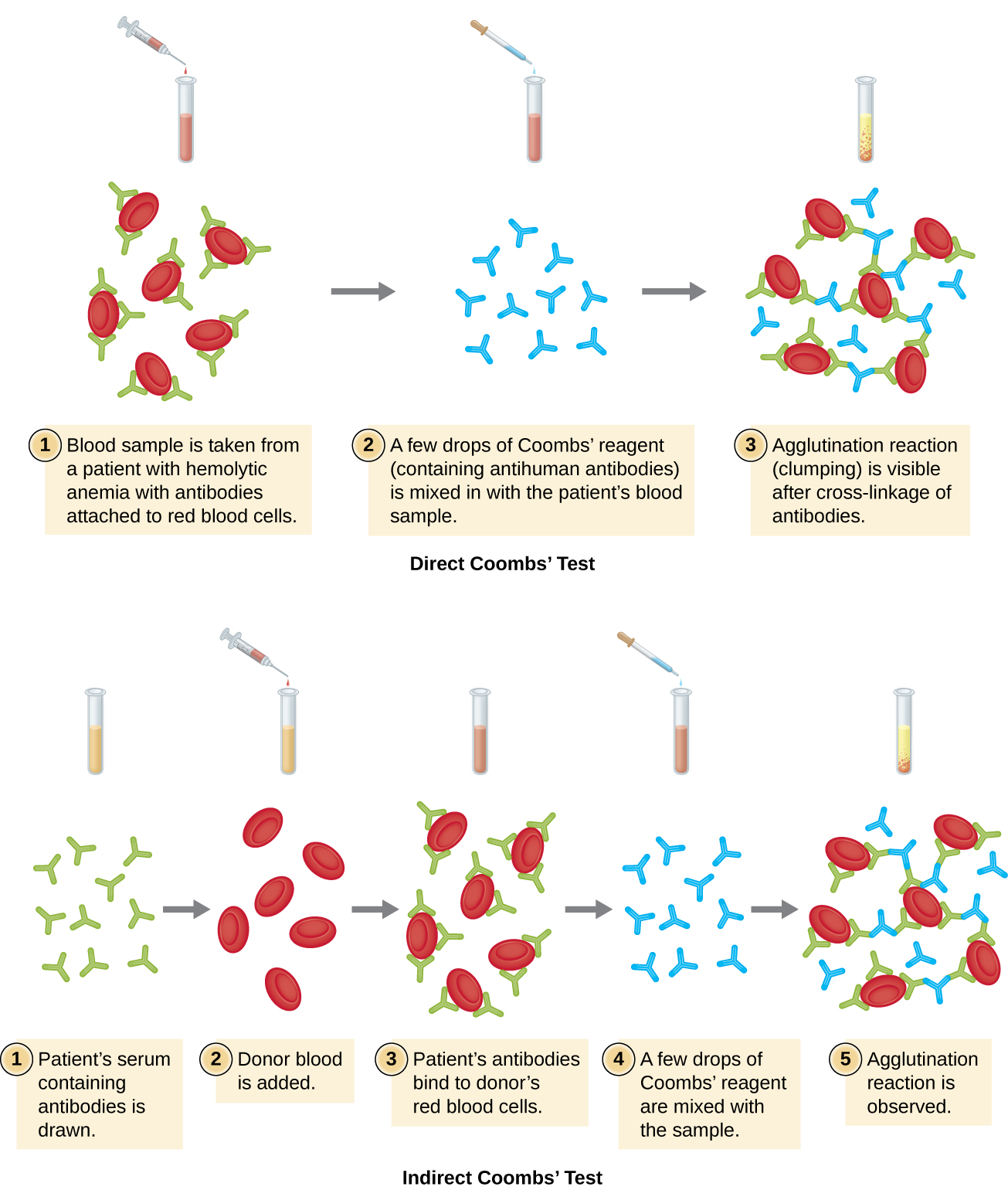
红细胞凝集称为血凝作用。 一种使用血凝的常用检测方法是库姆斯直接检测,也称为直接抗人球蛋白测试(DAT),通常用于寻找非凝集抗体。 该测试还可以检测附着在红细胞上的补体。
库姆斯测试通常用于新生儿出现黄疸,胆红素是血液中血红蛋白分解的产物,胆红素是血液中血红蛋白分解的产物,导致皮肤发黄。 库姆斯测试用于确定孩子的红细胞是否被母亲的抗体结合。 这些抗体会激活补体,导致红细胞裂解和随后的黄疸。 其他可能导致库姆斯直接检测呈阳性的疾病包括溶血输血反应、自身免疫性溶血性贫血、传染性单核细胞增多症(由爱泼斯坦-巴尔病毒引起)、梅毒和肺炎支原体。 在某些癌症中,库姆斯直接检测也可能呈阳性,也可能是对某些药物(例如青霉素)的过敏反应。
在这种情况下,与红细胞结合的抗体通常是IgG,并且由于抗原结合位点在IgG上的定向以及红细胞的体积相对较大,因此不太可能发生任何明显的凝集。 但是,可以通过添加库姆斯试剂来检测与红细胞结合的IgG的存在,库姆斯试剂是一种含有抗人IgG抗体的抗血清(可与抗补体联合使用)(图\(\PageIndex{4}\))。 库姆斯的试剂将附着在邻近红细胞上的IgG连接起来,从而促进凝集。
还有一种称为间接抗球蛋白测试(IAT)的间接库姆斯测试。 这会筛查个体是否有针对患者血清中未结合的红细胞抗原(A 和 B 抗原除外)的抗体(图\(\PageIndex{4}\))。 IAT 可用于筛查孕妇是否有可能导致新生儿溶血性疾病的抗体。 它也可以在输血之前使用。 下文将详细讨论如何执行 IAT。
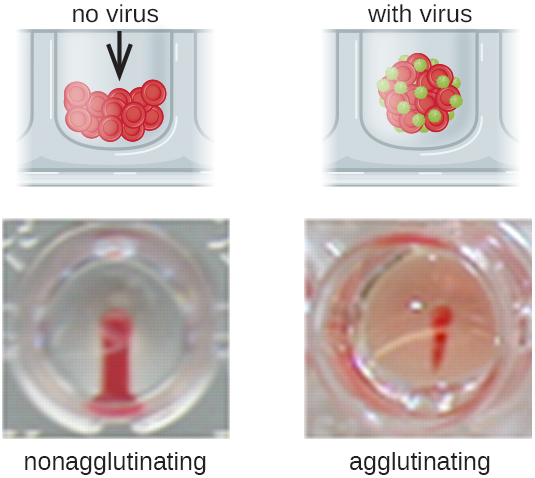
与红细胞结合的抗体不是血凝的唯一原因。 有些病毒还会与红细胞结合,当病毒交叉连接红细胞时,这种结合会导致凝集。 例如,流感病毒有两种不同类型的病毒峰值,分别是神经氨酸酶(N)和血凝素(H),后者因其凝集红细胞的能力而得名(参见病毒)。 因此,我们可以使用红细胞通过直接血凝测定(HA)来检测流感病毒的存在,在这种情况下,病毒会导致红细胞明显凝集。 流行性腮腺炎和风疹病毒也可以使用 HA 进行检测。
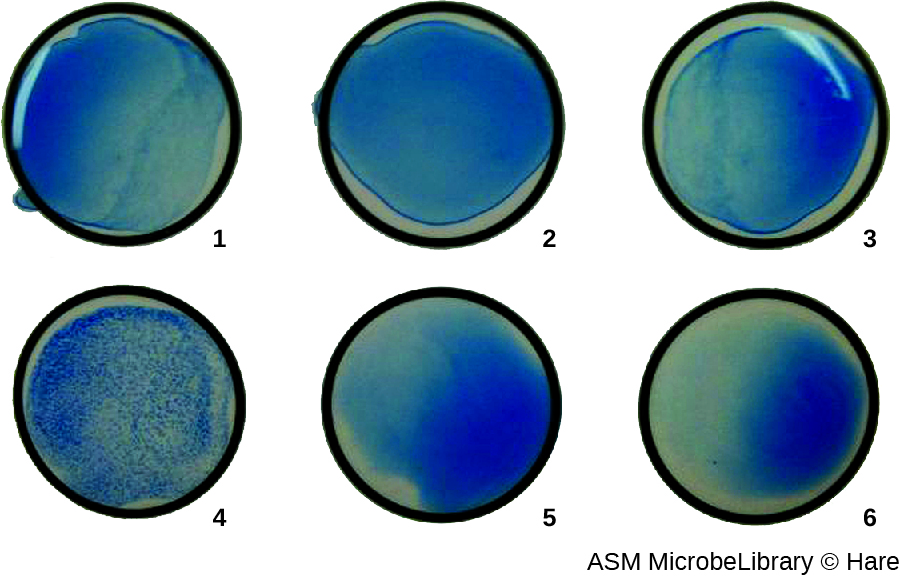
最常见的是,连续稀释病毒凝集测定用于测量滴度或估计细胞培养或疫苗生产中产生的病毒量。 病毒滴度可以使用直接 HA 来测定,方法是连续稀释含有病毒的样本,首先是高浓度的样本,然后在一系列孔中稀释。 产生可见凝集作用的最高稀释度是滴度。 该测定在带有 V 形或圆底孔的微量滴定板中进行。 在存在凝集病毒的情况下,红细胞和病毒聚集在一起,在井底产生弥漫性垫子。 在没有病毒的情况下,红细胞会滚动或沉积到井底,形成致密的颗粒,这就是为什么不能使用平底井的原因(图\(\PageIndex{5}\))。
对 HA 测定方法的修改可用于确定抗病毒抗体的滴度。 这些抗体存在于患者血清或实验室产生的抗血清中和病毒并阻止其凝集红细胞,从而使其成为病毒血凝抑制试验(HIA)。 在该检测中,将患者血清与标准量的病毒混合。 经过短暂的孵育后,添加标准量的红细胞,并观察到血凝作用。 患者血清的滴度是阻断凝集的最高稀释度(图\(\PageIndex{6}\))。

练习\(\PageIndex{2}\)
- 在血凝测定中检测到病毒的机制是什么?
- 哪个血凝结果告诉我们样本中病毒的滴度?
实验室里的动物
我们今天对人体免疫系统的了解大部分是通过使用动物(主要是哺乳动物)作为模型进行的研究学到的。 除研究外,哺乳动物还用于生产免疫诊断所需的大部分抗体和其他免疫系统成分。 疫苗、诊断、疗法和一般的转化医学都是通过动物模型研究开发出来的。
以实验动物生产免疫系统成分的一些常见用途为例。 豚鼠被用作补体来源,而小鼠是制造单克隆抗体的主要细胞来源。 这些单克隆抗体可用于研究和治疗目的。 Antisera 在多种物种中饲养,包括马、绵羊、山羊和兔子。 产生抗血清时,动物通常至少要注射两次,佐剂可用于增强抗体反应。 用于制造抗血清的大型动物会在很长一段时间内反复采集血液,对动物的伤害很小,但兔子的情况通常并非如此。 尽管我们可以从兔子的耳静脉中获得几毫升的血液,但我们通常需要更多的血量,这会导致动物死亡。
我们还使用动物来研究疾病。 培育梅毒螺旋体以研究梅毒的唯一方法是在活体动物身上。 许多病毒可以在细胞培养中生长,但是细胞培养的生长几乎没有告诉我们免疫系统对病毒的反应。 在研究一种新发现的疾病时,我们仍然采用科赫的假设,即要求使用来自纯培养物的病原体在实验动物中致病,作为证明特定微生物是疾病原因的关键步骤。 100多年来,研究动物宿主中细菌和病毒的增殖以及宿主免疫系统的反应一直是微生物学研究的核心。
尽管使用实验动物的做法对科学研究和医学诊断至关重要,但许多人强烈反对为人类利益剥削动物。 这种伦理论并不是一个新论点——事实上,查尔斯·达尔文的一个女儿是一位活跃的反活体切除主义者(活体切除术是切割或解剖活体动物来研究它的做法)。 大多数科学家承认,应该限制为研究目的利用动物的程度。 出于伦理考虑,美国国立卫生研究院(NIH)对可能进行的研究类型制定了严格的规定。 这些法规还包括对实验动物进行人道待遇的指导方针,为它们的住房、护理和安乐死制定了标准。 美国国立卫生研究院的文件《实验动物护理和使用指南》明确指出,在研究中使用动物是社会授予研究人员的特权。
美国国立卫生研究院的指导方针基于三个 R 的原则:替换、完善和减少。 研究人员应努力用非活模型取代动物模型,尽可能用无脊椎动物代替脊椎动物,或者在适用时使用计算机模型。 他们应该完善饲养和实验程序以减轻痛苦和痛苦,并使用实验设计和程序来减少获得所需信息所需的动物数量。 为了获得资金,研究人员必须使美国国立卫生研究院的审查人员确信,该研究证明使用动物是合理的,并且动物的使用符合指导方针。
在地方一级,任何使用动物并获得联邦资助的设施都必须有一个机构动物护理和使用委员会(IACUC),以确保遵守美国国立卫生研究院的指导方针。 IACUC 必须包括研究人员、管理人员、兽医以及至少一名与该机构无关的人,即有关公民。 该委员会还对实验室和协议进行视察。 对于涉及人体受试者的研究,机构审查委员会(IRB)确保遵循适当的指导方针。
访问此网站查看美国国立卫生研究院实验动物护理和使用指南。
血型分型和交叉配对
除了针对以前接触过的细菌和病毒的抗体外,大多数人还携带针对自己以外的血型的抗体。 目前有33种具有免疫学重要性的血型系统,其中许多系统在不同种族群体中受到限制或很少导致抗体的产生。 最重要、也许最为人所知的是ABO和Rh血型(见图19.1.3)。
在考虑输血单位的血液时,必须进行输血前的血液检测。 对于血液单位,商业制备的针对 A、B 和 Rh 抗原的抗体与来自这些单位的红细胞混合,以初步确认该单位的血型是准确的。 一旦要求输血单位的血液,确保捐献者(血液单位)和接受者(患者)与这些关键抗原相容至关重要。 除了确认该单位的血型外,还使用相同的商业制备的抗A、B和Rh抗体来确认患者的血型。 例如,如图所示\(\PageIndex{7}\),如果供体血液呈A阳性,它将与抗A抗血清和抗RH抗血清凝合。 如果没有观察到任何血清凝集,则血型将为 O 阴性。
确定血型后,在释放血液进行输血之前,进行交叉配对,将一小部分供体红细胞与等待输血的患者的血清混合。 如果患者确实有针对供体红细胞的抗体,则会发生血凝作用。 为了确认任何阴性检测结果并检查是否有致敏的红细胞,可以在混合物中添加库姆斯的试剂,以促进抗体与红细胞相互作用的可视化。
在某些情况下,也可以进行小型交叉比赛。 在该测定中,一小部分供体血清与患者红细胞混合。 这允许检测供体血清中的凝集抗体。 这种测试很少必要,因为输血通常使用填充的红细胞,大部分血浆都是通过离心法去除的。
除了 ABO 和 Rh 之外,红细胞还有许多其他抗原。 虽然大多数人不太可能获得针对这些抗原的抗体,但多次怀孕的女性或多次输血的患者可能是因为反复接触而获得抗体。 因此,使用抗体筛查测试来确定是否存在此类抗体。 对照商业制备的、汇集的、表达这些抗原的 O 型红细胞对患者血清进行检查。 如果发生凝集作用,则必须识别出患者所反应的抗原,并确定其不存在于供体单位中。

练习\(\PageIndex{3}\)
- 如果患者的血液凝集与抗 B 血清混合,则该患者的血型是什么?
- 什么是交叉配对试验?为什么要进行交叉配对试验?
下表\(\PageIndex{1}\)总结了本节中讨论的各种凝集测定。
| 测定类型 | 机制 | 示例 |
|---|---|---|
| 凝集 | 直接:抗体用于聚集细菌细胞或其他大型结构 | 血清分型细菌 |
| 间接:乳胶珠与抗原或抗体偶联使用,分别在患者血清中寻找抗体或抗原 | 确认患者血清中存在类风湿因子(IgM 结合型 Ig) | |
| 血凝作用 | 直接:一些细菌和病毒交叉连接红细胞并将它们聚集在一起 | 诊断流感、流行性腮腺炎和麻疹 |
| Direct Coombs 测试 (DAT):检测体内红细胞上的非凝集抗体或补体蛋白 | 检查母体抗体是否与新生儿红细胞结合 | |
| 间接库姆斯检测(IAT):筛查个体体体外是否存在针对患者血清中未结合的红细胞抗原(A 和 B 抗原除外)的抗体 | 进行输血前血液检测 | |
| 病毒血凝抑制:使用来自患者的抗体抑制病毒凝集 | 通过存在针对病毒的患者抗体来诊断各种病毒性疾病 | |
| 血型分型和交叉配对:检测血液中的 ABO、Rh 和次要抗原 | 将捐献者的血液与接受者的免疫需求相匹配 |
关键概念和摘要
- 抗体可以将细胞或大颗粒凝集成可见基质。 凝集测试通常在卡片上或微量滴定板上进行,允许使用少量试剂并排发生多种反应。
- 对某些蛋白质使用抗血清可以识别细菌物种中的血清病毒。
- 检测针对病原体的抗体可能是诊断疾病的有力工具,但是患者需要一段时间才能进行血清转化并检测到抗体水平。
- 间接凝集测定中乳胶珠的凝集可用于检测患者血清中是否存在特异性抗原或特异性抗体。
- 某些抗菌和抗病毒抗体的存在可以通过使用库姆斯直接测试来证实,该测试使用库姆斯的试剂交联与红细胞结合的抗体并促进血凝作用。
- 一些病毒和细菌会结合和凝集红细胞;这种相互作用是直接血凝测定的基础,最常用于确定溶液中病毒的滴度。
- 中和测定通过测量患者血清与标准量病毒混合后观察到的血凝减少来量化病毒特异性抗体的水平。
- 血凝测定还用于筛选和交叉匹配捐赠者和接受者的血液,以确保输血接受者在捐献的血液中没有抗原的抗体。
脚注
- 1 Lancef ield,Rebecca C.,“血液链球菌的抗原复合物。 I. 溶血性链球菌提取物中一种特定型质的演示,” 《实验医学杂志》第47期,第1期(1928):91-103。


