20.2: 体外检测抗原抗体复合物
- Page ID
- 200270
学习目标
- 描述用于寻找抗原抗体复合物的各种类型的测定
- 描述抗原抗体复合物从溶液中沉淀出来的情况
- 解释如何使用患者血清中的抗体来诊断疾病
用于检测体外(例如在试管中)的抗体和抗原的实验室测试称为体外测定。 当溶液中同时存在抗体及其相应的抗原时,我们通常可以观察到沉淀反应,在这种反应中,大型复合物(晶格)形成并沉淀在溶液中。 在接下来的几个章节中,我们将讨论几种常见的体外测定。
沉淀素反应
可见的抗原抗体复合物被称为沉淀素,产生沉淀素的体外测定称为沉淀素反应。 沉淀素反应通常涉及在含有抗体溶液的试管中添加可溶性抗原。 每种抗体有两个臂,每个臂都可以与一个抗原表位结合。 当一种抗体与两种抗原结合时,这两种抗原会被该抗体结合在一起。 当抗体将越来越多的抗原结合在一起,从而产生沉淀素时,晶格就会形成(图\(\PageIndex{1}\))。 大多数沉淀素测试使用多克隆抗血清而不是单克隆抗体,因为多克隆抗体可以与多个表位结合,从而更有可能形成晶格。 尽管单克隆抗体可能结合某些抗原,但这种结合的发生频率会降低,因此形成可见沉淀素的可能性要小得多。
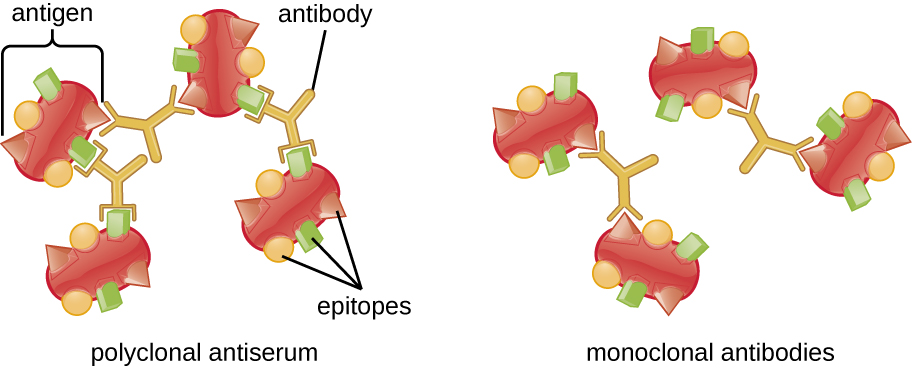
降水量还取决于其他几个因素。 例如,当抗体对抗原具有高亲和力时,沉淀会增强。 虽然大多数抗体以高亲和力结合抗原,但即使是高亲和力结合也使用相对较弱的非共价键,因此个体相互作用经常会中断并发生新的相互作用。
此外,为了使沉淀素的形成可见,必须有抗体与抗原的最佳比例。 最佳比率不大可能是 1:1 的抗原抗体比例;它可能会有很大差异,具体取决于抗原上表位的数量和抗体类别。 有些抗原可能只有一个或两个抗血清可以识别的抗原表位,而其他抗原在单个抗原分子上可能有许多不同的抗原表位和/或相同表位的多个实例。
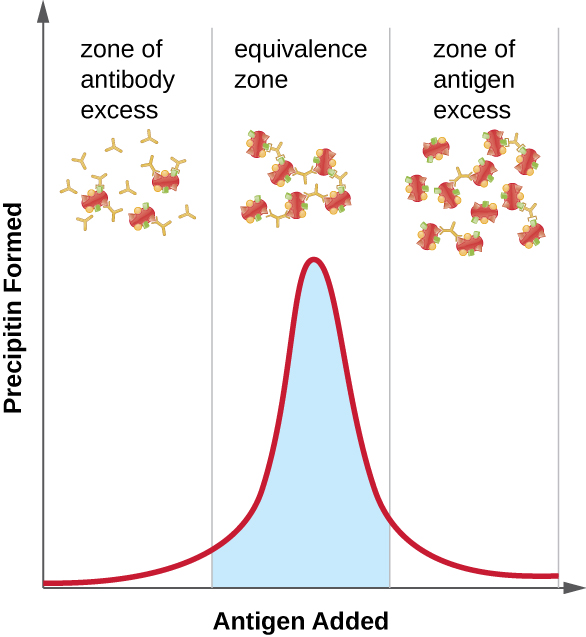
该图\(\PageIndex{2}\)说明了抗原和抗体的比例如何影响沉淀量。 为了达到最佳比例,将抗原缓慢添加到含有抗体的溶液中,并定性地确定沉淀素的量。 最初,没有足够的抗原来产生可见的晶格形成;这被称为抗体过量区域。 随着更多抗原的添加,反应进入等效区(或等效区域),在该区域既出现最佳抗原-抗体相互作用,又出现最大沉淀量。 如果添加更多的抗原,抗原的量就会变得过多,实际上会导致沉淀量减少。
练习\(\PageIndex{1}\)
- 沉淀素是什么?
- 为什么多克隆抗血清会产生更好的沉淀素反应?
沉淀素环试验
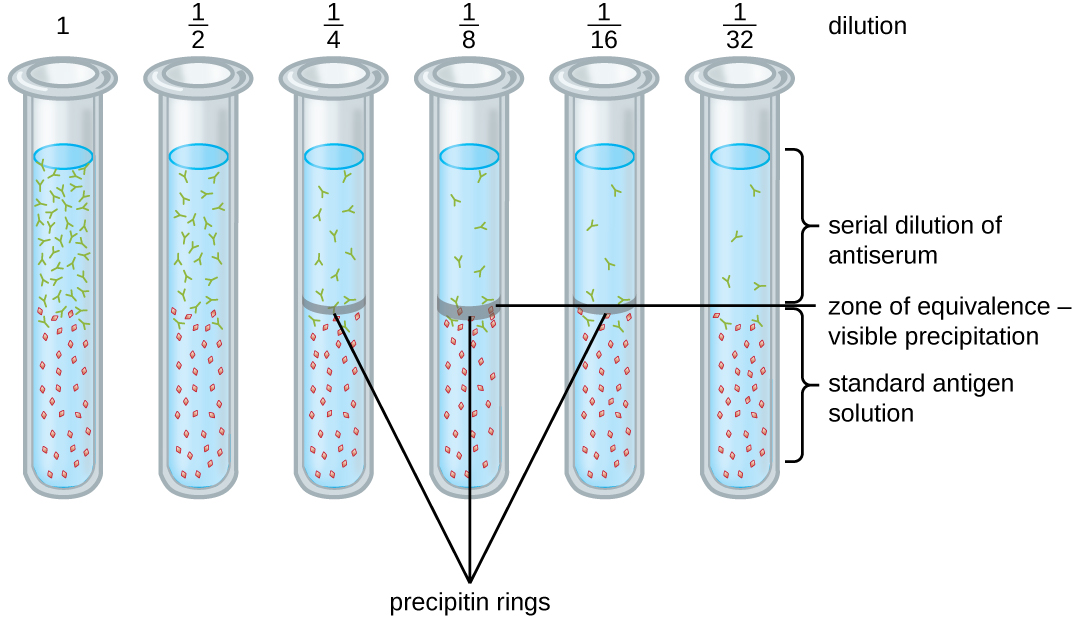
多种技术使我们能够使用沉淀素形成来量化抗原浓度或抗血清中存在的抗体量。 其中一种技术是沉淀素环试验(图\(\PageIndex{3}\)),它用于确定血清样本中抗原特异性抗体的相对含量。 为了进行此测试,通过在每根试管的底部添加抗原溶液来制备一组试管。 每根试管接收相同体积的溶液,抗原浓度恒定(例如 1 mg/mL)。 接下来,将甘油添加到每个试管中的抗原溶液中,然后连续稀释抗血清。 甘油可防止抗血清与抗原溶液混合,只允许在两种溶液的界面处发生抗原抗体结合。 结果是在试管中出现可见的沉淀素环,其抗原抗体比率在等效区内。 这种具有可见环的最高稀释度用于确定抗体的滴度。 滴度是显示正结果的最高稀释度的倒数,以整数表示。 在图中\(\PageIndex{3}\),滴度为 16。
虽然滴度的测量并不能绝对告诉我们存在多少抗体,但它确实可以衡量生物活性,而生物活性通常比绝对量更重要。 在这个例子中,知道抗血清中存在多少质量的 IgG 是没有用的,因为存在许多不同的抗体特异性;但对我们来说,重要的是要知道患者血清中有多少抗体活性是针对感兴趣的抗原的(例如特定病原体或过敏原)。
Ouchterlony Assay
虽然沉淀素环测试可以深入了解抗体与抗原的相互作用,但它也有一些缺点。 它需要使用大量的血清,并且必须格外小心,避免混合溶液和破坏戒指。 在琼脂凝胶基质中进行类似的测试可以最大限度地减少这些问题。 对于 1948 年首次描述该技术的 Orjan Ouchterlony,这种类型的测定被称为双重免疫扩散或 Ouchterlony 测定。
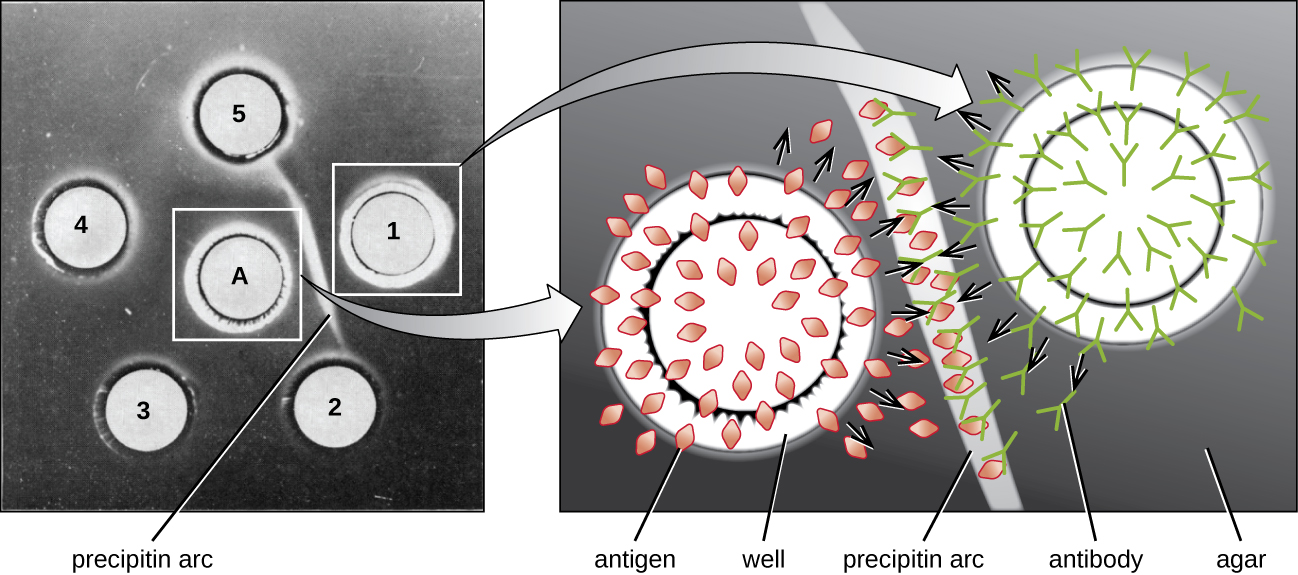
当琼脂经过高度纯化时,它会产生透明的无色凝胶。 在凝胶中打孔形成孔,然后在相邻的孔中添加抗原和抗血清。 蛋白质能够通过凝胶扩散,沉淀素弧在等效区域的孔之间形成。 由于 precipitin 晶格太大而无法通过凝胶扩散,因此弧线被牢固地锁定在适当的位置,易于看见(图\(\PageIndex{4}\))。
尽管现在有更灵敏和更定量的方法来检测抗体-抗原相互作用,但Ouchterlony测试提供了一种快速和定性的方法来确定抗血清是否具有针对特定抗原的抗体。 Ouchterlony 测试在寻找交叉反应性时特别有用。 我们可以检查抗血清与一组密切相关的抗原,看看哪些组合会形成沉淀素弧线。
径向免疫扩散试验
径向免疫扩散(RID)测定与Ouchterlony测定类似,但用于精确量化抗原浓度,而不是比较不同的抗原。 在该实验中,将抗血清添加到回火琼脂(略高于45°C的液态琼脂)中,然后将其倒入小型培养皿或玻璃载玻片上冷却。 在冷却后的琼脂中切开井,然后将抗原添加到井中并使其扩散。 当抗原和抗体相互作用时,它们形成沉淀区。 沉淀区直径的平方与抗原浓度成正比。 通过测量已知浓度的样品产生的沉淀区域(参见图中的样品外圈\(\PageIndex{5}\)),我们可以制备用于确定未知溶液浓度的标准曲线。 RID 测定也是测定许多血清蛋白(例如 C3 和 C4 补体蛋白等)浓度的有用测试。
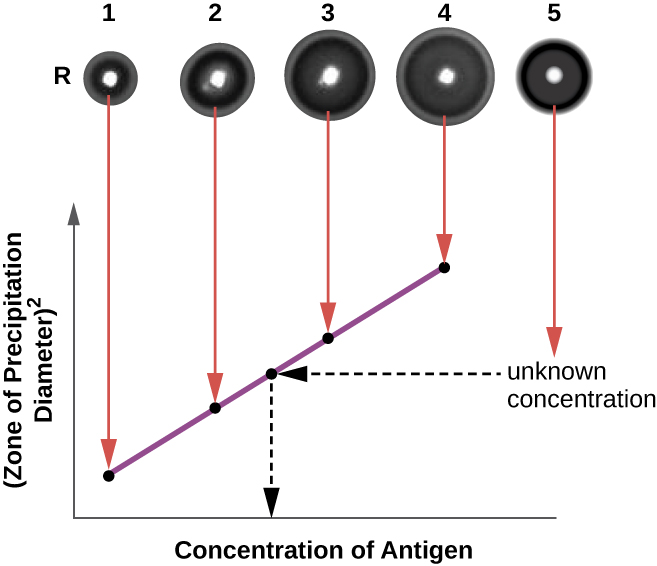
练习\(\PageIndex{2}\)
- 为什么在沉淀环测试中会形成沉淀素环,以及可能无法形成戒指的原因有哪些?
- 比较和对比 Ouchterlony 测定和径向免疫扩散测定中使用的技术。
絮凝试验
絮凝测定与沉淀素反应类似,不同之处在于它涉及脂质等不溶性抗原。 絮凝剂与沉淀素相似,因为存在可见的抗原和抗体晶格,但由于脂质不溶于水溶液,因此它们无法沉淀。 在试管流体中观察到絮凝(起泡),而不是沉淀。
使用絮凝法检测梅毒
梅毒是一种性传播感染,可导致成人严重的慢性疾病。 此外,它很容易在怀孕和分娩期间从受感染的母亲传染给新生儿,常常导致婴儿死产或严重的长期健康问题。 不幸的是,梅毒在准妈妈身上也很难诊断,因为它通常没有症状,尤其是在女性中。 此外,致病因子,梅毒螺旋体,既难以在传统的实验室培养基上生长,也太小,无法使用常规显微镜看见。 出于这些原因,梅毒的推定诊断通常通过检测密螺旋体抗原抗体的测试在实验室间接得到证实。
1906年,德国科学家奥古斯特·冯·瓦瑟曼(August von Wassermann)(1866—1925 年)推出了第一个梅毒检测方法,该检测依赖于检测患者血液中的抗螺旋体抗体。 在 Wassermann 测试中检测到的抗体是抗磷脂抗体,对 T. pallidum 没有特异性。 它们的存在可以帮助诊断梅毒,但由于它们是非特异性的,它们也可能导致患有其他疾病和自身免疫性疾病的患者出现假阳性结果。 多年来,最初的Wasserman测试经过了修改,以最大限度地减少误报,现在被称为性病研究实验室测试,以其缩写VDRL测试而闻名。
为了进行 VDRL 测试,将患者血清或脑脊液放置在载玻片上,其中含有心磷脂(一种存在于各种病原体的线粒体膜中的抗原磷脂)、卵磷脂和胆固醇的混合物。 卵磷脂和胆固醇可以稳定反应并减少误报。 来自感染患者血清的抗密螺旋体抗体将结合心磷脂并形成絮凝剂。 尽管VDRL测试比最初的Wassermann测定更具特异性,但自身免疫性疾病(例如系统性红斑狼疮)的患者仍可能出现误报。
中和试验
要引起感染,病毒必须与宿主细胞上的受体结合。 抗病毒抗体可以通过包覆病毒体,阻断结合来中和病毒感染(图18.1.6)。 这种活性可以中和病毒体,并可能导致形成大型抗体病毒复合物(通过吞噬作用很容易去除),或者通过抗体与病毒结合并阻断其与宿主细胞受体的结合。 这种中和活性是中和测定的基础,中和测定是用于诊断病毒感染的敏感测定。
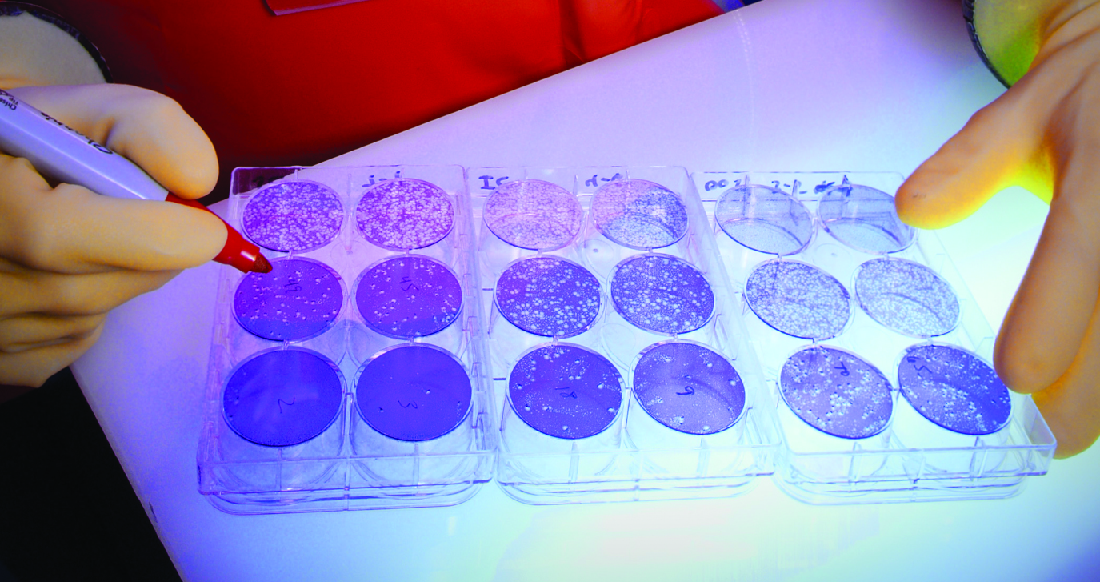
当病毒感染细胞时,它们通常会造成损害(细胞病变效应),其中可能包括宿主细胞的裂解。 通过在培养皿中培养宿主细胞,用一层薄薄的琼脂覆盖细胞,然后添加病毒(参见病毒的分离、培养和鉴定),可以直观地看到细胞病变效应。 病毒会非常缓慢地通过琼脂扩散。 病毒将进入宿主细胞,增殖(造成细胞损伤),从死亡的宿主细胞中释放,然后转移到邻近的细胞。 随着越来越多的细胞死亡,死细胞的斑块将形成(图\(\PageIndex{6}\))。
在病毒感染过程中,患者将对病毒产生抗体反应,我们可以使用斑块减少法对这些抗体进行量化。 为了进行测定,需要对血清样本进行连续稀释。 然后将每次稀释液与标准量的疑似病毒混合。 血清中的任何病毒特异性抗体都会中和部分病毒。 然后将悬浮液添加到培养物中的宿主细胞中,使任何未中和的病毒在几天后感染细胞并形成斑块。 滴度定义为显示斑块减少50%的最高稀释度的倒数。 滴度始终以整数表示。 例如,如果1/64的稀释度是显示牙菌斑减少50%的最高稀释度,则滴度为64。
患者血清中存在抗体并不能告诉我们患者目前是否被感染或过去曾被感染。 等待两周并测试另一个血清样本即可识别当前的感染。 第二个样本中和滴度增加了四倍,表明出现了新的感染。
练习\(\PageIndex{3}\)
在中和测定中,如果患者的血清中含有大量的抗病毒抗体,你会期望看到更多还是更少的斑块?
免疫电泳
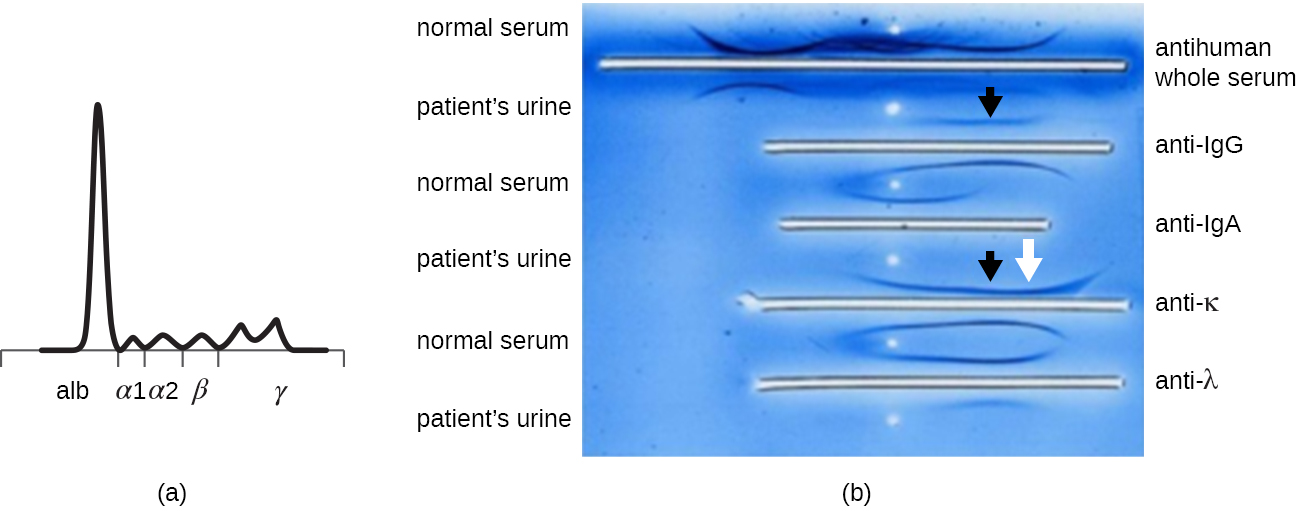
当患者血液中的蛋白质水平升高或尿液中的蛋白质流失时,临床医生通常会下令进行聚丙烯酰胺凝胶电泳(PAGE)测定(参见 DNA、RNA 和蛋白质的可视化和表征)。 该测定比较了各种血清蛋白的相对丰度。 可以使用免疫电泳(IEP)进一步研究异常的蛋白质电泳模式。 IEP 首先运行一个 PAGE。 针对特定血清蛋白的抗血清被添加到与电泳轨道平行的低谷中,形成沉淀素弧线,类似于欧赫特洛尼测定中看到的沉淀素弧线(图\(\PageIndex{7}\))。 这允许识别样本中异常的免疫球蛋白蛋白。
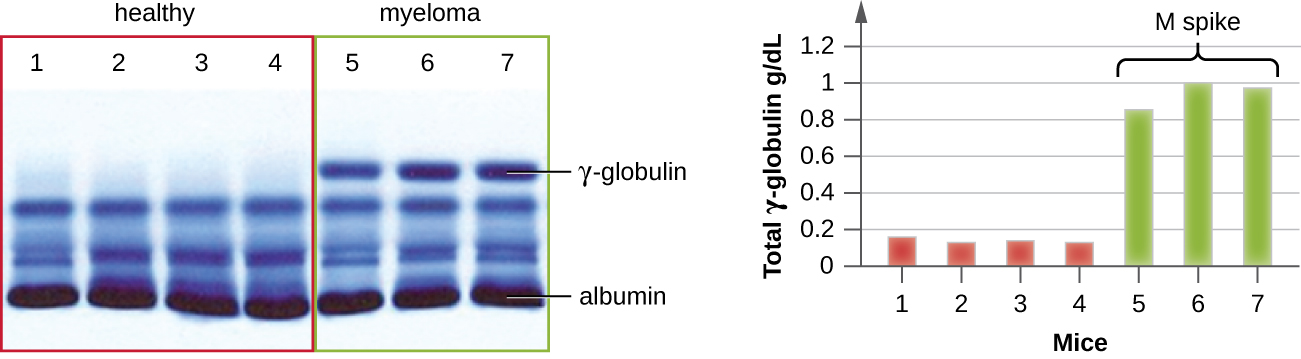
IEP 在诊断多发性骨髓瘤方面特别有用,多发性骨髓瘤是一种分泌抗体的细胞癌。 多发性骨髓瘤患者无法产生健康的抗体;相反,他们会产生异常的抗体,即单克隆蛋白(M 蛋白)。 因此,多发性骨髓瘤患者的血清蛋白水平将升高,该水平在蛋白质电泳凝胶的伽玛球蛋白区域显示出明显的波段,在密度计扫描中会出现尖峰(M 蛋白),而不是正常的宽涂片(图\(\PageIndex{7}\))。 当使用针对各种抗体重链和轻链的抗体形成沉淀素弧时,M 蛋白将对一类重链和一类轻链产生明显的偏斜弧线,如图所示\(\PageIndex{7}\)。
蛋白质电泳和免疫球蛋白结构的表征
电泳的出现最终促成了对抗体结构的研究和理解。 当瑞典生物化学家 Arne Tiselius(1902—1971)在 1937 年发表第一份蛋白质电泳结果时,2 他可以通过凝胶中产生的尖带识别蛋白白蛋白(最小、最丰富的血清蛋白)。 其他血清蛋白无法通过简单的蛋白质电泳来分解,因此他命名了这三个宽带,每个带中有许多蛋白质,即α球蛋白、β球蛋白和伽玛球蛋白。 两年后,美国免疫学家埃尔文·卡巴特(Elvin Kabat)(1914-2000)前往瑞典,使用这种新技术与提塞利乌斯合作,结果表明抗体以伽玛球蛋白的形式迁移。 3 有了这种新的认识,研究人员很快了解到,由于多发性骨髓瘤是一种抗体分泌细胞的癌症,可以通过蛋白质电泳在伽玛球蛋白区域存在大量 M 峰值来初步诊断。 在这一发现之前,由于很难获得纯样本进行研究,对免疫球蛋白结构的研究很少。 来自多发性骨髓瘤患者的血清被证明是高浓度单克隆免疫球蛋白的极好来源,为未来20多年的研究提供了原料,这些研究最终阐明了免疫球蛋白的结构。
练习\(\PageIndex{4}\)
总的来说,免疫电泳测定能达到什么目的?
免疫印迹测定:Western Blot
进行蛋白凝胶电泳后,可以使用抗体在凝胶中鉴定特定的蛋白质。 这种技术被称为 Western blot。 通过 PAGE 分离蛋白质后,凝胶中的蛋白质抗原被转移到硝化纤维素膜上并固定在硝化纤维素膜上。 然后,该膜可以暴露于为与目标蛋白质特异性结合而产生的一级抗体中。 然后,配备分子信标的第二种抗体将与第一个抗体结合。 这些二级抗体与另一种分子偶联,例如酶或荧光团(一种在光激发时会发出荧光的分子)。 当使用与酶偶联的抗体时,会添加该酶的显色底物。 这种底物通常是无色的,但在存在抗体的情况下会变色。 荧光或底物着色可识别特异性蛋白质在抗体结合的膜中的位置(图\(\PageIndex{9}\))。
通常,多克隆抗体用于蛋白质印迹测定。 它们比单抗体更敏感,因为它们能够与初级抗原的各种表位结合,而且来自多克隆抗体的信号通常比来自单抗体的信号强。 也可以使用单克隆抗体;但是,它们的生产成本要高得多,敏感性也较低,因为它们只能识别一种特定的表位。
Western blot 的几种变体在研究中很有用。 在西南印迹中,蛋白质通过 SDS-PAGE 分离,涂在硝化纤维素膜上,允许重生,然后用荧光或放射性标记的 DNA 探针进行探测;西南的目的是识别特定的 DNA 蛋白质相互作用。 进行远西方印迹以确定固定化蛋白(由SDS-PAGE分离,印在硝化纤维素膜上,允许重生)与非抗体蛋白质探针之间的蛋白质-蛋白质相互作用。 与远西方印迹中的固定化蛋白相互作用的结合非抗体蛋白可以通过放射性标记、荧光或使用带有酶分子信标的抗体来检测。
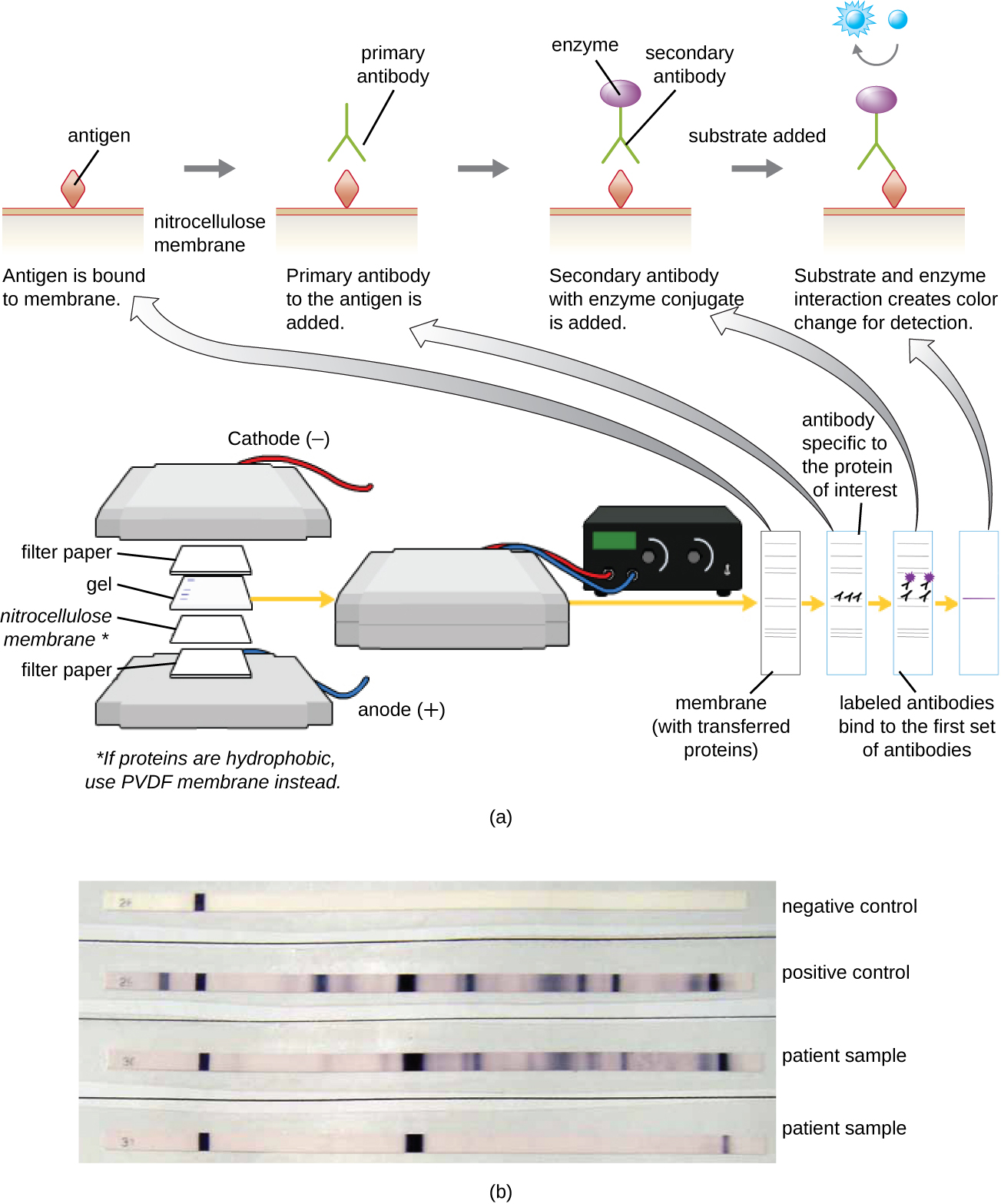
练习\(\PageIndex{5}\)
该酶在免疫印迹测定中的作用是什么?
补体介导免疫测定
抗体的关键功能之一是补体的激活(固定)。 例如,当抗体与细菌结合时,某些补体蛋白会识别结合的抗体并激活补体级联。 作为回应,其他补体蛋白与细菌结合,其中一些充当 opsonins 以提高吞噬效率,而另一些则在革兰氏阴性细菌细胞膜上形成漏洞,导致裂解。 这种裂解活性可用于检测血清中是否存在针对特定抗原的抗体。
在评估补体介导的细胞溶解时,红细胞是很好的指示细胞。 红细胞溶血会释放血红蛋白,这是一种颜色鲜艳的色素,即使是少量红细胞的溶血也会导致溶液变成明显的粉红色(图\(\PageIndex{10}\))。 这种特征在补体固定测试中起着作用,补体固定测试允许检测针对特定病原体的抗体。 补体固定测试可用于检查针对实验室中难以培养的病原体的抗体,例如真菌、病毒或细菌衣原体。
为了进行补体固定试验,将来自病原体的抗原添加到患者血清中。 如果存在抗原抗体,则该抗体将结合抗原并固定所有可用的补体。 当随后将红细胞和针对红细胞的抗体添加到混合物中时,将没有剩余的补体可以裂解红细胞。 因此,如果溶液仍然明确,则测试结果为阳性。 如果患者血清中没有抗病原体抗体,则添加的抗体将激活补体以裂解红细胞,从而产生阴性检测(图\(\PageIndex{10}\))。
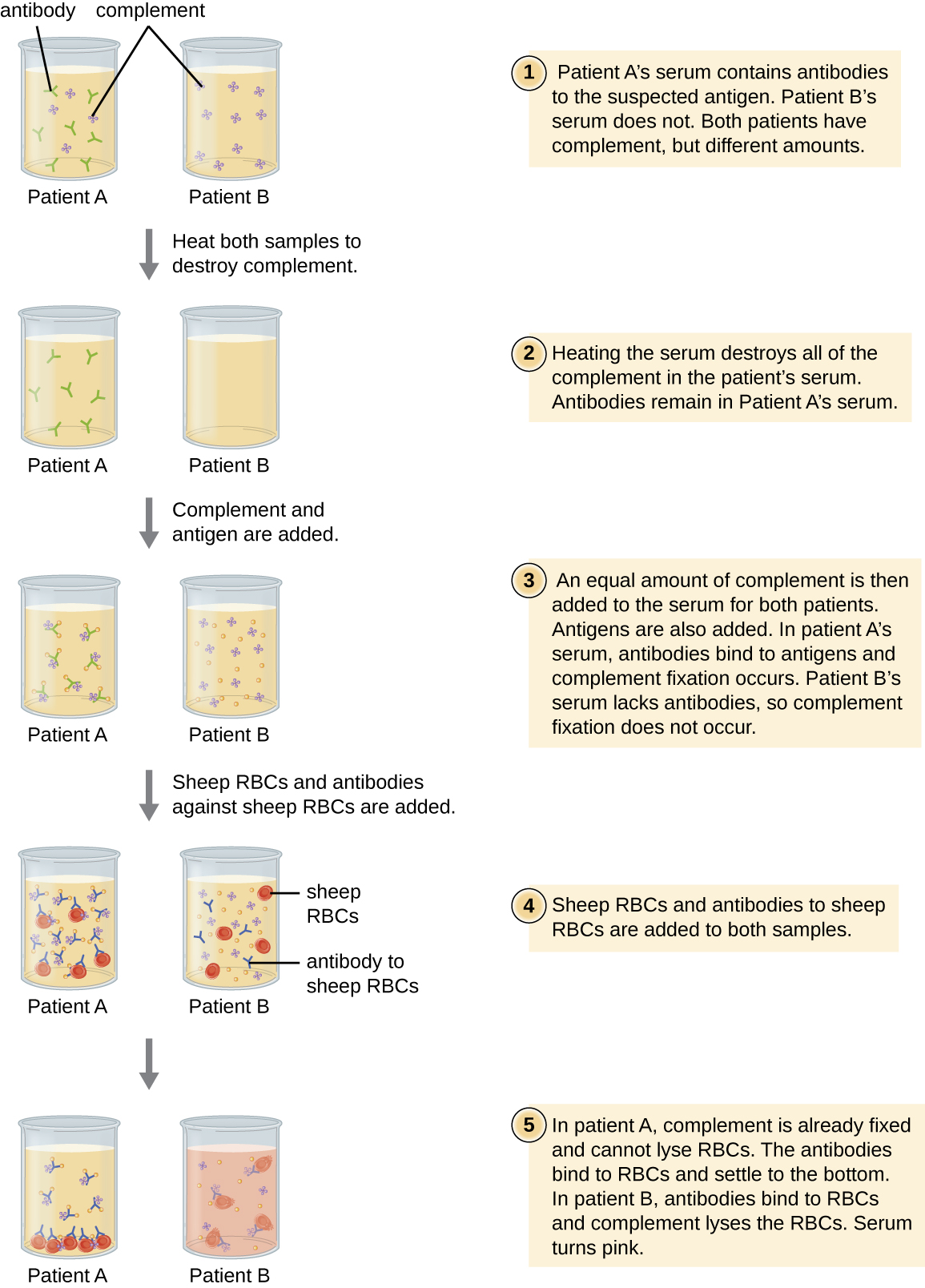
观看此视频,了解补品固定测试的步骤概述。
练习\(\PageIndex{6}\)
在补体固定试验中,如果血清变成粉红色,患者是否有抗原抗体? 解释一下。
表\(\PageIndex{1}\)总结了本节中讨论的各种类型的抗体-抗原测定。
| 测定类型 | 机制 | 示例 |
|---|---|---|
| 降水 | 抗体与可溶性抗原结合,形成可见的沉淀素 | 沉淀环试验,可视化溶液中晶格的形成 |
| 免疫电泳检查电泳后抗原的分布 | ||
| Ouchterlony 测定可比较各种抗原 | ||
| 通过径向免疫扩散法定量化抗原 | ||
| 絮凝 | 抗体在悬浮液中与不溶性分子结合,形成可见的聚集体 | 梅毒的 VDRL 检测 |
| 中和 | 抗体与病毒结合,阻断病毒进入靶细胞并防止斑块的形成 | 用于检测患者血清中是否存在中和抗体的斑块还原试验 |
| 补充激活 | 抗体与抗原结合,诱导补体激活,不留下任何补体来裂解红细胞 | 针对难以培养的细菌(如衣原体)的患者抗体的补体固定试验 |
关键概念和摘要
- 当以正确的比例存在时,抗体和抗原将形成沉淀素或晶格,从溶液中沉淀出来。
- 沉淀环测试可用于可视化溶液中的晶格形成。 Ouchterlony 测定表明凝胶中会形成晶格。 径向免疫扩散法用于通过测量注入抗体的凝胶中沉淀区的大小来量化抗原。
- 悬浮液中的不溶性抗原在被抗体结合时会形成絮凝剂。 这是梅毒 VDRL 测试的基础,在该测试中,抗密螺旋体抗体在悬浮液中与心磷脂结合。
- 病毒感染可以通过量化患者血清中的病毒中和抗体来检测。
- 使用免疫电泳识别血浆或血清中的不同抗体类别。
- 血清中存在特异性抗原(例如细菌或病毒蛋白)可以通过免疫印迹测定来证明,其中蛋白质被转移到硝化纤维素膜并使用标记的抗体进行鉴定。
- 在补体固定试验中,补体用于检测针对各种病原体的抗体。
脚注
- 1 Ouchterlony,Örjan,“测试白喉细菌产生毒素能力的体外方法”,A cta Pathologica Microbiologica Scandinavica 26,第 4 期(1949):516-24。
- 2 Tiselius,Arne,“血清球蛋白的电泳:正常和免疫血清的电泳分析”,《生化杂志》第 31 期,第 9 期(1937):1464。
- 3 Tiselius、Arne 和 Elvin A. Kabat。 “免疫血清和纯化抗体制剂的电泳研究”,《实验医学杂志》第69期,第1期(1939):119-31。


