3.4: 蛋白质
- Page ID
- 202182
培养技能
- 描述蛋白质在细胞和组织中的功能
- 讨论氨基酸和蛋白质之间的关系
- 解释蛋白质组织的四个级别
- 描述蛋白质形状和功能的联系方式
蛋白质是生命系统中最丰富的有机分子之一,在所有大分子中具有最多样化的功能范围。 蛋白质可能具有结构性、调节性、收缩性或保护性;它们可能用于运输、储存或膜;也可能是毒素或酶。 生命系统中的每个细胞可能含有数千种蛋白质,每种蛋白质都有独特的功能。 它们的结构,就像它们的功能一样,差异很大。 但是,它们都是氨基酸的聚合物,按线性顺序排列。
蛋白质的类型和功能
活细胞产生的@@ 酶是生化反应(如消化)的催化剂,通常是复杂的或共轭的蛋白。 每种酶对其作用的底物(一种与酶结合的反应物)具有特异性。 该酶可能有助于分解、重排或合成反应。 分解底物的酶被称为分解代谢酶,从底物中生成更复杂分子的酶称为合成代谢酶,影响反应速率的酶称为催化酶。 应该注意的是,所有酶都会提高反应速度,因此被认为是有机催化剂。 酶的一个例子是唾液淀粉酶,它会水解其底物直链淀粉,淀粉的成分。
激素是化学信号分子,通常是小蛋白质或类固醇,由内分泌细胞分泌,起到控制或调节特定的生理过程,包括生长、发育、新陈代谢和繁殖的作用。 例如,胰岛素是一种蛋白质激素,有助于调节血糖水平。 表中列出了蛋白质的主要类型和功能\(\PageIndex{1}\)。
| 键入 | 示例 | 函数 |
|---|---|---|
| 消化酶 | 淀粉酶、脂肪酶、胃蛋白酶、胰蛋白酶 | 通过将营养物质分解成单体单位来帮助消化食物 |
| 运输 | 血红蛋白、白蛋白 | 将血液或淋巴中的物质带到全身 |
| 结构性的 | 肌动蛋白、微管蛋白、角蛋白 | 构造不同的结构,比如细胞骨架 |
| 荷尔蒙 | 胰岛素、甲状腺素 | 协调不同身体系统的活动 |
| 防御 | 免疫球蛋白 | 保护身体免受外来病原体的侵害 |
| 可收缩 | 肌动蛋白、肌球蛋白 | 影响肌肉收缩 |
| 存储 | 豆类储存蛋白、蛋清(白蛋白) | 为胚胎和幼苗的早期发育提供营养 |
蛋白质具有不同的形状和分子量;有些蛋白质是球状的,而其他蛋白质本质上是纤维状的。 例如,血红蛋白是一种球状蛋白,但我们皮肤中发现的胶原蛋白是一种纤维蛋白。 蛋白质形状对其功能至关重要,这种形状由许多不同类型的化学键维持。 温度、pH 值的变化和接触化学物质可能导致蛋白质形状的永久变化,从而导致功能丧失,即所谓的变性。 所有蛋白质均由相同20种氨基酸的不同排列组成。
氨基酸
氨基酸是构成蛋白质的单体。 每种氨基酸都具有相同的基本结构,它由一个中心碳原子(也称为 α)碳组成,它与氨基(NH 2)、羧基(COOH)和氢原子结合。 每个氨基酸还有另一个原子或一组原子与中心原子结合,称为R基团(图\(\PageIndex{1}\))。
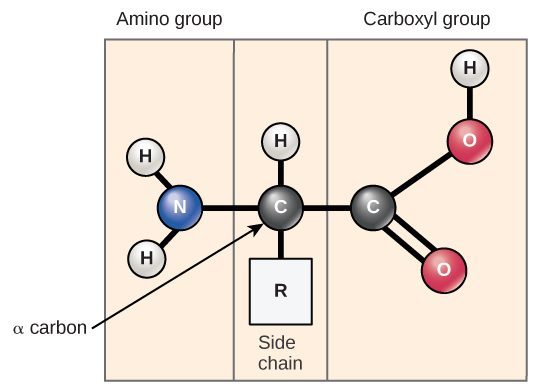
“氨基酸” 的名称源于这样一个事实,即它们的基本结构中同时含有氨基和羧基酸。 如前所述,蛋白质中存在20种氨基酸。 其中十种被认为是人类必需的氨基酸,因为人体无法产生它们,它们是从饮食中获得的。 对于每种氨基酸,R 基团(或侧链)是不同的(图\(\PageIndex{2}\))。
艺术连接
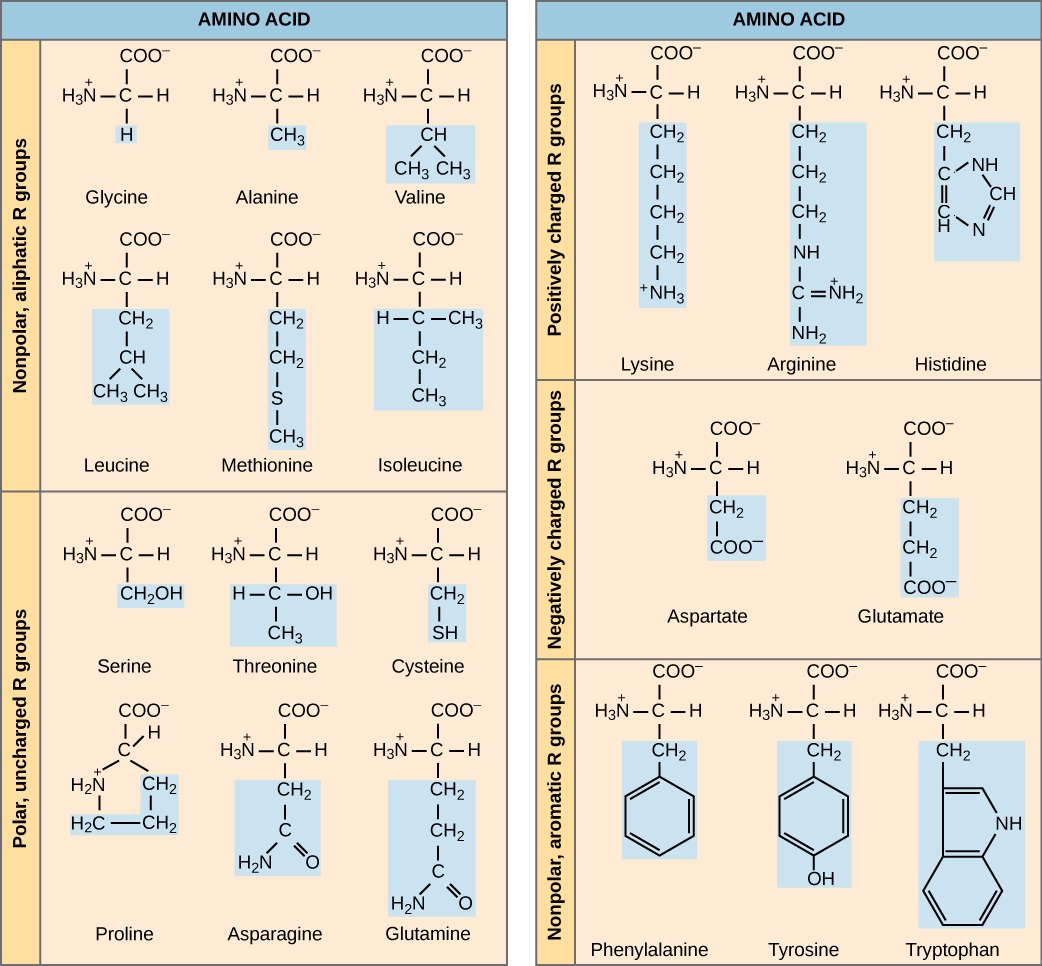
你期望在可溶性蛋白的表面找到哪些类别的氨基酸,你期望在内部找到哪些类别的氨基酸? 你期望在嵌入脂质双层的蛋白质中发现什么氨基酸分布?
侧链的化学性质决定了氨基酸的性质(即它是酸性、碱性、极性还是非极性)。 例如,氨基酸甘氨酸以氢原子作为 R 基。 缬氨酸、蛋氨酸和丙氨酸等氨基酸本质上是非极性或疏水性的,而丝氨酸、苏氨酸和半胱氨酸等氨基酸是极性的,具有亲水性侧链。 赖氨酸和精氨酸的侧链是带正电荷的,因此这些氨基酸也被称为碱性氨基酸。 脯氨酸具有与氨基相连的 R 基团,形成环状结构。 脯氨酸是氨基酸标准结构的例外,因为它的氨基与侧链没有分离(图\(\PageIndex{2}\))。
氨基酸由单个大写字母或三个字母的缩写表示。 例如,valine 以字母 V 或三个字母的符号 val 而闻名。 正如某些脂肪酸对饮食必不可少一样,一些氨基酸也是必需的。 它们被称为必需氨基酸,在人类中它们包括异亮氨酸、亮氨酸和半胱氨酸。 必需氨基酸是指在体内构建蛋白质所必需的氨基酸,尽管不是由人体产生的;哪些氨基酸是必需的,因生物体而异。
氨基酸的序列和数量最终决定了蛋白质的形状、大小和功能。 每种氨基酸通过共价键(称为肽键)附着在另一种氨基酸上,该共价键由脱水反应形成。 一种氨基酸的羧基和传入的氨基酸的氨基结合在一起,释放出一个水分子。 由此产生的键是肽键(图\(\PageIndex{3}\))。
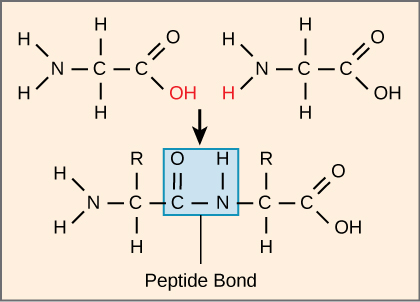
由这种连接形成的产物被称为肽。 随着越来越多的氨基酸加入这个生长链,由此产生的链被称为多肽。 每种多肽的一端都有一个游离氨基团。 该端被称为 N 末端或氨基末端,另一端具有游离羧基,也称为 C 或羧基末端。 虽然多肽和蛋白质这两个术语有时可以互换使用,但从技术上讲,多肽是氨基酸的聚合物,而蛋白质一词用于结合在一起、通常具有结合的非肽假体基团、具有独特形状且具有独特的功能。 在蛋白质合成(翻译)后,大多数蛋白质被修饰。 这些被称为翻译后修饰。 它们可能会发生裂解、磷酸化,或者可能需要添加其他化学基团。 只有经过这些修改,蛋白质才能完全发挥作用。
进化连接
细胞色素 ccytoChrome c 的进化意义是电子传输链的重要组成部分,是细胞呼吸的一部分,通常存在于细胞器线粒体中。 这种蛋白质具有血红素假体基团,在电子转移过程中,血红素的中心离子交替还原和氧化。 由于这种必需蛋白质在产生细胞能量中的作用至关重要,因此数百万年来变化不大。 蛋白质测序表明,不同物种之间存在大量的细胞色素c氨基酸序列同源性;换句话说,可以通过测量不同物种的DNA或蛋白质序列之间的相似性或差异来评估进化亲属关系。
科学家已经确定人类细胞色素c含有104个氨基酸。 对于迄今为止测序的来自不同生物的每个细胞色素 c 分子,其中 37 个氨基酸出现在所有细胞色素 c 样本中的相同位置。这表明可能存在共同的祖先。 在比较人类和黑猩猩蛋白序列时,未发现序列差异。 比较人猴和恒河猴序列时,发现的唯一差异在于一种氨基酸。 在另一项比较中,人体与酵母测序显示出第44位的差异。
蛋白质结构
如前所述,蛋白质的形状对其功能至关重要。 例如,一种酶可以在称为活性位点的位点与特定底物结合。 如果该活性位点由于局部变化或整体蛋白质结构的变化而改变,则该酶可能无法与底物结合。 要了解蛋白质是如何形成其最终形状或构象的,我们需要了解蛋白质结构的四个级别:初级、次级、三级和四级。
主要结构
多肽链中氨基酸的独特序列是其主要结构。 例如,胰腺激素胰岛素有两个多肽链,即A和B,它们通过二硫键连接在一起。 A 链的 N 末端氨基酸是甘氨酸,而 C 末端氨基酸是天冬酰胺(图
摘要
蛋白质是一类为细胞执行各种功能的大分子。 它们通过提供结构支持和充当酶、载体或激素来帮助新陈代谢。 蛋白质(单体)的组成部分是氨基酸。 每种氨基酸都有一个与氨基相连的中心碳、一个羧基、一个氢原子和一个 R 基团或侧链。 有 20 种常见的氨基酸,每种氨基酸在 R 组中各不相同。 每种氨基酸都通过肽键与其邻居相连。 长链氨基酸被称为多肽。
蛋白质分为四个级别:初级、二级、三级和(可选)第四级。 主要结构是氨基酸的独特序列。 多肽的局部折叠形成诸如 α 螺旋和 β-褶片之类的结构构成了二级结构。 整体三维结构是三级结构。 当两个或多个多肽结合形成完整的蛋白质结构时,这种结构被称为蛋白质的四元结构。 蛋白质的形状和功能错综复杂;任何由温度或pH值变化引起的形状变化都可能导致蛋白质变性和功能丧失。
艺术联系
图\(\PageIndex{2}\):你期望在可溶性蛋白的表面找到哪些类别的氨基酸,你期望在内部找到哪些类别的氨基酸? 你期望在嵌入脂质双层的蛋白质中发现什么氨基酸分布?
- 回答
-
极性和带电氨基酸残基(肽键形成后的剩余部分)更有可能出现在可溶性蛋白的表面,它们可以与水相互作用,而非极性(例如氨基酸侧链)更有可能出现在它们与水隔离的内部。 在膜蛋白中,非极性和疏水性氨基酸侧链与磷脂的疏水尾相关,而极性和带电氨基酸侧链与极性头群或水溶液相互作用。 但是,也有例外。 有时,带正电荷和负电荷的氨基酸侧链在蛋白质内部相互作用,在配体结合口袋中可以找到与配体相互作用的极性或带电的氨基酸侧链。
词汇表
- α-螺旋结构(α-螺旋结构)
- 通过将多肽折叠成螺旋形而形成的蛋白质二级结构的类型,氢键稳定结构
- 氨基酸
- 蛋白质的单体;具有中心碳或α碳,其上附着氨基、羧基、氢和R基或侧链;所有20种氨基酸的R基团都不同
- beta-pleated 床单(β-打褶)
- 存在于蛋白质中的二级结构,其中 “褶皱” 是由多肽链骨干上的原子之间的氢键形成的
- 监护人
- (也是 chaperonin)蛋白质在折叠过程中帮助新生蛋白质
- 变性
- 由于温度、pH 值变化或暴露于化学物质而导致蛋白质变形
- 酶
- 生化反应中的催化剂,通常是复合蛋白或共轭蛋白
- 激素
- 化学信号分子,通常是蛋白质或类固醇,由内分泌细胞分泌,起到控制或调节特定的生理过程的作用
- 肽键
- 通过脱水反应在两个氨基酸之间形成的键
- 多肽
- 由肽键连接的长链氨基酸
- 主要结构
- 蛋白质中氨基酸的线性序列
- 蛋白质
- 由一条或多条氨基酸链组成的生物大分子
- 四元结构
- 蛋白质中离散多肽亚单位的关联
- 二级结构
- 蛋白质通过一个氨基酸残基的氧原子与附着在另一个氨基酸残基的氮原子上的氢之间的分子内氢键形成的规则结构
- 三级结构
- 蛋白质的三维构象,包括二级结构元素之间的相互作用;由氨基酸侧链之间的相互作用形成


