2.2: 水
- Page ID
- 202141
培养技能
- 描述对维持生命至关重要的水的特性
- 解释为什么水是极好的溶剂
- 举例说明水的内聚力和粘合特性
- 讨论酸、碱和缓冲液在稳态中的作用
科学家为什么要花时间在其他星球上寻找水? 为什么水如此重要? 这是因为水对我们所知道的生命至关重要。 水是最丰富的分子之一,也是对地球生命最重要的分子。 大约 60-70% 的人体是由水组成的。 没有它,我们所知道的生命就不会存在。
水分子的极性及其产生的氢键使水成为一种独特的物质,具有与生命过程密切相关的特殊特性。 生命最初是在水环境中进化的,生物体的大部分细胞化学和新陈代谢都发生在细胞质中的含水内容物中。 水的特殊特性包括其高热容量和蒸发热、溶解极性分子的能力、其粘合性和粘合性以及分解成离子,从而产生 pH 值。 了解水的这些特征有助于阐明水在维持生命方面的重要性。
水之极性
水的重要特性之一是它由极性分子组成:水分子(H 2 O)中的氢气和氧气形成极性共价键。 虽然水分子没有净电荷,但水的极性会在氢气上产生略带正电荷,在氧气上产生略为负的电荷,这有助于水的吸引特性。 水之所以产生电荷,是因为氧气比氢气更具电负性,这使得在氧核附近发现共享电子的可能性比在氢核附近更大,从而在氧气附近产生部分负电荷。
由于水的极性,每个水分子都会吸引其他水分子,因为水分子之间的电荷相反,形成氢键。 水也会吸引或被其他极性分子和离子吸引。 易于与水相互作用或溶解在水中的极性物质被称为亲水性(Hydro-= “水”;-philic = “爱”)。 相比之下,油和脂肪等非极性分子不能很好地与水相互作用,如图所示,\(\PageIndex{1}\)与水分离而不是溶解在水中,正如我们在含有油和醋(一种酸性水溶液)的沙拉酱中所看到的那样。 这些非极性化合物被称为疏水性(Hydro-= “水”;-phobic = “恐惧”)。

水的状态:气体、液体和固体
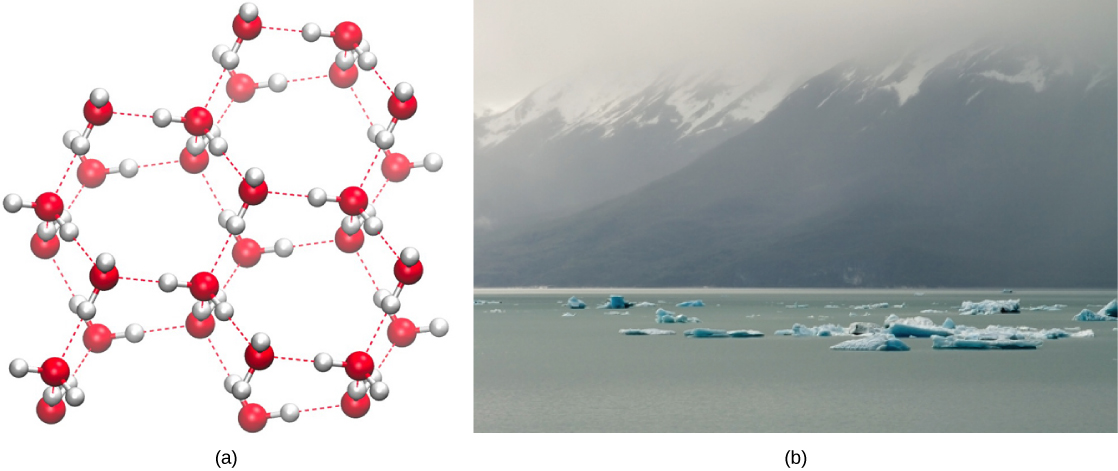
氢键的形成是液态水的重要品质,据我们所知,它对生命至关重要。 当水分子相互产生氢键时,与其他液体相比,水具有一些独特的化学特性,而且,由于生物的含水量很高,了解这些化学特征是理解生命的关键。 在液态水中,当水分子相互滑过时,氢键会不断形成和破裂。 这些键的断裂是由系统中所含的热量引起的水分子运动(动能)引起的。 当水煮沸时热量升高时,水分子的更高动能会导致氢键完全破裂,并允许水分子以气体(蒸汽或水蒸气)的形式逸出到空气中。 另一方面,当水温度降低而水冻结时,水分子会形成由氢键(没有足够的能量破坏氢键)维持的晶体结构,使冰的密度低于液态水,这种现象在其他水的凝固中是看不到的液体。
水的固体形态密度较低,这是由于氢键在冻结时的取向方式:与液态水相比,水分子被推得更远。 对于大多数其他液体,温度下降时的凝固包括降低分子之间的动能,使它们的包装比液体形式更紧密,并使固体的密度大于液体。
如图所示,冰的密度较低\(\PageIndex{2}\),是一种异常现象,它会导致它漂浮在液态水表面,例如在冰山中或一杯冰水中的冰块中。 在湖泊和池塘中,水面会形成冰,形成隔热屏障,保护池塘中的动植物免受冻结。 如果没有这层隔热冰,生活在池塘里的动植物就会冻结在坚固的冰块中,无法生存。 冻结对活生物体的不利影响是由冰相对于液态水的膨胀引起的。 冻结时形成的冰晶会破坏对活细胞功能至关重要的脆弱膜,对它们造成不可逆转的破坏。 只有当细胞中的水被甘油等另一种液体暂时取代时,细胞才能在冰冻状态下存活。
水的高热容量
水的高热容是由水分子之间的氢键引起的一种特性。 在所有液体中,水的比热容量最高。 比热定义为一克物质必须吸收或流失的热量才能将其温度改变一摄氏度。 对于水,这个量是一卡路里。 因此,水需要很长时间才能加热,需要很长时间才能冷却。 实际上,水的比热容大约是沙子的五倍。 这就解释了为什么陆地的冷却速度比大海快。 由于其高热容量,温血动物使用水来更均匀地将热量分散在体内:它的作用方式与汽车的冷却系统类似,将热量从温暖的地方输送到凉爽的地方,从而使人体保持更均匀的温度。
水的汽化热
水还具有很高的蒸发热,即将一克液体物质转化为气体所需的能量。 要实现水的这种变化,需要大量的热能(586 cal)。 这个过程发生在水表面。 随着液态水的升温,氢键使液态水分子很难相互分离,而液态水分子进入气相(蒸汽)是必需的。 因此,与乙醇(谷物酒精)这样的液体相比,水充当散热器或储热器,需要更多的热量才能煮沸,乙醇(谷物酒精)与其他乙醇分子的氢键比水的氢键弱。 最终,当水达到100摄氏度(212华氏度)的沸点时,热量能够破坏水分子之间的氢键,而水分子之间的动能(运动)使它们能够像气体一样从液体中逸出。 即使低于沸点,水的单个分子也会从其他水分子那里获得足够的能量,这样一些地表水分子就可以逸出并蒸发:这个过程被称为蒸发。
水需要断开氢键才能蒸发,这意味着在此过程中消耗了大量的能量。 随着水的蒸发,该过程会消耗能量,从而冷却发生蒸发的环境。 在包括人类在内的许多活生物体中,汗液的蒸发(即90%的水)可以使生物体冷却,从而维持体温的稳态。
水的溶剂特性
由于水是一种极性分子,具有略带正电荷和略带负电荷,因此离子和极性分子很容易溶解在其中。 因此,水被称为溶剂,一种能够溶解其他极性分子和离子化合物的物质。 与这些分子相关的电荷将与水形成氢键,用水分子包围颗粒。 这被称为补水球体或补水壳,如图所示
观看此视频,直接解释 pH 值及其对数标度。
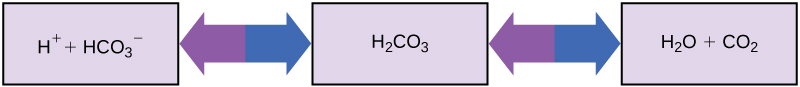
那么,身体需要接近中性 pH 值的生物如何摄取酸性和碱性物质(比如人喝橙汁)并存活呢? 缓冲区是关键。 缓冲液很容易吸收多余的 H + 或 OH —,将人体 pH 值精心维持在生存所需的狭窄范围内。 保持恒定的血液pH值对人的健康至关重要。 维持人体血液pH值的缓冲液包括碳酸(H 2 CO 3)、碳酸氢根离子(HCO 3 —)和二氧化碳(CO 2)。 当碳酸氢根离子与游离氢离子结合成为碳酸时,氢离子会被去除,从而减缓 pH 值的变化。 同样,如图所示\(\PageIndex{8}\),多余的碳酸可以转化为二氧化碳气体并通过肺部呼出。 这样可以防止血液中积聚过多的游离氢离子,从而危险地降低血液的 pH 值。 同样,如果在系统中引入过多的哦,碳酸会与之结合产生碳酸氢盐,从而降低 pH 值。 如果没有这种缓冲系统,人体的 pH 值会波动到足以危及生存。
缓冲液的其他例子是用于对抗过量胃酸的抗酸剂。 其中许多非处方药的作用方式与血液缓冲液相同,通常至少有一种离子能够吸收氢气并调节pH值,从而缓解那些在进食后遭受 “胃灼热” 的人。 有助于平衡pH值的水的独特特性以及水的其他特性对于维持地球上的生命至关重要。
摘要
水具有许多对维持生命至关重要的特性。 它是一种极性分子,允许形成氢键。 氢键允许离子和其他极性分子溶解在水中。 因此,水是一种极好的溶剂。 水分子之间的氢键使水具有很高的热容量,这意味着需要大量增加的热量才能提高其温度。 随着温度的升高,水之间的氢键不断破裂并重新形成。 尽管系统中增加了能量,但这可以使整体温度保持稳定。 水还表现出很高的蒸发热,这是生物如何通过汗液蒸发降温的关键。 水的内聚力允许表面张力的特性,而其粘合特性则被视为毛细管内水的上升。 pH 值是衡量溶液中氢离子浓度的指标,也是活生物体通过动态平衡高度调节的众多化学特性之一。 酸和碱可以改变 pH 值,但缓冲液往往会缓和它们引起的变化。 水的这些特性与活生物体进行的生化和物理过程密切相关,如果这些特性发生改变的话,生命就会大不相同。
脚注
- 1 W. Humphrey W.、A. Dalke 和 K. Schulten,“VMD—视觉分子动力学”,《分子图形学杂志》 14(1996):33-38。
- 2 W. Humphrey W.、A. Dalke 和 K. Schulten,“VMD—视觉分子动力学”,《分子图形学杂志》 14(1996):33-38。
词汇表
- 酸
- 捐赠氢离子并增加溶液中氢离子浓度的分子
- 附着力
- 水分子与其他分子之间的吸引力
- 基础
- 捐赠氢氧化物离子或以其他方式结合多余氢离子并降低溶液中氢离子浓度的分子
- 缓冲
- 通过吸收或释放氢或氢氧化物离子来防止 pH 值变化的物质
- 卡路里
- 将一克水的温度改变一摄氏度所需的热量
- 毛细管作用
- 之所以发生,是因为水分子被玻璃管等狭窄管状结构内表面的电荷所吸引,将水分子吸引到管的侧面
- 凝聚力
- 由水的极性引起的水分子之间的分子间力;造成表面张力
- 离解
- 从分子中释放离子,使原始分子现在由离子和原始分子的带电残留物组成,例如当水分解成 H + 和 OH 时 -
- 蒸发
- 将单个分子与水体表面、植物叶子或生物体皮肤分离
- 水的汽化热
- 液态水转化为水蒸气需要大量能量
- 亲水性的
- 描述了与水等其他极性分子相互作用良好的离子或极性分子
- 恐水的
- 描述未带电的非极性分子,这些分子与水等极性分子相互作用不佳
- 石蕊纸
- (也是 pH 纸)经过天然水溶性染料处理的滤纸,该染料会随着环境 pH 值的变化而改变颜色,因此可以用作 pH 指示剂
- pH 论文
- 见石蕊纸
- pH 标尺
- 比例范围从零到14,与溶液中氢离子的浓度成反比
- 溶剂
- 能够溶解另一种物质的物质
- 特定热容量
- 一克物质必须吸收或流失的热量才能将其温度变化一摄氏度
- 水化球体
- 当极性水分子包围带电分子或极性分子,从而使它们保持溶解并在溶液中时
- 表面张力
- 液体表面的张力阻止分子分离;由液体分子之间诱人的粘合力产生




