2.1:原子、同位素、离子和分子-基石
- Page ID
- 202165
培养技能
- 定义物质和元素
- 描述质子、中子和电子之间的相互关系
- 比较原子之间捐赠或共享电子的方式
- 解释天然存在的元素如何结合形成分子、细胞、组织、器官系统和生物
在最基本的层面上,生命是由物质组成的。 物质是占据空间并具有质量的任何物质。 元素是具有特定化学和物理特性的独特物质形式,普通化学反应无法将其分解成较小的物质。 有 118 个元素,但只有 92 个元素是自然存在的。 其余元素是在实验室合成的,并且不稳定。
每个元素都由其化学符号表示,该符号是单个大写字母,或者当第一个字母已经被另一个元素 “占用” 时,则由两个字母的组合。 有些元素使用英文术语表示元素,例如 C 表示碳,Ca 代表钙。 其他元素的化学符号源自其拉丁名称;例如,钠的符号是 Na,指的是 n atrium,拉丁语中的钠一词。
所有活生物体共有的四种元素是氧(O)、碳(C)、氢(H)和氮(N)。 在非生物世界中,元素的发现比例不同,活生物体共有的某些元素在整个地球上相对罕见,如表所示\(\PageIndex{1}\)。 例如,大气中富含氮气和氧气,但碳和氢含量很少,而地壳虽然含有氧气和少量氢气,但氮和碳却很少。 尽管它们的丰度不同,但所有元素及其之间的化学反应都遵循相同的化学和物理定律,无论它们是生物世界还是非生物世界的一部分。
| 元素 | 生命(人类) | 大气层 | 地壳 |
|---|---|---|---|
| 氧气 (O) | 65% | 21% | 46% |
| 碳 (C) | 18% | 跟踪 | 跟踪 |
| 氢气 (H) | 10% | 跟踪 | 0.1% |
| 氮气 (N) | 3% | 78% | 跟踪 |
原子的结构
要理解元素是如何融合在一起的,我们必须首先讨论元素的最小组成部分或组成部分,即原子。 原子是保留元素所有化学特性的最小物质单位。 例如,一个金原子具有金的所有特性,因为它在室温下是固体金属。 金币只是模制成硬币形状的大量金原子,其中含有少量被称为杂质的其他元素。 金原子无法分解成任何更小的东西,同时还能保留金的特性。
原子由两个区域组成:原子核,它位于原子的中心,包含质子和中子;以及原子的最外层区域,它将其电子保持在围绕原子核的轨道上,如图所示\(\PageIndex{1}\)。 原子包含质子、电子和中子以及其他亚原子粒子。 唯一的例外是氢气(H),它由一个质子和一个没有中子的电子组成。
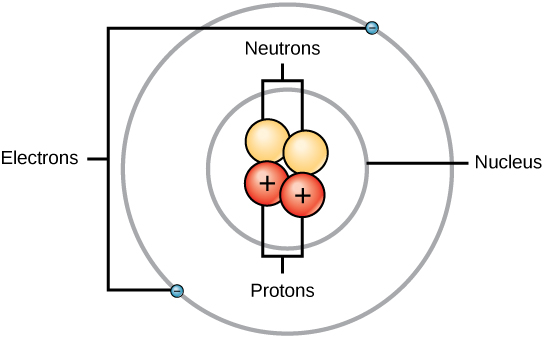
质子和中子的质量大致相同,约为1.67×10 -24 克。 科学家任意将这个质量量定义为一个原子质量单位(amu)或一个道尔顿,如表所示\(\PageIndex{2}\)。 尽管质量相似,但质子和中子的电荷不同。 质子带正电荷,而中子没有带电。 因此,原子中的中子数量对其质量有很大影响,但对它的电荷没有很大影响。 电子的质量比质子小得多,重量仅为9.11×10 -28 克,约为原子质量单位的1/1800。 因此,它们对元素的整体原子质量的贡献不大。 因此,在考虑原子质量时,习惯上忽略任何电子的质量,仅根据质子和中子的数量来计算原子的质量。 尽管电子不是质量的重要贡献者,但确实对原子的电荷做出了很大贡献,因为每个电子的负电荷等于质子的正电荷。 在未带电的中性原子中,绕原子核运行的电子数量等于原子核内的质子数。 在这些原子中,正电荷和负电荷相互抵消,导致原子没有净电荷。
考虑到质子、中子和电子的大小,原子的大部分体积(超过99%)实际上是空白空间。 面对所有这些空白空间,人们可能会问,为什么所谓的固体物体不只是相互穿过。 之所以不这样做,是因为围绕所有原子的电子都是带负电荷的,负电荷相互排斥。
| 充电 | 弥撒 (amu) | 地点 | |
|---|---|---|---|
| 质子 | +1 | 1 | 核 |
| 中子 | 0 | 1 | 核 |
| 电子 | —1 | 0 | 轨道 |
原子序数和质量
每个元素的原子都包含一定数量的质子和电子。 质子的数量决定了一个元素的原子序数,用于区分一个元素和另一个元素。 中子的数量是可变的,从而产生同位素,同位素是同一个原子的不同形式,仅在它们拥有的中子数量上有所不同。 质子的数量和中子的数量共同决定了元素的质量数,如图所示\(\PageIndex{2}\)。 请注意,在计算质量数时,忽略了电子对质量的微小贡献。 这种质量的近似值只需从质量数中减去质子数即可轻松计算出元素有多少中子。 由于元素的同位素的质量数将略有不同,科学家们还会确定原子质量,这是其天然存在的同位素的质量数的计算平均值。 通常,生成的数字包含一个分数。 例如,氯的原子质量(Cl)为35.45,因为氯由几种同位素组成,一些(大多数)的原子质量为35(17个质子和18个中子),有些则原子质量为37(17个质子和20个中子)。
艺术连接
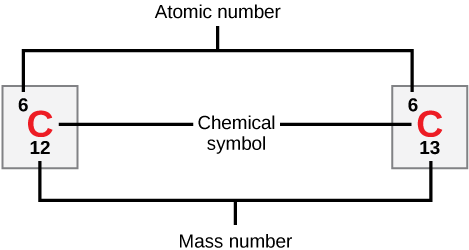
carbon-12 和 carbon-13 分别有多少中子?
同位素
同位素是元素的不同形式,具有相同数量的质子但中子数量不同。 一些元素,例如碳、钾和铀,具有天然存在的同位素。 Carbon-12 包含六个质子、六个中子和六个电子;因此,它的质量数为 12(六个质子和六个中子)。 Carbon-14 包含六个质子、八个中子和六个电子;它的原子质量为 14(六个质子和八个中子)。 这两种替代形式的碳是同位素。 有些同位素可能会发射中子、质子和电子,并获得更稳定的原子结构(较低的势能水平);这些是放射性同位素或放射性同位素。 放射性衰变(carbon-14丢失中子最终变成碳12)描述了不稳定原子原子核释放辐射时发生的能量损失。
进化连接:碳定年
碳通常以二氧化碳和甲烷等气态化合物的形式存在于大气中。 Carbon-14 (\(\ce C^{14}\)) 是一种天然存在的放射性同位素,由大气层\(\ce N^{14}\)(氮)通过添加中子和宇宙射线导致质子流失而在大气中产生。 这是一个持续的过程,因此总\(\ce C^{14}\)是在创造更多的东西。 由于活生物体\(\ce C^{14}\)最初以光合作用过程中固定的二氧化碳的形式吸收,因此其体内的相对含量等于大气\(\ce C^{14}\)中的浓度。\(\ce C^{14}\) 当生物死亡时,它不再摄入\(\ce C^{14}\),因此\(\ce C^{14}\)和之间的比率\(\ce C^{12}\)将随着称为β衰\(\ce C^{14}\)变的过程(电子或正电子的发射)逐渐衰减而下降。\(\ce N^{14}\) 这种衰变会在缓慢的过程中释放出能量。
大约 5,730 年后,遗嘱起始浓度的一\(\ce C^{14}\)半已转化为\(\ce N^{14}\)。 同位素原始浓度的一半衰减回更稳定的形式所花费的时间称为其半衰期。 因为的半衰期\(\ce C^{14}\)很长, 它用于标定以前的活物,例如旧骨头或木头. 将物体中发现的\(\ce C^{14}\)浓度与在大气中\(\ce C^{14}\)探测到的浓度的比率进行比较,可以确定尚未衰变的同位素量。 在此基础上,如果材料的年龄不超过大约 50,000 年,则可以准确地计算出其寿命\(\PageIndex{3}\),例如图中所示的侏儒猛 mm 象。 其他元素的同位素具有不同的半衰期。 例如,\(\ce K^{40}\)(钾-40)的半衰期为12.5亿年,\(\ce U^{235}\)(铀235)的半衰期约为7亿年。 通过使用放射测年法,科学家可以研究化石或其他灭绝生物遗骸的年龄,以了解生物是如何从早期物种进化而来的。

元素周期表
不同的元素在元素周期表中组织和显示。 该表由俄罗斯化学家德米特里·门捷列夫(Dmitri Mendeleev,1834—1907 年)于 1869 年制定,对尽管独一无二但与其他元素具有某些化学特性的元素进行了分组。 元素的特性决定了它们在室温下的物理状态:它们可能是气体、固体或液体。 元素还具有特定的化学反应性,即相互结合和化学结合的能力。
在元素周期表中,如图
视频:观看此视觉动画,观看 p 和 s 轨道的空间排列。
化学反应和分子
根据八位组法则,当所有元素的最外壳充满电子时,所有元素的稳定性最高。 这是因为原子处于这种构型在能量上是有利的,并且可以使它们保持稳定。 但是,由于并非所有元素都有足够的电子来填充其最外层的外壳,因此原子与其他原子形成化学键,从而获得获得稳定电子构型所需的电子。 当两个或多个原子相互化学结合时,由此产生的化学结构就是分子。 熟悉的水分子 H 2 O 由两个氢原子和一个氧原子组成;它们结合在一起形成水,如图所示\(\PageIndex{8}\)。 原子可以通过捐赠、接受或共享电子来填充其外壳来形成分子。
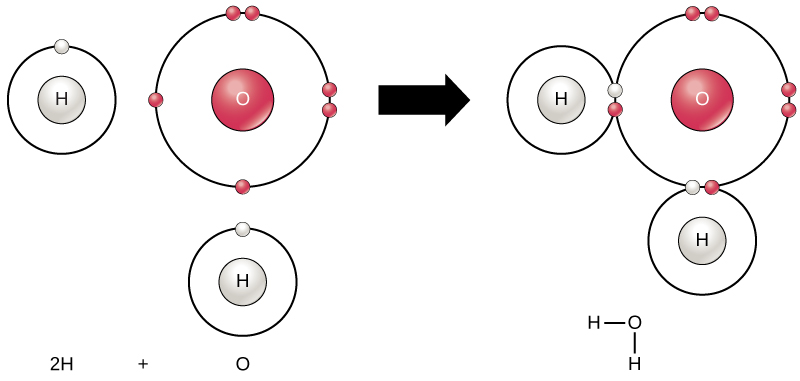
当两个或多个原子结合在一起形成分子或当键合的原子分解时,就会发生@@ 化学反应。 化学反应开始时使用的物质称为反应物(通常位于化学方程式的左侧),反应结束时发现的物质被称为产物(通常位于化学方程的右侧)。 通常在反应物和产物之间画一个箭头来表示化学反应的方向;这个方向并不总是 “单行道”。 要生成如上所示的水分子,化学方程为:
\[\ce{2H + O \rightarrow H_2O} \nonumber\]
简单化学反应的一个例子是过氧化氢分子的分解,每个过氧化氢分子由两个与两个氧原子(H 2 O 2)结合的氢原子组成。 反应物过氧化氢被分解成水,其中包含一个与两个氢原子(H 2 O)结合的氧原子,以及由两个键合的氧原子(O 2)组成的氧。 在以下方程中,该反应包括两个过氧化氢分子和两个水分子。 这是一个平衡化学方程的示例,其中方程两侧每个元素的原子数是相同的。 根据物质守恒定律,化学反应前后的原子数应相等,这样在正常情况下就不会产生或破坏任何原子。
\[\ce{2H_2O_2\: (hydrogen\: peroxide) \rightarrow 2H_2O\: (water) + O_2\: (oxygen)} \nonumber\]
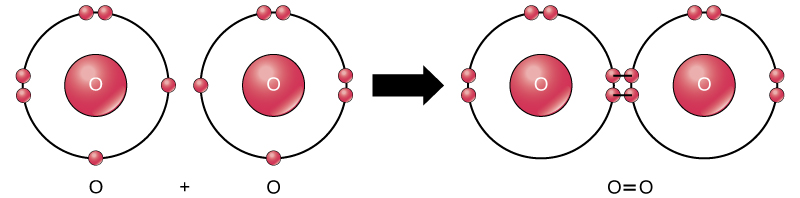
尽管这种反应的所有反应物和产物都是分子(每个原子都与至少一个其他原子结合),但在这种反应中,只有过氧化氢和水是化合物的代表:它们含有不止一种元素的原子。 另一方面,如图\(\PageIndex{9}\)所示,分子氧由两个双键合的氧原子组成,不被归类为化合物,而是单核分子。
一些化学反应,例如上面所示的化学反应,可以朝一个方向进行,直到反应物全部用完。 描述这些反应的方程包含一个单向箭头,并且是不可逆的。 可逆反应是指可以朝任一方向发展的反应。 在可逆反应中,反应物被转化为产物,但是当产物的浓度超过一定阈值(特定反应的特征)时,其中一些产物将被转化为反应物;此时,产物和反应物的名称被颠倒了。 这种来回一直持续到反应物和产物之间出现一定的相对平衡,这种状态称为平衡。 这些可逆反应的情况通常用化学方程表示,双头箭头指向反应物和产物。
例如,在人体血液中,过量的氢离子(H +)与碳酸氢根离子(HCO 3 -)结合,形成与碳酸(H 2 CO 3)的平衡状态。 如果将碳酸添加到该系统中,其中一些碳酸将被转化为碳酸氢盐和氢离子。
\[\ce{HCO^{-}_3 + H^+ \leftrightarrow H_2CO_3} \nonumber\]
但是,在生物反应中,很少能实现平衡,因为反应物或产物或两者的浓度在不断变化,通常一种反应的产物是另一种反应的反应物。 回到血液中氢离子过多的例子,碳酸的形成将是反应的主要方向。 但是,碳酸也可以作为二氧化碳气体(通过呼气)离开人体,而不是转化回碳酸氢根离子,从而根据称为质量作用定律的化学定律将反应推向右边。 这些反应对于维持我们血液的稳态很重要。
\[\ce{HCO_3^- + H^+ \leftrightarrow H_2CO_3 \leftrightarrow CO_2 + H_2O} \nonumber\]
离子和离子键
有些原子在获得或失去一个电子(或可能是两个电子)并形成离子时会更稳定。 这填满了它们最外层的电子壳,使它们的能量更加稳定。 因为电子的数量不等于质子的数量,所以每个离子都有净电荷。 阳离子是通过丢失电子形成的正离子。 负离子是通过获得电子形成的,被称为阴离子。 例如,阴离子的元素名称被更改为以 “-ide” 结尾:例如,氯的阴离子被称为氯化物,硫的阴离子被称为硫化物。
电子从一个元素到另一个元素的这种运动被称为电子转移。 如图所\(\PageIndex{10}\)示,钠(Na)的外电子壳中只有一个电子。 钠捐出一个电子所消耗的能量要比接受另外七个电子填充外壳所需的能量少。 如果钠失去一个电子,它现在有 11 个质子、11 个中子和 10 个电子,剩下的总电荷为 +1。 它现在被称为钠离子。 处于最低能量状态(称为基态)的氯(Cl)的外壳中有七个电子。 同样,氯气获得一个电子比失去七个电子更节能。 因此,它往往会获得一个电子来产生一个具有 17 个质子、17 个中子和 18 个电子的离子,从而产生净负(—1)电荷。 它现在被称为氯离子。 在这个例子中,钠会捐出一个电子来清空其外壳,而氯会接受该电子来填充其外壳。 现在,两个离子都满足八位组规则,并且具有完整的最外层炮弹。 由于电子的数量不再等于质子的数量,因此每个电子现在都是离子,并具有 +1(钠阳离子)或 —1(氯化物阴离子)电荷。 请注意,这些交易通常只能同时进行:为了使钠原子失去电子,必须有合适的接收者(例如氯原子)在场。
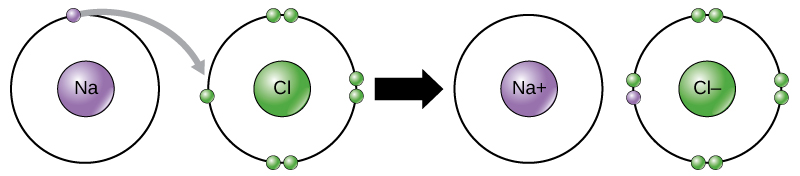
离子键在电荷相反的离子之间形成。 例如,带正电荷的钠离子和带负电荷的氯离子结合在一起形成氯化钠或食盐的晶体,从而形成净电荷为零的结晶分子。
某些盐在生理学中被称为电解质(包括钠、钾和钙)、神经冲动传导、肌肉收缩和水平衡所必需的离子。 许多运动饮料和膳食补充剂提供这些离子,以替代运动时因出汗而从体内流失的离子。
共价键和其他键和相互作用
满足八位组规则的另一种方法是在原子之间共享电子以形成共价键。 这些键比活生物体分子中的离子键更强,更常见。 共价键通常存在于碳基有机分子中,例如我们的DNA和蛋白质。 共价键也存在于 H 2 O、CO 2 和 O 2 等无机分子中。 可以共享一对、两对或三对电子,分别形成单键、双键和三键。 两个原子之间的共价键越多,它们的连接就越牢固。 因此,三重键是最强的。
尽管分子氮 N 2 是大气中最丰富的气体,但不同水平的共价键的强度是活生物很难获得用于构建分子的氮的主要原因之一。 分子氮由两个相互结合的氮原子组成,与所有分子一样,两个氮原子之间共享这三对电子可以填充它们的外部电子壳,从而使分子比单个氮原子更稳定。 这种强大的三键使生命系统很难分解这种氮以将其用作蛋白质和DNA的成分。
水分子的形成提供了共价键的一个例子。 结合形成水分子的氢原子和氧原子通过共价键结合在一起,如图所示\(\PageIndex{8}\)。 来自氢气的电子将其时间分散在氢原子的不完整外壳和氧原子的不完整外壳之间。 为了完全填充氧气的外壳,氧气的外壳中有六个电子,但有八个电子会更稳定,需要两个电子(每个氢原子一个):因此,众所周知的公式 H 2 O。电子在两个元素之间共享,以填充外壳每个,使两个元素都更加稳定。
链接到学习
视频:观看这段短视频,观看离子键和共价键合的动画。
极性共价键
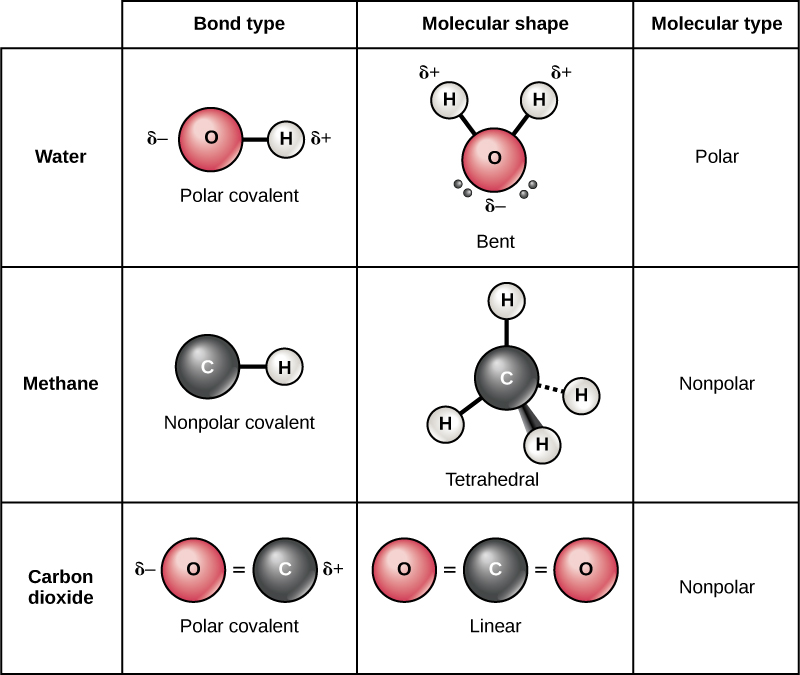
共价键有两种类型:极性和非极性。 如图所示,在极性共价键中\(\PageIndex{11}\),电子被原子不平等地共享,对一个原子核的吸引力比另一个原子核更大。 由于电子在不同元素的原子之间分布不均匀,因此会产生略带正电荷(β +)或略为负(β —)的电荷。 这种部分电荷是水的重要特性,也是其许多特征的原因。
水是一种极性分子,氢原子获得部分正电荷,氧气获得部分负电荷。 之所以发生这种情况,是因为氧原子的原子核对氢原子电子的吸引力比氢原子对氧气电子的吸引力更大。 因此,氧气的电负性比氢气高,共享电子在氧核附近停留的时间比在氢原子核附近停留的时间长,这使氧和氢原子分别略带负电荷和正电荷。 另一种说法是,在氧核附近找到共享电子的可能性要比在氢核附近找到共享电子的可能性更大。 无论哪种方式,只要一个元素的电负性明显高于另一个元素,原子的相对电负性就会导致部分电荷的产生,然后这些极键产生的电荷可以在相反元素的吸引力基础上用于形成氢键部分收费。 (下文将详细讨论的氢键是电荷略带正电荷的氢原子与其他分子中带轻微带负电荷的原子之间的弱键。) 由于大分子内部通常有电负性不同的原子,因此有机分子中经常存在极键。
非极性共价键
非极性共价键在相同元素的两个原子之间或平等共享电子的不同元素之间形成。 例如,分子氧(O 2)是非极性的,因为电子将在两个氧原子之间平均分布。
非极性共价键的另一个例子是甲烷(CH 4),也如图所示\(\PageIndex{11}\)。 碳的最外壳中有四个电子,还需要四个电子才能填充它。 它从四个氢原子中获得这四个氢原子,每个原子提供一个,形成由八个电子组成的稳定外壳。 碳和氢不具有相同的电负性,但相似;因此,形成了非极性键。 每个氢原子都需要一个电子作为其最外层的外壳,当氢原子含有两个电子时,它就会被填充。 这些元素在碳和氢原子之间平等共享电子,从而形成非极性共价分子。
氢键和范德华的相互作用
元素之间的离子键和共价键需要能量才能破裂。 离子键不如共价那么强,共价决定了它们在生物系统中的行为。 但是,并非所有键都是离子键或共价键。 分子之间也可能形成较弱的键。 经常出现的两个弱键是氢键和范德华相互作用。 没有这两种类型的纽带,我们所知道的生命就不会存在。 氢键提供了水的许多关键的、维持生命的特性,还可以稳定蛋白质和DNA的结构,而DNA是细胞的组成部分。
当形成含有氢的极性共价键时,该键中的氢气具有略带正电荷,因为氢气的电子被更强地拉向另一种元素而远离氢气。 由于氢气略为正,它会被邻近的负电荷所吸引。 发生这种情况时,来自一个分子的氢气的 β + 与另一个分子(通常是氧气或氮)或同一个分子内电负性更强的原子(通常是氧气或氮)上的 β 电荷之间会发生微弱的相互作用。 这种相互作用被称为氢键。 这种类型的键很常见,经常发生在水分子之间。 单个氢键很弱,很容易破裂;但是,它们大量存在于水和有机聚合物中,共同产生了主要的力量。 氢键还负责将 DNA 双螺旋连接在一起。
与氢键一样,范德华的相互作用是分子之间的弱吸引力或相互作用。 范德华的吸引力可能发生在任何两个或两个以上的分子之间,并且取决于电子密度的微小波动,而电子密度在原子周围并不总是对称的。 为了实现这些吸引力,这些分子必须彼此非常接近。 这些键以及离子键、共价键和氢键有助于形成细胞中蛋白质的三维结构,这是其正常功能所必需的。
职业联系:药物化学家
药物化学家负责开发新药物,并努力确定新旧药物的作用方式。 他们参与药物研发过程的每一个步骤。 药物可以在自然环境中找到,也可以在实验室中合成。 在许多情况下,自然界中发现的潜在药物会在实验室中进行化学改变,以使其更安全、更有效,有时合成版本的药物会取代自然界中发现的药物。
在最初发现或合成药物之后,化学家随后开发出药物,可能对其进行化学改造,对其进行测试以查看药物是否有毒,然后设计高效大规模生产的方法。 然后,开始了批准该药物供人使用的过程。 在美国,药物批准由美国食品药品监督管理局(FDA)处理,涉及一系列利用人体受试者进行的大规模实验,以确保药物无害并有效治疗其旨在治疗的疾病。 该过程通常需要数年时间,除化学家外,还需要医生和科学家的参与才能完成测试并获得批准。
最初在活生物体中发现的药物的一个例子是紫杉醇(紫杉醇),这是一种用于治疗乳腺癌的抗癌药物。 这种药物是在太平洋紫杉树的树皮中发现的。 另一个例子是阿司匹林,它最初是从柳树皮中分离出来的。 寻找药物通常意味着测试数百个植物、真菌和其他生命形式的样本,看看其中是否发现了任何生物活性化合物。 有时,传统医学可以为现代医学提供线索,说明在哪里可以找到活性化合物。 例如,使用柳树皮制造药物已有数千年的历史,其历史可以追溯到古埃及。 但是,直到1800年代末,被称为乙酰水杨酸的阿司匹林分子才被纯化并上市供人使用。
偶尔,发现为一种用途开发的药物具有不可预见的效果,使这些药物能够以其他不相关的方式使用。 例如,药物米诺地尔(Rogaine)最初是为治疗高血压而开发的。 在人体上进行测试时,发现服用该药物的人会长出新头发。 最终,这种药物被销售给秃发的男性和女性,以恢复脱发。
药物化学家的职业生涯可能涉及侦探工作、实验和药物开发,所有这些都是为了让人类更健康。
摘要
物质是任何占据空间并具有质量的东西。 它由元素组成。 所有自然存在的92种元素都具有独特的特性,使它们能够以各种方式结合形成分子,而分子反过来又结合形成细胞、组织、器官系统和生物。 原子由质子、中子和电子组成,是保留该元素所有特性的元素的最小单位。 电子可以转移、共享或造成原子之间的电荷差异以产生键,包括离子键、共价键和氢键,以及范德华的相互作用。
艺术联系
图\(\PageIndex{2}\):carbon-12 和 carbon-13 分别有多少中子?
- 回答
-
Carbon-12 有六个中子。 Carbon-13 有七个中子。
图\(\PageIndex{6}\):一个原子可以给出、吸收或与另一个原子共享电子,以实现全价壳,这是最稳定的电子结构。 从这个数字来看,为了实现稳定的电子配置,第 1 组中的元素需要丢失多少电子? 要实现稳定的配置,第 14 组和 17 组中的元素需要获得多少电子?
- 回答
-
第 1 组中的元素需要丢失一个电子才能实现稳定的电子结构。 第 14 组和第 17 组中的元素需要分别获得四个和一个电子才能实现稳定的配置。
词汇表
- 阴离子
- 由原子获得一个或多个电子形成的负离子
- 原子
- 保留元素所有化学特性的最小物质单位
- 原子质量
- 计算出的元素同位素质量数的平均值
- 原子数
- 原子中的质子总数
- 平衡化学方程
- 化学反应陈述,产物和反应物的每种类型原子的数量相等
- 阳离子
- 由原子丢失一个或多个电子形成的正离子
- 化学键
- 两个或多个相同或不同原子之间的相互作用导致分子的形成
- 化学反应
- 导致分子中原子重排的过程
- 化学反应性
- 相互结合和化学结合的能力
- 化合物
- 由至少两种不同元素的原子组成的分子组成的物质
- 共价键
- 两个相同或不同元素之间形成的强键类型;原子共享电子时形成
- 电解质
- 神经冲动传导、肌肉收缩和水平衡所必需的离子
- 电子
- 位于电子轨道原子核之外的带负电荷的亚原子粒子;缺乏功能质量且负电荷为 —1 单位
- 电子配置
- 原子电子壳中电子的排列(例如,1s 2 2s 2 2p 6)
- 电子轨道
- 电子在原子核周围的空间分布情况;最有可能发现电子的区域
- 电子转移
- 电子从一种元素移动到另一种元素;在产生离子键时很重要
- 电负性
- 某些元素能够吸引电子(通常是氢原子),在分子中获得部分负电荷并在氢原子上产生部分正电荷
- 元素
- 118 种无法分解成较小物质的独特物质之一;每种元素都有独特的特性和指定数量的质子
- 平衡
- 封闭系统中可逆化学反应中相对反应物和产物浓度的稳定状态
- 氢键
- 稍带正电荷的氢原子与其他分子中带轻微带负电荷的原子之间的键很弱
- 惰性气体
- (也是稀有气体)元素,外层电子壳已填充,与其他原子没有反应
- 离子
- 不包含相等数量的质子和电子的原子或化学基团
- 离子键
- 电荷相反的离子(阳离子和阴离子)之间形成的化学键
- 不可逆的化学反应
- 化学反应,其中反应物单向产生产物
- 同位素
- 一种或多种具有不同中子数的元素形式
- 群众行动法则
- 化学定律规定反应速率与反应物质的浓度成正比
- 质量数
- 原子中质子和中子的总数
- 事情
- 任何有质量并占用空间的东西
- 分子
- 两个或多个原子化学结合在一起
- 中子
- 驻留在原子核中的无带电粒子;质量为 1 amu
- 稀有气体
- 参见惰性气体
- 非极性共价键
- 当原子之间平均共享电子时,原子之间形成的一种共价键
- 核
- 原子的核心;包含质子和中子
- 八位组规则
- 规则是,当原子在最外层的壳中容纳八个电子时,它们是最稳定的
- 轨道的
- 原子核周围的区域;包含电子
- 周期表
- 表示每个元素的原子序数和原子质量的元素组织图;提供有关元素属性的关键信息
- 极性共价键
- 一种共价键,由于电子共享不均而形成,导致分子中产生略带正电荷和略带负电荷的区域
- 产品
- 在化学方程右侧发现的分子
- 质子
- 存在于原子核中的带正电荷的粒子;质量为 1 amu,电荷为 +1
- 放射性同位素
- 发射由亚原子粒子组成的辐射以形成更稳定的元素的同位素
- 反应物
- 在化学方程左侧发现的分子
- 可逆的化学反应
- 双向化学反应,如果产物浓度足够高,则会变成反应物
- 瓦朗斯外壳
- 原子的最外壳
- 范德华互动
- 由于临时电荷吸引了非常接近的原子,分子之间的相互作用非常弱



