9.2: أنواع الروابط الجزيئية
- Page ID
- 196471
في نهاية هذا القسم، ستكون قادرًا على:
- التمييز بين الأنواع المختلفة للروابط الجزيئية
- حدد طاقة تفكك الجزيء باستخدام المفاهيم: طاقة التأين، وألفة الإلكترون، وقوة كولوم
- وصف الترابط التساهمي من حيث التماثل التبادلي
- شرح البنية الفيزيائية للجزيء من حيث مفهوم التهجين
حققت ميكانيكا الكم نجاحًا استثنائيًا في شرح البنية والترابط في الجزيئات، وبالتالي فهي الأساس لجميع الكيمياء. تشرح كيمياء الكم، كما يطلق عليها أحيانًا، أسئلة أساسية مثل سبب وجود\(H_2O\) الجزيئات، ولماذا تكون زاوية الترابط بين ذرات الهيدروجين في هذا الجزيء 104.5 درجة بالضبط، ولماذا ترتبط هذه الجزيئات معًا لتكوين ماء سائل في درجة حرارة الغرفة. يمكن أن يكون تطبيق ميكانيكا الكم على الجزيئات أمرًا صعبًا للغاية من الناحية الرياضية، لذلك ستكون مناقشتنا نوعية فقط.
عندما ندرس الجزيئات ثم المواد الصلبة، سنستخدم العديد من النماذج العلمية المختلفة. في بعض الحالات، ننظر إلى الجزيء أو البلورة كمجموعة من النوى النقطية مع الإلكترونات التي تدور حول الخارج في مسارات محددة جيدًا، كما هو الحال في نموذج Bohr. في حالات أخرى، نستخدم معرفتنا الكاملة بميكانيكا الكم لدراسة هذه الأنظمة باستخدام وظائف الموجة ومفهوم دوران الإلكترون. من المهم أن نتذكر أننا ندرس الفيزياء الحديثة باستخدام النماذج، وأن النماذج المختلفة مفيدة لأغراض مختلفة. نحن لا نستخدم دائمًا النموذج الأقوى، عندما يقوم نموذج أقل قوة وأسهل في الاستخدام بالمهمة.
أنواع السندات
تتكون الوحدات الكيميائية من أنواع مختلفة من الروابط الكيميائية. تتكون الرابطة الأيونية عندما ينتقل الإلكترون من ذرة إلى أخرى. تحدث الرابطة التساهمية عندما تتشارك ذرتان أو أكثر الإلكترونات. تحدث رابطة Van der Waals بسبب جذب الجزيئات المستقطبة للشحنة وهي أضعف بكثير من الروابط الأيونية أو التساهمية. توجد أيضًا العديد من أنواع الترابط الأخرى. في كثير من الأحيان، يحدث الترابط عبر أكثر من آلية. يركز هذا القسم على الترابط الأيوني والتساهمي.
روابط أيونية
ربما تكون الرابطة الأيونية أسهل أنواع الروابط التي يمكن فهمها. يشرح تكوين مركبات الملح، مثل كلوريد الصوديوم،\(\ce{NaCl}\). تحتوي ذرة الصوديوم (الرمز Na) على نفس ترتيب الإلكترون مثل ذرة النيون بالإضافة إلى إلكترون واحد قدره 3 ثوان. مطلوب 5.14 eV فقط من طاقة التأين لإزالة هذا الإلكترون الواحد من ذرة الصوديوم. لذلك، يمكن لـ Na التخلي بسهولة عن هذا الإلكترون أو التبرع به إلى ذرة مجاورة (قريبة)، مما يحقق ترتيبًا أكثر استقرارًا للإلكترونات. يتطلب الكلور (الرمز Cl) إلكترونًا واحدًا فقط لإكمال غلاف التكافؤ الخاص به، لذلك فهو يقبل هذا الإلكترون بسهولة إذا كان بالقرب من ذرة الصوديوم. لذلك نقول أن الكلور له تقارب كبير للإلكترون، وهي الطاقة المرتبطة بالإلكترون المقبول. الطاقة التي تخلصها ذرة الكلور في هذه العملية هي 3.62 eV. بعد انتقال الإلكترون من ذرة الصوديوم إلى ذرة الكلور، تصبح ذرة الصوديوم أيون إيجابي وتصبح ذرة الكلور أيون سالب.
يبدو رد الفعل هذا كما يلي
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \label{rx1} \]
ويتم إعطاء إجمالي الطاقة المطلوبة لهذا النقل من خلال
\[E_{transfer} = 5.14 \,\text{eV} - 3.62 \,\text{eV} = 1.52 \,\text{eV}. \label{9.1} \]
يواجه أيون الصوديوم الموجب وأيون الكلوريد السالب قوة كولوم الجذابة. يتم إعطاء الطاقة الكامنة المرتبطة بهذه القوة من خلال
\[U_{coul} = -\dfrac{ke^2}{r_0}, \nonumber \]
أين\(ke^2 = 1.440\, \text{eV-nm}\)\(r_0\) هي المسافة بين الأيونات.
عندما تتحرك أيونات الصوديوم والكلوريد معًا («تنزل تل الطاقة المحتمل»)، تصبح قوة الجذب بين الأيونات أقوى. ومع ذلك، إذا أصبحت الأيونات قريبة جدًا، تبدأ وظائف الموجة الأساسية للإلكترون في الأيونات بالتداخل. نظرًا لمبدأ الاستبعاد، فإن هذا الإجراء يعزز الإلكترونات الأساسية - وبالتالي الجزيء بأكمله - إلى حالة طاقة أعلى.
\[\ce{ Na^{+}(g) + Cl^{-}(g) -> NaCl(g)} \label{rx2} \]
تحدث مسافة فصل التوازن (أو طول الرابطة) بين الأيونات عندما يكون الجزيء في أدنى حالة طاقة له. بالنسبة للثنائي الذري\(\ce{NaCl}\)، تبلغ هذه المسافة 0.236 نانومتر. \(\PageIndex{1}\)يوضِّح الشكل إجمالي الطاقة\(\ce{NaCl}\) كدالة لمسافة الفصل بين الأيونات.
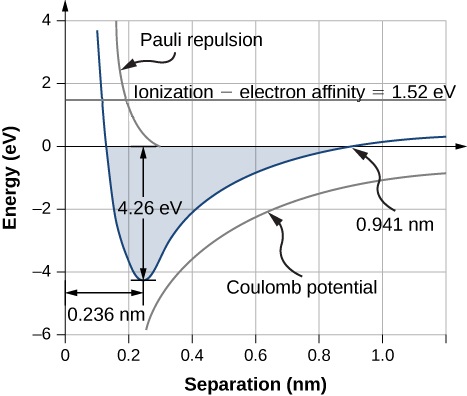
الطاقة الإجمالية المطلوبة لتشكيل وحدة ملح واحدة من\(\ce{Cl}\) الذرات المحايدة\(\ce{Na}\) هي مجموع الطاقات المرتبطة بنقل الإلكترون (المعادلة\ المرجع {rx1}) والجمع الأيوني (المعادلة\ ref {rx2}):
\[U_{form} = E_{transfer} + U_{coul} + U_{ex}, \nonumber \]
\(U_{ex}\)أين الطاقة المرتبطة بالتنافر بين الإلكترونات الأساسية بسبب مبدأ استبعاد باولي. \(U_{form}\)يجب أن تكون القيمة سالبة حتى تتشكل الرابطة تلقائيًا (وإلا تكون الطاقة أقل في الأنواع المنفصلة). تُعرّف طاقة التفكك بأنها الطاقة المطلوبة لفصل الوحدة إلى الأيونات المكونة لها، مكتوبة
\[U_{diss} = -U_{form} \nonumber \]
كل وحدة صيغة ثنائية الذرة لها طاقة التفكك المميزة وطول فصل التوازن. يتم إعطاء قيم العينة في الجدول\(\PageIndex{1}\).
يمكن كسر الروابط بشكل متماثل أو غير متماثل. يُطلق على الأول اسم التحلل المتجانس وهو أساس طاقة تفكك الرابطة المعتادة (المتجانسة). بالنسبة لوحدة صيغة الملح (\(\ce{NaCl}\))، سيكون التفاعل المتماثل المرتبط
\[\ce{NaCl(g) -> Na (g) + Cl(g)} \label{homo} \]
يُطلق على القص غير المتماثل للرابطة اسم التحلل غير المتجانس (أي طاقة تفكك الرابطة غير المتجانسة). \(\ce{ NaCl}\)سيكون رد الفعل غير المتجانس المرتبط بـ
\[\ce{NaCl(g) -> Na^{+} (g) + Cl^{-}(g)} \label{hetero} \]
يتم\(E_{transfer}\) إعطاء الفرق في طاقات تفكك الرابطة المتجانسة وغير المتجانسة فقط من خلال المعادلة\ ref {9.1}.
| الجزيء | طاقة التفكك (eV) | فصل التوازن (نانومتر) (طول الرابطة) |
|---|---|---|
| كلوريد الصوديوم | 4.26 | 0.236 |
| NaF | 4.99 | 0.193 |
| NaBR | 3.8 | 0.250 |
| آني | 3.1 | 0.271 |
| Nah | 2.08 | 0.189 |
| ليكل | 4.86 | 0.202 |
| LiH | 2.47 | 0.239 |
| LIII | 3.67 | 0.238 |
| كلوريد متعدد الكلور | 4.43 | 0.267 |
| كيلوبتراً | 3.97 | 0.282 |
| RBF | 5.12 | 0.227 |
| ثنائي الفينيل متعدد الكلور | 4.64 | 0.279 |
| CSI | 3.57 | 0.337 |
| ح ح | 4.5 | 0.075 |
| ني-ن | 9.8 | 0.11 |
| أو-أو | 5.2 | 0.12 |
| اف-اف | 1.6 | 0.14 |
| سي إل سي إل | 2.5 | 0.20 |
ما طاقة التفكك لوحدة صيغة الملح (NaCl)؟
إستراتيجية
كلوريد الصوديوم (\(\ce{NaCl}\)) هو ملح يتكون من روابط أيونية. يعتمد تغيير الطاقة المرتبط بهذه الرابطة على ثلاث عمليات رئيسية:
- تأين Na وقبول الإلكترون من ذرة Na بواسطة ذرة Cl؛ و
- جذب الكولوم للأيونات الناتجة (\(\ce{Na^{+}}\)و\(\ce{Cl^{-}}\)).
- إذا اقتربت الأيونات كثيرًا، فإنها تنفر بسبب مبدأ الاستبعاد (0.32 eV).
مسافة فصل التوازن هي\(r_0 = 0.236 \text{nm}\).
الحل
التغيير في الطاقة المرتبط بنقل الإلكترون من Na إلى Cl هو 1.52 eV (المعادلة\ ref {9.1}). عند فصل الاتزان، تكون الذرات\(r_0 = 0.236 \text{nm}\) منفصلة. الطاقة الكامنة الكهروستاتيكية للذرات هي
\[\begin{align*} U_{could} &= -\dfrac{ke^2}{r_0} \\[5pt] &= - \dfrac{1.44 \, \text{eV} \cdot nm}{0.236 \,nm} \\[5pt] &= - 6.10 \, \text{eV} . \end{align*} \nonumber \]
إجمالي فرق الطاقة المرتبط بتكوين وحدة صيغة NaCl هو
\[\begin{align*}E_{form} &= E_{transfer} + U_{coul} + U_{ex} \\[5pt] &= 1.52 \, \text{eV} + (−6.10 eV) + 0.32\, \text{eV} \\[5pt] &= -4.26 eV \end{align*} \nonumber \]
لذلك، تبلغ طاقة التفكك المتماثل 4.26 eV.\(\ce{NaCl}\)
الدلالة
إن تكوين وحدة صيغة NaCl عن طريق الترابط الأيوني مفيد للغاية. تبلغ طاقة التفكك أو الطاقة المطلوبة لفصل وحدة NaCl إلى\(Na\)\(Cl\) الذرات 4.26 eV، بما يتفق مع الشكل\(\PageIndex{1}\).
لماذا تعتبر الطاقة الكامنة المرتبطة بمبدأ الاستبعاد إيجابية في المثال\(\PageIndex{1}\)؟
- إجابة
-
إنه يتوافق مع قوة التنافر بين الإلكترونات الأساسية في الأيونات.
على أي\(\ce{Cl}\) مسافة\(\ce{Na}\) - هل من الملائم جدًا حدوث هذا التفاعل؟
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \nonumber \]
- إجابة
-
يحدث هذا عندما تقوم طاقة الجهد الكهربائي (\(U_{coul}\)) وطاقة تنافر باولي (\(U_{ex}\)) بمعادلة الطاقة لنقل الإلكترون (\(E_{transfer}\))، وهو 0.941 نانومتر وفقًا للشكل\(\PageIndex{1}\). لاحظ ذلك\(U_{ex} \approx 0\) على هذه المسافة.
بالنسبة لأيون الصوديوم في بلورة NaCl الأيونية،\(U_{could}\) يجب تعديل التعبير عن طاقة جهد كولوم بعامل يعرف باسم ثابت Madelung. يأخذ هذا العامل في الاعتبار تفاعل أيون الصوديوم مع جميع أيونات الكلوريد والصوديوم القريبة. يبلغ ثابت Madelung لبلورة NaCl حوالي 1.75. تشير هذه القيمة إلى مسافة فصل الاتزان بين\(Na^+\)\(Cl^-\) والأيونات قدرها 0.280 نانومتر - وهي أكبر قليلاً من المسافة الخاصة بـ NaCl ثنائي الذرة. سنعود إلى هذه النقطة مرة أخرى لاحقًا.
السندات التساهمية
في رابطة أيونية، ينتقل الإلكترون من ذرة إلى أخرى. ومع ذلك، في رابطة تساهمية، يتم تقاسم الإلكترون بين ذرتين. لا يمكن لآلية الترابط الأيوني تفسير وجود جزيئات مثل\(H_2\),\(O_2\), و CO, نظرًا لعدم وجود مسافة فصل تكون فيها طاقة الجذب السلبية الكامنة أكبر في الحجم من الطاقة اللازمة لإنشاء الأيونات. يعتمد الفهم الدقيق لكيفية ارتباط هذه الجزيئات تساهميًا على فهم أعمق لميكانيكا الكم يتجاوز تغطية هذا الكتاب، لكننا سنصف الآليات نوعيًا في القسم التالي.
يمكن فهم الروابط التساهمية باستخدام المثال البسيط\(\ce{H_2^{+}}\) للجزيء، والذي يتكون من إلكترون واحد في المجال الكهربائي لبروتونين. يمكن تصميم هذا النظام بواسطة إلكترون في بئر مربع مزدوج (الشكل\(\PageIndex{2}\)). من المحتمل أيضًا العثور على الإلكترون في كل بئر، لذا فإن وظيفة الموجة إما متماثلة أو غير متماثلة حول نقطة في منتصف المسافة بين الآبار.
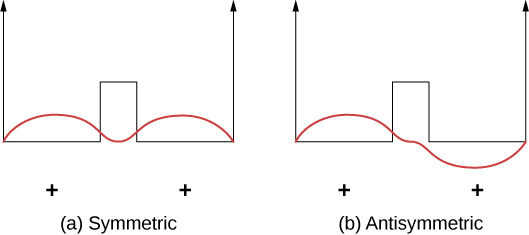
تخيل الآن أن البئرين مفصولين بمسافة كبيرة. في الحالة الأرضية، توجد وظيفة الموجة في واحدة من حالتين محتملتين: إما قمة موجبة واحدة («سنام» تشبه الموجة الجيبية) في كلا البئرين (الحالة المتماثلة)، أو ذروة موجبة في بئر واحدة وقمة سالبة في الأخرى (حالة عدم التماثل). هذه الدول لديها نفس الطاقة. ومع ذلك، عندما يتم تجميع الآبار معًا، تصبح وظيفة الموجة المتماثلة هي الحالة الأرضية وتصبح الحالة المضادة للتناظر أول حالة مثيرة - وبعبارة أخرى، يتم تقسيم مستوى طاقة الإلكترون. لاحظ أن حالة التماثل الفضائي تصبح الحالة المواتية للطاقة (الطاقة المنخفضة).
نفس التحليل مناسب لإلكترون مرتبط بذرتين هيدروجين. هنا، تحتوي أشكال وظائف موجة الحالة الأرضية على الشكل\(e^{-r/a_0}\) أو\(e^{(-|x|/a_0)}\) في بُعد واحد. تشير حالة التماثل الفضائي المواتية للطاقة إلى كثافة شحن عالية في منتصف المسافة بين البروتونات حيث من المحتمل أن تسحب الإلكترونات البروتونات المشحونة إيجابًا معًا.
إذا تمت إضافة إلكترون ثانٍ إلى هذا النظام لتكوين\(H_2\) جزيء، يجب أن تصف دالة الموجة كلا الجسيمين، بما في ذلك علاقتهما المكانية ودوراتهما النسبية. يجب أن تحترم وظيفة الموجة هذه أيضًا عدم قابلية تمييز الإلكترونات. («إذا رأيت إلكترون واحدًا، فقد رأيتهم جميعًا.») على وجه الخصوص، يجب ألا ينتج عن تبديل الإلكترونات أو تبادلها تأثيرًا ملحوظًا، وهي خاصية تسمى التماثل التبادلي. يمكن أن يكون التماثل التبادلي متماثلًا، ولا ينتج عنه أي تغيير في وظيفة الموجة، أو مضادًا للتماثل، مما ينتج عنه تغيير عام في علامة دالة الموجة - ولا يمكن ملاحظة أي منهما.
كما نناقش لاحقًا، يجب أن تكون دالة الموجة الكلية لإلكترونين مضادة للتناظر عند التبادل. على سبيل المثال، يمكن أن يكون إلكترونان مرتبطان بجزيء الهيدروجين في حالة تماثل الفضاء مع دوران مضاد للالتوازي (↑ ↓) أو حالة عدم تناسق الفضاء مع دوران متوازي (↑). تعتبر الحالة ذات الدورات المضادة للالتوازي مواتية للطاقة وبالتالي تستخدم في الترابط التساهمي. ومع ذلك، إذا تم ربط البروتونات معًا بشكل وثيق جدًا، يصبح التنافر بين البروتونات مهمًا. (في الجزيئات الأخرى، يتم توفير هذا التأثير من خلال مبدأ الاستبعاد.) ونتيجة لذلك،\(H_2\) يصل فصل التوازن إلى حوالي 0.074 نانومتر مع طاقة ربط تبلغ 4.52 eV.
قم بزيارة هذا البرنامج التعليمي لـ PBS Learning Media والمحاكاة التفاعلية لاستكشاف القوى الجذابة والمثيرة للاشمئزاز التي تعمل على الجسيمات الذرية والترابط التساهمي في\(H_2\) الجزيء.
تستبعد ميكانيكا الكم العديد من أنواع الجزيئات. على سبيل المثال،\(H_3\) لا يتشكل الجزيء، لأنه إذا اقتربت ذرة H ثالثة من الهيدروجين ثنائي الذرة، فإن الوظيفة الموجية للإلكترون في هذه الذرة تتداخل مع الإلكترونات في الذرتين الأخريين. إذا كانت جميع الإلكترونات الثلاثة في الحالات الأرضية لذراتها الخاصة، فإن زوجًا واحدًا من الإلكترونات يشترك في جميع الأرقام الكمومية نفسها، وهو أمر محظور بموجب مبدأ الاستبعاد. بدلاً من ذلك، يتم دفع أحد الإلكترونات إلى حالة طاقة أعلى. لا يوجد فصل بين ثلاثة بروتونات يكون فيها إجمالي تغير الطاقة لهذه العملية سلبيًا - أي عندما يحدث الترابط تلقائيًا. وبالمثل، لا\(He_2\) ترتبط تساهميًا في الظروف العادية، لأن هذه الذرات ليس لديها إلكترونات متكافئة لمشاركتها. عندما يتم جمع الذرات معًا، تتداخل وظائف الموجة للإلكترونات الأساسية، وبسبب مبدأ الاستبعاد، يتم إجبار الإلكترونات على حالة طاقة أعلى. لا يوجد فصل يكون فيه هذا الجزيء مناسبًا بقوة.
الترابط في الجزيئات متعددة الذرات
الجزيء متعدد الذرات هو جزيء يتكون من أكثر من ذرتين. تتراوح الأمثلة من جزيء الماء البسيط إلى جزيء البروتين المعقد. غالبًا ما يمكن فهم هياكل هذه الجزيئات من حيث الترابط التساهمي والتهجين. التهجين هو تغيير في بنية الطاقة للذرة حيث تشارك الحالات المختلطة (الحالات التي يمكن كتابتها كتراكب خطي للآخرين) في الترابط.
لتوضيح التهجين، ضع في اعتبارك الترابط في جزيء مائي بسيط\(H_2O\). التكوين الإلكتروني للأكسجين هو\(1s^22s^22p^4\). توجد إلكترونات 1 s و 2 s في «أغلفة مغلقة» ولا تشارك في الترابط. الإلكترونات الأربعة المتبقية هي إلكترونات التكافؤ. يمكن لهذه الإلكترونات ملء ست حالات محتملة (\(l = 1, m = 0, \pm 1\)بالإضافة إلى الدوران لأعلى ولأسفل). طاقات هذه الحالات هي نفسها، لذلك يمكن لذرة الأكسجين استغلال أي مزيج خطي من هذه الحالات في الترابط مع ذرات الهيدروجين. هذه التركيبات الخطية (التي تعلمتها في الفصل الخاص بالبنية الذرية) تسمى المدارات الذرية، ويتم الإشارة إليها بواسطة\(p_x\)، و\(p_y\)، و\(p_z\). يوضح الشكل توزيعات شحنة الإلكترون لهذه المدارات\(\PageIndex{3}\).
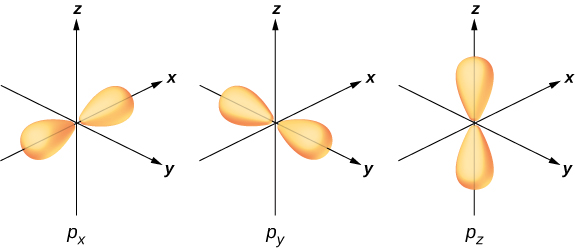
يعد تحويل وظائف الموجة الإلكترونية للأكسجين إلى\(p_x, p_y\)\(p_z\) ذرات الهيدروجين والمدارات في وجود ذرات الهيدروجين مثالاً على التهجين. تم العثور على إلكترونين في\(p_z\) المدار مع دورات مزدوجة (↑ ↓). تم العثور على إلكترون واحد في كل من\(p_x\)\(p_y\) المدارات، مع دوران غير مزدوج. تشارك المدارات الأخيرة في الترابط مع ذرات الهيدروجين. استنادًا إلى الشكل\(\PageIndex{3}\)، نتوقع أن تكون زاوية الترابط لـ H—O—H 90 درجة. ومع ذلك، إذا قمنا بتضمين تأثيرات التنافر بين الذرات، فإن زاوية الرابطة هي 104.5 درجة. يمكن استخدام نفس الحجج لفهم الشكل رباعي السطوح للميثان (\(CH_4\)) والجزيئات الأخرى.


