20.5: تقنيات الأجسام المضادة التلقائية الفلورية
- Page ID
- 194973
أهداف التعلم
- وصف فوائد فحوصات الأجسام المضادة الفلورية المناعية مقارنة بالمقايسات غير الفلورية
- قارن فحوصات الأجسام المضادة الفلورية المباشرة وغير المباشرة
- اشرح كيف يمكن استخدام مقياس التدفق الخلوي لتحديد مجموعات فرعية معينة من الخلايا الموجودة في مزيج معقد من أنواع الخلايا
- اشرح كيف يمكن استخدام فارز الخلايا المنشط بالفلور لفصل أنواع فريدة من الخلايا
يمكن تحقيق التصور السريع للبكتيريا من عينة سريرية مثل مسحة الحلق أو البلغم من خلال تقنيات الأجسام المضادة الفلورية (FA) التي تربط علامة الفلورسنت (الفلوروجين) بالمنطقة الثابتة للجسم المضاد، مما ينتج عنه جزيء مراسل سريع الاستخدام وسهل الرؤية أو القياس، و قادرة على ربط العلامات المستهدفة بخصوصية عالية. يمكننا أيضًا تسمية الخلايا، مما يسمح لنا بتحديد مجموعات فرعية معينة من الخلايا بدقة أو حتى تنقية هذه المجموعات الفرعية لمزيد من البحث.
كما هو الحال مع المقايسات الإنزيمية، قد تكون طرق FA مباشرة، حيث يربط المُصنَّف mAb مستضدًا، أو غير مباشرة، حيث تربط الأجسام المضادة الثانوية متعددة النسيلة الأجسام المضادة للمريض التي تتفاعل مع مستضد مُعد مُعد. تم توضيح تطبيقات هاتين الطريقتين في الشكل 2.3.8. تُستخدم طرق FA أيضًا في أنظمة عد وفرز الخلايا الآلية لتعداد أو فصل المجموعات السكانية الفرعية المصنفة للخلايا في العينة.
تقنيات الأجسام المضادة الفلورية المباشرة
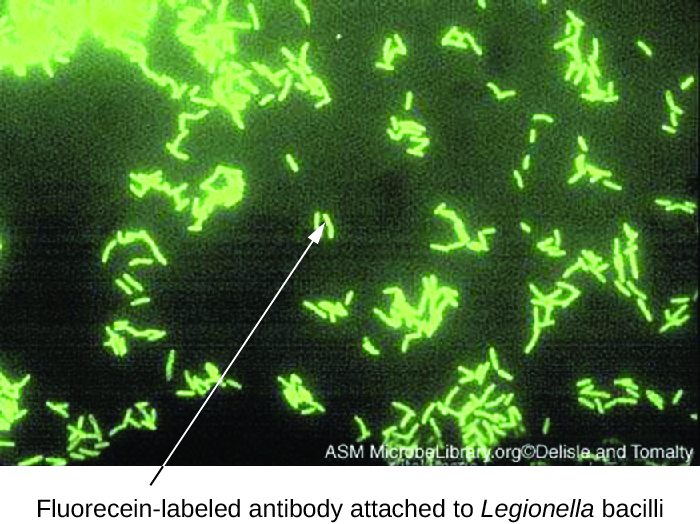
تستخدم اختبارات الأجسام المضادة الفلورية المباشرة (DFA) مادة mAb تحمل علامة فلورسنت لربط وإضاءة المستضد المستهدف. اختبارات DFA مفيدة بشكل خاص للتشخيص السريع للأمراض البكتيرية. على سبيل المثال، يمكن استخدام الأجسام المضادة التي تحمل علامة الفلورسنت ضد المكورات العقدية المقيحة (بكتيريا المجموعة أ) للحصول على تشخيص التهاب الحلق العقدي من مسحة الحلق. التشخيص جاهز في غضون دقائق، ويمكن أن يبدأ المريض بالمضادات الحيوية قبل مغادرة العيادة. يمكن أيضًا استخدام تقنيات DFA لتشخيص الالتهاب الرئوي الناجم عن الميكوبلازما الرئوية أو الليجيونيلا الرئوية من عينات البلغم (الشكل\(\PageIndex{1}\)). ترتبط الأجسام المضادة الفلورية بالبكتيريا الموجودة على شريحة مجهرية، مما يسمح بالكشف السريع عن البكتيريا باستخدام المجهر الفلوري. وبالتالي، تعتبر تقنية DFA ذات قيمة لتصور بعض البكتيريا التي يصعب عزلها أو استزراعها من عينات المرضى.
التمارين\(\PageIndex{1}\)
في اختبار الأجسام المضادة الفلورية المباشر، ما الذي يرتبط به الجسم المضاد الفلوري؟
تقنيات الأجسام المضادة الفلورية المباشرة
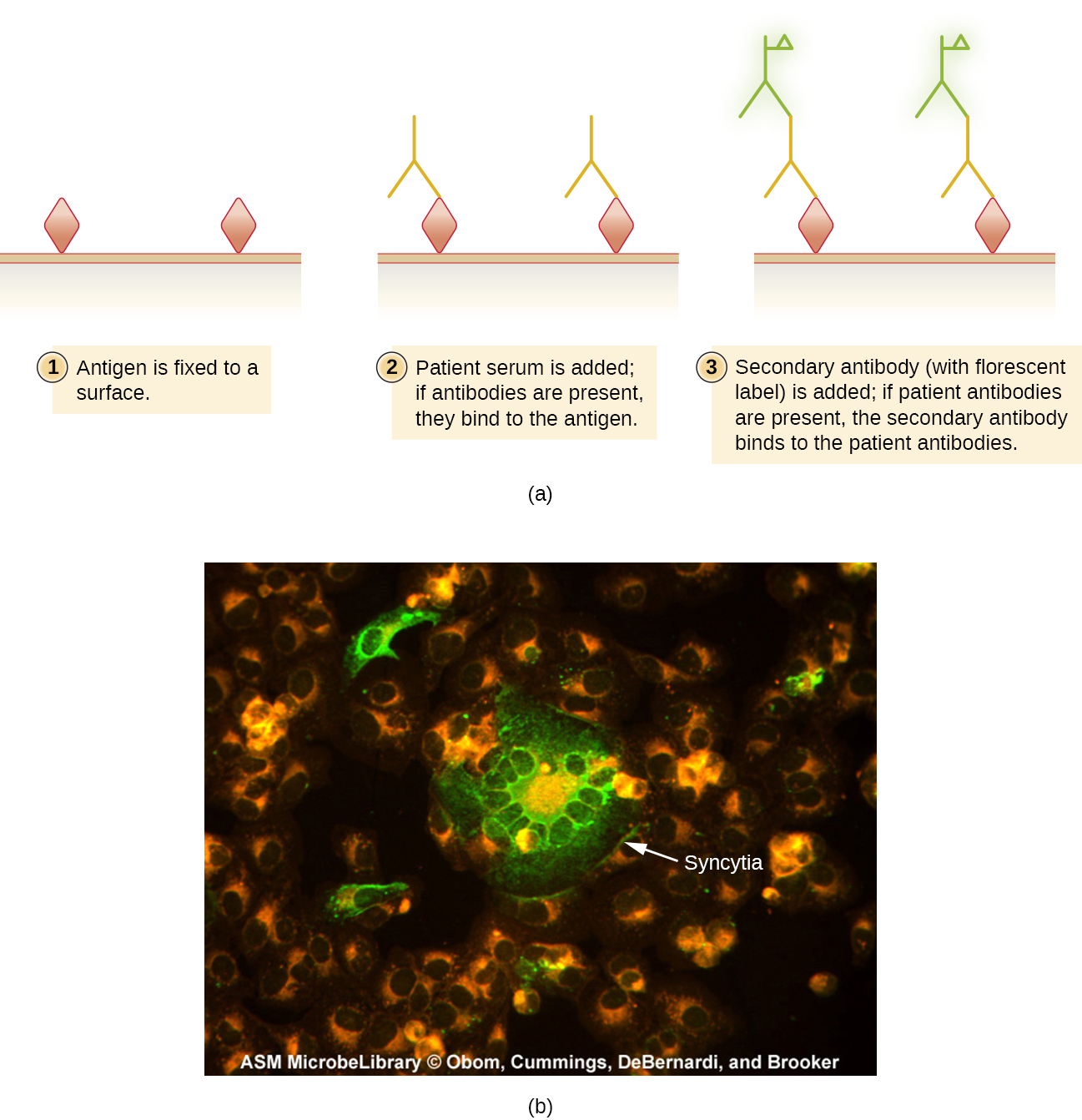
تُستخدم اختبارات الأجسام المضادة الفلورية غير المباشرة (IFA\(\PageIndex{2}\)) (الشكل) للبحث عن الأجسام المضادة في مصل المريض. على سبيل المثال، يستخدم اختبار IFA لتشخيص مرض الزهري خلايا T. pallidum المعزولة من حيوان المختبر (لا يمكن زراعة البكتيريا على وسائط المختبر) ومسحة محضرة على شريحة زجاجية. يتم توزيع مصل المريض على اللطاخة ويسمح للأجسام المضادة للتريبونيمال، إن وجدت، بالارتباط. يتم غسل المصل وإضافة جسم مضاد ثانوي. الجسم المضاد الثانوي هو غلوبولين مناعي مضاد للإنسان مقترن بالفلوروجين. عند الفحص، لن تكون بكتيريا T. pallidum مرئية إلا إذا كانت مرتبطة بالأجسام المضادة من مصل المريض.
يوفر اختبار IFA لمرض الزهري مكملاً مهمًا لاختبار VDRL الذي تمت مناقشته في الكشف عن مجمعات الأجسام المضادة للمستضد. من المرجح أن يولد VDRL تفاعلات إيجابية كاذبة أكثر من اختبار IFA؛ ومع ذلك، يعد VDRL اختبارًا أفضل لتحديد ما إذا كانت العدوى نشطة حاليًا.
اختبارات IFA مفيدة أيضًا لتشخيص أمراض المناعة الذاتية. على سبيل المثال، تتميز الذئبة الحمامية الجهازية (SLE) (انظر اضطرابات المناعة الذاتية) بمستويات تعبير مرتفعة عن الأجسام المضادة للنواة (ANA). يمكن التعبير عن هذه الأجسام المضادة الذاتية مقابل مجموعة متنوعة من البروتينات الرابطة للحمض النووي وحتى ضد الحمض النووي نفسه. نظرًا لصعوبة تشخيص المناعة الذاتية في كثير من الأحيان، خاصة في وقت مبكر من تطور المرض، يمكن أن يكون اختبار ANA دليلًا قيمًا في إجراء التشخيص وبدء العلاج المناسب.
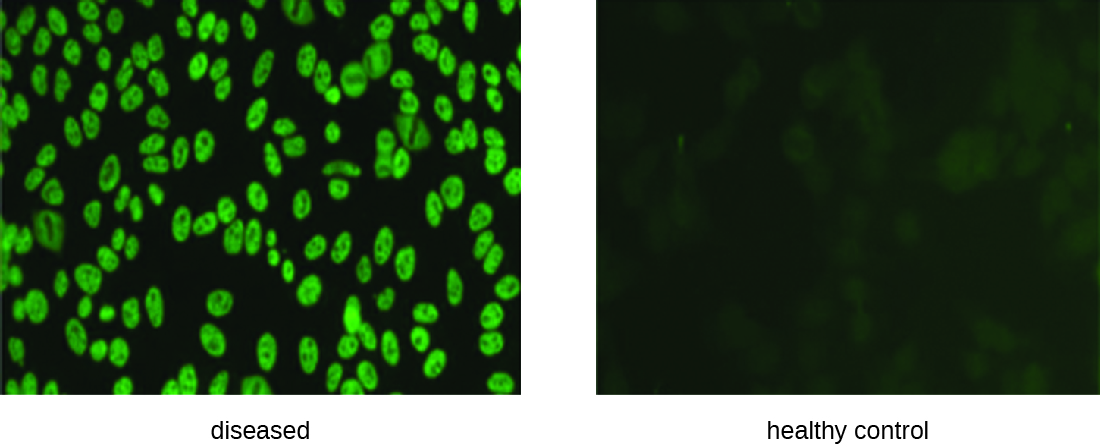
يبدأ IFA لـ ANA بتثبيت الخلايا المزروعة في الثقافة على شريحة زجاجية وجعلها قابلة للنفاذ إلى الأجسام المضادة. ثم يتم تحضين الشرائح بتخفيفات تسلسلية للمصل من المريض. بعد فترة الحضانة، يتم غسل الشريحة لإزالة البروتينات غير المرتبطة، وإضافة الجسم المضاد الفلوري (IgG المضاد للإنسان المقترن بالفلوروجين). بعد الحضانة والغسيل، يمكن فحص الخلايا بحثًا عن التألق الواضح حول النواة (الشكل\(\PageIndex{3}\)). يتم تحديد عيار ANA في المصل من خلال أعلى تخفيف يظهر الفلورة. نظرًا لأن العديد من الأشخاص الأصحاء يعبرون عن ANA، توصي الكلية الأمريكية لأمراض الروماتيزم بأن يكون العيار 1:40 على الأقل في حالة وجود أعراض تشمل جهازين أو أكثر من أجهزة الأعضاء ليتم اعتبارها مؤشرًا على مرض الذئبة الحمراء. 1
التمارين\(\PageIndex{2}\)
- في اختبار الأجسام المضادة الفلورية غير المباشر، ما الذي يرتبط به الجسم المضاد الفلوري؟
- ما الذي يبحث عنه اختبار ANA؟
قياس التدفق الخلوي
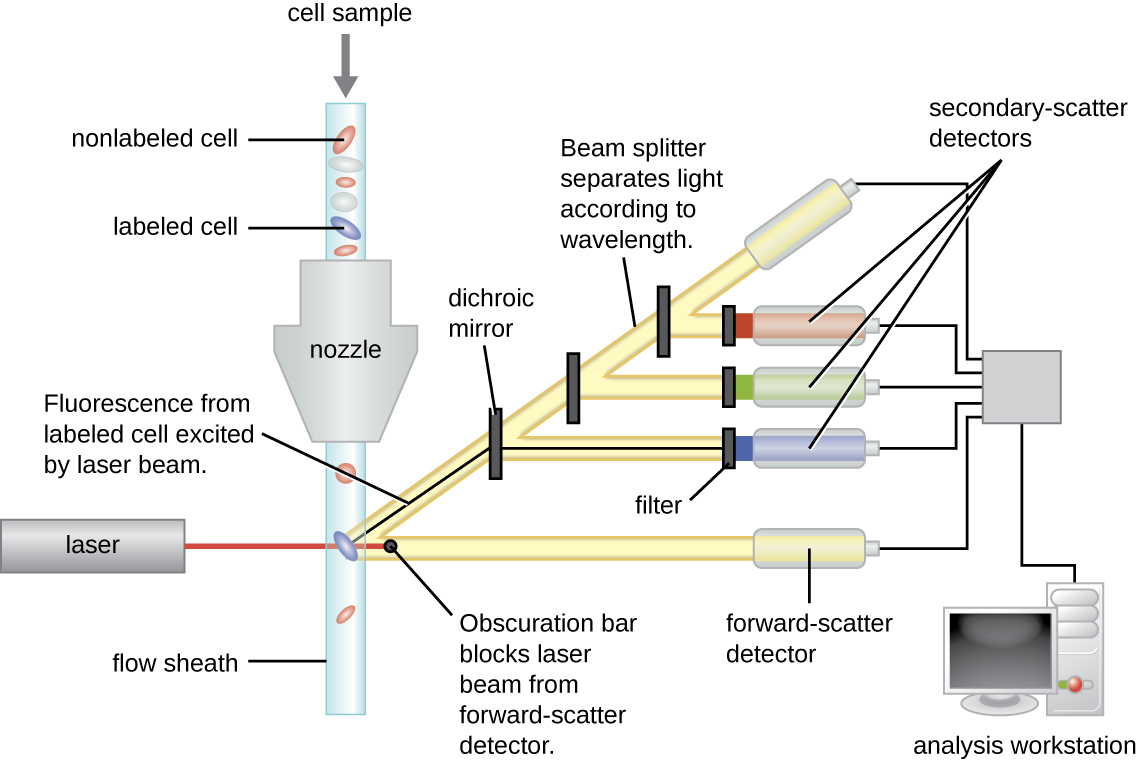
يمكن استخدام الأجسام المضادة المصنفة بالفلور لتحديد كمية الخلايا من نوع معين في خليط معقد باستخدام قياس التدفق الخلوي (الشكل\(\PageIndex{4}\))، وهو نظام آلي لعد الخلايا يكتشف الخلايا الفلورية أثناء مرورها عبر أنبوب ضيق خلية واحدة في كل مرة. على سبيل المثال، في حالات الإصابة بفيروس نقص المناعة البشرية، من المهم معرفة مستوى خلايا CD4 T في دم المريض؛ إذا انخفضت الأرقام إلى أقل من 500 لكل ميكرولتر من الدم، يصبح المريض أكثر عرضة للإصابة بالعدوى الانتهازية؛ أقل من 200 لكل ميكرولتر، لم يعد بإمكان المريض تكوين استجابة مناعية تكيفية مفيدة على الإطلاق. يبدأ التحليل باحتضان مجموعة من الخلايا المختلطة (على سبيل المثال، خلايا الدم البيضاء من متبرع) باستخدام mAb مُصنَّف بالفلور خصيصًا لمجموعة فرعية من الخلايا (على سبيل المثال، مضاد CD4). تبحث بعض التجارب في علامتي خلية في وقت واحد عن طريق إضافة فلوروجين مختلف إلى mAb المناسب. ثم يتم إدخال الخلايا إلى مقياس التدفق الخلوي من خلال الشعيرات الدموية الضيقة التي تجبر الخلايا على المرور في ملف واحد. يتم استخدام الليزر لتنشيط الفلوروجين. يشع ضوء الفلورسنت في جميع الاتجاهات، لذلك يمكن وضع كاشف الفلورة بزاوية من ضوء الليزر الساقط.
\(\PageIndex{4}\)يوضح الشكل شريط التعتيم أمام كاشف التبعثر الأمامي الذي يمنع ضوء الليزر من الوصول إلى الكاشف. عندما تمر خلية عبر شريط الليزر، يكتشف كاشف التبعثر الأمامي الضوء المنتشر حول شريط التعتيم. يتحول الضوء المتناثر إلى نبضة جهد، ويقوم مقياس الخلايا بحساب الخلية. يتم الكشف عن الفلورة من خلية مصنفة بواسطة أجهزة الكشف عن التشتت الجانبي. يمر الضوء عبر مرايا ثنائية اللون مختلفة بحيث يتم استقبال الضوء المنبعث من الفلوروفور بواسطة الكاشف الصحيح.
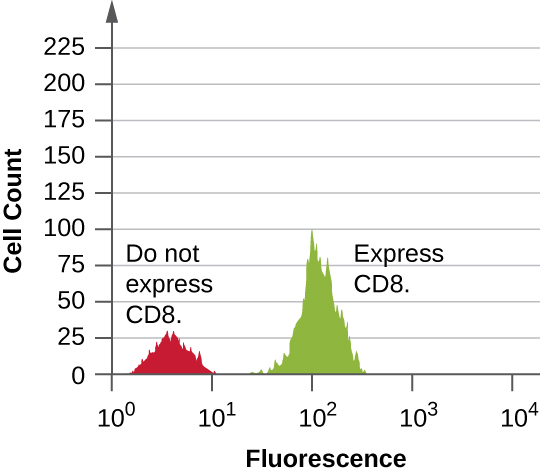
يتم جمع البيانات من كل من أجهزة الكشف عن التشتت الأمامي والجانبي. إحدى الطرق التي يمكن من خلالها تقديم هذه البيانات هي في شكل رسم بياني. يتم وضع التشتت الأمامي على المحور y (لتمثيل عدد الخلايا)، ويتم وضع التشتت الجانبي على المحور x (لتمثيل التألق لكل خلية). مقياس المحور x هو لوغاريتمي، لذلك تزداد شدة الفلورة بعامل 10 مع زيادة كل وحدة على طول المحور. \(\PageIndex{5}\)يصور الشكل مثالاً يتم فيه دمج ثقافة الخلايا مع جسم مضاد متصل بالفلور للكشف عن خلايا CD8 ثم تحليلها عن طريق قياس التدفق الخلوي. يحتوي الرسم البياني على قمتين. تحتوي الذروة الموجودة على اليسار على قراءات إشعاعية منخفضة، تمثل المجموعة الفرعية من مجموعة الخلايا (حوالي 30 خلية) التي لا تتألق؛ وبالتالي، فهي غير مرتبطة بالأجسام المضادة وبالتالي لا تعبر عن CD8. تحتوي الذروة الموجودة على اليمين على قراءات إشعاعية أعلى، تمثل المجموعة الفرعية من مجموعة الخلايا (حوالي 100 خلية) التي تظهر الفلورة؛ وبالتالي، فهي مرتبطة بالجسم المضاد وبالتالي تعبر عن CD8.
التمارين\(\PageIndex{3}\)
- ما الغرض من الليزر في مقياس التدفق الخلوي؟
- في الإخراج من مقياس التدفق الخلوي، تعادل المساحة الموجودة أسفل الرسم البياني ماذا؟
التركيز السريري: القرار
بعد إخطار جميع المرضى البالغ عددهم 1300 مريض، يبدأ المستشفى بجدولة فحص فيروس نقص المناعة البشرية. تم تحديد المواعيد بعد 3 أسابيع على الأقل من آخر زيارة للمريض إلى المستشفى لتقليل مخاطر السلبيات الكاذبة. نظرًا لتوقع بعض الإيجابيات الكاذبة، قام طبيب الصحة العامة بإعداد بروتوكول استشاري لأي مريض جاءت نتيجة ELISA غير المباشرة إيجابية.
من بين 1300 مريض، كانت نتيجة اختبار ثمانية إيجابية باستخدام ELISA. تم إبطال خمسة من هذه الاختبارات من خلال اختبارات البقع الغربية السلبية، لكن بقعة غربية واحدة جاءت إيجابية، مما يؤكد أن المريض قد أصيب بالفعل بفيروس نقص المناعة البشرية. عادت البقع الغربية المتبقية غير محددة. كان على هؤلاء الأفراد الخضوع لاختبار ثالث، وهو PCR، لتأكيد وجود أو عدم وجود تسلسلات فيروس نقص المناعة البشرية. لحسن الحظ، جاءت نتيجة فحص كلا المريضين سلبية
أما بالنسبة للمريض الوحيد الذي تأكد إصابته بفيروس نقص المناعة البشرية، فإن الاختبارات لا يمكن أن تثبت أو تدحض أي صلة بالمحاقن التي تعرض للخطر من قبل موظف المستشفى السابق. ومع ذلك، فإن تأمين المستشفى سيغطي بالكامل علاج المريض، والذي بدأ على الفور.
على الرغم من أن لدينا الآن أدوية فعالة عادة في السيطرة على تطور فيروس نقص المناعة البشرية والإيدز، إلا أنه لا يوجد علاج حتى الآن. إذا تركت دون علاج، أو إذا فشل نظام الدواء، فسوف يعاني المريض من انخفاض تدريجي في عدد الخلايا التائية المساعدة CD4، مما يؤدي إلى ضعف شديد في جميع وظائف المناعة التكيفية. حتى الانخفاضات المعتدلة في أعداد الخلايا التائية المساعدة يمكن أن تؤدي إلى نقص المناعة، مما يجعل المريض عرضة للعدوى الانتهازية. لمراقبة حالة الخلايا التائية المساعدة للمريض، سيستخدم المستشفى قياس التدفق الخلوي. يسمح هذا الاختبار الحساس للأطباء بتحديد عدد الخلايا التائية المساعدة بدقة حتى يتمكنوا من ضبط العلاج إذا كان العدد أقل من 500 خلية/ميكرولتر.
فرز الخلايا باستخدام الفلورة المناعية
يمكن أيضًا تعديل مقياس التدفق الخلوي والفلورة المناعية لفرز الخلايا من عينة واحدة إلى مجموعات فرعية منقاة من الخلايا لأغراض البحث. يُطلق على هذا التعديل لمقياس التدفق الخلوي اسم فارز الخلايا المنشط بالفلور (FACS). في نظام FACS، يؤدي إشعاع الخلية إلى حث الجهاز على وضع شحنة على قطرة من السائل الناقل الذي يحتوي على تلك الخلية. الشحنة خاصة بالطول الموجي لضوء الفلورسنت، مما يسمح بالفرز التفاضلي بهذه الشحنات المختلفة. يتم الفرز بواسطة عاكس إلكتروستاتيكي ينقل القطرة المشحونة التي تحتوي على الخلية إلى وعاء تجميع أو آخر. ينتج عن هذه العملية مجموعات فرعية عالية النقاء من الخلايا.
أحد قيود FACS هو أنه يعمل فقط على الخلايا المعزولة. وبالتالي، ستعمل الطريقة في فرز خلايا الدم البيضاء، لأنها موجودة كخلايا معزولة. ولكن بالنسبة للخلايا الموجودة في الأنسجة، لا يمكن تطبيق قياس التدفق الخلوي إلا إذا تمكنا من استئصال الأنسجة وفصلها إلى خلايا مفردة (باستخدام البروتياز لربط جزيئات التصاق الخلايا الخلوية) دون تعطيل سلامة الخلية. يمكن استخدام هذه الطريقة على الأورام، ولكن في كثير من الأحيان، يتم استخدام الكيمياء المناعية والكيمياء المناعية لدراسة الخلايا في الأنسجة.
شاهد مقاطع الفيديو لمعرفة المزيد حول كيفية عمل قياس التدفق الخلوي و FACS.
التمارين\(\PageIndex{4}\)
في فرز الخلايا المنشطة بالفلور، ما هي خصائص الخلايا المستهدفة التي تسمح بفصلها؟
\(\PageIndex{1}\)يقارن الجدول آليات تقنيات الأجسام المضادة الفلورية التي تمت مناقشتها في هذا القسم.
| نوع الفحص | الآلية | أمثلة |
|---|---|---|
| الأجسام المضادة الفلورية المباشرة (DFA) | يستخدم مقرنات الأجسام المضادة للفلوروجين لتسمية البكتيريا من عينات المرضى | تصوير الليجيونيلا الرئوية من مسحة الحلق |
| الأجسام المضادة الفلورية غير المباشرة (IFA | يكتشف الأجسام المضادة الخاصة بالأمراض في مصل براءات الاختراع | تشخيص مرض الزهري؛ الكشف عن الأجسام المضادة للنواة (ANA) لمرض الذئبة وأمراض المناعة الذاتية الأخرى |
| قياس التدفق الخلوي | يصنف أغشية الخلايا بعلامات اقتران الأجسام المضادة الفلوروجينية التي يثيرها الليزر؛ يقوم الجهاز بحساب الخلية وتسجيل الفلورة النسبية | حساب عدد خلايا CD4 أو CD8 ذات العلامات الفلورية في العينة |
| فارز الخلايا المنشطة بالفلور (FACS) | شكل من أشكال قياس التدفق الخلوي الذي يحسب الخلايا ويفصلها ماديًا إلى مجموعات من الخلايا الفلورية العالية والمنخفضة | فرز الخلايا السرطانية |
المفاهيم الأساسية والملخص
- تستخدم فحوصات الفلورة المناعية مقرنات الأجسام المضادة والفلوروجين لإضاءة المستضدات من أجل الكشف السهل والسريع.
- يمكن استخدام الفلورة المناعية المباشرة للكشف عن وجود البكتيريا في العينات السريرية مثل البلغم.
- يكتشف الفلورة المناعية غير المباشرة وجود الأجسام المضادة الخاصة بالمستضد في مصل المريض. يرتبط الجسم المضاد الفلوري بالجسم المضاد الخاص بالمستضد بدلاً من المستضد.
- يعد استخدام فحوصات الفلورة المناعية غير المباشرة للكشف عن الأجسام المضادة للنواة أداة مهمة في تشخيص العديد من أمراض المناعة الذاتية.
- يستخدم قياس التدفق الخلوي MABs الفلورية ضد بروتينات غشاء الخلية لتحديد مجموعات فرعية محددة من الخلايا في الخلائط المعقدة.
- تعد أجهزة فرز الخلايا التي يتم تنشيطها بالفلور امتدادًا لقياس التدفق الخلوي حيث يتم استخدام كثافة الفلورة لفصل الخلايا ماديًا إلى مجموعات من الفلورة العالية والمنخفضة.
الحواشي
- 1 جيل، وجيمس م.، وآنا إم كويزل، وبيتر ف. روكا، ودين تي والترز. «تشخيص الذئبة الحمامية الجهازية». طبيب الأسرة الأمريكي 68، رقم 11 (2003): 2179-2186.


