20.4: المقايسات المناعية الإنزيمية (EIA) ومقايسات الامتصاص المناعي المرتبطة بالإنزيم (ELISA)
- Page ID
- 194968
أهداف التعلم
- اشرح الاختلافات والتشابهات بين EIA و FEIA و ELISA
- وصف الاختلاف والتشابهات بين الكيمياء النسيجية المناعية وكيمياء الخلايا المناعية
- وصف الأغراض المختلفة لـ ELISA المباشرة وغير المباشرة
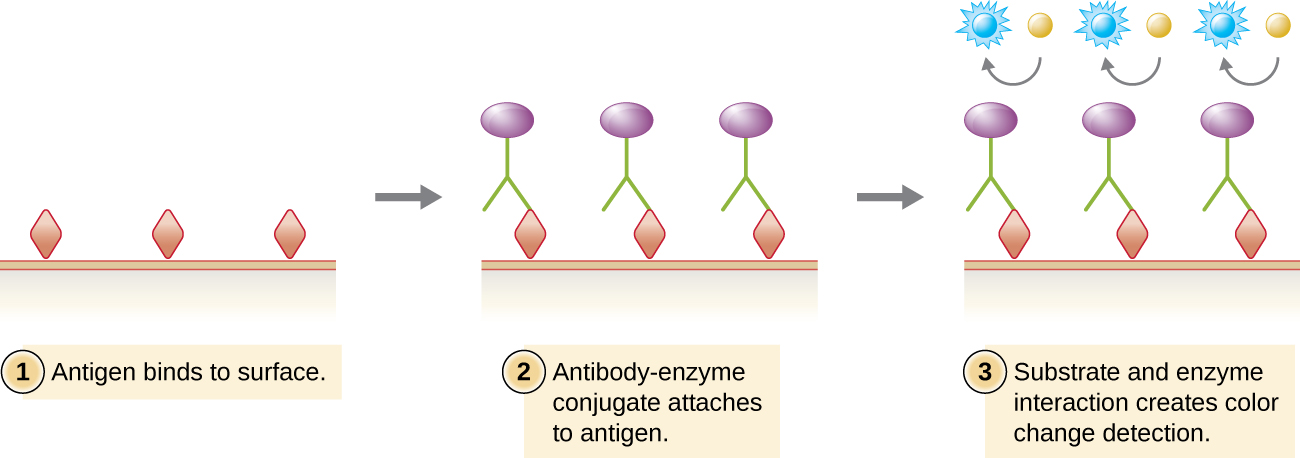
على غرار اللطخة الغربية، تستخدم المقايسات المناعية الإنزيمية (EIAs) الأجسام المضادة للكشف عن وجود المستضدات. ومع ذلك، تختلف تقييمات الأثر البيئي عن البقع الغربية في أن المقايسات تُجرى في ألواح ميكروتيتر أو في الجسم الحي بدلاً من الغشاء الماص. هناك العديد من الأنواع المختلفة من EIAs، ولكنها جميعًا تتضمن جزيء الجسم المضاد الذي تربط منطقته الثابتة إنزيمًا، مما يترك المنطقة المتغيرة حرة في ربط مستضدها المحدد. تسمح إضافة ركيزة للإنزيم بتصور المستضد أو تحديده كميًا (الشكل\(\PageIndex{1}\)).
في EIAs، تكون ركيزة الإنزيم في الغالب كروموجين، وهو جزيء عديم اللون يتم تحويله إلى منتج نهائي ملون. أكثر الإنزيمات استخدامًا هي الفوسفاتاز القلوي وبيروكسيداز الفجل الذي تتوفر له الركائز المناسبة بسهولة. في بعض تقييمات الأثر البيئي، تكون الركيزة عبارة عن فلوروجين، وهو جزيء غير فلوري يحوله الإنزيم إلى شكل فلوري. يُطلق على تقييمات الأثر البيئي التي تستخدم الفلوروجين اسم المقايسات المناعية للإنزيمات الفلورية (FeIAs). يمكن الكشف عن الفلورة إما عن طريق المجهر الفلوري أو مقياس الطيف الضوئي.
عيار MMR
لقاح MMR هو لقاح مركب يوفر الحماية ضد الحصبة والنكاف والحصبة الألمانية (الحصبة الألمانية). يتلقى معظم الناس لقاح MMR كأطفال وبالتالي لديهم أجسام مضادة ضد هذه الأمراض. ومع ذلك، ولأسباب مختلفة، حتى الأفراد الذين تم تطعيمهم قد يصبحون عرضة لهذه الأمراض مرة أخرى لاحقًا في الحياة. على سبيل المثال، قد يتلقى بعض الأطفال جولة واحدة فقط من لقاح MMR بدلاً من الاثنين الموصى بهما. بالإضافة إلى ذلك، قد يبدأ عيار الأجسام المضادة الواقية في جسم الفرد في الانخفاض مع تقدم العمر أو نتيجة لبعض الحالات الطبية.
لتحديد ما إذا كان عيار الجسم المضاد في مجرى الدم للفرد كافيًا لتوفير الحماية، يمكن إجراء اختبار عيار MMR. الاختبار عبارة عن اختبار مناعي بسيط يمكن إجراؤه بسرعة باستخدام عينة دم. ستشير نتائج الاختبار إلى ما إذا كان الفرد لا يزال يتمتع بالمناعة أو يحتاج إلى جرعة أخرى من لقاح MMR.
غالبًا ما يكون الخضوع لاختبار MMR شرطًا قبل التوظيف للعاملين في مجال الرعاية الصحية، وخاصة أولئك الذين سيتواصلون بشكل متكرر مع الأطفال الصغار أو المرضى الذين يعانون من نقص المناعة. إذا أصيب عامل الرعاية الصحية بالحصبة أو النكاف أو الحصبة الألمانية، يمكن للفرد نقل هذه الأمراض بسهولة إلى المرضى المعرضين للإصابة، مما يؤدي إلى تفشي المرض. اعتمادًا على نتائج مقياس MMR، قد يحتاج العاملون في مجال الرعاية الصحية إلى إعادة التطعيم قبل بدء العمل.
إمونوستاين
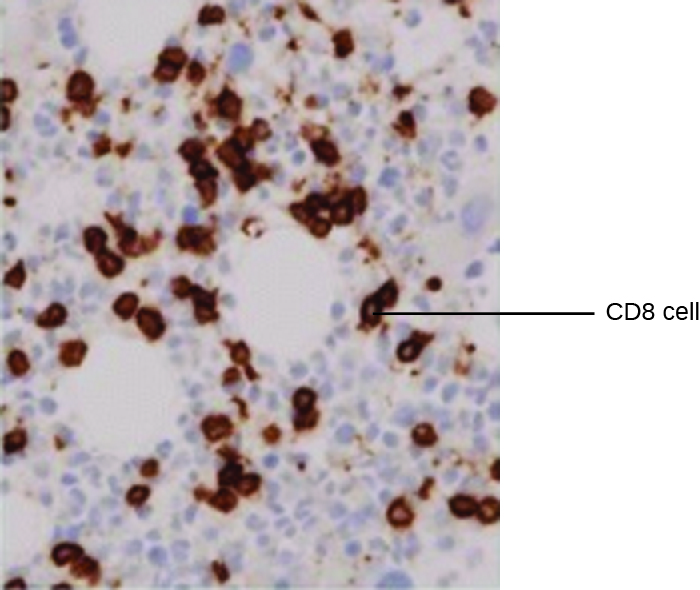
أحد الاستخدامات القوية لـ EIA هو التنجيد المناعي، حيث تعمل مرافقات إنزيم الأجسام المضادة على تعزيز الفحص المجهري. تستخدم الكيمياء المناعية (IHC) لفحص الأنسجة بأكملها. كما هو موضح في الشكل\(\PageIndex{2}\)، يمكن تلوين جزء من الأنسجة لتصور أنواع الخلايا المختلفة. في هذا المثال، تم استخدام mAb ضد CD8 لتلطيخ خلايا CD8 في قسم من أنسجة اللوزتين. أصبح من الممكن الآن حساب عدد خلايا CD8، وتحديد أعدادها النسبية مقابل أنواع الخلايا الأخرى الموجودة، وتحديد موقع هذه الخلايا داخل هذا النسيج. ستكون هذه البيانات مفيدة لدراسة أمراض مثل الإيدز، حيث تكون الوظيفة الطبيعية لخلايا CD8 ضرورية لإبطاء تطور المرض.
الكيمياء المناعية (ICC) هي شكل قيم آخر من أشكال تثبيط المناعة. على الرغم من التشابه مع IHC، في ICC، يتم تجريد مادة المصفوفة خارج الخلية، ويتم حفر غشاء الخلية بالكحول لجعله قابلاً للاختراق للأجسام المضادة. يسمح هذا للأجسام المضادة بالمرور عبر غشاء الخلية والارتباط بأهداف محددة داخل الخلية. يمكن تصور العضيات ومكونات الهيكل الخلوي وغيرها من الهياكل داخل الخلايا بهذه الطريقة. في حين أن بعض تقنيات ICC تستخدم EIA، يمكن استبدال الإنزيم بجزيء فلوري، مما يجعله مقايسًا مناعيًا فلوري.
التمارين\(\PageIndex{1}\)
- ما الفرق بين الكيمياء المناعية وكيمياء الخلايا المناعية؟
- ما الذي يجب أن ينطبق على منتج التفاعل الأنزيمي المستخدم في الكيمياء المناعية؟
مقايسات الامتصاص المناعي المرتبطة بالإنزيم (ELISAS)
تستخدم مقايسات الامتصاص المناعي المرتبطة بالإنزيم (ELISAs) على نطاق واسع EIAs. في ELISA المباشر، يتم تثبيت المستضدات في بئر صفيحة ميكروتيتر. تتم إضافة الجسم المضاد الخاص بمستضد معين والذي يقترن بإنزيم إلى كل بئر. إذا كان المستضد موجودًا، فسوف يرتبط الجسم المضاد. بعد الغسيل لإزالة أي أجسام مضادة غير مقيدة، تتم إضافة ركيزة عديمة اللون (كروموجين). يؤدي وجود الإنزيم إلى تحويل الركيزة إلى منتج نهائي ملون (الشكل\(\PageIndex{1}\)). في حين أن هذه التقنية أسرع لأنها تتطلب فقط استخدام جسم مضاد واحد، إلا أن عيبها أن الإشارة الصادرة من ELISA المباشر أقل (حساسية أقل).
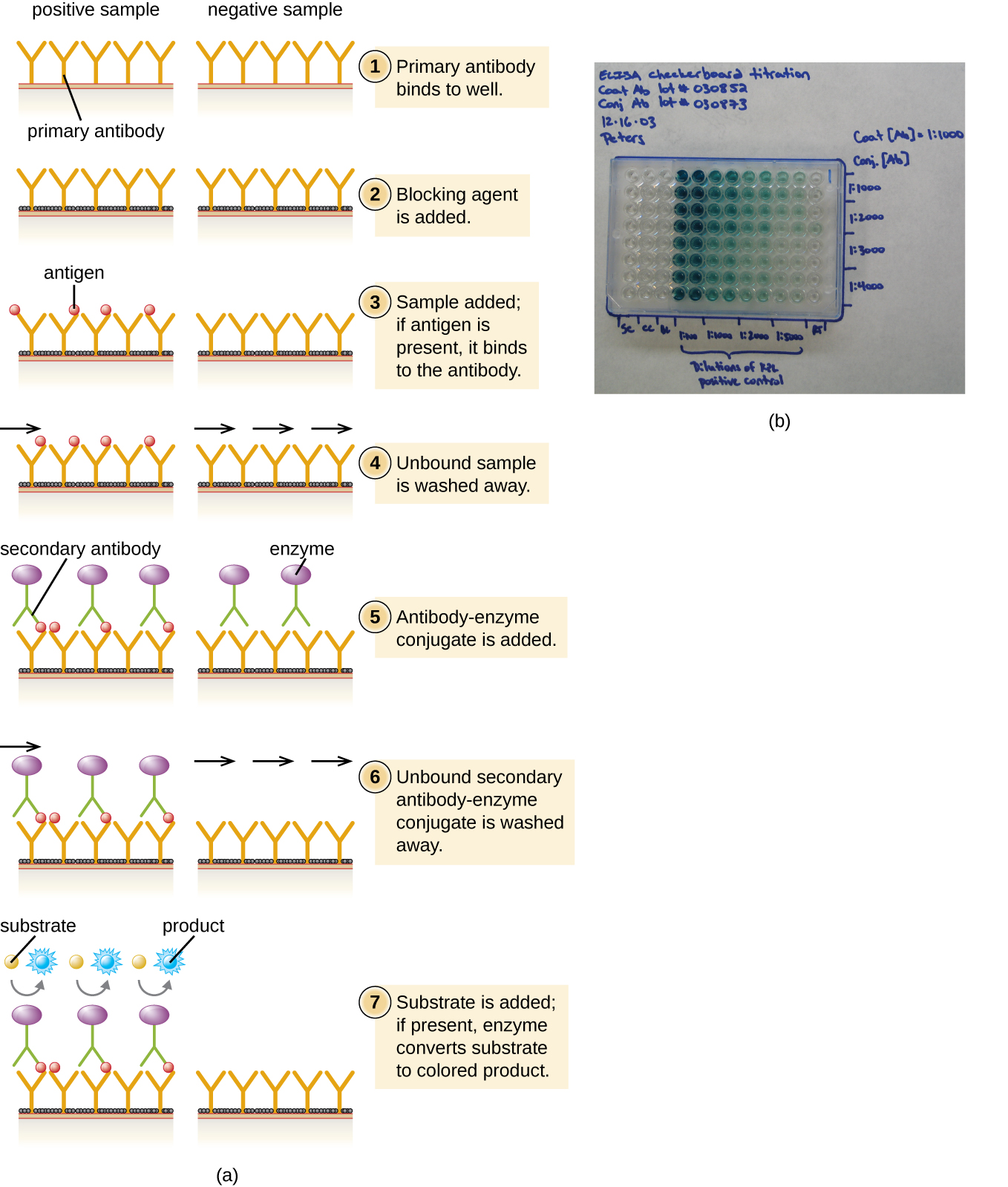
في شطيرة ELISA، يتمثل الهدف في استخدام الأجسام المضادة لتحديد كمية مستضد معين موجود في المحلول بدقة، مثل المستضد من العامل الممرض، أو بروتين المصل، أو هرمون من الدم أو البول لإدراج بعض الأمثلة فقط. الخطوة الأولى من شطيرة ELISA هي إضافة الجسم المضاد الأساسي إلى جميع آبار لوحة ميكروتيتر (الشكل\(\PageIndex{3}\)). يلتصق الجسم المضاد بالبلاستيك من خلال التفاعلات الكارهة للماء. بعد فترة حضانة مناسبة، يتم غسل أي جسم مضاد غير مرتبط. يتم استخدام الغسلات المماثلة بين كل خطوة من الخطوات اللاحقة لضمان بقاء الجزيئات المرتبطة بشكل خاص فقط متصلة باللوحة. ثم يتم إضافة بروتين مانع (مثل الألبومين أو بروتين الحليب الكازين) لربط مواقع ربط البروتين غير المحددة المتبقية في البئر. ستتلقى بعض الآبار كميات معروفة من المستضد للسماح ببناء منحنى قياسي، ويتم إضافة محاليل مستضد غير معروفة إلى الآبار الأخرى. يلتقط الجسم المضاد الأساسي المستضد، وبعد الغسل، تتم إضافة الجسم المضاد الثانوي، وهو جسم مضاد متعدد النسيلة يقترن بإنزيم. بعد الغسيل النهائي، تتم إضافة ركيزة عديمة اللون (كروموجين)، ويقوم الإنزيم بتحويلها إلى منتج نهائي ملون. يتم قياس كثافة لون العينة الناتجة عن المنتج النهائي باستخدام مقياس الطيف الضوئي. تتناسب كمية اللون المنتجة (المقاسة كامتصاص) بشكل مباشر مع كمية الإنزيم، والتي بدورها تتناسب بشكل مباشر مع المستضد الملتقط. تعتبر ELISAs حساسة للغاية، مما يسمح بتحديد كمية المستضد في النانوجرام (10 - 9 جم) لكل نطاق مل.
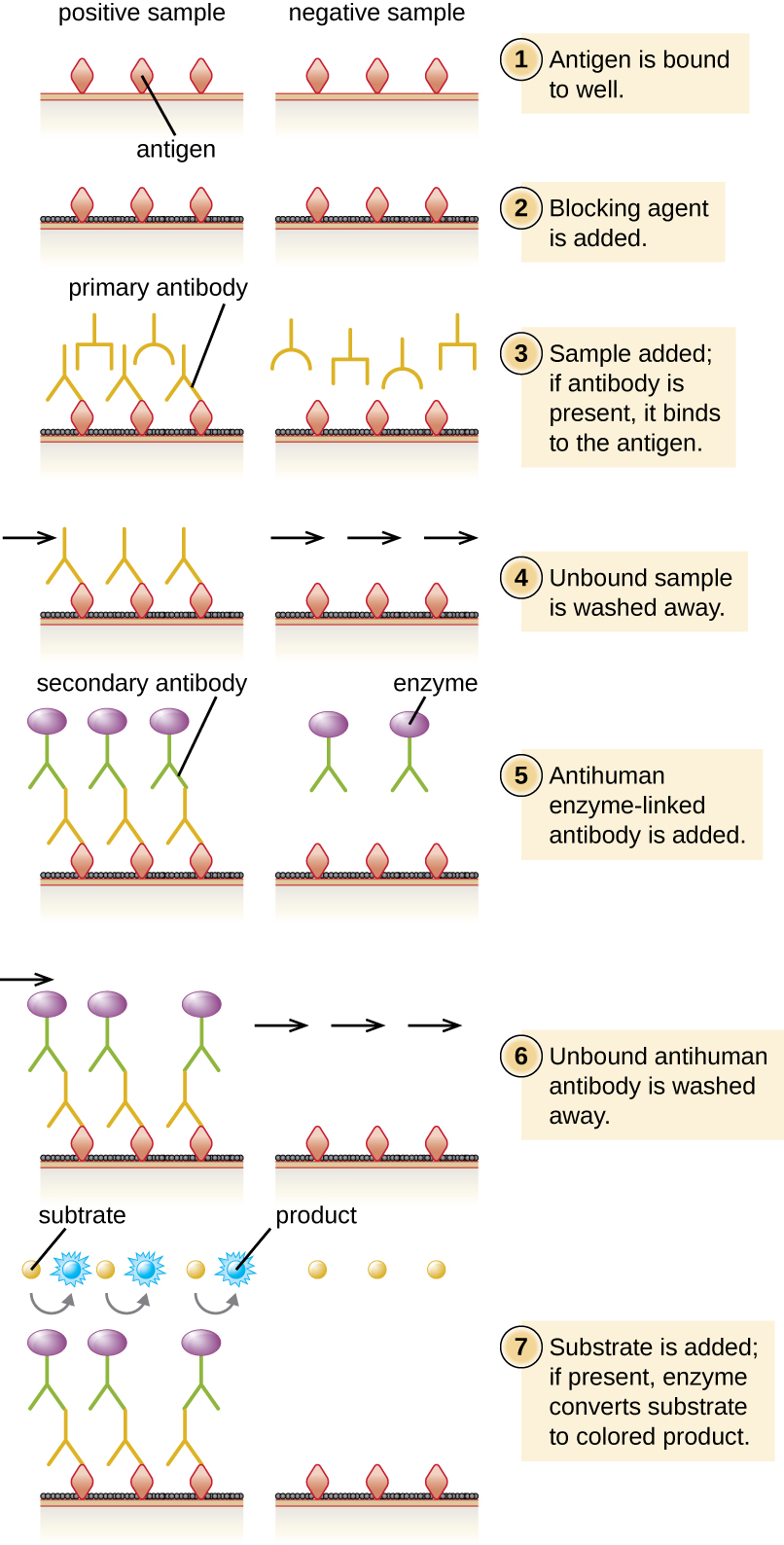
في ELISA غير المباشر، نقوم بتحديد كمية الأجسام المضادة الخاصة بالمستضد بدلاً من المستضد. يمكننا استخدام ELISA غير المباشر للكشف عن الأجسام المضادة ضد العديد من أنواع مسببات الأمراض، بما في ذلك Borrelia burgdorferi (مرض لايم) وفيروس نقص المناعة البشرية. هناك ثلاثة اختلافات مهمة بين ELISAs المباشرة وغير المباشرة كما هو موضح في الشكل\(\PageIndex{4}\). بدلاً من استخدام الأجسام المضادة لالتقاط المستضد، يبدأ ELISA غير المباشر بربط المستضد المعروف (مثل الببتيدات من فيروس نقص المناعة البشرية) إلى الجزء السفلي من آبار ألواح الميكروتيتر. بعد حجب المواقع غير المرتبطة على اللوحة، تتم إضافة مصل المريض؛ في حالة وجود الأجسام المضادة (الأجسام المضادة الأولية)، فإنها ستربط المستضد. بعد غسل أي بروتينات غير مرتبطة، يتم توجيه الجسم المضاد الثانوي مع إنزيمه المترافق ضد الجسم المضاد الأساسي (مثل الغلوبولين المناعي المضاد للإنسان). يسمح لنا الجسم المضاد الثانوي بتحديد مقدار الجسم المضاد الخاص بالمستضد الموجود في مصل المريض من خلال شدة اللون الناتج عن تفاعل الإنزيم والكروموجين المترافق.
كما هو الحال مع العديد من الاختبارات الأخرى للأجسام المضادة التي تمت مناقشتها في هذا الفصل، هناك دائمًا قلق بشأن التفاعل المتبادل مع الأجسام المضادة الموجهة ضد بعض المستضد الآخر، مما قد يؤدي إلى نتائج إيجابية كاذبة. وبالتالي، لا يمكننا تشخيص عدوى فيروس نقص المناعة البشرية بشكل نهائي (أو أي نوع آخر من العدوى) بناءً على اختبار ELISA واحد غير مباشر. يجب أن نؤكد أي اختبار إيجابي مشتبه به، والذي يتم إجراؤه غالبًا إما باستخدام النبتة المناعية التي تحدد فعليًا وجود ببتيدات معينة من العامل الممرض أو اختبار لتحديد الأحماض النووية المرتبطة بالعامل الممرض، مثل النسخ العكسي PCR (RT-PCR) أو مستضد الحمض النووي اختبار.
التمارين\(\PageIndex{2}\)
- ما هو الغرض من الجسم المضاد الثانوي في ELISA المباشر؟
- ما الذي تحدده إليسا المباشرة وغير المباشرة؟
التركيز السريري: الجزء 2
على الرغم من أن الاتصال واختبار 1300 مريض لفيروس نقص المناعة البشرية سيستغرق وقتًا طويلاً ومكلفًا، إلا أن المسؤولين كانوا يأملون في تقليل مسؤولية المستشفى من خلال البحث بشكل استباقي عن الضحايا المحتملين لجريمة الموظف المارق وعلاجهم. إن الكشف المبكر عن فيروس نقص المناعة البشرية مهم، ويمكن أن يؤدي العلاج الفوري إلى إبطاء تقدم المرض.
هناك مجموعة متنوعة من اختبارات الفحص لفيروس نقص المناعة البشرية، ولكن الأكثر استخدامًا هو ELISA غير المباشر. كما هو الحال مع ELISAs غير المباشرة الأخرى، يعمل الاختبار عن طريق ربط المستضد (في هذه الحالة، ببتيدات فيروس نقص المناعة البشرية) ببئر في لوحة مكونة من 96 بئرًا. إذا كان المريض مصابًا بفيروس نقص المناعة البشرية، فسوف ترتبط الأجسام المضادة لفيروس نقص المناعة البشرية بالمستضد ويتم تحديدها بواسطة مترافق إنزيم الجسم المضاد الثاني.
التمارين\(\PageIndex{3}\)
- ما مدى دقة اختبار ELISA غير المباشر لفيروس نقص المناعة البشرية، وما هي العوامل التي يمكن أن تؤثر على دقة الاختبار؟
- هل يجب على المستشفى استخدام أي اختبارات أخرى لتأكيد نتائج ELISA غير المباشرة؟
الترشيح المناعي والمقايسات الكروماتوغرافية المناعية
في بعض الحالات، قد يكون من الضروري اكتشاف أو تحديد كمية المستضدات أو الأجسام المضادة الموجودة بتركيز منخفض جدًا في المحلول. تم تطوير تقنيات الترشيح المناعي لجعل هذا ممكنًا. في الترشيح المناعي، يتم تمرير كمية كبيرة من السوائل عبر غشاء مسامي إلى وسادة ماصة. سوف يلتقط المستضد المرتبط بالغشاء المسامي الجسم المضاد أثناء مروره؛ بدلاً من ذلك، يمكننا أيضًا ربط الجسم المضاد بالغشاء لالتقاط المستضد.
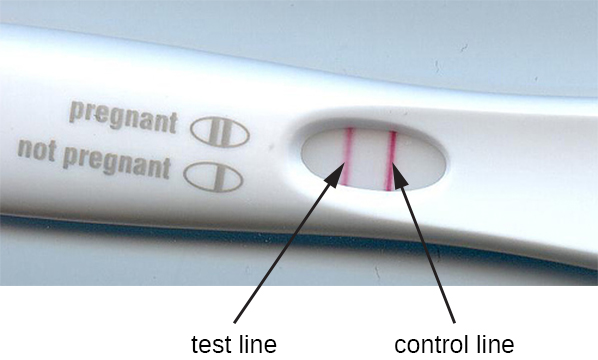
تم تكييف طريقة الترشيح المناعي في تطوير المقايسات الكروماتوغرافية المناعية، والمعروفة باسم اختبارات التدفق الجانبي أو اختبارات الشريط. هذه الاختبارات سريعة وسهلة الأداء، مما يجعلها شائعة للاستخدام في نقاط الرعاية (أي في عيادة الطبيب) أو الاستخدام المنزلي. أحد الأمثلة على ذلك هو اختبار TORCH الذي يسمح للأطباء بفحص النساء الحوامل أو الأطفال حديثي الولادة بحثًا عن العدوى بمجموعة من الفيروسات ومسببات الأمراض الأخرى (التوكسوبلازما والفيروسات الأخرى والحصبة الألمانية والفيروس المضخم للخلايا والهربس البسيط). تعد اختبارات الحمل في المنزل مثالًا آخر يستخدم على نطاق واسع لاختبار التدفق الجانبي (الشكل\(\PageIndex{5}\)). اختبارات الترشيح المناعي شائعة أيضًا في البلدان النامية، لأنها غير مكلفة ولا تتطلب تبريدًا مستمرًا للكواشف المجففة. ومع ذلك، فإن التكنولوجيا مدمجة أيضًا في بعض معدات المختبرات المتطورة.
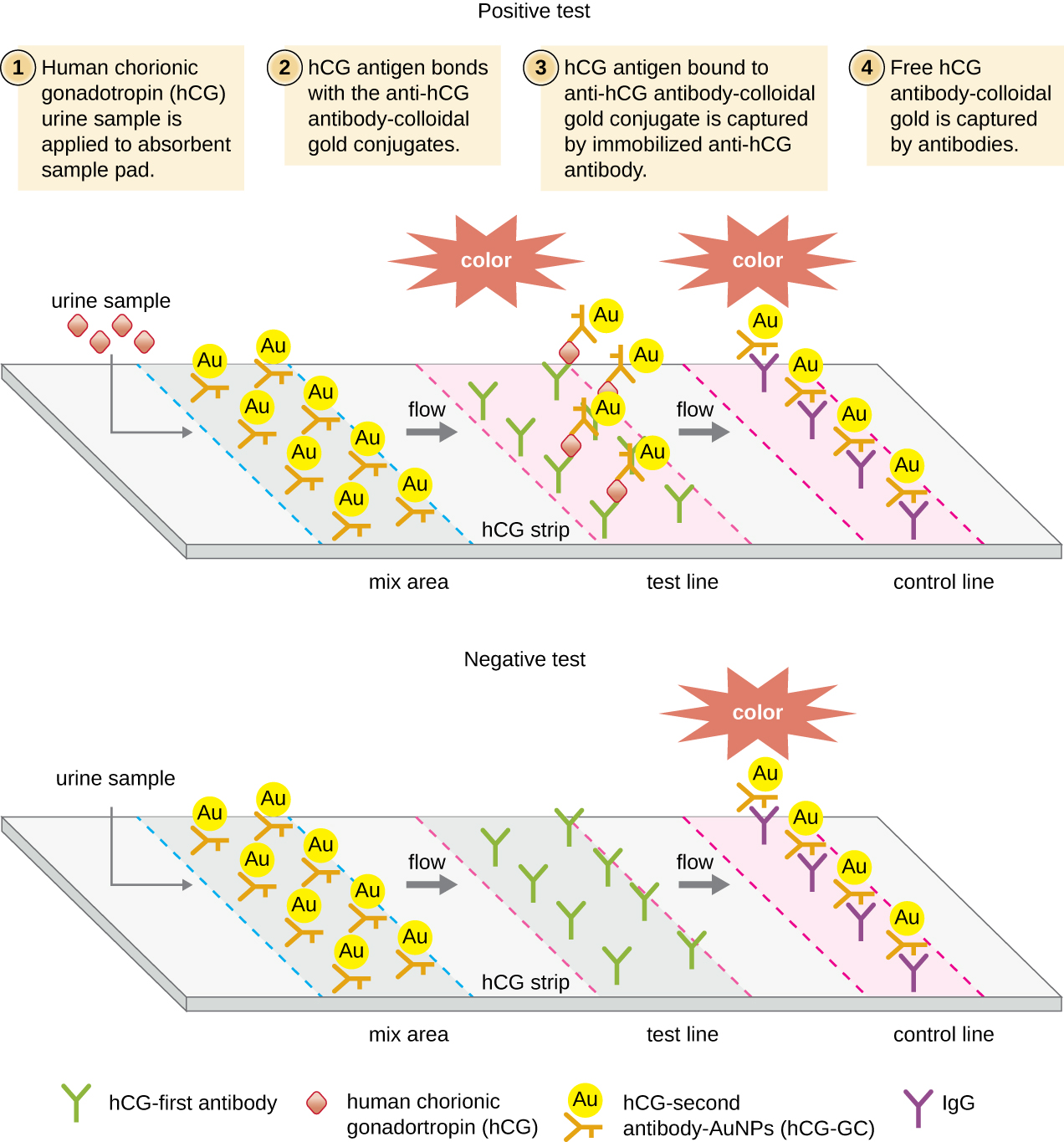
في اختبارات التدفق الجانبي (الشكل\(\PageIndex{6}\))، يتم وضع سوائل مثل البول على وسادة ماصة على شريط الاختبار. يتدفق السائل بفعل الشعيرات الدموية ويتحرك عبر شريط من الخرز مع الأجسام المضادة المتصلة بأسطحها. يقوم السائل الموجود في العينة فعليًا بترطيب الكواشف الموجودة في حالة جفاف في الشريط. ستعمل الحبيبات المطلية بالأجسام المضادة المصنوعة من اللاتكس أو جزيئات الذهب الصغيرة على ربط المستضدات في سائل الاختبار. ثم تتدفق مجمعات مستضد الأجسام المضادة فوق شريط ثانٍ يحتوي على جسم مضاد ثابت ضد المستضد؛ سيحتفظ هذا الشريط بالخرز الذي يربط المستضد. شريط تحكم ثالث يربط أي خرزات. يشير اللون الأحمر (من جزيئات الذهب) أو الأزرق (من حبات اللاتكس) الذي يتطور عند خط الاختبار إلى اختبار إيجابي. إذا تطور اللون فقط عند خط التحكم، يكون الاختبار سلبيًا.
مثل تقنيات ELISA، تستفيد اختبارات التدفق الجانبي من شطائر الأجسام المضادة، مما يوفر الحساسية والخصوصية. على الرغم من أنها ليست كمية مثل ELISA، إلا أن هذه الاختبارات تتميز بأنها سريعة وغير مكلفة ولا تعتمد على معدات خاصة. وبالتالي، يمكن لأي شخص القيام بها في أي مكان. هناك بعض المخاوف بشأن وضع مثل هذه الاختبارات التشخيصية القوية في أيدي الأشخاص الذين قد لا يفهمون قيود الاختبارات، مثل إمكانية الحصول على نتائج إيجابية كاذبة. بينما أصبحت اختبارات الحمل المنزلية مقبولة على نطاق واسع، أثارت اختبارات الكشف عن الأجسام المضادة في المنزل لأمراض مثل فيروس نقص المناعة البشرية بعض المخاوف في المجتمع الطبي. تساءل البعض عما إذا كان ينبغي السماح بالإدارة الذاتية لمثل هذه الاختبارات في حالة عدم وجود موظفين طبيين يمكنهم شرح نتائج الاختبار وطلب اختبارات تأكيدية مناسبة. ومع ذلك، مع تزايد أعداد اختبارات التدفق الجانبي، والتطور السريع لتقنية المختبر على الرقاقة (الشكل 20.1)، من المرجح أن تصبح الاختبارات الطبية المنزلية أكثر شيوعًا في المستقبل.
التمارين\(\PageIndex{4}\)
- ما العملية الفيزيائية التي تتطلبها طريقة التدفق الجانبي لتعمل؟
- اشرح الغرض من الشريط الثالث في اختبار التدفق الجانبي.
\(\PageIndex{1}\)يقارن الجدول بعض الآليات والأمثلة الرئيسية لبعض تقييمات الأثر البيئي التي تمت مناقشتها في هذا القسم بالإضافة إلى الخلايا المناعية، والتي تمت مناقشتها في الكشف عن مجمعات الأجسام المضادة للمستضد.
| نوع الفحص | الآلية | إجراءات محددة | أمثلة |
|---|---|---|---|
| الخلايا المناعية | يستخدم اقتران الأجسام المضادة للأنزيمات لتحديد بروتينات معينة تم نقلها إلى غشاء ماص | البقعة الغربية: تكتشف وجود بروتين معين | الكشف عن وجود ببتيدات فيروس نقص المناعة البشرية (أو الببتيدات من العوامل المعدية الأخرى) في مصل المريض |
| إمونوستاين | يستخدم اقتران الأجسام المضادة للأنزيمات لتلطيخ جزيئات معينة على الخلايا أو فيها | الكيمياء المناعية: تستخدم لتلطيخ خلايا معينة في الأنسجة | بقعة لوجود خلايا CD8 في الأنسجة المضيفة |
| مقايسة الماصة المناعية المرتبطة بالإنزيم (ELISA) | يستخدم مرافقات الإنزيم والأجسام المضادة لتحديد الجزيئات المستهدفة | ELISA المباشر: يستخدم جسمًا مضادًا واحدًا للكشف عن وجود مستضد | الكشف عن مستضد فيروس نقص المناعة البشرية p24 لمدة تصل إلى شهر واحد بعد الإصابة |
| ELISA غير المباشر: يقيس كمية الأجسام المضادة المنتجة ضد المستضد | اكتشاف الأجسام المضادة لفيروس نقص المناعة البشرية في المصل | ||
| المقايسات الكروماتوغرافية المناعية (التدفق الجانبي) | تستخدم التقنيات التقاط مجمعات الأجسام المضادة للمستضد المتدفقة ذات العلامات الملونة بواسطة الأجسام المضادة الثابتة لتشخيص المرض | ساندويتش ELISA: يقيس كمية المستضد المرتبط بالجسم المضاد | الكشف عن الأجسام المضادة لمسببات الأمراض المختلفة في أمصال المريض (مثل البكتيريا العقدية السريعة وعصا قياس الملاريا) |
| اختبار الحمل للكشف عن الجونادوتروفين المشيمي البشري في البول |
التركيز السريري: الجزء 3
على الرغم من أن ELISA غير المباشر لفيروس نقص المناعة البشرية هو اختبار حساس، إلا أن هناك العديد من الاعتبارات المعقدة أولاً، إذا تم اختبار شخص مصاب في وقت مبكر جدًا بعد الإصابة، فقد يؤدي الاختبار إلى نتائج سلبية كاذبة. تستغرق فترة التحويل المصلي عمومًا حوالي ثلاثة أسابيع، ولكن في بعض الحالات، يمكن أن تكون أكثر من شهرين.
بالإضافة إلى السلبيات الكاذبة، يمكن أن تحدث الإيجابيات الكاذبة أيضًا، عادةً بسبب العدوى السابقة بالفيروسات الأخرى التي تحفز الأجسام المضادة المتفاعلة. يعتمد معدل الإيجابية الكاذبة على العلامة التجارية المعينة للاختبار المستخدم، ولكن 0.5٪ ليس بالأمر غير المعتاد. 1 نظرًا لاحتمال وجود نتيجة إيجابية خاطئة، تتم متابعة جميع الاختبارات الإيجابية باختبار تأكيدي. غالبًا ما يكون هذا الاختبار التأكيدي عبارة عن كتلة مناعية (بقعة غربية) يتم فيها تحديد ببتيدات فيروس نقص المناعة البشرية من دم المريض باستخدام مترافق إنزيم Mab خاص بفيروس نقص المناعة البشرية. ستؤكد البقعة الغربية الإيجابية وجود عدوى بفيروس نقص المناعة البشرية وستؤكد وصمة سلبية عدم وجود فيروس نقص المناعة البشرية على الرغم من ELISA الإيجابي.
لسوء الحظ، غالبًا ما تؤدي البقع الغربية لمستضدات فيروس نقص المناعة البشرية إلى نتائج غير محددة، وفي هذه الحالة، لا تؤكد أو تبطل نتائج ELISA غير المباشرة. في الواقع، يمكن أن يتراوح معدل عدم المحددات بين 10 و 49٪ (ولهذا السبب، إلى جانب تكلفتها، لا يتم استخدام البقع الغربية للفحص). على غرار ELISA غير المباشر، يمكن أن تحدث وصمة عار غربية غير محددة بسبب التفاعل المتبادل أو العدوى الفيروسية السابقة أو اللقاحات أو أمراض المناعة الذاتية.
التمارين\(\PageIndex{5}\)
- من بين 1300 مريض يخضعون للاختبار، كم عدد اختبارات ELISA الإيجابية الكاذبة المتوقعة؟
- من بين الإيجابيات الخاطئة، كم عدد البقع الغربية غير المحددة التي يمكن توقعها؟
- كيف سيعالج المستشفى أي حالات تكون فيها البقعة الغربية للمريض غير محددة؟
المفاهيم الأساسية والملخص
- تُستخدم المقايسات المناعية الإنزيمية (EIA) لتصور المستضدات وتحديد كميتها. يستخدمون الجسم المضاد المقترن بإنزيم لربط المستضد، ويقوم الإنزيم بتحويل الركيزة إلى منتج نهائي يمكن ملاحظته. قد تكون الركيزة إما كروموجين أو فلوروجين.
- التلطيخ المناعي هو أسلوب تقييم الأثر البيئي لتصور الخلايا في الأنسجة (الكيمياء المناعية) أو فحص الهياكل داخل الخلايا (الكيمياء الخلوية المناعية).
- يتم استخدام ELISA المباشر لتحديد المستضد في المحلول. يلتقط الجسم المضاد الأساسي المستضد، بينما يوفر الجسم المضاد الثانوي إنزيمًا. يتناسب إنتاج المنتج النهائي من الركيزة الكروموجينية بشكل مباشر مع كمية المستضد الملتقط.
- يتم استخدام ELISA غير المباشر للكشف عن الأجسام المضادة في مصل المريض عن طريق ربط المستضد ببئر لوحة ميكروتيتر، مما يسمح للجسم المضاد (الأساسي) للمريض بربط المستضد والجسم المضاد الثانوي المقترن بالإنزيم للكشف عن الجسم المضاد الأساسي.
- يتم استخدام الترشيح المناعي والمقايسات المناعية في اختبارات التدفق الجانبي، والتي يمكن استخدامها لتشخيص الحمل والأمراض المختلفة عن طريق الكشف عن مركبات الأجسام المضادة للمستضد ذات العلامات الملونة في البول أو عينات السوائل الأخرى
الحواشي
- 1 توماس، وجوستين جي، وفيكتور جافي، وجوديث شافير، وخوسيه أبرو، «اختبار فيروس نقص المناعة البشرية: توصيات الولايات المتحدة 2014"، طبيب الأسرة التقويمي 6، رقم 6 (2014).


