20.3: مقايسات الإلصاق
- Page ID
- 194929
أهداف التعلم
- قارن الإلصاق المباشر وغير المباشر
- تحديد الاستخدامات المختلفة للتراص الدموي في تشخيص المرض
- شرح كيفية تحديد أنواع الدم
- اشرح الخطوات المستخدمة لمقارنة الدم لاستخدامه في نقل الدم
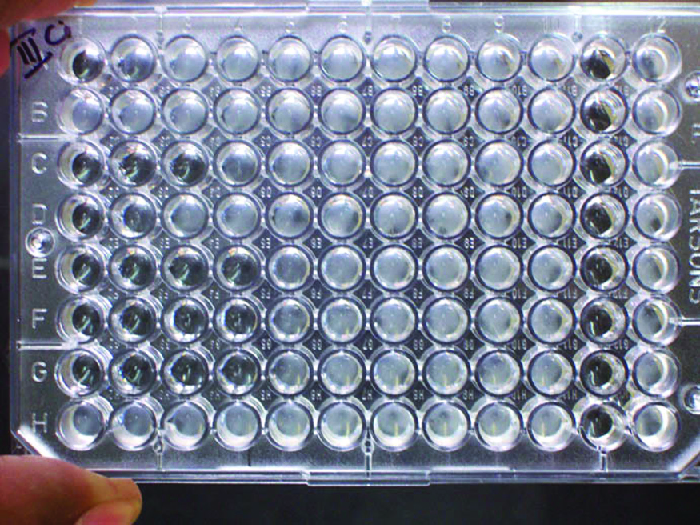
بالإضافة إلى التسبب في ترسيب الجزيئات القابلة للذوبان وتلبد الجزيئات المعلقة، يمكن للأجسام المضادة أيضًا أن تجمع الخلايا أو الجسيمات معًا (مثل حبات اللاتكس المغلفة بالمستضد) في عملية تسمى التراص (الشكل 18.1.8). يمكن استخدام الإلصاق كمؤشر لوجود الأجسام المضادة ضد البكتيريا أو خلايا الدم الحمراء. عادةً ما تكون اختبارات الإلصاق سريعة وسهلة التنفيذ على شريحة زجاجية أو لوحة ميكروتيتر (الشكل\(\PageIndex{1}\)). تحتوي لوحات Microtiter على مجموعة من الآبار لاستيعاب كميات صغيرة من الكواشف ومراقبة التفاعلات (مثل التراص) إما بصريًا أو باستخدام مقياس طيفي مصمم خصيصًا. تأتي الآبار بأحجام مختلفة للمقايسات التي تتضمن كميات مختلفة من الكواشف.
تراص البكتيريا والفيروسات
تم تطوير استخدام اختبارات الإلصاق لتحديد بكتيريا المكورات العقدية في عشرينيات القرن الماضي من قبل ريبيكا لانسفيلد بالعمل مع زميليها A.R. Dochez و Oswald Avery. 1 استخدمت الأجسام المضادة لتحديد بروتين M، وهو عامل ضراوة على المكورات العقدية وهو ضروري لقدرة البكتيريا على التسبب في التهاب الحلق. يعد إنتاج الأجسام المضادة ضد بروتين M أمرًا بالغ الأهمية في تكوين استجابة وقائية ضد البكتيريا.
استخدم لانسفيلد مضاد الأمصال لإظهار أن سلالات مختلفة من نفس النوع من المكورات العقدية تعبر عن إصدارات مختلفة من بروتين M، وهو ما يفسر سبب إصابة الأطفال بالتهاب الحلق بشكل متكرر. صنف لانسفيلد المكورات العقدية الانحلالية بيتا إلى مجموعات عديدة بناءً على الاختلافات المستضدية في السكريات الخاصة بالمجموعة الموجودة في جدار الخلية البكتيرية. تسمى السلالات بالسيروفار لأنها تختلف باستخدام مضادات الأمصال. يعد تحديد السيروفار الموجودة في تفشي المرض أمرًا مهمًا لأن بعض السيروفار قد تسبب مرضًا أكثر خطورة من غيرها.
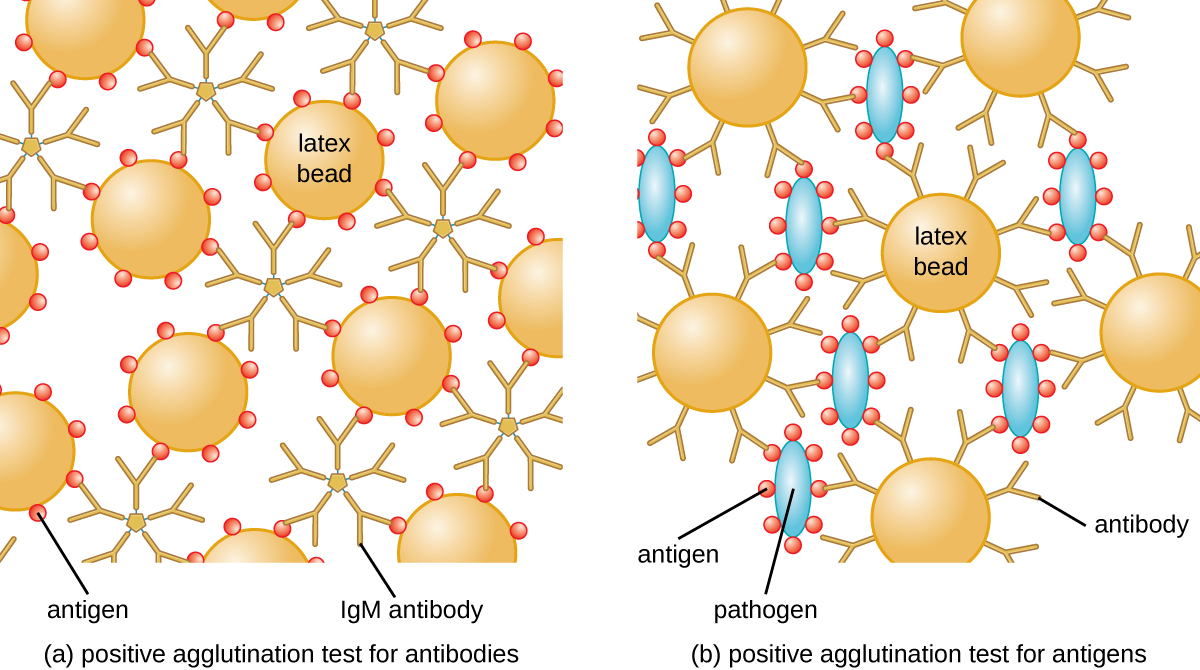
الطريقة التي طورها لانسفيلد هي اختبار التراص المباشر، حيث تتراكم الخلايا البكتيرية نفسها. تُستخدم إستراتيجية مماثلة بشكل أكثر شيوعًا اليوم عند تحديد مصليات البكتيريا والفيروسات؛ ومع ذلك، لتحسين تصور التراص، قد يتم ربط الأجسام المضادة بحبات اللاتكس الخاملة. تسمى هذه التقنية مقايسة التراص غير المباشر (أو اختبار تثبيت اللاتكس)، لأن تراص الحبيبات هو علامة على ارتباط الأجسام المضادة ببعض المستضد الآخر (الشكل\(\PageIndex{2}\)). يمكن استخدام المقايسات غير المباشرة للكشف عن وجود الأجسام المضادة أو المستضدات المحددة.
لتحديد الأجسام المضادة في مصل المريض، يتم ربط المستضد المهم بحبات اللاتكس. عند مزجه بمصل المريض، ستربط الأجسام المضادة المستضد، وتربط حبات اللاتكس وتتسبب في تراكم الحبيبات بشكل غير مباشر؛ هذا يشير إلى وجود الجسم المضاد (الشكل\(\PageIndex{3}\)). تُستخدم هذه التقنية غالبًا عند البحث عن الأجسام المضادة لـ IgM، لأن هيكلها يوفر أقصى قدر من الربط المتقاطع. أحد الأمثلة المستخدمة على نطاق واسع لهذا الفحص هو اختبار عامل الروماتويد (RF) لتأكيد تشخيص التهاب المفاصل الروماتويدي. RF هو، في الواقع، وجود الأجسام المضادة IgM التي ترتبط بـ IgG الخاص بالمريض. سوف تقوم RF بتجميع حبات اللاتكس المطلية بـ IgG.
في الاختبار العكسي، يمكن اكتشاف المستضدات القابلة للذوبان في مصل المريض عن طريق ربط أجسام مضادة محددة (عادةً mABs) بحبيبات اللاتكس وخلط هذا المركب مع المصل (الشكل\(\PageIndex{3}\)).
تُستخدم اختبارات الإلصاق على نطاق واسع في البلدان المتخلفة التي قد تفتقر إلى المرافق المناسبة لزراعة البكتيريا. على سبيل المثال، يبحث اختبار Widal، المستخدم لتشخيص حمى التيفوئيد، عن تراص الأنواع الفرعية من السالمونيلا المعوية التيفية في مصل المريض. اختبار Widal سريع وغير مكلف ومفيد لرصد مدى تفشي المرض؛ ومع ذلك، فإنه ليس بنفس دقة الاختبارات التي تنطوي على زراعة البكتيريا. غالبًا ما ينتج اختبار Widal نتائج إيجابية كاذبة في المرضى الذين يعانون من عدوى سابقة بأنواع فرعية أخرى من السالمونيلا، بالإضافة إلى السلبيات الكاذبة في المرضى الذين يعانون من فرط بروتينات الدم أو نقص المناعة.
بالإضافة إلى ذلك، فإن اختبارات التراص محدودة بسبب حقيقة أن المرضى عمومًا لا ينتجون مستويات يمكن اكتشافها من الأجسام المضادة خلال الأسبوع الأول (أو أكثر) من العدوى. يقال إن المريض قد خضع للتحول المصلي عندما تصل مستويات الأجسام المضادة إلى عتبة الكشف. عادةً ما يتزامن التحول المصلي مع ظهور علامات وأعراض المرض. ومع ذلك، في حالة الإصابة بفيروس نقص المناعة البشرية، على سبيل المثال، يستغرق الأمر عمومًا 3 أسابيع حتى يحدث التحول المصلي، وفي بعض الحالات، قد يستغرق الأمر وقتًا أطول.
على غرار تقنيات اختبار حلقة البريسيبتين ومقايسات اللويحات، فإنه من الروتين إعداد التخفيفات التسلسلية ثنائية الأبعاد لمصل المريض وتحديد عيار الأجسام المضادة المتراصة الموجودة. نظرًا لأن مستويات الأجسام المضادة تتغير بمرور الوقت في كل من الاستجابات المناعية الأولية والثانوية، فمن خلال فحص العينات بمرور الوقت، يمكن اكتشاف التغيرات في عيار الأجسام المضادة. على سبيل المثال، ستؤدي مقارنة العيار خلال المرحلة الحادة من العدوى مقابل العيار من مرحلة النقاهة إلى التمييز بين ما إذا كانت العدوى حالية أو حدثت في الماضي. من الممكن أيضًا مراقبة مدى استجابة الجهاز المناعي للمريض للممرض.
شاهد هذا الفيديو الذي يوضح تفاعلات الإلصاق مع حبات اللاتكس.
التمارين\(\PageIndex{1}\)
- كيف يتم استخدام الإلصاق لتمييز السيروفار عن بعضها البعض؟
- في اختبار حبة اللاتكس لاختبار الأجسام المضادة في مصل المريض، ما هي الحبيبات المغلفة؟
- ماذا حدث عندما يخضع المريض للتحول المصلي؟
الإلصاق الدموي
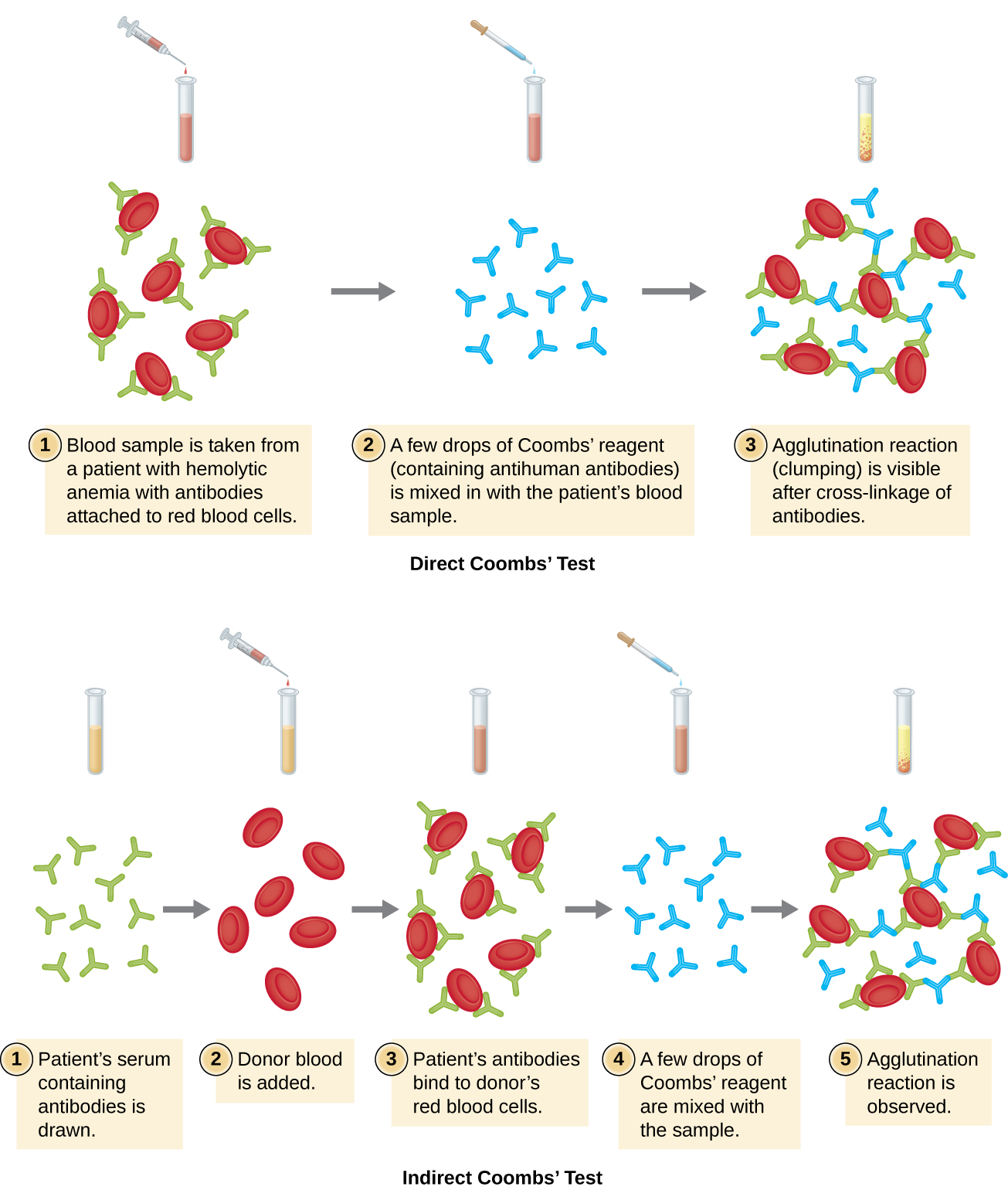
يُطلق على تراص خلايا الدم الحمراء اسم التراص الدموي. أحد الاختبارات الشائعة التي تستخدم التراص الدموي هو اختبار كومبس المباشر، والذي يُطلق عليه أيضًا اختبار الجلوبيولين المضاد المباشر للإنسان (DAT)، والذي يبحث عمومًا عن الأجسام المضادة غير المتكدسة. يمكن للاختبار أيضًا اكتشاف المكمل المرتبط بخلايا الدم الحمراء.
غالبًا ما يتم إجراء اختبار كومبس عندما يعاني المولود الجديد من اليرقان، وهو اصفرار الجلد بسبب ارتفاع تركيزات البيليروبين في الدم، وهو نتاج تحلل الهيموجلوبين في الدم. يُستخدم اختبار كومبس لتحديد ما إذا كانت خلايا الدم الحمراء للطفل مرتبطة بالأجسام المضادة للأم. ستعمل هذه الأجسام المضادة على تنشيط المكمل، مما يؤدي إلى تحلل خلايا الدم الحمراء واليرقان اللاحق. تشمل الحالات الأخرى التي يمكن أن تسبب اختبارات كومبس المباشرة الإيجابية تفاعلات نقل الدم الانحلالي وفقر الدم الانحلالي المناعي الذاتي وداء كريات الدم البيضاء المعدية (الناجم عن فيروس Epstein-Barr) والزهري والالتهاب الرئوي الميكوبلازما. يمكن أيضًا رؤية اختبار كومبس المباشر الإيجابي في بعض أنواع السرطان وكرد فعل تحسسي لبعض الأدوية (مثل البنسلين).
غالبًا ما تكون الأجسام المضادة المرتبطة بخلايا الدم الحمراء في هذه الحالات هي IgG، وبسبب اتجاه مواقع ربط المستضد على IgG والحجم الكبير نسبيًا لخلية الدم الحمراء، فمن غير المحتمل أن يحدث أي تراص مرئي. ومع ذلك، يمكن اكتشاف وجود IgG المرتبط بخلايا الدم الحمراء عن طريق إضافة كاشف Coombs، وهو مصل مضاد يحتوي على أجسام مضادة لـ IgG (يمكن دمجها مع مضاد المكمل) (الشكل\(\PageIndex{4}\)). يربط كاشف كومبس IgG المرتبط بخلايا الدم الحمراء المجاورة وبالتالي يعزز التراص.
هناك أيضًا اختبار Coombs غير المباشر المعروف باسم اختبار مضاد الغلوبولين غير المباشر (IAT). يقوم هذا بفحص الفرد بحثًا عن الأجسام المضادة ضد مستضدات خلايا الدم الحمراء (بخلاف مستضدات A و B) غير الموجودة في مصل المريض (الشكل\(\PageIndex{4}\)). يمكن استخدام IAT لفحص النساء الحوامل بحثًا عن الأجسام المضادة التي قد تسبب المرض الانحلالي لحديثي الولادة. يمكن استخدامه أيضًا قبل إجراء عمليات نقل الدم. تتم مناقشة المزيد من التفاصيل حول كيفية تنفيذ IAT أدناه.
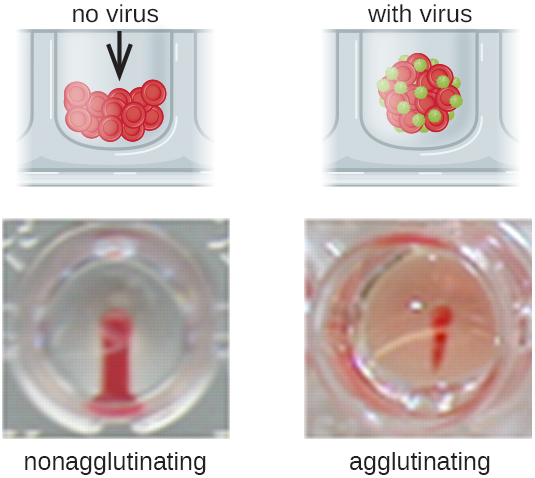
الأجسام المضادة التي ترتبط بخلايا الدم الحمراء ليست السبب الوحيد للتراص الدموي. ترتبط بعض الفيروسات أيضًا بخلايا الدم الحمراء، ويمكن أن يتسبب هذا الارتباط في التراص عندما تربط الفيروسات خلايا الدم الحمراء. على سبيل المثال، تحتوي فيروسات الإنفلونزا على نوعين مختلفين من الطفرات الفيروسية تسمى نيورامينيداز (N) والهيماغلوتينين (H)، وقد سُمي هذا الأخير لقدرته على تكديس خلايا الدم الحمراء (انظر الفيروسات). وبالتالي، يمكننا استخدام خلايا الدم الحمراء للكشف عن وجود فيروس الأنفلونزا عن طريق فحوصات التراص الدموي المباشر (HA)، حيث يتسبب الفيروس في تراص واضح لخلايا الدم الحمراء. يمكن أيضًا اكتشاف فيروسات النكاف والحصبة الألمانية باستخدام HA.
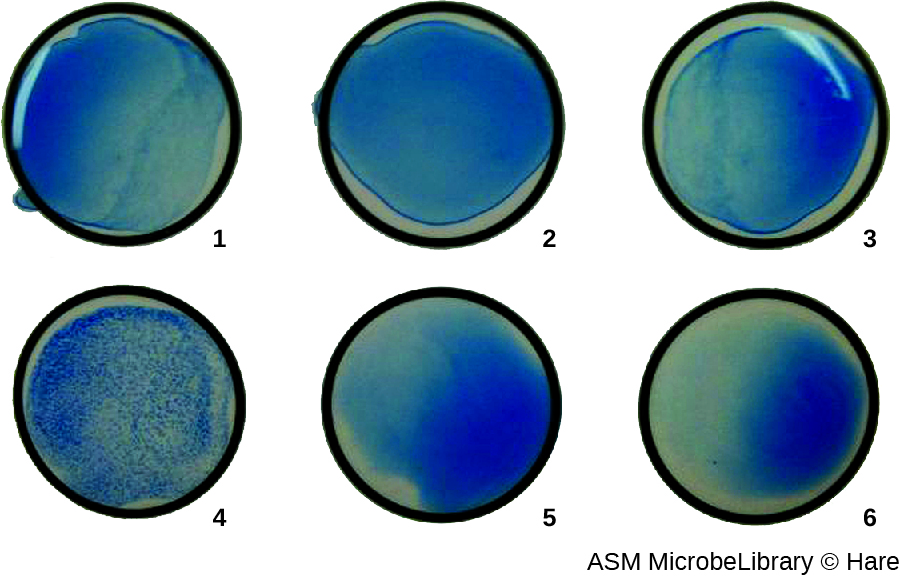
في أغلب الأحيان، يتم استخدام اختبار التراص الفيروسي المخفف التسلسلي لقياس العيار أو تقدير كمية الفيروس المنتج في زراعة الخلايا أو لإنتاج اللقاح. يمكن تحديد عيار الفيروس باستخدام HA المباشر عن طريق إجراء تخفيف تسلسلي للعينة التي تحتوي على الفيروس، بدءًا من التركيز العالي للعينة التي يتم تخفيفها بعد ذلك في سلسلة من الآبار. أعلى نسبة تخفيف تنتج التراص المرئي هي العيار. يتم إجراء الفحص في لوحة ميكروتيتر ذات آبار ذات قاع V أو دائري. في حالة وجود فيروسات متراكمة، تتجمع خلايا الدم الحمراء والفيروسات معًا وتنتج حصيرًا منتشرًا فوق قاع البئر. في حالة عدم وجود فيروس، تتدحرج خلايا الدم الحمراء أو تترسب إلى قاع البئر وتشكل حبيبًا كثيفًا، ولهذا السبب لا يمكن استخدام الآبار ذات القاع المسطح (الشكل\(\PageIndex{5}\)).
يمكن استخدام تعديل اختبار HA لتحديد عيار الأجسام المضادة للفيروسات. سيؤدي وجود هذه الأجسام المضادة في مصل المريض أو في مصل مضاد تم إنتاجه في المختبر إلى تحييد الفيروس ومنعه من تراكم الخلايا الحمراء، مما يجعل هذا اختبارًا لتثبيط التراص الدموي الفيروسي (HIA). في هذا الفحص، يتم خلط مصل المريض بكمية قياسية من الفيروس. بعد فترة حضانة قصيرة، تتم إضافة كمية قياسية من خلايا الدم الحمراء ويتم ملاحظة التراص الدموي. عيار مصل المريض هو أعلى تخفيف يمنع التراص (الشكل\(\PageIndex{6}\)).

التمارين\(\PageIndex{2}\)
- ما الآلية التي يتم من خلالها اكتشاف الفيروسات في اختبار التراص الدموي؟
- ما نتيجة التراص الدموي التي تخبرنا بعيار الفيروس في العينة؟
الحيوانات في المختبر
تم تعلم الكثير مما نعرفه اليوم عن جهاز المناعة البشري من خلال الأبحاث التي أجريت باستخدام الحيوانات - في المقام الأول، الثدييات - كنماذج. إلى جانب البحث، تُستخدم الثدييات أيضًا لإنتاج معظم الأجسام المضادة ومكونات الجهاز المناعي الأخرى اللازمة للتشخيص المناعي. تم تطوير اللقاحات والتشخيصات والعلاجات والطب الانتقالي بشكل عام من خلال البحث باستخدام نماذج حيوانية.
ضع في اعتبارك بعض الاستخدامات الشائعة لحيوانات المختبر لإنتاج مكونات الجهاز المناعي. تُستخدم خنازير غينيا كمصدر للمكملات، والفئران هي المصدر الأساسي للخلايا لصنع MABs. يمكن استخدام MABs هذه في البحث ولأغراض علاجية. تتم تربية Antisera في مجموعة متنوعة من الأنواع، بما في ذلك الخيول والأغنام والماعز والأرانب. عند إنتاج مصل مضاد، عادة ما يتم حقن الحيوان مرتين على الأقل، ويمكن استخدام المواد المساعدة لتعزيز استجابة الجسم المضاد. سيتم حصاد الدم للحيوانات الكبيرة المستخدمة في صنع مضادات الأمصال بشكل متكرر على مدى فترات طويلة من الزمن، مع إلحاق ضرر بسيط بالحيوانات، ولكن هذا ليس هو الحال عادة بالنسبة للأرانب. على الرغم من أنه يمكننا الحصول على بضعة مليلترات من الدم من عروق أذن الأرانب، إلا أننا نحتاج عادةً إلى كميات أكبر، مما يؤدي إلى نفوق الحيوانات.
كما نستخدم الحيوانات لدراسة المرض. الطريقة الوحيدة لزراعة Treponema pallidum لدراسة مرض الزهري هي في الحيوانات الحية. يمكن أن تنمو العديد من الفيروسات في زراعة الخلايا، لكن النمو في زراعة الخلايا يخبرنا القليل جدًا عن كيفية استجابة الجهاز المناعي للفيروس. عند العمل على مرض تم اكتشافه حديثًا، ما زلنا نستخدم افتراضات Koch، والتي تتطلب التسبب في المرض في حيوانات المختبر باستخدام مسببات الأمراض من الثقافة النقية كخطوة حاسمة في إثبات أن الكائنات الحية الدقيقة معينة هي سبب المرض. كانت دراسة انتشار البكتيريا والفيروسات في الحيوانات المضيفة، وكيفية استجابة الجهاز المناعي للمضيف، أمرًا محوريًا في الأبحاث الميكروبيولوجية لأكثر من 100 عام.
في حين أن ممارسة استخدام حيوانات المختبر ضرورية للبحث العلمي والتشخيص الطبي، فإن العديد من الناس يعترضون بشدة على استغلال الحيوانات لمنفعة الإنسان. هذه الحجة الأخلاقية ليست جديدة - في الواقع، كانت إحدى بنات تشارلز داروين ناشطة في مكافحة التشريح (التشريح هو ممارسة قطع أو تشريح حيوان حي لدراسته). يعترف معظم العلماء بأنه يجب أن تكون هناك قيود على مدى إمكانية استغلال الحيوانات لأغراض البحث. دفعت الاعتبارات الأخلاقية المعاهد الوطنية للصحة (NIH) إلى وضع لوائح صارمة بشأن أنواع البحوث التي يمكن إجراؤها. تتضمن هذه اللوائح أيضًا إرشادات للمعاملة الإنسانية لحيوانات المختبر، ووضع معايير لإيوائها ورعايتها وقتلها الرحيم. توضح وثيقة NIH «دليل رعاية واستخدام حيوانات المختبر» أن استخدام الحيوانات في البحث هو امتياز يمنحه المجتمع للباحثين.
تستند إرشادات NIH إلى مبدأ العناصر الثلاثة: الاستبدال والتنقيح والخفض. يجب أن يسعى الباحثون إلى استبدال النماذج الحيوانية بنماذج غير حية، واستبدال الفقاريات باللافقاريات كلما أمكن ذلك، أو استخدام نماذج الكمبيوتر عند الاقتضاء. يجب عليهم تحسين التربية والإجراءات التجريبية للحد من الألم والمعاناة، واستخدام التصاميم والإجراءات التجريبية التي تقلل من عدد الحيوانات اللازمة للحصول على المعلومات المطلوبة. للحصول على التمويل، يجب على الباحثين إرضاء مراجعي NIH بأن البحث يبرر استخدام الحيوانات وأن استخدامها يتوافق مع الإرشادات.
على المستوى المحلي، يجب أن يكون لدى أي منشأة تستخدم الحيوانات وتتلقى تمويلًا فيدراليًا لجنة مؤسسية لرعاية واستخدام الحيوانات (IACUC) تضمن اتباع إرشادات NIH. يجب أن يشمل IACUC الباحثين والإداريين والطبيب البيطري وشخص واحد على الأقل ليس له علاقة بالمؤسسة، أي المواطن المعني. تقوم هذه اللجنة أيضًا بإجراء عمليات تفتيش للمختبرات والبروتوكولات. بالنسبة للأبحاث التي تشمل البشر، يضمن مجلس المراجعة المؤسسية (IRB) اتباع الإرشادات المناسبة.
قم بزيارة هذا الموقع لعرض دليل NIH لرعاية واستخدام حيوانات المختبر.
كتابة الدم والمطابقة المتقاطعة
بالإضافة إلى الأجسام المضادة ضد البكتيريا والفيروسات التي تعرضوا لها سابقًا، يحمل معظم الأفراد أيضًا أجسامًا مضادة ضد أنواع الدم الأخرى غير تلك الخاصة بهم. يوجد حاليًا 33 نظامًا مهمًا من الناحية المناعية لفصيلة الدم، والعديد منها مقيد داخل مجموعات عرقية مختلفة أو نادرًا ما يؤدي إلى إنتاج أجسام مضادة. الأكثر أهمية وربما أشهرها هي مجموعات الدم ABO و Rh (انظر الشكل 19.1.3).
عند النظر في وحدات الدم لنقل الدم، يجب إجراء اختبار الدم قبل نقل الدم. بالنسبة لوحدة الدم، يتم خلط الأجسام المضادة المعدة تجاريًا ضد مستضدات A و B و Rh مع خلايا الدم الحمراء من الوحدات للتأكد مبدئيًا من دقة فصيلة الدم في الوحدة. بمجرد طلب وحدة دم لنقل الدم، من المهم للغاية التأكد من توافق المتبرع (وحدة الدم) والمتلقي (المريض) مع هذه المستضدات الهامة. بالإضافة إلى تأكيد نوع دم الوحدة، يتم تأكيد فصيلة دم المريض أيضًا باستخدام نفس الأجسام المضادة المعدة تجاريًا لـ A و B و Rh. على سبيل المثال، كما هو موضح في الشكل\(\PageIndex{7}\)، إذا كان دم المتبرع إيجابيًا لـ A، فسوف يتراكم مع المصل المضاد لـ A ومع المصل المضاد لـ RH. إذا لم يلاحظ أي تراص في أي من الأمصال، فسيكون نوع الدم سالبًا لـ O.
بعد تحديد فصيلة الدم، مباشرة قبل إطلاق الدم لنقله، يتم إجراء مباراة متقاطعة يتم فيها خلط جزء صغير من خلايا الدم الحمراء للمتبرع بمصل من المريض الذي ينتظر نقل الدم. إذا كان لدى المريض أجسام مضادة ضد خلايا الدم الحمراء المانحة، فسيحدث تراص دموي. لتأكيد أي نتائج سلبية للاختبار والتحقق من خلايا الدم الحمراء الحساسة، يمكن إضافة كاشف Coombs إلى المزيج لتسهيل تصور تفاعل خلايا الدم الحمراء بين الأجسام المضادة.
في بعض الظروف، قد يتم إجراء مباراة عرضية بسيطة أيضًا. في هذا الفحص، يتم خلط كمية صغيرة من مصل المتبرع مع خلايا الدم الحمراء للمريض. هذا يسمح بالكشف عن الأجسام المضادة المتراصة في مصل المتبرع. نادرًا ما يكون هذا الاختبار ضروريًا لأن عمليات نقل الدم تستخدم عمومًا خلايا الدم الحمراء المعبأة مع إزالة معظم البلازما عن طريق الطرد المركزي.
تحتوي خلايا الدم الحمراء على العديد من المستضدات الأخرى بالإضافة إلى ABO و Rh. في حين أنه من غير المحتمل أن يكون لدى معظم الناس أجسام مضادة ضد هذه المستضدات، فإن النساء اللواتي تعرضن لحمل متعدد أو المرضى الذين خضعوا لعمليات نقل متعددة قد يصابون بها بسبب التعرض المتكرر. لهذا السبب، يتم استخدام اختبار شاشة الأجسام المضادة لتحديد ما إذا كانت هذه الأجسام المضادة موجودة. يتم فحص مصل المريض مقابل خلايا الدم الحمراء المُعدة تجاريًا والمجمعة من النوع O التي تعبر عن هذه المستضدات. في حالة حدوث تراص، يجب تحديد المستضد الذي يستجيب له المريض وتحديد عدم وجوده في الوحدة المانحة.

التمارين\(\PageIndex{3}\)
- إذا كان دم المريض يتراكم بمصل مضاد B، فما فصيلة دم المريض؟
- ما هو اختبار المطابقة المتقاطعة، ولماذا يتم إجراؤه؟
\(\PageIndex{1}\)يلخص الجدول الأنواع المختلفة من مقايسات الإلصاق التي تمت مناقشتها في هذا القسم.
| نوع الفحص | الآلية | مثال |
|---|---|---|
| الإلصاق | مباشر: يستخدم الجسم المضاد لتكتل الخلايا البكتيرية أو الهياكل الكبيرة الأخرى | بكتيريا التنميط المصلي |
| غير مباشر: تقترن حبات اللاتكس بالمستضد أو الجسم المضاد للبحث عن الأجسام المضادة أو المستضد، على التوالي، في مصل المريض | تأكيد وجود عامل الروماتويد (IGM binding Ig) في مصل المريض | |
| الإلصاق الدموي | مباشر: تقوم بعض البكتيريا والفيروسات بربط خلايا الدم الحمراء وتجميعها معًا | تشخيص الأنفلونزا والنكاف والحصبة |
| اختبار Direct Combs (DAT): يكتشف الأجسام المضادة غير المتكتلة أو البروتينات التكميلية على خلايا الدم الحمراء في الجسم الحي | التحقق من ارتباط الأجسام المضادة للأم بخلايا الدم الحمراء لحديثي الولادة | |
| اختبار كومبس غير المباشر (IAT): يقوم بفحص الفرد بحثًا عن الأجسام المضادة ضد مستضدات خلايا الدم الحمراء (بخلاف مستضدات A و B) غير الموجودة في مصل المريض في المختبر | إجراء اختبار الدم قبل نقل الدم | |
| تثبيط تراص الدم الفيروسي: يستخدم الأجسام المضادة من المريض لمنع التراص الفيروسي | تشخيص الأمراض الفيروسية المختلفة من خلال وجود أجسام مضادة للمرضى ضد الفيروس | |
| تصنيف الدم والمطابقة المتقاطعة: يكتشف ABO و Rh والمستضدات الثانوية في الدم | يطابق دم المتبرع بمتطلبات المناعة لدى المتلقي |
المفاهيم الأساسية والملخص
- يمكن للأجسام المضادة تجميع الخلايا أو الجسيمات الكبيرة في مصفوفة مرئية. غالبًا ما تُجرى اختبارات التراص على البطاقات أو في ألواح ميكروتيتر التي تسمح بحدوث تفاعلات متعددة جنبًا إلى جنب باستخدام كميات صغيرة من الكواشف.
- يسمح استخدام مضاد الأمصال ضد بروتينات معينة بتحديد السيروفار داخل أنواع البكتيريا.
- يمكن أن يكون اكتشاف الأجسام المضادة ضد العامل الممرض أداة قوية لتشخيص المرض، ولكن هناك فترة زمنية قبل أن يمر المرضى بالتحول المصلي ويصبح مستوى الأجسام المضادة قابلاً للاكتشاف.
- يمكن استخدام تراص حبات اللاتكس في فحوصات التراص غير المباشر للكشف عن وجود مستضدات معينة أو أجسام مضادة محددة في مصل المريض.
- يمكن تأكيد وجود بعض الأجسام المضادة للبكتيريا والفيروسات من خلال استخدام اختبار كومبس المباشر، والذي يستخدم كاشف كومبس لربط الأجسام المضادة المرتبطة بخلايا الدم الحمراء وتسهيل عملية التراص الدموي.
- تقوم بعض الفيروسات والبكتيريا بربط خلايا الدم الحمراء وتكديسها؛ وهذا التفاعل هو أساس اختبار التراص الدموي المباشر، والذي يستخدم غالبًا لتحديد عيار الفيروس في المحلول.
- تحدد اختبارات التحييد مستوى الجسم المضاد الخاص بالفيروس عن طريق قياس الانخفاض في التراص الدموي الذي لوحظ بعد خلط مصل المريض بكمية قياسية من الفيروس.
- تُستخدم فحوصات التراص الدموي أيضًا لفحص الدم المتبرع والمتلقي ومطابقته للتأكد من أن متلقي نقل الدم ليس لديه أجسام مضادة للمستضدات في الدم المتبرع به.
الحواشي
- 1 لانسفيلد، ريبيكا سي، «المركب المستضدي للمكورات العقدية الهيموليتيكوس. أولاً - عرض توضيحي لمادة خاصة بالنوع في مستخلصات المكورات العقدية الدموية»، مجلة الطب التجريبي 47، رقم 1 (1928): 91-103.


