20.2: الكشف عن مجمعات الأجسام المضادة للمستضد في المختبر
- Page ID
- 194956
أهداف التعلم
- وصف أنواع مختلفة من المقايسات المستخدمة للعثور على مجمعات الأجسام المضادة للمستضد
- وصف الظروف التي تترسب فيها مجمعات الأجسام المضادة للمستضد خارج المحلول
- اشرح كيف يمكن استخدام الأجسام المضادة في مصل المريض لتشخيص المرض
تسمى الاختبارات المعملية للكشف عن الأجسام المضادة والمستضدات خارج الجسم (على سبيل المثال، في أنبوب الاختبار) المقايسات المختبرية. عند وجود كل من الأجسام المضادة والمستضدات المقابلة لها في محلول، يمكننا غالبًا ملاحظة تفاعل الترسيب الذي تتشكل فيه المجمعات الكبيرة (المشابك) وتستقر خارج المحلول. في الأقسام العديدة القادمة، سنناقش العديد من الاختبارات الشائعة في المختبر.
تفاعلات الترسيب
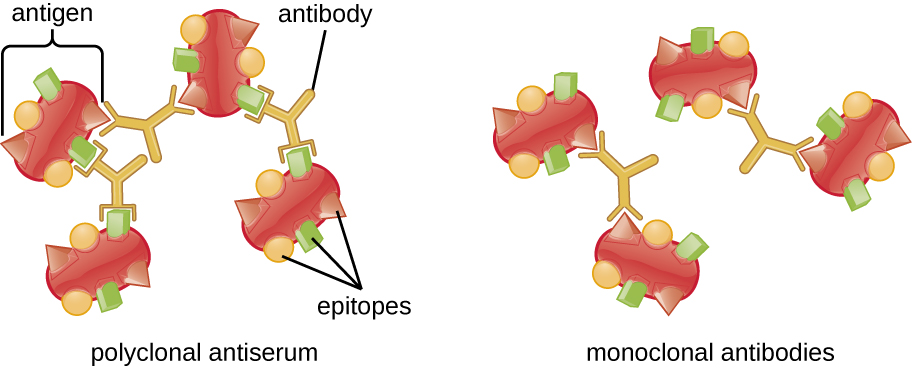
يُطلق على مركب الأجسام المضادة للمستضد المرئي اسم بريسبيتين، وتُسمى المقايسات المختبرية التي تنتج بريسبيتين بتفاعلات البريسيبتين. عادةً ما يتضمن تفاعل البريسيبتين إضافة مستضدات قابلة للذوبان إلى أنبوب اختبار يحتوي على محلول من الأجسام المضادة. كل جسم مضاد له ذراعان، كل منهما يمكن أن يرتبط بمثارة. عندما يرتبط الجسم المضاد بمستضدين، يصبح المستضدان مرتبطين معًا بواسطة الجسم المضاد. يمكن أن تتشكل الشبكة عندما تربط الأجسام المضادة المزيد والمزيد من المستضدات معًا، مما يؤدي إلى ظهور بريسبيتين (الشكل\(\PageIndex{1}\)). تستخدم معظم اختبارات البريسيبتين مصلًا مضادًا متعدد النسيلة بدلاً من الأجسام المضادة أحادية النسيلة لأن الأجسام المضادة متعددة النسيلة يمكن أن ترتبط بحفر متعددة، مما يزيد من احتمالية تكوين الشبكة. على الرغم من أن MABs قد تربط بعض المستضدات، إلا أن الارتباط سيحدث بشكل أقل، مما يقلل من احتمالية تشكل الكريبيتين المرئي.
تعتمد كمية الأمطار أيضًا على عدة عوامل أخرى. على سبيل المثال، يتم تعزيز الترسيب عندما تكون الأجسام المضادة ذات تقارب كبير مع المستضد. في حين أن معظم الأجسام المضادة تربط المستضد بتقارب عالي، حتى الارتباط عالي التقارب يستخدم روابط غير تساهمية ضعيفة نسبيًا، بحيث تنكسر التفاعلات الفردية في كثير من الأحيان وستحدث تفاعلات جديدة.
بالإضافة إلى ذلك، لكي يكون تكوين البريسيبتين مرئيًا، يجب أن تكون هناك نسبة مثالية من الجسم المضاد إلى المستضد. من غير المحتمل أن تكون النسبة المثلى هي نسبة المستضد إلى الأجسام المضادة بنسبة 1:1؛ يمكن أن تختلف بشكل كبير، اعتمادًا على عدد الحليمات الموجودة على المستضد وفئة الأجسام المضادة. قد تحتوي بعض المستضدات على حلقة واحدة أو اثنتين فقط يتعرف عليها المصل المضاد، في حين أن المستضدات الأخرى قد تحتوي على العديد من المثبتات المختلفة و/أو مثيلات متعددة من نفس الظهارة على جزيء مستضد واحد.
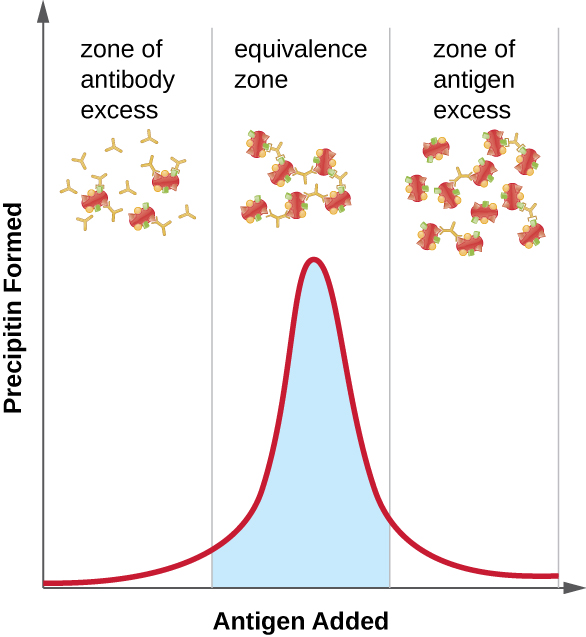
\(\PageIndex{2}\)يوضح الشكل كيف تؤثر نسبة المستضد والأجسام المضادة على كمية الترسيب. لتحقيق النسبة المثلى، تتم إضافة المستضد ببطء إلى محلول يحتوي على أجسام مضادة، ويتم تحديد كمية البريسيبتين نوعيًا. في البداية، لا يوجد مستضد كافٍ لإنتاج تكوين شبكي مرئي؛ وهذا ما يسمى بمنطقة زيادة الأجسام المضادة. مع إضافة المزيد من المستضد، يدخل التفاعل منطقة التكافؤ (أو منطقة التكافؤ)، حيث يحدث كل من التفاعل الأمثل بين المستضد والأجسام المضادة والحد الأقصى للترسيب. إذا تمت إضافة المزيد من المستضد، فإن كمية المستضد ستصبح مفرطة وتتسبب فعليًا في انخفاض كمية الترسيب.
التمارين\(\PageIndex{1}\)
- ما هي وصفة طبية؟
- لماذا تنتج الأمصال المضادة متعددة النسيلة تفاعلًا أفضل للبريسيبتين؟
اختبار حلقة Precipitin
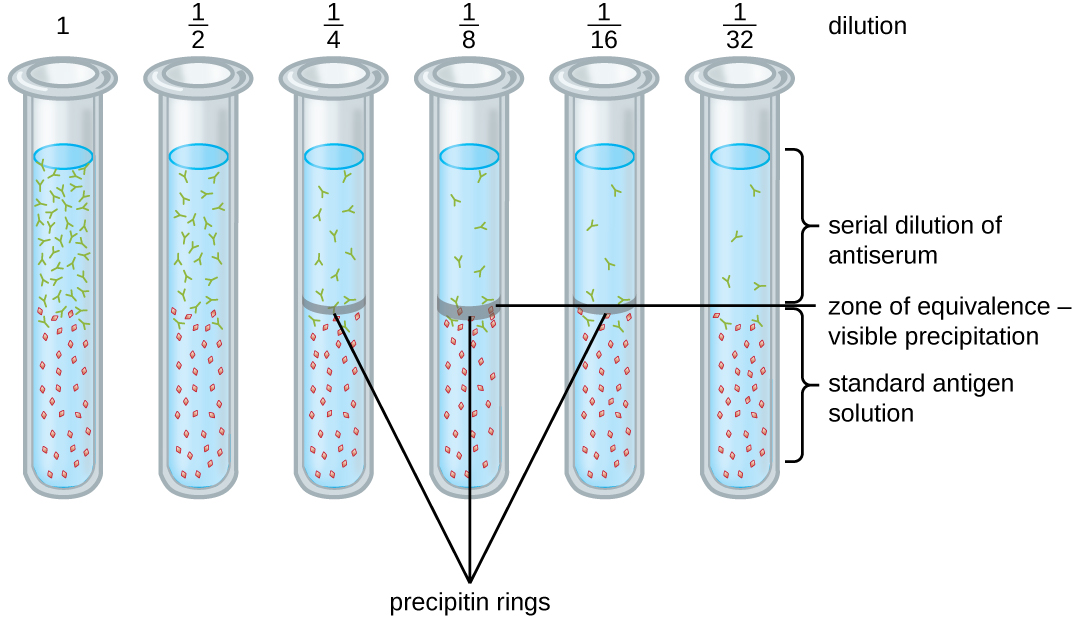
تسمح لنا مجموعة متنوعة من التقنيات باستخدام تكوين البريسيبتين لتحديد تركيز المستضد أو كمية الأجسام المضادة الموجودة في المصل المضاد. إحدى هذه التقنيات هي اختبار حلقة Precipitin (الشكل\(\PageIndex{3}\))، والذي يستخدم لتحديد الكمية النسبية للجسم المضاد الخاص بالمستضد في عينة من المصل. لإجراء هذا الاختبار، يتم إعداد مجموعة من أنابيب الاختبار بإضافة محلول مستضد إلى أسفل كل أنبوب. يتلقى كل أنبوب نفس حجم المحلول، ويكون تركيز المستضدات ثابتًا (على سبيل المثال، 1 مجم/مل). بعد ذلك، يتم إضافة الجلسرين إلى محلول المستضد في كل أنبوب اختبار، يليه تخفيف تسلسلي للمصل المضاد. يمنع الجلسرين خلط المصل المضاد بمحلول المستضد، مما يسمح بربط الأجسام المضادة للمستضد فقط عند واجهة الحلين. والنتيجة هي حلقة مرئية من البريسيبتين في الأنابيب التي تحتوي على نسبة الأجسام المضادة للمستضد داخل منطقة التكافؤ. يتم استخدام هذا التخفيف الأعلى بحلقة مرئية لتحديد عيار الأجسام المضادة. والعيار هو مقلوب التخفيف الأعلى الذي يُظهر نتيجة إيجابية، معبراً عنها كرقم صحيح. في الشكل\(\PageIndex{3}\)، يكون العيار 16.
في حين أن قياس العيار لا يخبرنا بالأرقام المطلقة عن مقدار الأجسام المضادة الموجودة، إلا أنه يعطي مقياسًا للنشاط البيولوجي، والذي غالبًا ما يكون أكثر أهمية من الكمية المطلقة. في هذا المثال، لن يكون من المفيد معرفة كتلة IgG الموجودة في المصل المضاد، لأن هناك العديد من الخصائص المختلفة للأجسام المضادة الموجودة؛ ولكن من المهم بالنسبة لنا أن نعرف مقدار نشاط الأجسام المضادة في مصل المريض الموجه ضد المستضد المعني (على سبيل المثال، عامل ممرض معين أو مسببات الحساسية).
مقايسة الأوتشتيرلوني
بينما يوفر اختبار حلقة Precipitin رؤى حول تفاعلات مستضد الأجسام المضادة، إلا أنه يحتوي أيضًا على بعض العيوب. يتطلب استخدام كميات كبيرة من المصل، ويجب توخي الحذر الشديد لتجنب خلط المحاليل وتعطيل الحلقة. يمكن أن يؤدي إجراء اختبار مماثل في مصفوفة جل أجار إلى تقليل هذه المشكلات. يُطلق على هذا النوع من المقايسات اسم الانتشار المناعي المزدوج أو مقايسة Ouchterlony لـ Orjan Ouchterlony، 1 الذي وصف التقنية لأول مرة في عام 1948.
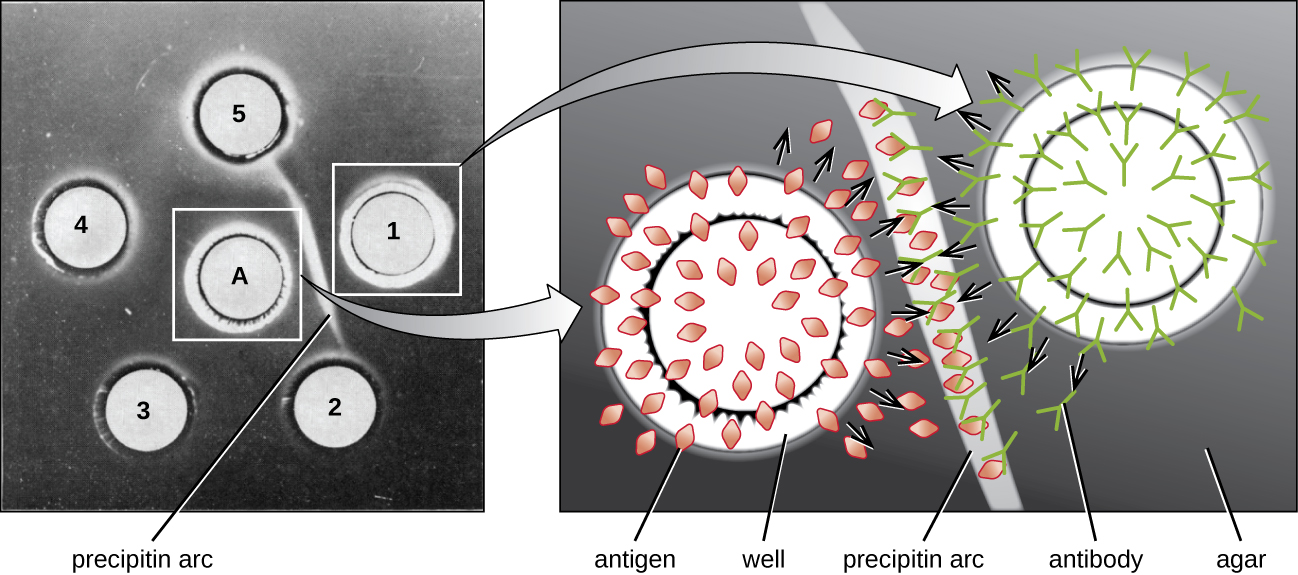
عندما يكون الأجار عالي النقاء، فإنه ينتج جلًا شفافًا عديم اللون. يتم ثقب الثقوب في الجل لتشكيل الآبار، ويتم إضافة المستضد ومضادات الأمصال إلى الآبار المجاورة. البروتينات قادرة على الانتشار من خلال الجل، وتتشكل أقواس البريسيبتين بين الآبار في منطقة التكافؤ. نظرًا لأن شبكة البريكبيتين كبيرة جدًا بحيث لا يمكن نشرها عبر الجل، فإن الأقواس مثبتة بإحكام في مكانها ويسهل رؤيتها (الشكل\(\PageIndex{4}\)).
على الرغم من وجود طرق أكثر حساسية وكمية للكشف عن تفاعلات مستضد الأجسام المضادة، فإن اختبار Ouchterlony يوفر طريقة سريعة ونوعية لتحديد ما إذا كان المصل المضاد يحتوي على أجسام مضادة ضد مستضد معين. يعد اختبار Ouchterlony مفيدًا بشكل خاص عند البحث عن التفاعل التبادلي. يمكننا فحص المصل المضاد مقابل مجموعة من المستضدات ذات الصلة الوثيقة ومعرفة التركيبات التي تشكل أقواس بريسيبتين.
مقايسة الانتشار المناعي الشعاعي
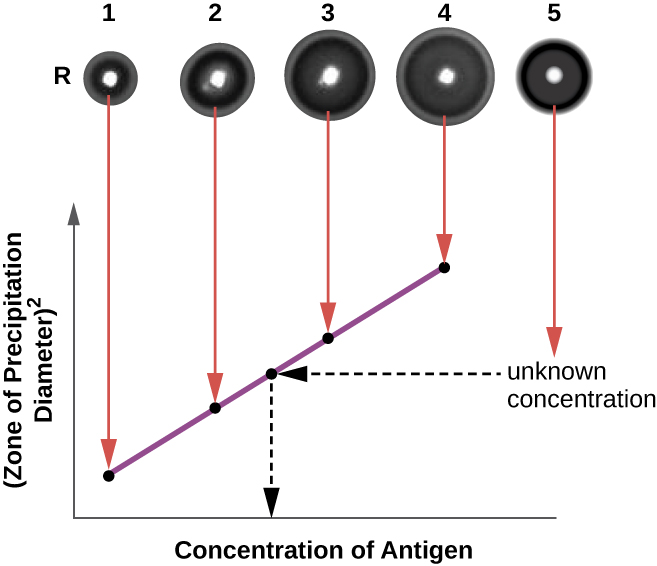
يشبه اختبار الانتشار المناعي الشعاعي (RID) مقايسة Ouchterlony ولكنه يستخدم لتحديد تركيز المستضد بدقة بدلاً من مقارنة المستضدات المختلفة. في هذا الاختبار، يُضاف المصل المضاد إلى أجار مقسّى (أجار سائل عند درجة حرارة أعلى بقليل من 45 درجة مئوية)، ويُسكب في طبق بتري صغير أو على شريحة زجاجية ويُترك ليبرد. يتم قطع الآبار في الأجار المبرد، ثم يتم إضافة المستضد إلى الآبار والسماح له بالانتشار. عندما يتفاعل المستضد والجسم المضاد، فإنهما يشكلان منطقة هطول الأمطار. يتناسب مربع قطر منطقة هطول الأمطار بشكل مباشر مع تركيز المستضد. من خلال قياس مناطق الترسيب الناتجة عن عينات ذات تركيز معروف (انظر الحلقة الخارجية للعينات في الشكل\(\PageIndex{5}\))، يمكننا إعداد منحنى قياسي لتحديد تركيز محلول غير معروف. يعد اختبار RID اختبارًا مفيدًا أيضًا لتحديد تركيز العديد من بروتينات المصل مثل البروتينات التكميلية C3 و C4، من بين أمور أخرى.
التمارين\(\PageIndex{2}\)
- لماذا تتشكل حلقة البريسيبتين في اختبار حلقة بريسيبيتين، وما هي بعض الأسباب التي قد تؤدي إلى عدم تشكل الحلقة؟
- قارن وقارن بين التقنيات المستخدمة في مقايسة Ouchterlony ومقايسة الانتشار المناعي الشعاعي.
فحوصات التلبد
اختبار التلبد يشبه تفاعل البريسيبتين إلا أنه يتضمن مستضدات غير قابلة للذوبان مثل الدهون. يشبه الندف البريسيبتين من حيث وجود شبكة مرئية من المستضد والأجسام المضادة، ولكن نظرًا لأن الدهون غير قابلة للذوبان في محلول مائي، فإنها لا يمكن أن تترسب. بدلاً من الترسيب، لوحظ التلبد (الرغوة) في سائل أنبوب الاختبار.
استخدام التلبد لاختبار مرض الزهري
مرض الزهري هو عدوى تنتقل عن طريق الاتصال الجنسي ويمكن أن تسبب مرضًا شديدًا ومزمنًا لدى البالغين. بالإضافة إلى ذلك، ينتقل المرض بسهولة من الأمهات المصابات إلى أطفالهن حديثي الولادة أثناء الحمل والولادة، مما يؤدي في كثير من الأحيان إلى ولادة جنين ميت أو مشاكل صحية خطيرة طويلة الأمد للرضيع. لسوء الحظ، قد يكون من الصعب أيضًا تشخيص مرض الزهري لدى الأمهات الحوامل، لأنه غالبًا ما يكون بدون أعراض، خاصة عند النساء. بالإضافة إلى ذلك، يصعب نمو العامل المسبب، وهو بكتيريا Treponema pallidum، على وسائط المختبر التقليدية وصغيرة جدًا بحيث لا يمكن رؤيتها باستخدام الفحص المجهري الروتيني. لهذه الأسباب، يتم تأكيد التشخيصات الافتراضية لمرض الزهري بشكل عام بشكل غير مباشر في المختبر باستخدام الاختبارات التي تكشف الأجسام المضادة لمستضدات اللولبية.
في عام 1906، قدم العالم الألماني أوغست فون واسرمان (1866-1925) أول اختبار لمرض الزهري يعتمد على اكتشاف الأجسام المضادة للتريبونيمال في دم المريض. كانت الأجسام المضادة المكتشفة في اختبار Wassermann عبارة عن أجسام مضادة للفوسفوليبيد غير خاصة بـ T. pallidum. يمكن أن يساعد وجودها في تشخيص مرض الزهري، ولكن لأنها غير محددة، يمكن أن تؤدي أيضًا إلى نتائج إيجابية كاذبة في المرضى الذين يعانون من أمراض أخرى وحالات المناعة الذاتية. تم تعديل اختبار Wasserman الأصلي على مر السنين لتقليل الإيجابيات الكاذبة ويعرف الآن باسم اختبار مختبر أبحاث الأمراض التناسلية، المعروف اختصاره، اختبار VDRL.
لإجراء اختبار VDRL، يتم وضع مصل المريض أو السائل الشوكي الدماغي على شريحة بمزيج من الكارديوليبين (فوسفوليبيد مستضدي موجود في غشاء الميتوكوندريا لمسببات الأمراض المختلفة) والليسيثين والكوليسترول. يعمل الليسيثين والكوليسترول على استقرار التفاعل وتقليل الإيجابيات الكاذبة. سوف تربط الأجسام المضادة للتريبونيمال من مصل المريض المصاب الكارديوليبين وتشكل ندفًا. على الرغم من أن اختبار VDRL أكثر تحديدًا من اختبار Wassermann الأصلي، فقد تظل الإيجابيات الكاذبة تحدث في المرضى الذين يعانون من أمراض المناعة الذاتية التي تسبب تلفًا واسعًا للخلايا (مثل الذئبة الحمامية الجهازية).
مقايسة تحييد
للتسبب في العدوى، يجب أن ترتبط الفيروسات بالمستقبلات الموجودة على الخلايا المضيفة. يمكن للأجسام المضادة للفيروسات تحييد العدوى الفيروسية عن طريق طلاء الفيروسات، ومنع الارتباط (الشكل 18.1.6). يعمل هذا النشاط على تحييد الفيروسات ويمكن أن يؤدي إلى تكوين مجمعات كبيرة من فيروسات الأجسام المضادة (التي يمكن إزالتها بسهولة عن طريق البلعمة) أو عن طريق ربط الأجسام المضادة بالفيروس ومنع ارتباطه بمستقبلات الخلايا المضيفة. نشاط التحييد هذا هو أساس فحوصات التحييد، المقايسات الحساسة المستخدمة لتشخيص العدوى الفيروسية.
عندما تصيب الفيروسات الخلايا، فإنها غالبًا ما تسبب ضررًا (تأثيرات الاعتلال الخلوي) التي قد تشمل تحلل الخلايا المضيفة. يمكن تصور تأثيرات الاعتلال الخلوي من خلال نمو الخلايا المضيفة في طبق بتري، وتغطية الخلايا بطبقة رقيقة من الأجار، ثم إضافة الفيروس (انظر العزلة والثقافة وتحديد الفيروسات). سوف ينتشر الفيروس ببطء شديد عبر الأجار. سوف يدخل الفيروس الخلية المضيفة، ويتكاثر (يسبب تلف الخلية)، ويتم إطلاقه من الخلية المضيفة الميتة، ثم ينتقل إلى الخلايا المجاورة. مع موت المزيد والمزيد من الخلايا، ستتشكل لويحات الخلايا الميتة (الشكل\(\PageIndex{6}\)).
خلال مسار العدوى الفيروسية، سيقوم المريض بتكوين استجابة الأجسام المضادة للفيروس، ويمكننا تحديد كمية تلك الأجسام المضادة باستخدام اختبار تقليل اللويحات. لإجراء الفحص، يتم إجراء تخفيف تسلسلي على عينة المصل. ثم يتم خلط كل تخفيف بكمية موحدة من الفيروس المشتبه به. أي أجسام مضادة خاصة بالفيروس في المصل ستحييد بعض الفيروس. ثم تتم إضافة المعلقات إلى الخلايا المضيفة في المزرعة للسماح لأي فيروس غير محايد بإصابة الخلايا وتشكيل لويحات بعد عدة أيام. يُعرّف العيار بأنه مقلوب أعلى تخفيف يُظهر انخفاضًا بنسبة 50٪ في اللويحات. يتم التعبير عن العيار دائمًا كرقم صحيح. على سبيل المثال، إذا كان التخفيف بنسبة 1/64 هو أعلى تخفيف يُظهر انخفاضًا بنسبة 50٪ في الترسبات، فإن العيار هو 64.
لا يخبرنا وجود الأجسام المضادة في مصل المريض ما إذا كان المريض مصابًا حاليًا أو مصابًا في الماضي. يمكن تحديد العدوى الحالية من خلال الانتظار لمدة أسبوعين واختبار عينة مصل أخرى. تشير الزيادة بمقدار أربعة أضعاف في عيار التعادل في هذه العينة الثانية إلى وجود عدوى جديدة.
التمارين\(\PageIndex{3}\)
في اختبار التحييد، إذا كان مصل المريض يحتوي على أعداد كبيرة من الأجسام المضادة للفيروسات، هل تتوقع رؤية المزيد أو أقل من اللويحات؟
إستشراد مناعي
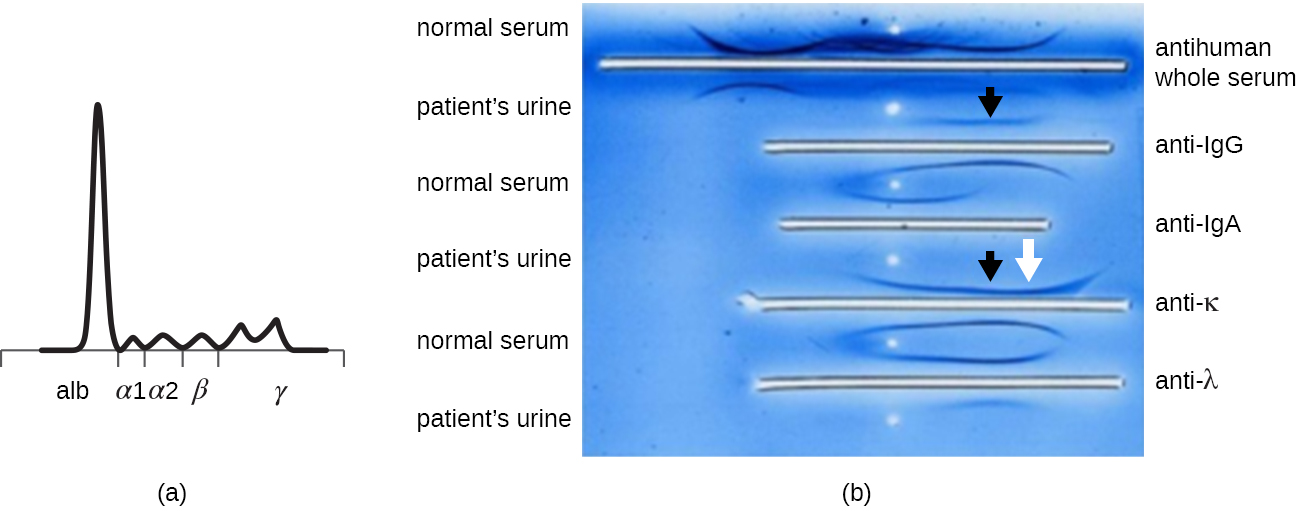
عندما يكون لدى المريض مستويات مرتفعة من البروتين في الدم أو يفقد البروتين في البول، غالبًا ما يطلب الطبيب إجراء اختبار الرحلان الكهربي لجل بولي أكريلاميد (PAGE) (انظر تصور وتوصيف الحمض النووي والحمض النووي الريبي والبروتين). يقارن هذا الفحص الوفرة النسبية لأنواع مختلفة من بروتينات المصل. يمكن إجراء المزيد من الدراسة لأنماط الرحلان الكهربي غير الطبيعي للبروتين باستخدام الرحلان الكهربي المناعي (IEP). يبدأ IEP بتشغيل صفحة. تتم إضافة مضادات الأمصال ضد بروتينات المصل المختارة إلى الأحواض التي تعمل بالتوازي مع مسار الرحلان الكهربائي، مما يشكل أقواس بريسبيتين مماثلة لتلك التي شوهدت في اختبار Ouchterlony (الشكل\(\PageIndex{7}\)). هذا يسمح بتحديد بروتينات الغلوبولين المناعي غير الطبيعية في العينة.
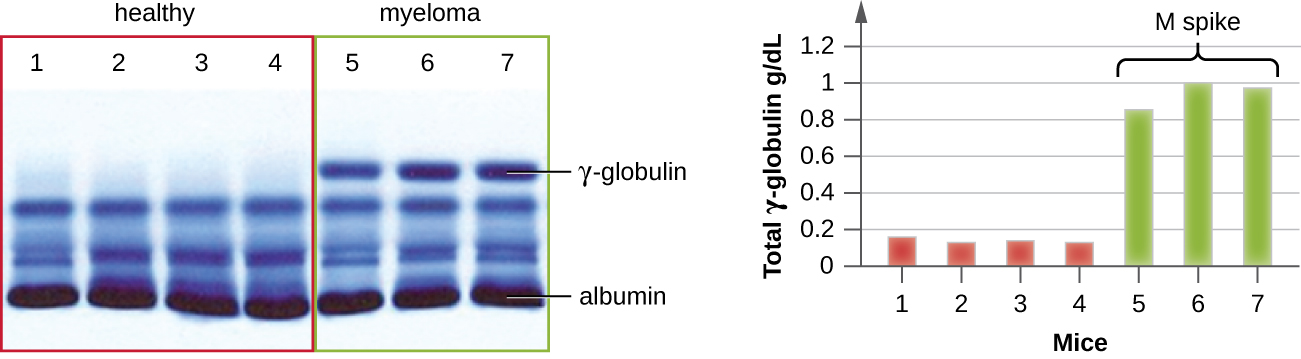
يعد IEP مفيدًا بشكل خاص في تشخيص الورم النقوي المتعدد، وهو سرطان الخلايا التي تفرز الأجسام المضادة. لا يمكن للمرضى الذين يعانون من الورم النقوي المتعدد إنتاج أجسام مضادة صحية؛ وبدلاً من ذلك ينتجون أجسامًا مضادة غير طبيعية هي بروتينات أحادية النسيلة (بروتينات M). وبالتالي، فإن المرضى الذين يعانون من الورم النقوي المتعدد سيصابون بمستويات مرتفعة من بروتين المصل تظهر نطاقًا مميزًا في منطقة جاما الجلوبيولين من جل الرحلان الكهربائي للبروتين وارتفاعًا حادًا (في بروتين M) في مسح مقياس الكثافة بدلاً من المسحة العريضة العادية (الشكل\(\PageIndex{7}\)). عند استخدام الأجسام المضادة ضد الأنواع المختلفة من سلاسل الأجسام المضادة الثقيلة والخفيفة لتشكيل أقواس بريسيبتين، سيتسبب بروتين M في ظهور أقواس منحرفة بشكل واضح مقابل فئة واحدة من السلاسل الثقيلة وفئة واحدة من السلاسل الخفيفة كما هو موضح في الشكل\(\PageIndex{7}\).
الرحلان الكهربائي للبروتين وتوصيف بنية الغلوبولين المناعي
أدى ظهور الرحلان الكهربائي في النهاية إلى البحث وفهم بنية الأجسام المضادة. عندما نشر عالم الكيمياء الحيوية السويدي آرني تيسيليوس (1902-1971) أول نتائج الرحلان الكهربي للبروتين في عام 1937 2، استطاع التعرف على بروتين الألبومين (أصغر بروتين مصل وأكثره وفرة) من خلال الشريط الحاد الذي أنتجه في الجل. لم يكن بالإمكان حل بروتينات المصل الأخرى عن طريق الرحلان الكهربي البروتيني البسيط، لذلك قام بتسمية النطاقات الثلاثة العريضة، مع وجود العديد من البروتينات في كل فرقة، وهي ألفا وبيتا وغاما غلوبولين. بعد ذلك بعامين، سافر عالم المناعة الأمريكي إلفين كابات (1914-2000) إلى السويد للعمل مع تيسيليوس باستخدام هذه التقنية الجديدة وأظهر أن الأجسام المضادة تهاجر في صورة جلوبيولين جاما. 3 مع هذا الفهم الجديد في متناول اليد، سرعان ما تعلم الباحثون أن الورم النقوي المتعدد، لأنه سرطان الخلايا التي تفرز الأجسام المضادة، يمكن تشخيصه مبدئيًا من خلال وجود ارتفاع كبير في M في منطقة جاما-جلوبولين بواسطة الرحلان الكهربائي للبروتين. قبل هذا الاكتشاف، كانت الدراسات حول بنية الغلوبولين المناعي ضئيلة، بسبب صعوبة الحصول على عينات نقية للدراسة. أثبتت الأمصال المأخوذة من مرضى الورم النقوي المتعددين أنها مصدر ممتاز للغلوبولين المناعي أحادي النسيلة عالي التخصيب، حيث توفر المادة الخام للدراسات على مدار العشرين عامًا القادمة التي أسفرت عن توضيح بنية الغلوبولين المناعي.
التمارين\(\PageIndex{4}\)
بشكل عام، ما الذي تنجزه مقايسة الرحلان المناعي؟
مقايسة إمونوبلوت: ذا ويسترن بلوت
بعد إجراء الرحلان الكهربي لجل البروتين، يمكن تحديد بروتينات معينة في الجل باستخدام الأجسام المضادة. تُعرف هذه التقنية باسم البقعة الغربية. بعد فصل البروتينات بواسطة PAGE، يتم نقل مستضدات البروتين الموجودة في الجل إلى غشاء النيتروسليلوز وتثبيته. يمكن أن يتعرض هذا الغشاء بعد ذلك لجسم مضاد أساسي يتم إنتاجه للربط بشكل خاص بالبروتين محل الاهتمام. ثم يرتبط الجسم المضاد الثاني المجهز بمنارة جزيئية بالأول. تقترن هذه الأجسام المضادة الثانوية بجزيء آخر مثل الإنزيم أو الفلوروفور (جزيء يتألق عند تحفيزه بالضوء). عند استخدام الأجسام المضادة المقترنة بالإنزيمات، تتم إضافة ركيزة كروموجينية للإنزيم. عادة ما تكون هذه الركيزة عديمة اللون ولكنها ستتطور لونها في وجود الجسم المضاد. يحدد التلوين الفلوري أو الركيزة موقع البروتين المحدد في الغشاء الذي ترتبط به الأجسام المضادة (الشكل\(\PageIndex{9}\)).
عادةً ما يتم استخدام الأجسام المضادة متعددة النسيلة في فحوصات البقع الغربية. وهي أكثر حساسية من MABs نظرًا لقدرتها على الارتباط بمختلف أشكال المستضد الأولي، وعادة ما تكون الإشارة الصادرة عن الأجسام المضادة متعددة النسيلة أقوى من تلك الصادرة عن mABs. يمكن أيضًا استخدام الأجسام المضادة أحادية النسيلة؛ ومع ذلك، فإن إنتاجها أكثر تكلفة بكثير وأقل حساسية، لأنها قادرة فقط على التعرف على مثارة واحدة محددة.
العديد من الاختلافات في البقعة الغربية مفيدة في البحث. في البقعة الجنوبية الغربية، يتم فصل البروتينات بواسطة SDS-PAGE، ويتم مسحها على غشاء النيتروسليلوز، والسماح لها بالعودة إلى طبيعتها، ثم فحصها باستخدام مسبار الحمض النووي المسمى بالأشعة أو الإشعاع؛ الغرض من الجنوب الغربي هو تحديد تفاعلات بروتين الحمض النووي المحددة. يتم إجراء المدونات الغربية القصوى لتحديد تفاعلات البروتين والبروتين بين البروتينات المجمدة (مفصولة بواسطة SDS-PAGE، ويتم مسحها على غشاء النيتروسليلوز، ويسمح لها بإعادة النمو) ومجسات البروتين غير المضادة. يمكن اكتشاف البروتينات غير المضادة المرتبطة التي تتفاعل مع البروتينات المجمدة في البقعة الغربية البعيدة عن طريق وضع العلامات الإشعاعية أو الفلورة أو استخدام جسم مضاد مع منارة جزيئية إنزيمية.
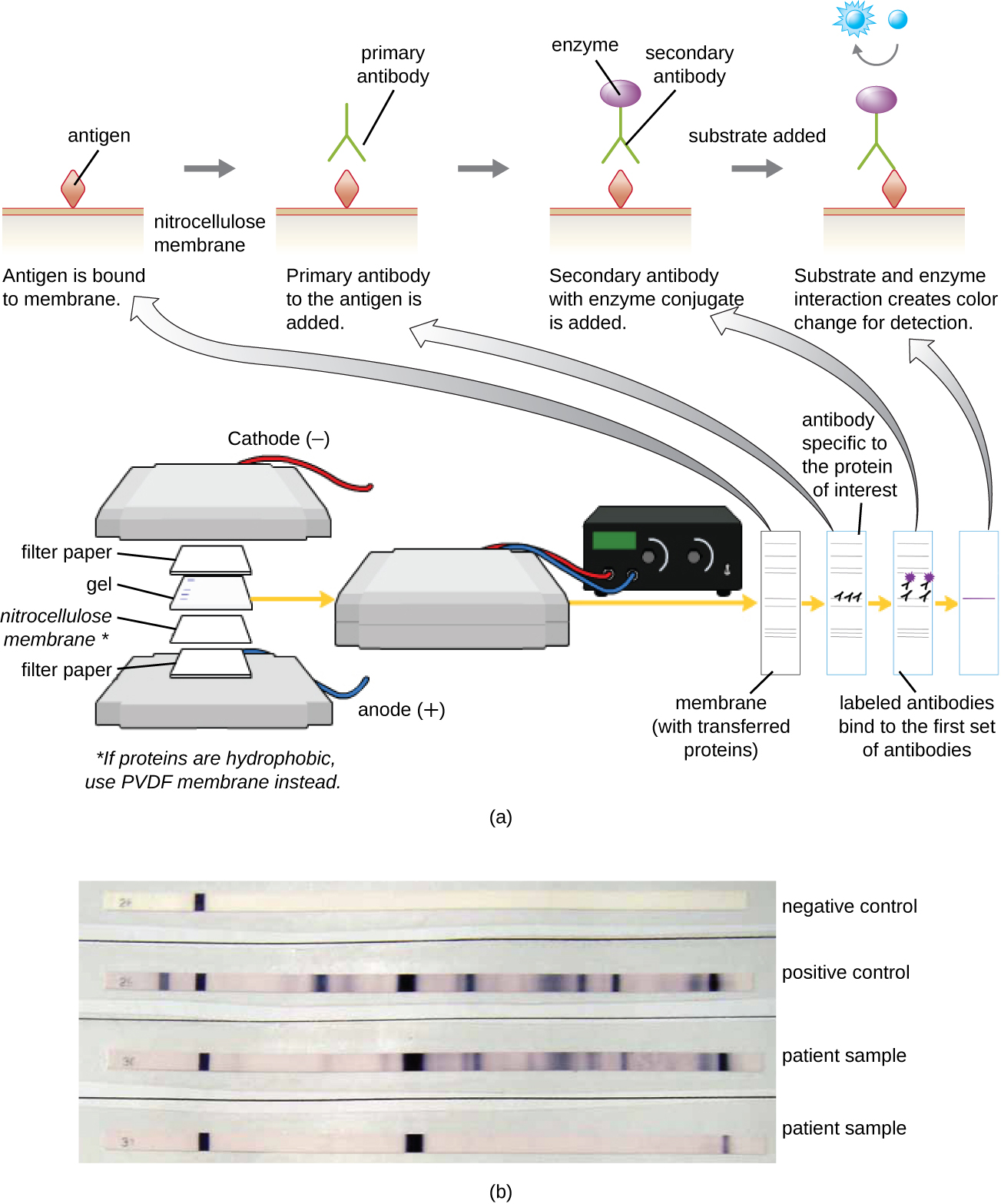
التمارين\(\PageIndex{5}\)
ما وظيفة الإنزيم في مقايسة إمونوبلوت؟
المقايسة المناعية التكميلية
تتمثل إحدى الوظائف الرئيسية للأجسام المضادة في تنشيط (تثبيت) المكمل. عندما يرتبط الجسم المضاد بالبكتيريا، على سبيل المثال، تتعرف بعض البروتينات التكميلية على الجسم المضاد المرتبط وتنشط السلسلة التكميلية. استجابةً لذلك، ترتبط البروتينات التكميلية الأخرى بالبكتيريا حيث يعمل بعضها كأوبسونين لزيادة كفاءة البلعمة والبعض الآخر يخلق ثقوبًا في أغشية الخلايا البكتيرية سالبة الجرام، مما يتسبب في التحلل. يمكن استخدام هذا النشاط الليتي للكشف عن وجود الأجسام المضادة ضد مستضدات معينة في المصل.
خلايا الدم الحمراء هي خلايا مؤشر جيدة لاستخدامها عند تقييم التحلل الخلوي بوساطة المكملات. يؤدي انحلال خلايا الدم الحمراء إلى إطلاق الهيموجلوبين، وهو صبغة ذات ألوان زاهية، وسيؤدي انحلال الدم حتى لعدد صغير من الخلايا الحمراء إلى أن يصبح المحلول ورديًا بشكل ملحوظ (الشكل\(\PageIndex{10}\)). تلعب هذه الخاصية دورًا في اختبار التثبيت التكميلي، والذي يسمح باكتشاف الأجسام المضادة ضد مسببات أمراض معينة. يمكن استخدام اختبار التثبيت التكميلي للتحقق من الأجسام المضادة ضد مسببات الأمراض التي يصعب زراعتها في المختبر مثل الفطريات أو الفيروسات أو بكتيريا الكلاميديا.
لإجراء اختبار التثبيت التكميلي، تتم إضافة المستضد من العامل الممرض إلى مصل المريض. في حالة وجود أجسام مضادة للمستضد، فإن الجسم المضاد سيربط المستضد ويصلح كل المكملات المتاحة. عند إضافة خلايا الدم الحمراء والأجسام المضادة ضد خلايا الدم الحمراء لاحقًا إلى المزيج، لن يتبقى أي مكمل لتحلل الخلايا الحمراء. وبالتالي، إذا ظل الحل واضحًا، يكون الاختبار إيجابيًا. إذا لم تكن هناك أجسام مضادة لمسببات الأمراض في مصل المريض، فإن الأجسام المضادة المضافة ستنشط المكمل لتحلل الخلايا الحمراء، مما يؤدي إلى اختبار سلبي (الشكل\(\PageIndex{10}\)).
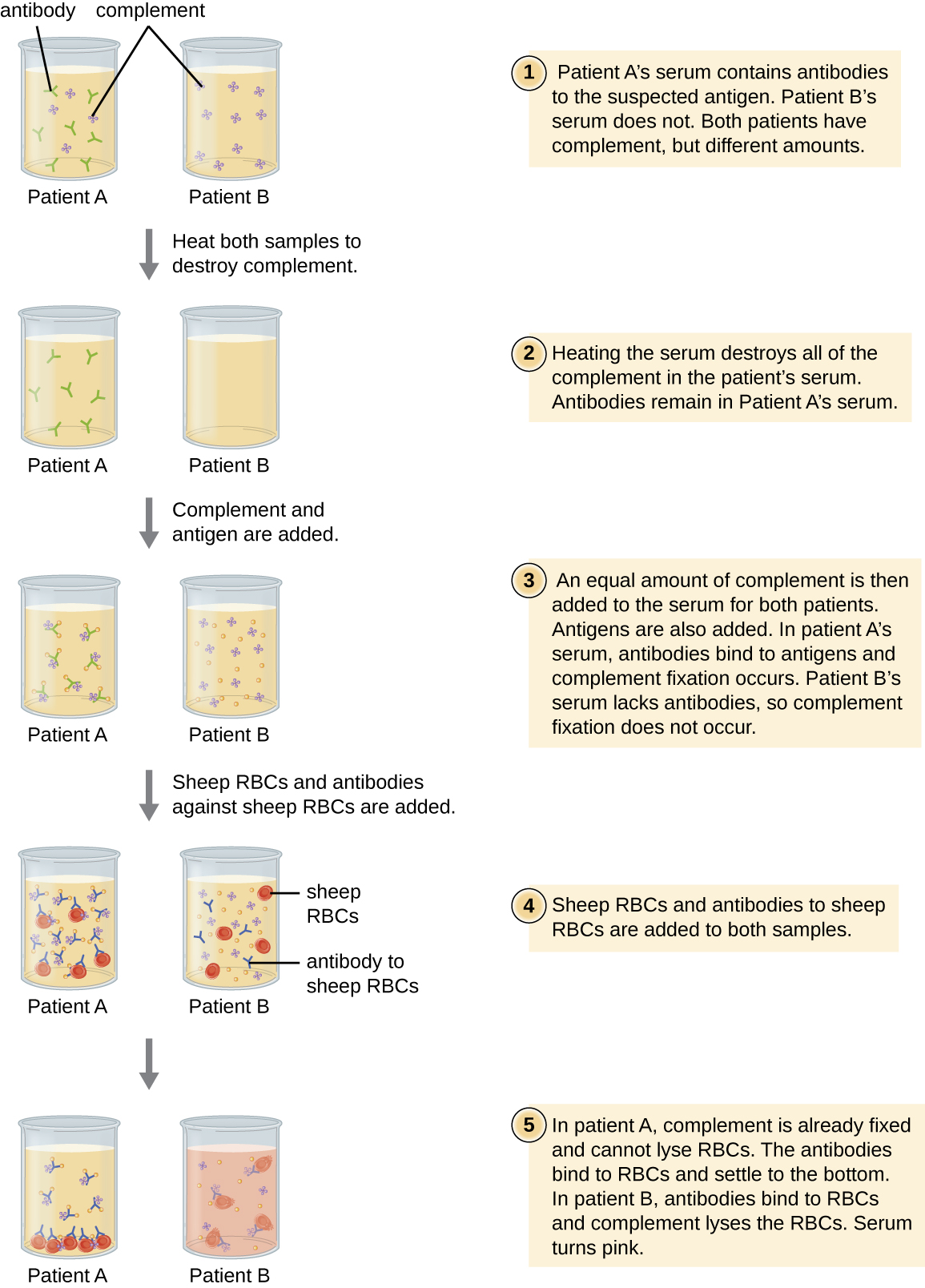
شاهد هذا الفيديو لمشاهدة مخطط تفصيلي لخطوات اختبار التثبيت التكميلي.
التمارين\(\PageIndex{6}\)
في اختبار التثبيت التكميلي، إذا تحول لون المصل إلى اللون الوردي، فهل لدى المريض أجسام مضادة للمستضد أم لا؟ اشرح.
\(\PageIndex{1}\)يلخص الجدول الأنواع المختلفة من فحوصات مستضد الأجسام المضادة التي تمت مناقشتها في هذا القسم.
| نوع الفحص | الآلية | أمثلة |
|---|---|---|
| هطول | يرتبط الجسم المضاد بالمستضد القابل للذوبان، ويشكل بريسبيتين مرئيًا | اختبار حلقة Precipitin لتصور تكوين الشبكة في المحلول |
| الرحلان الكهربي المناعي لفحص توزيع المستضدات بعد الرحلان الكهربائي | ||
| اختبار Ouchterlony لمقارنة المستضدات المتنوعة | ||
| اختبار الانتشار المناعي الشعاعي لتحديد المستضدات | ||
| التلبد | يرتبط الجسم المضاد بالجزيئات غير القابلة للذوبان المعلقة، مما يشكل مجاميع مرئية | اختبار VDRL لمرض الزهري |
| تحييد | يرتبط الجسم المضاد بالفيروسات ويمنع دخول الفيروس إلى الخلايا المستهدفة ويمنع تكوين اللويحات | اختبار تقليل اللويحات للكشف عن وجود الأجسام المضادة المعادلة في مصل المريض |
| تفعيل مكمل | يرتبط الجسم المضاد بالمستضد، مما يؤدي إلى تنشيط المكمل وعدم ترك أي مكمل لتحلل خلايا الدم الحمراء | اختبار التثبيت التكميلي للأجسام المضادة للمرضى ضد البكتيريا التي يصعب زراعتها مثل الكلاميديا |
المفاهيم الأساسية والملخص
- عند التواجد بالنسب الصحيحة، سيشكل الجسم المضاد والمستضد بريسيبتين أو شبكة تترسب خارج المحلول.
- يمكن استخدام اختبار حلقة Precipitin لتصور تكوين الشبكة في المحلول. يوضح اختبار Ouchterlony تكوين الشبكة في مادة هلامية. يتم استخدام اختبار الانتشار المناعي الشعاعي لتحديد المستضد عن طريق قياس حجم منطقة الترسيب في مادة هلامية مملوءة بالأجسام المضادة.
- ستشكل المستضدات غير القابلة للذوبان المعلقة ندفًا عند ربطها بالأجسام المضادة. هذا هو أساس اختبار VDRL لمرض الزهري حيث ترتبط الأجسام المضادة للتريبونيمال بالكارديوليبين المعلق.
- يمكن اكتشاف العدوى الفيروسية عن طريق قياس الأجسام المضادة المحايدة للفيروسات في مصل المريض.
- يتم تحديد فئات الأجسام المضادة المختلفة في البلازما أو المصل باستخدام الرحلان المناعي.
- يمكن إثبات وجود مستضدات معينة (مثل البروتينات البكتيرية أو الفيروسية) في المصل من خلال فحوصات البقع الغربية، حيث يتم نقل البروتينات إلى غشاء النيتروسليلوز وتحديدها باستخدام الأجسام المضادة المصنفة.
- في اختبار التثبيت التكميلي، يتم استخدام المكمل للكشف عن الأجسام المضادة ضد مسببات الأمراض المختلفة.
الحواشي
- 1 Ouchterlony، أورجان، «طريقة في المختبر لاختبار قدرة بكتيريا الدفتيريا على إنتاج السموم»، Acta Pathologica Microbiologica Scandinavica 26، رقم 4 (1949): 516-24.
- 2 تيسيليوس، آرني، «الرحلان الكهربائي لجلوبيولين المصل: التحليل الكهربي للمصل الطبيعي والمناعي»، المجلة البيوكيميائية 31، رقم 9 (1937): 1464.
- (3) تيسيليوس وآرني وإلفين أ. كابات. «دراسة كهربية للأمصال المناعية ومستحضرات الأجسام المضادة النقية»، مجلة الطب التجريبي 69، رقم 1 (1939): 119-31.


