20.1: تطبيقات عملية للأجسام المضادة أحادية النسيلة ومتعددة النسيلة
- Page ID
- 194951
أهداف التعلم
- قارن طريقة تطوير واستخدام وخصائص الأجسام المضادة أحادية النسيلة ومتعددة النسيلة
- اشرح طبيعة التفاعل التبادلي للأجسام المضادة ولماذا تقل هذه المشكلة مع الأجسام المضادة أحادية النسيلة
التركيز السريري: الجزء الأول
في حادثة مؤسفة، تم القبض على عامل رعاية صحية يعاني من الإدمان وهو يسرق محاقن مسكنات الألم ويستبدلها بحقن مليئة بمواد غير معروفة. قامت المستشفى على الفور بفصل الموظف وإلقاء القبض عليه؛ ومع ذلك، ثبتت إصابة مريضين كان قد عمل معهم لاحقًا بفيروس نقص المناعة البشرية.
وفي حين لم يكن هناك أي دليل على أن العدوى نشأت من المحاقن الملوثة، اتخذ طبيب الصحة العامة في المستشفى خطوات فورية لتحديد ما إذا كان أي مرضى آخرين قد تعرضوا للخطر. على الرغم من أن العامل لم يتم توظيفه إلا لفترة قصيرة، فقد تقرر أنه كان على اتصال بأكثر من 1300 مريض. قررت المستشفى الاتصال بجميع هؤلاء المرضى وإجراء اختبار لفيروس نقص المناعة البشرية.
التمارين\(\PageIndex{1}\)
- لماذا يشعر المستشفى أنه من الضروري اختبار كل مريض لفيروس نقص المناعة البشرية؟
- ما أنواع الاختبارات التي يمكن استخدامها لتحديد ما إذا كان المريض مصابًا بفيروس نقص المناعة البشرية؟
بالإضافة إلى كونها ضرورية لاستجابتنا المناعية الطبيعية، توفر الأجسام المضادة أدوات قوية لأغراض البحث والتشخيص. إن الخصوصية العالية للأجسام المضادة تجعلها أداة ممتازة لاكتشاف وتحديد مجموعة واسعة من الأهداف، من الأدوية إلى بروتينات المصل إلى الكائنات الحية الدقيقة. باستخدام الاختبارات المختبرية، يمكن استخدام الأجسام المضادة لترسيب المستضدات القابلة للذوبان، وتراكم الخلايا (المتكتلة)، وتسمم البكتيريا وقتلها بمساعدة المكملات، وتحييد الأدوية والسموم والفيروسات.
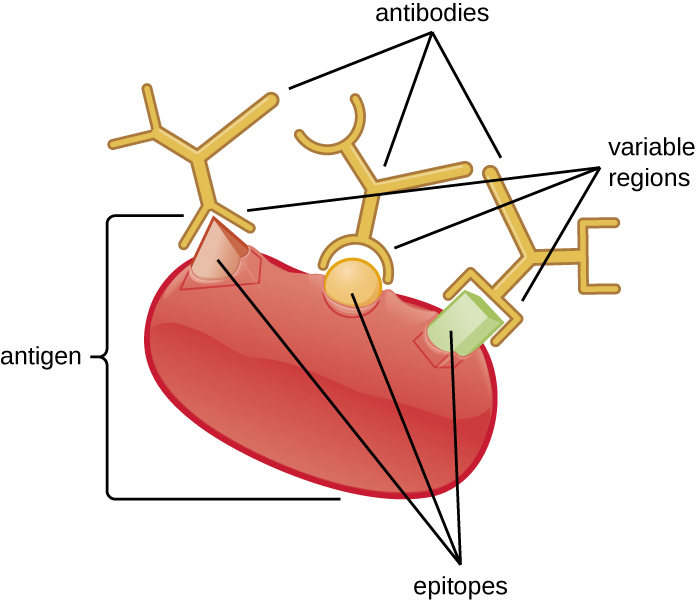
تنتج خصوصية الجسم المضاد من موقع ربط المستضد المتكون داخل المناطق المتغيرة - مناطق الجسم المضاد التي تحتوي على أنماط فريدة من الأحماض الأمينية التي يمكن أن ترتبط فقط بالمستضدات المستهدفة بتسلسل جزيئي يوفر شحنات تكميلية وروابط غير تساهمية. ومع ذلك، هناك قيود على خصوصية الأجسام المضادة. تتشابه بعض المستضدات كيميائيًا لدرجة أن التفاعل المتبادل يحدث؛ بمعنى آخر، ترتبط الأجسام المضادة المرفوعة ضد مستضد واحد بمستضد واحد بمستضد مشابه كيميائيًا ولكنه مختلف. ضع في اعتبارك مستضدًا يتكون من بروتين واحد يحتوي على مثبتات متعددة (الشكل\(\PageIndex{1}\)). قد يحفز هذا البروتين الفردي إنتاج العديد من الأجسام المضادة المختلفة، والتي قد يرتبط بعضها بمثيلات متطابقة كيميائيًا على بروتينات أخرى.
من المرجح أن يحدث التفاعل المتبادل بين الأجسام المضادة والمستضدات ذات التقارب أو الطموح المنخفض. التقارب، الذي يمكن تحديده تجريبيًا، هو مقياس لقوة الارتباط بين موقع ربط الجسم المضاد والمبيض، في حين أن الطموح هو القوة الكلية لجميع التفاعلات في مجمع مستضد الأجسام المضادة (الذي قد يحتوي على أكثر من موقع ربط واحد). يتأثر الطموح بالتقارب وكذلك الترتيبات الهيكلية للظهارة والمناطق المتغيرة للجسم المضاد. إذا كان الجسم المضاد يتمتع بدرجة عالية من الانتماء/الطموح لمستضد معين، فمن غير المرجح أن يتفاعل مع المستضد الذي يكون له تقارب/جاذبية أقل.
التمارين\(\PageIndex{2}\)
- ما الخاصية التي تجعل الأجسام المضادة مفيدة للبحث والتشخيص السريري؟
- ما هو التفاعل التبادلي ولماذا يحدث؟
إنتاج الأجسام المضادة متعددة النسيلة
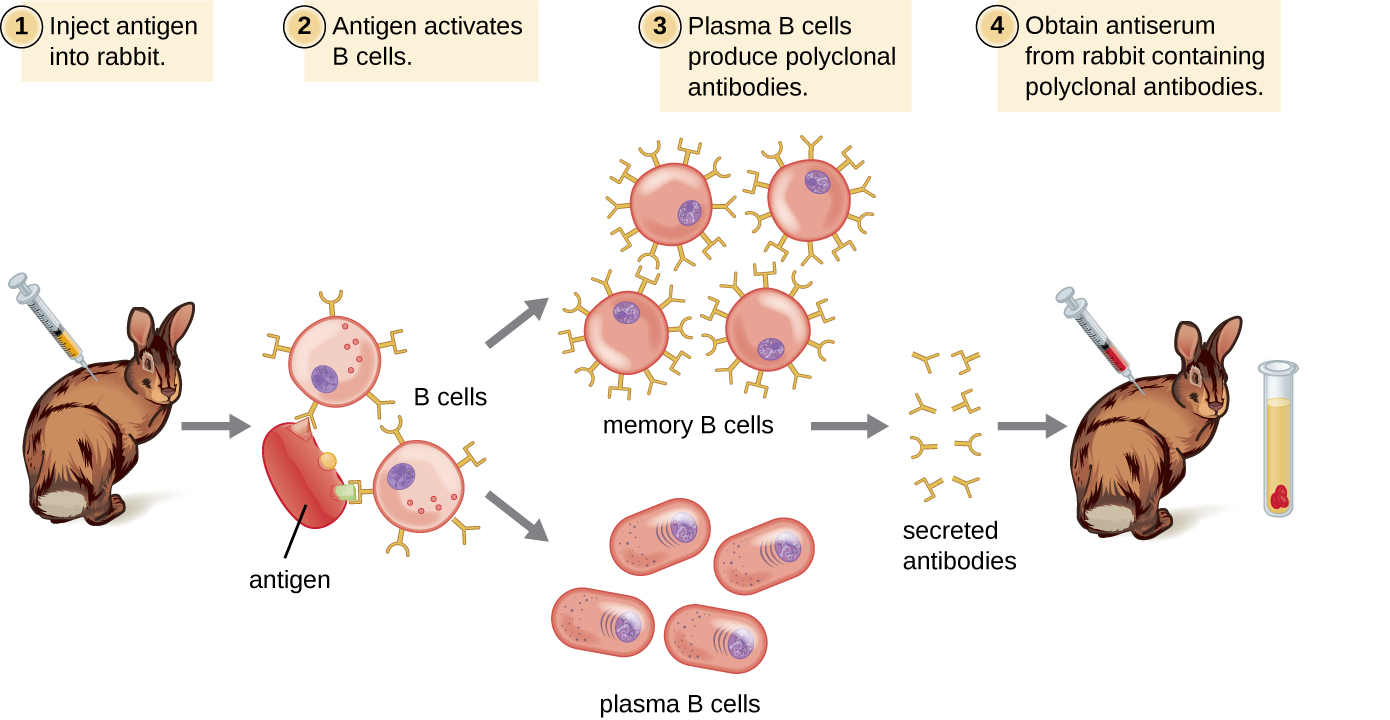
غالبًا ما يتم الحصول على الأجسام المضادة المستخدمة لأغراض البحث والتشخيص عن طريق حقن حيوان مختبر مثل الأرنب أو الماعز بمستضد معين. في غضون بضعة أسابيع، سينتج الجهاز المناعي للحيوان مستويات عالية من الأجسام المضادة الخاصة بالمستضد. يمكن حصاد هذه الأجسام المضادة في مصل مضاد، وهو مصل كامل يتم جمعه من حيوان بعد التعرض لمستضد. نظرًا لأن معظم المستضدات عبارة عن هياكل معقدة ذات حواتم متعددة، فإنها تؤدي إلى إنتاج أجسام مضادة متعددة في حيوان المختبر. هذا ما يسمى باستجابة الأجسام المضادة متعددة النسيلة هو أيضًا نموذجي للاستجابة للعدوى من قبل جهاز المناعة البشري. وبالتالي فإن المصل المضاد المستخرج من حيوان سيحتوي على أجسام مضادة من مستنسخات متعددة من الخلايا البائية، مع استجابة كل خلية B لمثارة معينة على المستضد (الشكل\(\PageIndex{2}\)).
عادة ما يتم حقن حيوانات المختبر مرتين على الأقل بالمستضد عند استخدامها لإنتاج مصل مضاد. ستعمل الحقنة الثانية على تنشيط خلايا الذاكرة التي تصنع أجسامًا مضادة من فئة IgG ضد المستضد. تخضع خلايا الذاكرة أيضًا لنضج التقارب، مما يؤدي إلى مجموعة من الأجسام المضادة بمتوسط تقارب أعلى. يحدث نضوج التقارب بسبب الطفرات في المناطق المتغيرة لجين الغلوبولين المناعي، مما يؤدي إلى ظهور خلايا B ذات مواقع ربط المستضد متغيرة قليلاً. عند إعادة التعرض للمستضد، سيتم تحفيز تلك الخلايا البائية القادرة على إنتاج الأجسام المضادة ذات المواقع المرتبطة بالمستضد ذات التقارب العالي للتكاثر وإنتاج المزيد من الأجسام المضادة مقارنة بنظيراتها الأقل تقاربًا. غالبًا ما يتم خلط المادة المساعدة، وهي مادة كيميائية تحفز التنشيط العام لجهاز المناعة الذي يحفز إنتاج الأجسام المضادة بشكل أكبر، مع المستضد قبل الحقن.
لن يحتوي المصل المضاد الذي يتم الحصول عليه من الحيوانات على أجسام مضادة ضد المستضد الذي يتم إدخاله بشكل مصطنع في المختبر فحسب، بل سيحتوي أيضًا على أجسام مضادة لأي مستضدات أخرى تعرض لها الحيوان خلال حياته. لهذا السبب، يجب أولاً «تنقية» الأمصال المضادة لإزالة الأجسام المضادة الأخرى قبل استخدام الأجسام المضادة للبحث أو الاختبارات التشخيصية.
الاستخدامات السريرية لأمصال أنتيسيرا متعددة النسيلة
تُستخدم الأمصال المضادة متعددة النسيلة في العديد من الاختبارات السريرية المصممة لتحديد ما إذا كان المريض ينتج أجسامًا مضادة استجابةً لمسببات أمراض معينة. في حين أن هذه الاختبارات هي بالتأكيد أدوات تشخيصية قوية، إلا أن لها قيودها، لأنها وسيلة غير مباشرة لتحديد ما إذا كان هناك عامل ممرض معين. يمكن أن تؤدي الاختبارات التي تعتمد على استجابة متعددة النسيلة أحيانًا إلى نتيجة إيجابية كاذبة - بمعنى آخر، اختبار يؤكد وجود مستضد غير موجود في الواقع. يمكن أن تؤدي الاختبارات القائمة على الأجسام المضادة أيضًا إلى نتيجة سلبية كاذبة، والتي تحدث عندما يفشل الاختبار في اكتشاف جسم مضاد موجود بالفعل.
يمكن وصف دقة اختبارات الأجسام المضادة من حيث حساسية الاختبار وخصوصية الاختبار. حساسية الاختبار هي احتمال الحصول على نتيجة اختبار إيجابية عندما يكون المريض مصابًا بالفعل. إذا كان الاختبار ذا حساسية عالية، يكون احتمال النتيجة السلبية الزائفة منخفضًا. خصوصية الاختبار، من ناحية أخرى، هي احتمال الحصول على نتيجة اختبار سلبية عندما لا يكون المريض مصابًا. إذا كان الاختبار ذا خصوصية عالية، فإن احتمال وجود نتيجة إيجابية كاذبة يكون منخفضًا.
غالبًا ما تحدث الإيجابيات الكاذبة بسبب التفاعل المتبادل، والذي يمكن أن يحدث عندما تتشابه الحطاطات من مسببات الأمراض المختلفة مع تلك الموجودة على العامل الممرض الذي يتم اختباره. لهذا السبب، غالبًا ما تستخدم الاختبارات القائمة على الأجسام المضادة فقط كاختبارات فحص؛ إذا كانت النتائج إيجابية، يتم استخدام اختبارات تأكيدية أخرى للتأكد من أن النتائج لم تكن إيجابية كاذبة.
على سبيل المثال، يمكن فحص عينة دم من مريض يشتبه في إصابته بالتهاب الكبد C بحثًا عن الفيروس باستخدام الأجسام المضادة التي ترتبط بالمستضدات على فيروس التهاب الكبد C. إذا كان المريض مصابًا بالفعل بفيروس التهاب الكبد C، فسوف ترتبط الأجسام المضادة بالمستضدات، مما يؤدي إلى نتيجة اختبار إيجابية. إذا لم يكن المريض مصابًا بفيروس التهاب الكبد C، فلن ترتبط الأجسام المضادة عمومًا بأي شيء ويجب أن يكون الاختبار سلبيًا؛ ومع ذلك، قد تحدث نتيجة إيجابية كاذبة إذا كان المريض مصابًا سابقًا بأي من مجموعة متنوعة من مسببات الأمراض التي تثير الأجسام المضادة التي تتفاعل مع التهاب الكبد C مستضدات الفيروسات. تتميز اختبارات الأجسام المضادة لالتهاب الكبد C بحساسية عالية (احتمال منخفض لحدوث نتيجة سلبية خاطئة) ولكنها ذات خصوصية منخفضة (احتمال كبير لوجود نتيجة إيجابية خاطئة). وبالتالي، يجب على المرضى الذين ثبتت إصابتهم أن يخضعوا لاختبار تأكيدي ثانٍ لاستبعاد احتمال وجود نتيجة إيجابية كاذبة. الاختبار التأكيدي هو اختبار أكثر تكلفة واستهلاكًا للوقت يختبر بشكل مباشر وجود الحمض النووي الريبي الفيروسي لالتهاب الكبد C في الدم. لا يمكن تشخيص المريض نهائيًا بعدوى التهاب الكبد C إلا بعد أن يعود الاختبار التأكيدي إيجابيًا. يمكن أن تؤدي الاختبارات القائمة على الأجسام المضادة إلى نتيجة سلبية خاطئة إذا لم ينتج الجهاز المناعي للمريض، لأي سبب من الأسباب، مستويات يمكن اكتشافها من الأجسام المضادة. بالنسبة لبعض الأمراض، قد يستغرق الأمر عدة أسابيع بعد الإصابة قبل أن ينتج الجهاز المناعي أجسامًا مضادة كافية لعبور عتبة الكشف عن الفحص. في المرضى الذين يعانون من نقص المناعة، قد لا يكون الجهاز المناعي قادرًا على إنتاج مستوى يمكن اكتشافه من الأجسام المضادة.
هناك قيد آخر لاستخدام إنتاج الأجسام المضادة كمؤشر للمرض وهو أن الأجسام المضادة في الدم ستستمر لفترة طويلة بعد إزالة العدوى. اعتمادًا على نوع العدوى، ستظل الأجسام المضادة موجودة لعدة أشهر؛ وفي بعض الأحيان، قد تكون موجودة طوال الفترة المتبقية من حياة المريض. وبالتالي، فإن الاختبار الإيجابي المستند إلى الأجسام المضادة يعني فقط أن المريض أصيب في وقت ما؛ ولا يثبت أن العدوى نشطة.
بالإضافة إلى دورها في التشخيص، يمكن لأمصال المضادات متعددة النسيلة تنشيط المكمل والكشف عن وجود البكتيريا في البيئات السريرية والصناعات الغذائية، وإجراء مجموعة واسعة من تفاعلات الترسيب التي يمكنها اكتشاف وقياس بروتينات المصل أو الفيروسات أو المستضدات الأخرى. ومع ذلك، نظرًا لوجود العديد من خصائص الجسم المضاد في مصل مضاد متعدد النسيلة، هناك احتمال كبير بأن يتفاعل المصل المضاد مع المستضدات التي لم يتعرض لها الفرد أبدًا. لذلك، يجب علينا دائمًا مراعاة إمكانية حدوث نتائج إيجابية كاذبة عند العمل مع مصل مضاد متعدد النسيلة.
التمارين\(\PageIndex{3}\)
- ما هي الإيجابية الكاذبة وما هي بعض أسباب حدوث الإيجابيات الكاذبة؟
- ما هي السلبية الكاذبة وما هي بعض أسباب حدوث الإيجابيات الكاذبة؟
- إذا كانت نتيجة اختبار المريض سلبية في اختبار شديد الحساسية، فما احتمال إصابة الشخص بمسببات المرض؟
إنتاج أجسام مضادة أحادية النسيلة
تتطلب بعض أنواع الاختبارات خصوصية الجسم المضاد وتقاربه بشكل أفضل مما يمكن الحصول عليه باستخدام مصل مضاد متعدد النسيلة. لتحقيق هذه الخصوصية العالية، يجب أن ترتبط جميع الأجسام المضادة بتقارب كبير مع مثارة واحدة. يمكن توفير هذه الخصوصية العالية من خلال الأجسام المضادة أحادية النسيلة (mABs). \(\PageIndex{1}\)يقارن الجدول بعض الخصائص المهمة للأجسام المضادة أحادية النسيلة ومتعددة النسيلة.
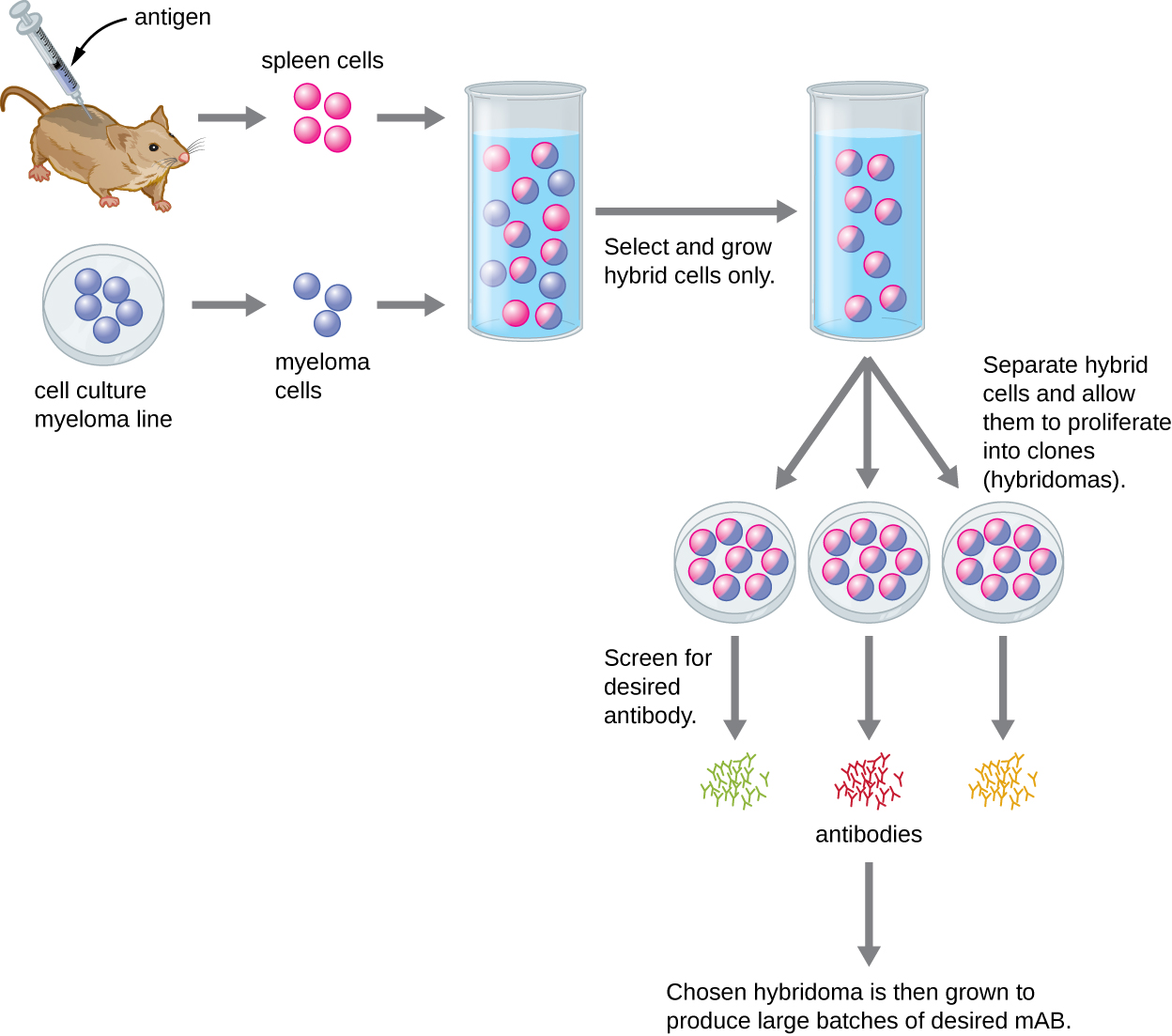
على عكس الأجسام المضادة متعددة النسيلة، التي يتم إنتاجها في الحيوانات الحية، يتم إنتاج الأجسام المضادة أحادية النسيلة في المختبر باستخدام تقنيات زراعة الأنسجة. يتم إنتاج MABs عن طريق تحصين حيوان، غالبًا فأر، عدة مرات باستخدام مستضد معين. ثم تتم إزالة الخلايا البائية من طحال الحيوان المحصن. نظرًا لأن الخلايا البائية الطبيعية غير قادرة على التكاثر إلى الأبد، فإنها تندمج مع خلايا B السرطانية الخالدة التي تسمى خلايا الورم النقوي، لإنتاج خلايا الورم الهجين. يتم بعد ذلك وضع جميع الخلايا في وسط انتقائي يسمح فقط للأورام الهجينة بالنمو؛ لا يمكن لخلايا الورم النقوي غير المستخدمة أن تنمو، وتموت أي خلايا B غير مستخدمة. يتم بعد ذلك فحص الأورام الهجينة، القادرة على النمو باستمرار في المزرعة أثناء إنتاج الأجسام المضادة، بحثًا عن mAb المطلوب. أما أولئك الذين ينتجون الماب المطلوب فيتم تربيتهم في زراعة الأنسجة؛ ويتم حصاد وسط الاستزراع بشكل دوري وتنقية الماب من الوسط. هذه عملية مكلفة للغاية وتستغرق وقتًا طويلاً. قد يستغرق الأمر أسابيع من الزراعة وعدة لترات من الوسائط لتوفير ما يكفي من MABs للتجربة أو لعلاج مريض واحد. MABs باهظة الثمن (الشكل\(\PageIndex{3}\)).
| الأجسام المضادة أحادية النسيلة | الأجسام المضادة متعددة النسيلة |
|---|---|
| إنتاج باهظ الثمن | إنتاج غير مكلف |
| وقت إنتاج طويل | إنتاج سريع |
| كميات كبيرة من الأجسام المضادة المحددة | كميات كبيرة من الأجسام المضادة غير النوعية |
| تعرف على صورة واحدة على المستضد | تعرف على العديد من المثبتات على المستضد |
| يكون الإنتاج مستمرًا وموحدًا بمجرد تكوين الورم الهجين | تختلف الدفعات المختلفة في التركيب |
الاستخدامات السريرية للأجسام المضادة أحادية النسيلة
نظرًا لأن الطرق الأكثر شيوعًا لإنتاج الأجسام المضادة أحادية النسيلة تستخدم خلايا الماوس، فمن الضروري إنشاء أجسام مضادة أحادية النسيلة إنسانية للاستخدام السريري البشري. لا يمكن حقن الأجسام المضادة للماوس بشكل متكرر في البشر، لأن الجهاز المناعي سيتعرف عليها على أنها غريبة وسيستجيب لها بالأجسام المضادة المعادلة. يمكن تقليل هذه المشكلة عن طريق الهندسة الجينية للجسم المضاد في خلية الماوس B. يتم ربط المناطق المتغيرة لضوء الماوس وجينات السلسلة الثقيلة بمناطق ثابتة بشرية، ثم يتم نقل الجين الخيالي إلى خلية مضيفة. يسمح هذا بإنتاج mAb الذي يكون في الغالب «بشريًا» مع كون موقع ربط المستضد فقط من أصل الماوس.
تم استخدام MABs المتوافقة مع البشر بنجاح لعلاج السرطان مع الحد الأدنى من الآثار الجانبية. على سبيل المثال، كان عقار Herceptin المضاد أحادي النسيلة المتوافق مع البشر مفيدًا في علاج بعض أنواع سرطان الثدي. كانت هناك أيضًا بعض التجارب الأولية على mAb المتوافق مع البشر لعلاج الأمراض المعدية، ولكن لا يتم استخدام أي من هذه العلاجات حاليًا. في بعض الحالات، أثبتت MABs أنها محددة جدًا في علاج الأمراض المعدية، لأنها تتعرف على بعض مصليات مسببات الأمراض دون غيرها. يمكن أن يؤدي استخدام مزيج من MABs المتعددة التي تستهدف سلالات مختلفة من العامل الممرض إلى معالجة هذه المشكلة. ومع ذلك، فإن التكلفة الكبيرة المرتبطة بإنتاج mAb تمثل تحديًا آخر منع MABs من أن تصبح عملية للاستخدام في علاج الالتهابات الميكروبية. 1
إحدى التقنيات الواعدة لـ MABs الرخيصة هي استخدام النباتات المعدلة وراثيًا لإنتاج الأجسام المضادة (أو الأجسام النباتية). تعمل هذه التقنية على تحويل الخلايا النباتية إلى مصانع الأجسام المضادة بدلاً من الاعتماد على خلايا زراعة الأنسجة، وهي مكلفة ومتطلبة تقنيًا. في بعض الحالات، قد يكون من الممكن توصيل هذه الأجسام المضادة عن طريق جعل المرضى يأكلون النباتات بدلاً من استخراج وحقن الأجسام المضادة. على سبيل المثال، في عام 2013، قامت مجموعة بحثية باستنساخ جينات الأجسام المضادة في النباتات التي لديها القدرة على تحييد مادة سامة مهمة من البكتيريا التي يمكن أن تسبب أمراض الجهاز الهضمي الشديدة. 2 يمكن أن يؤدي تناول النباتات إلى توصيل الأجسام المضادة مباشرة إلى السم.
التمارين\(\PageIndex{4}\)
- كيف يتم إنتاج الأجسام المضادة أحادية النسيلة المؤمنة؟
- ماذا يعني «أحادي النسيلة» للأجسام المضادة أحادية النسيلة؟
استخدام الأجسام المضادة أحادية النسيلة لمكافحة الإيبولا
خلال تفشي الإيبولا 2014-2015 في غرب إفريقيا، تم علاج عدد قليل من المرضى المصابين بالإيبولا باستخدام ZmApp، وهو دواء ثبت فعاليته في التجارب التي أجريت على قرود المكاك الريسوس قبل بضعة أشهر فقط. 3 ZmApp عبارة عن مزيج من ثلاثة MABs يتم إنتاجها عن طريق دمج جينات الأجسام المضادة في نباتات التبغ باستخدام ناقل فيروسي. باستخدام ثلاثة mABs، يكون الدواء فعالًا عبر سلالات متعددة من الفيروس. لسوء الحظ، لم يكن هناك سوى ما يكفي من ZmApp لعلاج عدد قليل من المرضى.
في حين أن التكنولوجيا الحالية ليست كافية لإنتاج كميات كبيرة من ZmApp، إلا أنها تُظهر أن الأجسام النباتية - MABs المنتجة من النباتات - قابلة للاستخدام السريري، ومن المحتمل أن تكون فعالة من حيث التكلفة، وتستحق المزيد من التطوير. شهدت السنوات القليلة الماضية انفجارًا في عدد الأدوية الجديدة القائمة على MAB لعلاج السرطان والأمراض المعدية؛ ومع ذلك، فإن الاستخدام الواسع النطاق لهذه الأدوية تثبطه حاليًا تكلفتها الباهظة، خاصة في الأجزاء المتخلفة من العالم، حيث قد تكلف جرعة واحدة أكثر من دخل المريض مدى الحياة. يمكن أن يؤدي تطوير طرق لاستنساخ جينات الأجسام المضادة إلى النباتات إلى تقليل التكاليف بشكل كبير.
المفاهيم الأساسية والملخص
- ترتبط الأجسام المضادة بخصوصية عالية بالمستضدات المستخدمة لتحدي جهاز المناعة، ولكنها قد تظهر أيضًا تفاعلًا متبادلًا من خلال الارتباط بالمستضدات الأخرى التي تشترك في الخصائص الكيميائية مع المستضد الأصلي.
- سيؤدي حقن المستضد في حيوان إلى استجابة الأجسام المضادة متعددة النسيلة التي يتم فيها إنتاج أجسام مضادة مختلفة تتفاعل مع الحلقات المختلفة على المستضد.
- تُعد الأمصال المضادة متعددة النسيلة مفيدة لبعض أنواع الاختبارات المعملية، ولكن الاختبارات الأخرى تتطلب مزيدًا من الخصوصية. عادةً ما تُستخدم الاختبارات التشخيصية التي تستخدم الأمصال المضادة متعددة النسيلة للفحص فقط نظرًا لاحتمال ظهور نتائج إيجابية كاذبة وسلبية كاذبة.
- توفر الأجسام المضادة أحادية النسيلة خصوصية أعلى من المضادات المضادة متعددة النسيلة لأنها ترتبط بمثارة واحدة وعادة ما تكون ذات تقارب كبير.
- عادةً ما يتم إنتاج الأجسام المضادة أحادية النسيلة عن طريق زراعة الأورام الهجينة التي تفرز الأجسام المضادة المشتقة من الفئران. تُستخدم MABs حاليًا لعلاج السرطان، لكن تكلفتها الباهظة حالت دون استخدامها على نطاق أوسع لعلاج الأمراض المعدية. ومع ذلك، فإن إمكاناتها للاستخدام المختبري والسريري تقود تطوير حلول جديدة وفعالة من حيث التكلفة مثل الأجسام النباتية.
الحواشي
- 1 سايلور وكارولين وإيكاترينا داداتشوفا وأرتورو كاساديفال، «العلاجات القائمة على الأجسام المضادة أحادية النسيلة للأمراض الميكروبية»، اللقاح 27 (2009): G38-G46.
- (2) ناكانيشي وكاتسوهيرو وآخرون، «إنتاج الأجسام النباتية الهجينة IgG/IgA ذات النشاط المعادل ضد سموم شيغا 1"، PLoS One 8، رقم 11 (2013): e80712.
- 3 Qiu، Xiangguo وآخرون، «عودة مرض فيروس الإيبولا المتقدم في الرئيسيات غير البشرية باستخدام ZmApp»، الطبيعة 514 (2014): 47-53.


