12.3: طرق الجينوم الكامل والتطبيقات الصناعية
- Page ID
- 195325
أهداف التعلم
- شرح استخدامات التحليلات المقارنة على مستوى الجينوم
- تلخيص مزايا المنتجات الصيدلانية المعدلة وراثيًا
أدى التقدم في البيولوجيا الجزيئية إلى إنشاء مجالات علمية جديدة تمامًا. من بين هذه المجالات التي تدرس جوانب الجينوم الكامل، والتي يشار إليها مجتمعة باسم طرق الجينوم الكامل. في هذا القسم، سنقدم لمحة موجزة عن مجالات الجينوم الكامل في علم الجينوم والنسخ والبروتيوميات.
علم الجينوم والنسخ والبروتيوميات
تسمى دراسة ومقارنة الجينومات بأكملها، بما في ذلك المجموعة الكاملة من الجينات وتسلسل النوكليوتيدات وتنظيمها، علم الجينوم. يتمتع هذا المجال بإمكانيات كبيرة للتقدم الطبي المستقبلي من خلال دراسة الجينوم البشري وكذلك جينومات الكائنات الحية المعدية. ساهم تحليل الجينوم الميكروبي في تطوير المضادات الحيوية الجديدة وأدوات التشخيص واللقاحات والعلاجات الطبية وتقنيات تنظيف البيئة.
مجال النسخ هو علم المجموعة الكاملة لجزيئات mRNA التي تنتجها الخلايا. يقارن العلماء أنماط التعبير الجيني بين الخلايا المضيفة المصابة وغير المصابة، ويكتسبون معلومات مهمة حول الاستجابات الخلوية للأمراض المعدية. بالإضافة إلى ذلك، يمكن استخدام النسخ لرصد التعبير الجيني لعوامل الضراوة في الكائنات الحية الدقيقة، ومساعدة العلماء على فهم العمليات المسببة للأمراض بشكل أفضل من وجهة النظر هذه.
عندما يتم تطبيق علم الجينوم والنسخ على مجتمعات ميكروبية بأكملها، فإننا نستخدم مصطلحي الميتاجينوميات وعلم الوراثة، على التوالي. تسمح الميتاجينوميات وعلم الوراثة للباحثين بدراسة الجينات والتعبير الجيني من مجموعة من الأنواع المتعددة، والتي قد لا يكون من السهل استزراع العديد منها أو استزراعها على الإطلاق في المختبر. يمكن استخدام مصفوفة DNA الدقيقة (التي تمت مناقشتها في القسم السابق) في دراسات الميتاجينوميات.
ومن التطبيقات السريرية الصاعدة الأخرى لعلم الجينوم والنسخات علم الجينوم الدوائي، والذي يُطلق عليه أيضًا علم السموم الجيني، والذي يتضمن تقييم فعالية الأدوية وسلامتها على أساس المعلومات المستمدة من التسلسل الجينومي للفرد. يمكن دراسة الاستجابات الجينومية للأدوية باستخدام الحيوانات التجريبية (مثل الفئران المختبرية أو الفئران) أو الخلايا الحية في المختبر قبل الشروع في الدراسات مع البشر. يمكن أن تكون التغييرات في التعبير الجيني في وجود الدواء في بعض الأحيان مؤشرًا مبكرًا على احتمالية حدوث تأثيرات سامة. يمكن استخدام معلومات تسلسل الجينوم الشخصي يومًا ما لوصف الأدوية التي ستكون أكثر فعالية وأقل سمية على أساس النمط الجيني للمريض الفردي.
تعد دراسة البروتيوميات امتدادًا لعلم الجينوم الذي يسمح للعلماء بدراسة المكمل الكامل للبروتينات في كائن حي يسمى البروتيوم. على الرغم من أن جميع خلايا الكائن الحي متعدد الخلايا لها نفس مجموعة الجينات، فإن الخلايا في الأنسجة المختلفة تنتج مجموعات مختلفة من البروتينات. وبالتالي، فإن الجينوم ثابت، لكن البروتين يختلف وهو ديناميكي داخل الكائن الحي. يمكن استخدام البروتيوميات لدراسة البروتينات التي يتم التعبير عنها تحت ظروف مختلفة داخل نوع خلية واحدة أو لمقارنة أنماط التعبير البروتيني بين الكائنات الحية المختلفة.
المرض الأبرز الذي تتم دراسته باستخدام الأساليب البروتينية هو السرطان، ولكن يتم تطبيق مجال الدراسة هذا أيضًا على الأمراض المعدية. يجري البحث حاليًا لدراسة جدوى استخدام الأساليب البروتينية لتشخيص أنواع مختلفة من التهاب الكبد والسل وعدوى فيروس نقص المناعة البشرية، والتي يصعب تشخيصها باستخدام التقنيات المتاحة حاليًا. 1
يعتمد التحليل البروتيني الحديث والمتطور على تحديد البروتينات التي تسمى المؤشرات الحيوية، والتي يتأثر تعبيرها بعملية المرض. تُستخدم المؤشرات الحيوية حاليًا للكشف عن أشكال مختلفة من السرطان وكذلك العدوى التي تسببها مسببات الأمراض مثل Yersinia pestis وفيروس Vaccinia. 2
تشمل العلوم «-omic» الأخرى المتعلقة بالجينوم والبروتيوميات علم الأيض والجلوكوز والدهون، والتي تركز على المجموعة الكاملة من مستقلبات الجزيئات الصغيرة والسكريات والدهون، على التوالي، الموجودة داخل الخلية. من خلال هذه الأساليب العالمية المختلفة، يواصل العلماء جمع وتجميع وتحليل كميات كبيرة من المعلومات الجينية. يمكن استخدام هذا المجال الناشئ من المعلوماتية الحيوية، من بين العديد من التطبيقات الأخرى، للحصول على أدلة لعلاج الأمراض وفهم عمل الخلايا.
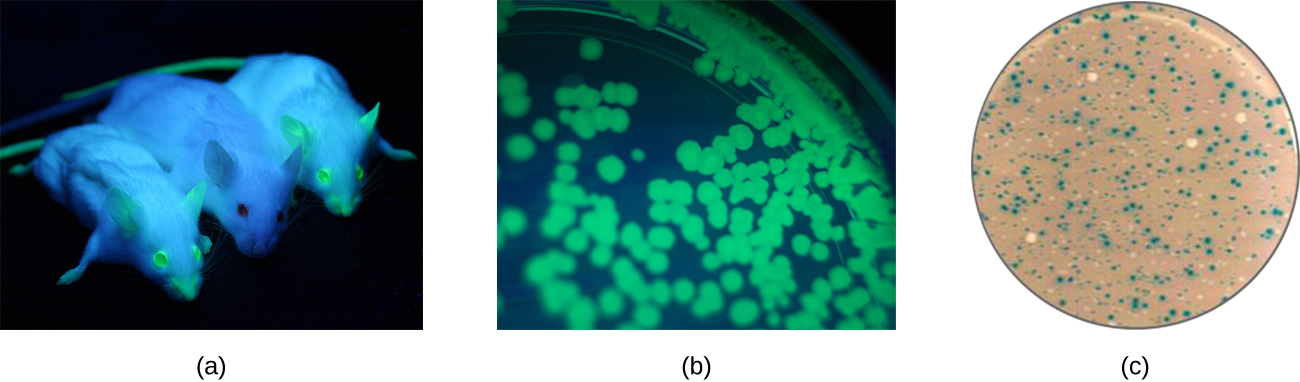
بالإضافة إلى ذلك، يمكن للباحثين استخدام علم الوراثة العكسي، وهو أسلوب متعلق بالتحليل الطفري الكلاسيكي، لتحديد وظيفة جينات معينة. تضمنت الطرق الكلاسيكية لدراسة وظيفة الجينات البحث عن الجينات المسؤولة عن نمط ظاهري معين. يستخدم علم الوراثة العكسي النهج المعاكس، بدءًا من تسلسل الحمض النووي المحدد ومحاولة تحديد النمط الظاهري الذي ينتجه. بدلاً من ذلك، يمكن للعلماء ربط الجينات المعروفة (تسمى جينات المراسل) التي تشفر الخصائص التي يمكن ملاحظتها بسهولة بالجينات ذات الاهتمام، ويمكن مراقبة موقع التعبير عن هذه الجينات ذات الاهتمام بسهولة. وهذا يعطي الباحث معلومات مهمة حول ما قد يفعله المنتج الجيني أو مكان وجوده في الكائن الحي. تشمل جينات المراسل الشائعة بكتيريا LaCz، التي تقوم بترميز بيتا غالاكتوزيداز والتي يمكن مراقبة نشاطها من خلال التغيرات في لون المستعمرة في وجود X-gal كما هو موضح سابقًا، والجين الذي يشفر بروتين قناديل البحر والبروتين الفلوري الأخضر (GFP) الذي يمكن تصور نشاطه في المستعمرات تحت التعرض للأشعة فوق البنفسجية (الشكل\(\PageIndex{1}\)).
التمارين\(\PageIndex{1}\)
- كيف يختلف علم الجينوم عن علم الوراثة التقليدي؟
- إذا كنت ترغب في دراسة كيفية استجابة خليتين مختلفتين في الجسم للعدوى، فما مجال علم الجينوم الذي ستطبقه؟
- ما هي المؤشرات الحيوية المكتشفة في البروتيوميات المستخدمة؟
التركيز السريري: القرار
نظرًا لأن أعراض كايلا كانت مستمرة وخطيرة بما يكفي للتدخل في الأنشطة اليومية، قرر طبيب كايلا طلب بعض الاختبارات المعملية. جمع الطبيب عينات من دم كايلا والسائل النخاعي (CSF) والسائل الزليلي (من إحدى ركبتيها المتورمتين) وطلب تحليل PCR على العينات الثلاث. جاءت اختبارات PCR على السائل النخاعي والسائل الزليلي إيجابية لوجود Borrelia burgdorferi، وهي البكتيريا التي تسبب مرض لايم.
وصف طبيب كايلا على الفور دورة كاملة من المضاد الحيوي الدوكسيسيكلين. لحسن الحظ، تعافت كايلا تمامًا في غضون بضعة أسابيع ولم تعاني من الأعراض طويلة المدى لمتلازمة مرض لايم بعد العلاج (PTLDS)، والتي تصيب 10-20٪ من مرضى مرض لايم. لمنع العدوى في المستقبل، نصحها طبيب كايلا باستخدام طارد الحشرات وارتداء ملابس واقية خلال مغامراتها في الهواء الطلق. يمكن لهذه الإجراءات أن تحد من التعرض للقراد الحامل لللايم، وهو أمر شائع في العديد من مناطق الولايات المتحدة خلال الأشهر الأكثر دفئًا من العام. كما نُصحت كايلا بالاعتياد على فحص نفسها بحثًا عن القراد بعد عودتها من الأنشطة الخارجية، حيث أن الإزالة الفورية للقراد تقلل بشكل كبير من فرص الإصابة.
غالبًا ما يصعب تشخيص مرض لايم. لا يتم زراعة B. burgdorferi بسهولة في المختبر، ويمكن أن تكون الأعراض الأولية خفيفة جدًا وتشبه أعراض العديد من الأمراض الأخرى. ولكن إذا تُركت الأعراض دون علاج، فقد تصبح شديدة جدًا وموهنة. بالإضافة إلى اختبارين للأجسام المضادة، لم يكونا حاسمين في حالة كايلا، واختبار PCR، يمكن استخدام البقعة الجنوبية مع مجسات الحمض النووي الخاصة بـ B. burgdorferi لتحديد الحمض النووي من العامل الممرض. يتم أيضًا استخدام تسلسل جينات البروتين السطحي لأنواع بوريليا لتحديد السلالات داخل الأنواع التي قد تنتقل بسهولة إلى البشر أو تسبب مرضًا أكثر خطورة.
تقنية الحمض النووي المؤتلف وإنتاج الأدوية
قدمت الهندسة الوراثية طريقة لإنشاء منتجات صيدلانية جديدة تسمى أدوية الحمض النووي المؤتلف. وتشمل هذه المنتجات أدوية المضادات الحيوية واللقاحات والهرمونات المستخدمة لعلاج الأمراض المختلفة. \(\PageIndex{1}\)يسرد الجدول أمثلة لمنتجات الحمض النووي المؤتلف واستخداماتها.
على سبيل المثال، يمكن تعديل مسارات تخليق المضادات الحيوية التي تحدث بشكل طبيعي لمختلف Streptomyces spp.، المعروفة منذ فترة طويلة بقدراتها على إنتاج المضادات الحيوية، لتحسين الإنتاجية أو لإنشاء مضادات حيوية جديدة من خلال إدخال جينات ترميز إنزيمات إضافية. تم إنتاج أكثر من 200 مضاد حيوي جديد من خلال التعطيل المستهدف للجينات والمزيج الجديد من جينات تخليق المضادات الحيوية في مضيفي Streptomyces المنتجين للمضادات الحيوية. 3
تُستخدم الهندسة الوراثية أيضًا لتصنيع لقاحات الوحدة الفرعية، والتي تعتبر أكثر أمانًا من اللقاحات الأخرى لأنها تحتوي على جزيء مستضد واحد فقط وتفتقر إلى أي جزء من جينوم العامل الممرض (انظر اللقاحات). على سبيل المثال، يتم إنتاج لقاح التهاب الكبد B عن طريق إدخال جين يشفر البروتين السطحي لالتهاب الكبد B في الخميرة؛ ثم تنتج الخميرة هذا البروتين، الذي يتعرف عليه جهاز المناعة البشري كمستضد. يتم تنقية مستضد التهاب الكبد B من مزارع الخميرة ويتم إعطاؤه للمرضى كلقاح. على الرغم من أن اللقاح لا يحتوي على فيروس التهاب الكبد B، فإن وجود البروتين المستضدي يحفز الجهاز المناعي لإنتاج أجسام مضادة تحمي المريض من الفيروس في حالة التعرض. 4 5
كانت الهندسة الوراثية مهمة أيضًا في إنتاج البروتينات العلاجية الأخرى، مثل الأنسولين والإنترفيرون وهرمون النمو البشري، لعلاج مجموعة متنوعة من الحالات الطبية البشرية. على سبيل المثال، في وقت من الأوقات، كان من الممكن علاج مرض السكري فقط عن طريق إعطاء المرضى أنسولين الخنازير، مما تسبب في ردود فعل تحسسية بسبب الاختلافات الصغيرة بين البروتينات المعبر عنها في الأنسولين البشري والأنسولين الخنزيري. ومع ذلك، منذ عام 1978، تم استخدام تقنية الحمض النووي المؤتلف لإنتاج كميات كبيرة من الأنسولين البشري باستخدام E. coli في عملية غير مكلفة نسبيًا تنتج منتجًا صيدلانيًا أكثر فعالية باستمرار. قام العلماء أيضًا بهندسة E. coli وراثيًا القادرة على إنتاج هرمون النمو البشري (HGH)، والذي يستخدم لعلاج اضطرابات النمو لدى الأطفال وبعض الاضطرابات الأخرى عند البالغين. تم استنساخ جين هرمون النمو من مكتبة cDNA وإدخاله في خلايا E. coli عن طريق استنساخه إلى ناقل بكتيري. في نهاية المطاف، سيتم استخدام الهندسة الوراثية لإنتاج لقاحات الحمض النووي والعلاجات الجينية المختلفة، وكذلك الأدوية المخصصة لمكافحة السرطان والأمراض الأخرى.
| منتج الحمض النووي المؤتلف | تطبيق |
|---|---|
| ببتيد ناتريوتريك الأذيني | علاج أمراض القلب (مثل فشل القلب الاحتقاني) وأمراض الكلى وارتفاع ضغط الدم |
| DNase | علاج إفرازات الرئة اللزجة في التليف الكيسي |
| إرثروبويتين | علاج فقر الدم الشديد مع تلف الكلى |
| العامل الثامن | علاج الهيموفيليا |
| لقاح التهاب الكبد B | الوقاية من عدوى التهاب الكبد B |
| هرمون النمو البشري | علاج نقص هرمون النمو ومتلازمة تيرنر والحروق |
| إنسولين بشري | علاج مرض السكري |
| إنترفيرون | علاج التصلب المتعدد والسرطانات المختلفة (مثل سرطان الجلد) والالتهابات الفيروسية (مثل التهاب الكبد B و C) |
| تيتراسينومايسين | تستخدم كمضادات حيوية |
| منشط بلازمينوجين للأنسجة | علاج الانسداد الرئوي في السكتة الإقفارية واحتشاء عضلة القلب |
التمارين\(\PageIndex{2}\)
- ما هي البكتيريا التي تم هندستها وراثيًا لإنتاج الأنسولين البشري لعلاج مرض السكري؟
- اشرح كيف يمكن تصميم الكائنات الحية الدقيقة لإنتاج اللقاحات.
تقنية تداخل الرنا
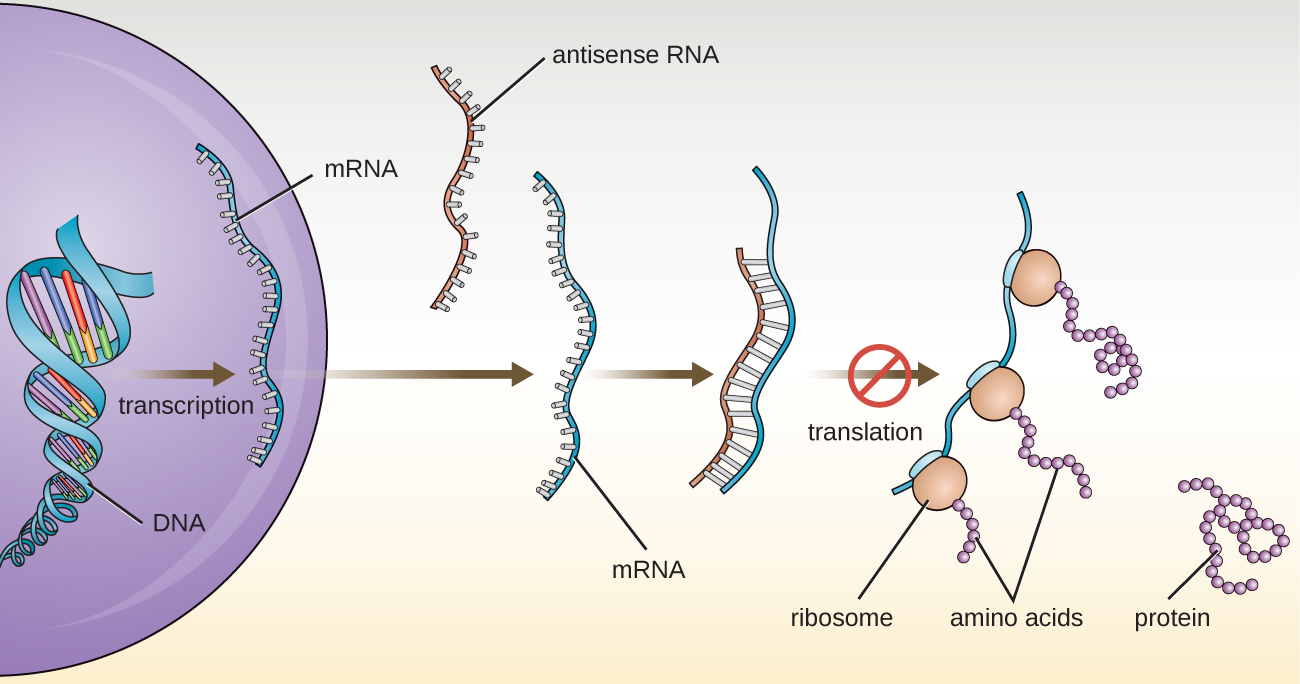
في هيكل ووظيفة الحمض النووي الريبي، وصفنا وظيفة mRNA و rRNA و tRNA. بالإضافة إلى هذه الأنواع من الحمض النووي الريبي، تنتج الخلايا أيضًا عدة أنواع من جزيئات الحمض النووي الريبي الصغيرة غير المشفرة التي تشارك في تنظيم التعبير الجيني. وتشمل هذه جزيئات الحمض النووي الريبي المضادة للتحسس، والتي تكمل مناطق جزيئات mRNA المحددة الموجودة في كل من بدائيات النواة والخلايا حقيقية النواة. تلعب جزيئات الحمض النووي الريبي غير المشفرة دورًا رئيسيًا في تداخل الحمض النووي الريبي (RNAi)، وهي آلية تنظيمية طبيعية يتم من خلالها منع جزيئات mRNA من توجيه تخليق البروتينات. ينتج تداخل الحمض النووي الريبي لجينات معينة عن الاقتران الأساسي لجزيئات الحمض النووي الريبي المضاد للحس القصيرة أحادية السلسلة إلى مناطق داخل جزيئات mRNA التكميلية، مما يمنع تخليق البروتين. تستخدم الخلايا تداخل الحمض النووي الريبي لحماية نفسها من الغزو الفيروسي، مما قد يؤدي إلى إدخال جزيئات الحمض النووي الريبي المزدوجة كجزء من عملية التكاثر الفيروسي (الشكل\(\PageIndex{2}\)).
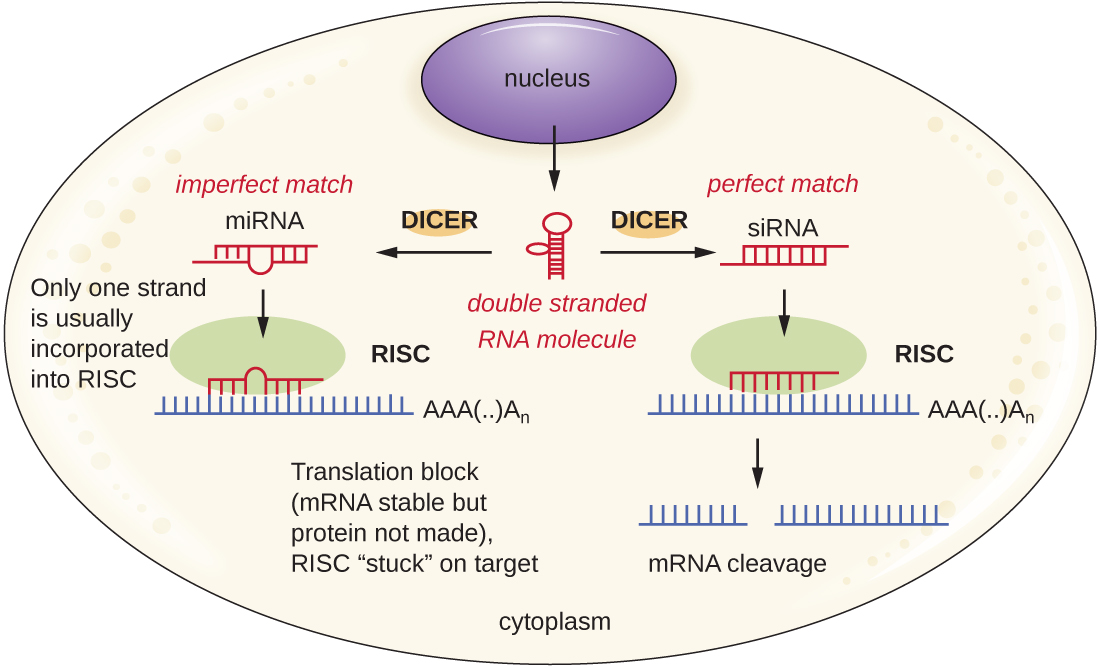
يعمل الباحثون حاليًا على تطوير تقنيات لمحاكاة العملية الطبيعية لتداخل الحمض النووي الريبي كطريقة لعلاج الالتهابات الفيروسية في الخلايا حقيقية النواة. تتضمن تقنية تداخل الحمض النووي الريبي استخدام الرنا الصغيرة المتداخلة (SiRNAs) أو microRNAs (mIRNAs\(\PageIndex{3}\)) (الشكل). تعد SIRNAs مكملة تمامًا لنسخة mRNA لجين معين ذي أهمية بينما تكون miRNAs مكملة في الغالب. ترتبط هذه الحمض النووي الريبي المزدوج بـ DICER، وهو نواة داخلية تقسم الحمض النووي الريبي إلى جزيئات قصيرة (يبلغ طولها حوالي 20 نيوكليوتيدًا). ثم يتم ربط الحمض النووي الريبي بمركب إسكات الحمض النووي الريبي (RISC)، وهو بروتين ريبونوكليوبروتين. يرتبط مجمع Sirna-risc بـ mRNA ويشققه. بالنسبة لـ miRNA، يرتبط واحد فقط من الخطين بـ RISC. ثم يرتبط مجمع mirna-risc بـ mRNA، مما يمنع الترجمة. إذا كان mIRNA مكملاً تمامًا للجين المستهدف، فيمكن شق mRNA. وتُعرف هذه الآليات مجتمعة باسم إسكات الجينات.
المفاهيم الأساسية والملخص
- يسمح علم الجينوم للباحثين بدراسة الكائنات الحية على مستوى شامل وله العديد من التطبيقات ذات الصلة الطبية.
- تسمح عمليات النسخ والبروتيوميات للباحثين بمقارنة أنماط التعبير الجيني بين الخلايا المختلفة وتظهر وعدًا كبيرًا في فهم الاستجابات العالمية بشكل أفضل لظروف مختلفة.
- تكمل تقنيات علم الأحياء المختلفة بعضها البعض وتوفر معًا صورة أكثر اكتمالًا لحالة الكائن الحي أو المجتمع الميكروبي (الميتاجينوميكس).
- أدى التحليل المطلوب لمجموعات البيانات الكبيرة المنتجة من خلال علم الجينوم والنسخ والبروتيوميات إلى ظهور المعلوماتية الحيوية.
- تُستخدم جينات المراسل التي تقوم بترميز الخصائص التي يمكن ملاحظتها بسهولة لتتبع أنماط التعبير الجيني للجينات ذات الوظيفة غير المعروفة.
- أدى استخدام تقنية الحمض النووي المؤتلف إلى إحداث ثورة في صناعة الأدوية، مما سمح بالإنتاج السريع لأدوية الحمض النووي المؤتلف عالية الجودة المستخدمة لعلاج مجموعة متنوعة من الحالات البشرية.
- تتمتع تقنية تداخل الحمض النووي الريبي بوعد كبير كطريقة لعلاج الالتهابات الفيروسية عن طريق إسكات التعبير عن جينات معينة.
الحواشي
- (1) E.O. List و D.E. Beryman و B. Bower و L. Sackman-Sala و E. Gosney و J. Ding و S. Okada و J.J. Kopchick. «استخدام البروتيوميات لدراسة الأمراض المعدية». الاضطرابات المعدية - أهداف الأدوية (الأهداف الدوائية الحالية سابقًا - الاضطرابات المعدية) رقم 8 (2008): 31-45.
- 2 موهان ناتيسان وروبرت جي أولريش. «المصفوفات الدقيقة للبروتين والمؤشرات الحيوية للأمراض المعدية». المجلة الدولية للعلوم الجزيئية 11 رقم 12 (2010): 5165-5183.
- (3) خوسيه لويس أدريو وأرنولد إل ديمين. «الكائنات الحية المؤتلفة لإنتاج المنتجات الصناعية». الأخطاء المعدلة بيولوجيًا رقم 1 رقم 2 (2010): 116-131.
- 4 وزارة الصحة والخدمات الإنسانية الأمريكية. «أنواع اللقاحات». 2013. www.vaccines.gov/more_info/types/ #subunit. تم الوصول إليه في 27 مايو 2016.
- 5 قائمة أدوية الإنترنت. ريمبيفاكس. 2015. http://www.rxlist.com/recombivax-drug.htm. تم الوصول إليه في 27 مايو 2016.


