12.2: تصور وتوصيف الحمض النووي
- Page ID
- 195326
أهداف التعلم
- اشرح استخدام مجسات الحمض النووي لتصور تسلسلات الحمض النووي المحددة
- اشرح استخدام الرحلان الكهربي الهلامي لفصل أجزاء الحمض النووي
- شرح مبدأ التقييد (طول الشظية) وتحليل تعدد الأشكال واستخداماته
- قارن وقارن بين البقع الجنوبية والشمالية
- شرح مبادئ واستخدامات تحليل المصفوفة الدقيقة
- وصف الطرق المستخدمة لفصل متغيرات البروتين وتصورها
- شرح طريقة واستخدامات تفاعل البوليميراز المتسلسل وتسلسل الحمض النووي
يمكن أن يساعدنا تسلسل جزيء الحمض النووي في تحديد الكائن الحي عند مقارنته بالتسلسلات المعروفة الموجودة في قاعدة البيانات. يمكن أن يخبرنا التسلسل أيضًا بشيء عن وظيفة جزء معين من الحمض النووي، مثل ما إذا كان يقوم بتشفير بروتين معين. تعد مقارنة توقيعات البروتين - مستويات التعبير عن صفائف معينة من البروتينات - بين العينات طريقة مهمة لتقييم الاستجابات الخلوية للعديد من العوامل البيئية والضغوط. يمكن أن يكشف تحليل بصمات البروتين عن هوية الكائن الحي أو كيفية استجابة الخلية أثناء المرض.
الحمض النووي والبروتينات ذات الأهمية مجهرية وعادة ما يتم خلطها مع العديد من الجزيئات الأخرى بما في ذلك الحمض النووي أو البروتينات غير ذات الصلة باهتماماتنا. تم تطوير العديد من التقنيات لعزل وتوصيف الجزيئات ذات الاهتمام. تم تطوير هذه الأساليب في الأصل لأغراض البحث، ولكن في كثير من الحالات تم تبسيطها لدرجة أن الاستخدام السريري الروتيني ممكن. على سبيل المثال، يمكن اكتشاف العديد من مسببات الأمراض، مثل بكتيريا Helicobacter pylori، التي تسبب قرحة المعدة، باستخدام الاختبارات القائمة على البروتين. بالإضافة إلى ذلك، يمكن الآن لعدد متزايد من فحوصات تحديد الهوية المحددة والدقيقة للغاية القائمة على تضخيم الحمض النووي الكشف عن مسببات الأمراض مثل البكتيريا المعوية المقاومة للمضادات الحيوية وفيروس الهربس البسيط وفيروس الحماق النطاقي وغيرها الكثير.
التحليل الجزيئي للحمض النووي
في هذا القسم الفرعي، سنحدد بعض الطرق الأساسية المستخدمة لفصل وتصور أجزاء معينة من الحمض النووي التي تهم العالم. لا تتطلب بعض هذه الطرق معرفة التسلسل الكامل لجزيء الحمض النووي. قبل ظهور التسلسل السريع للحمض النووي، كانت هذه الطرق هي الوحيدة المتاحة للعمل مع الحمض النووي، لكنها لا تزال تشكل الترسانة الأساسية للأدوات التي يستخدمها علماء الوراثة الجزيئية لدراسة استجابات الجسم للأمراض الميكروبية وغيرها من الأمراض.
فحص الحمض النووي
جزيئات الحمض النووي صغيرة، والمعلومات الواردة في تسلسلها غير مرئية. كيف يقوم الباحث بعزل امتداد معين من الحمض النووي، أو بعد عزله، وتحديد الكائن الحي الذي ينتمي إليه، وما هو تسلسله، أو وظيفته؟ تستخدم إحدى طرق تحديد وجود تسلسل معين من الحمض النووي قطعًا مصطنعة من الحمض النووي تسمى المجسات. يمكن استخدام المجسات لتحديد الأنواع البكتيرية المختلفة في البيئة والعديد من مجسات الحمض النووي متاحة الآن للكشف عن مسببات الأمراض سريريًا. على سبيل المثال، تُستخدم مجسات الحمض النووي للكشف عن مسببات الأمراض المهبلية المبيضات البيضاء والغاردنريلا المهبلية والتريكوموناس فاجيناليس.
لفحص مكتبة الجينوم بحثًا عن جين معين أو تسلسل اهتمام معين، يجب أن يعرف الباحثون شيئًا عن هذا الجين. إذا كان لدى الباحثين جزء من تسلسل الحمض النووي للجين محل الاهتمام، فيمكنهم تصميم مسبار الحمض النووي، وهو جزء من الحمض النووي أحادي الجديلة يكمل جزءًا من الجين محل الاهتمام ويختلف عن تسلسلات الحمض النووي الأخرى في العينة. يمكن تصنيع مسبار الحمض النووي كيميائيًا بواسطة المختبرات التجارية، أو قد يتم إنشاؤه عن طريق استنساخ جزء من الحمض النووي وعزله وتشويهه من كائن حي. في كلتا الحالتين، يجب تسمية مسبار الحمض النووي بعلامة جزيئية أو منارة، مثل ذرة الفوسفور المشعة (كما هو مستخدم في التصوير الشعاعي الذاتي) أو صبغة الفلورسنت (كما هو مستخدم في التهجين الفلوري في الموقع، أو FISH)، بحيث يمكن رؤية المسبار والحمض النووي الذي يرتبط به (الشكل 1) \(\PageIndex{1}\)). يجب أيضًا تغيير طبيعة عينة الحمض النووي التي يتم فحصها لجعلها أحادية الشريط بحيث يمكن لمسبار الحمض النووي أحادي الجديلة أن يصلب إلى عينة الحمض النووي أحادية الجديلة في المواقع التي تكون فيها تسلسلاتها مكملة. في حين أن هذه التقنيات مفيدة للتشخيص، إلا أن استخدامها المباشر على البلغم وعينات الجسم الأخرى قد يمثل مشكلة بسبب الطبيعة المعقدة لهذه العينات. غالبًا ما يجب عزل الحمض النووي أولاً من عينات الجسم من خلال طرق الاستخراج الكيميائي قبل استخدام مسبار الحمض النووي لتحديد مسببات الأمراض.
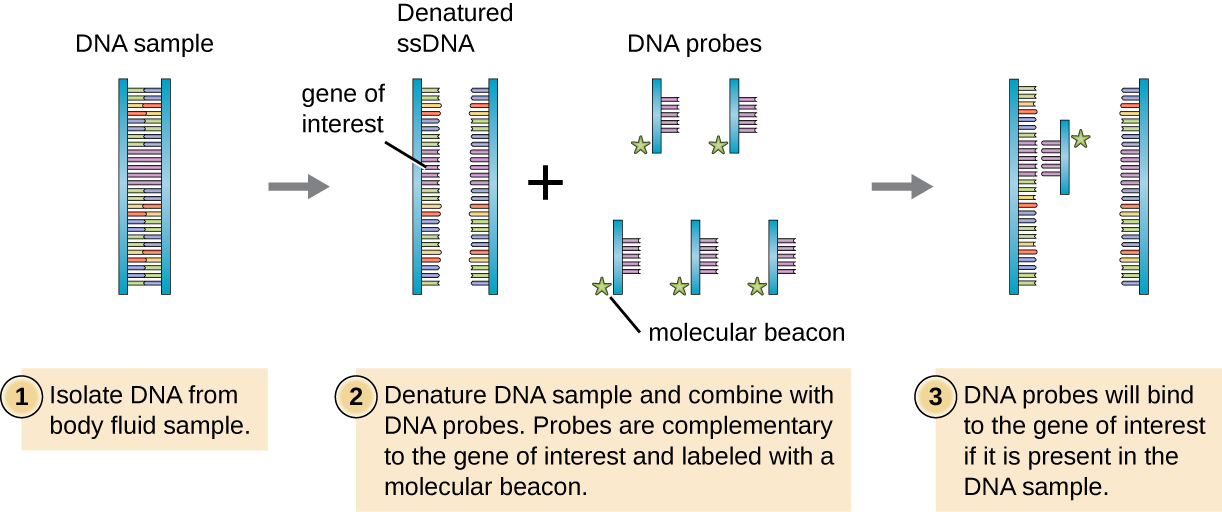
التركيز السريري: الجزء 2
يمكن أن تكون الأعراض الخفيفة الشبيهة بالإنفلونزا التي تعاني منها كايلا ناتجة عن أي عدد من العوامل المعدية. بالإضافة إلى ذلك، فإن العديد من حالات المناعة الذاتية غير المعدية، مثل التصلب المتعدد، والذئبة الحمامية الجهازية (SLE)، والتصلب الجانبي الضموري (ALS)، لها أيضًا أعراض تتوافق مع أعراض كايلا المبكرة. ومع ذلك، على مدار عدة أسابيع، تفاقمت أعراض كايلا. بدأت تعاني من آلام المفاصل في ركبتيها وخفقان القلب وعرج غريب في عضلات وجهها. بالإضافة إلى ذلك، عانت من تيبس الرقبة وصداع مؤلم. على مضض، قررت أن الوقت قد حان لطلب الرعاية الطبية.
التمارين\(\PageIndex{1}\)
- هل تقدم أعراض كايلا الجديدة أي أدلة على نوع العدوى أو أي حالة طبية أخرى قد تكون مصابة بها؟
- ما الاختبارات أو الأدوات التي قد يستخدمها مقدم الرعاية الصحية لتحديد العامل الممرض الذي يسبب أعراض كايلا؟
الرحلان الكهربي لجل أغاروز
هناك عدد من الحالات التي قد يرغب فيها الباحث في فصل مجموعة من أجزاء الحمض النووي بأحجام مختلفة ماديًا. يمكن للباحث أيضًا هضم عينة الحمض النووي باستخدام إنزيم تقييدي لتكوين أجزاء. يمكن أن ينتج عن الحجم الناتج ونمط توزيع الأجزاء غالبًا معلومات مفيدة حول تسلسل قواعد الحمض النووي التي يمكن استخدامها، مثل مسح الباركود، لتحديد الفرد أو النوع الذي ينتمي إليه الحمض النووي.
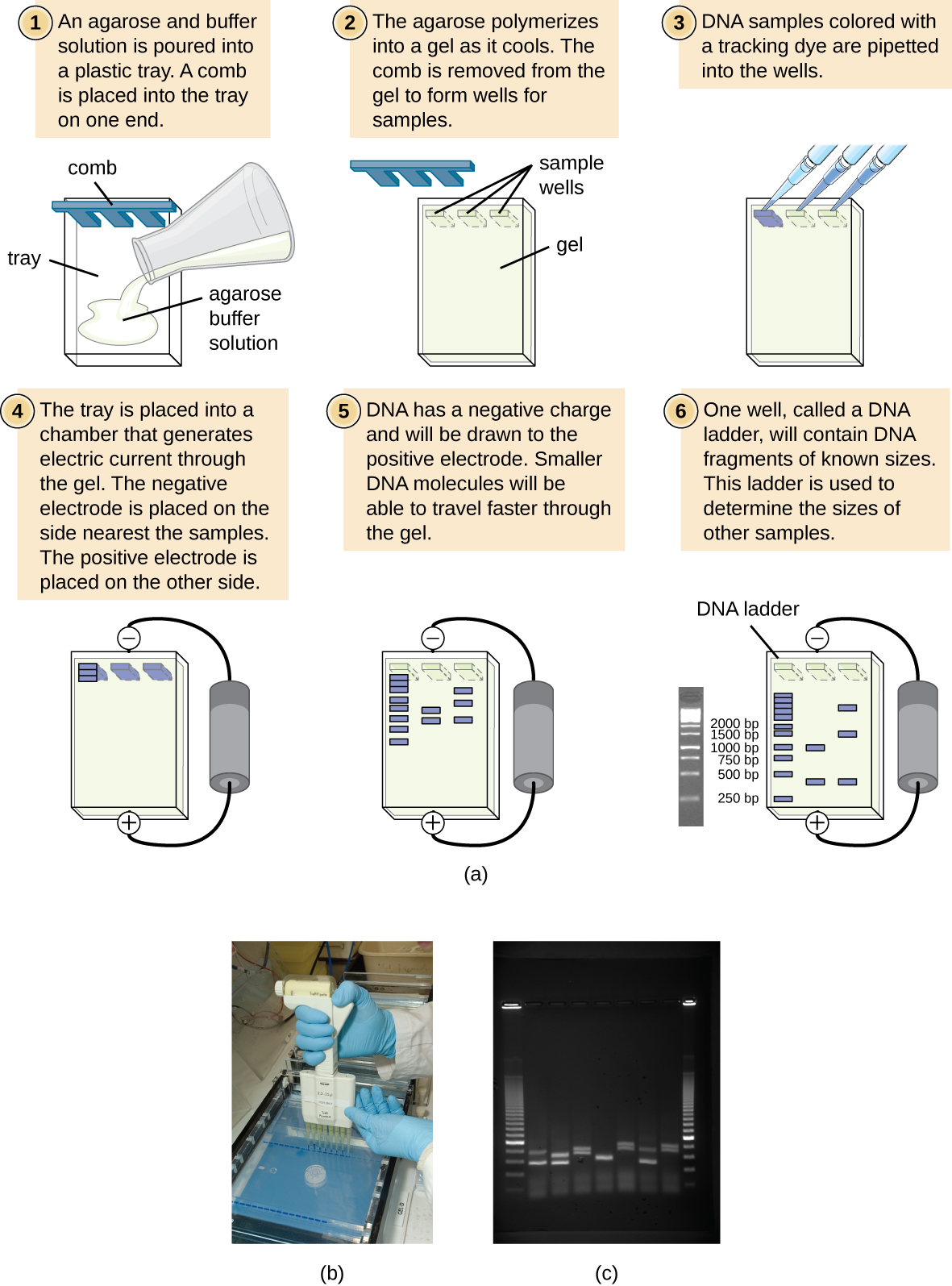
يعتبر الرحلان الكهربي الهلامي تقنية شائعة الاستخدام لفصل الجزيئات البيولوجية بناءً على الحجم والخصائص البيوكيميائية، مثل الشحنة والقطبية. يستخدم الرحلان الكهربائي لجل Agarose على نطاق واسع لفصل الحمض النووي (أو RNA) بأحجام مختلفة قد تتولد عن طريق هضم إنزيم التقييد أو بوسائل أخرى، مثل PCR (الشكل\(\PageIndex{2}\)).
بسبب العمود الفقري المشحون سلبًا، ينجذب الحمض النووي بشدة إلى القطب الموجب. في الرحلان الكهربي لجل الأغاروز، يتم توجيه الجل أفقيًا في محلول عازل. يتم تحميل العينات في آبار العينات على جانب الجل الأقرب إلى القطب السالب، ثم يتم سحبها من خلال المنخل الجزيئي لمصفوفة الأغاروز باتجاه القطب الموجب. تعيق مصفوفة الأغاروز حركة الجزيئات الأكبر عبر الجل، بينما تمر الجزيئات الصغيرة بسهولة أكبر. وبالتالي، ترتبط مسافة الهجرة ارتباطًا عكسيًا بحجم جزء الحمض النووي، حيث تنتقل الأجزاء الصغيرة مسافة أطول عبر الجل. يمكن تقدير أحجام شظايا الحمض النووي داخل العينة من خلال المقارنة مع الأجزاء ذات الحجم المعروف في سلم الحمض النووي الذي يعمل أيضًا على نفس الجل. لفصل أجزاء الحمض النووي الكبيرة جدًا، مثل الكروموسومات أو الجينومات الفيروسية، يمكن تعديل الرحلان الكهربائي لهلام الأغاروز عن طريق التناوب الدوري لاتجاه المجال الكهربائي أثناء الرحلان الكهربي للمجال النبضي (PFGE). في PFGE، يمكن للشظايا الصغيرة إعادة توجيه نفسها والانتقال بشكل أسرع قليلاً من الأجزاء الأكبر حجمًا، وبالتالي يمكن أن تعمل هذه التقنية على فصل الأجزاء الكبيرة جدًا التي قد تنتقل معًا أثناء الرحلان الكهربائي القياسي لجل الأغاروز. في أي من تقنيات الرحلان الكهربائي هذه، يمكن اكتشاف مواقع شظايا الحمض النووي أو الحمض النووي الريبي في الجل بطرق مختلفة. إحدى الطرق الشائعة هي إضافة بروميد الإيثيديوم، وهي بقعة تدخل في الأحماض النووية في مواقع غير محددة ويمكن تصورها عند التعرض للأشعة فوق البنفسجية. تتوفر الآن بقع أخرى أكثر أمانًا من بروميد الإيثيديوم، وهو مادة مسرطنة محتملة.
تحليل تعدد أشكال طول جزء التقييد (RFLP)
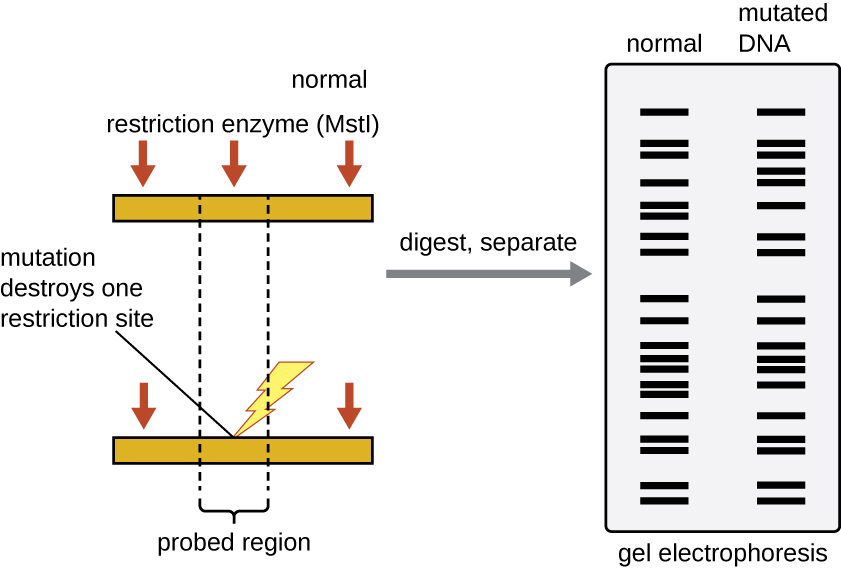
مواقع التعرف على إنزيم التقييد قصيرة (يبلغ طولها بضعة نيوكليوتيدات فقط)، ومتشابهات خاصة بالتسلسل، ويمكن العثور عليها في جميع أنحاء الجينوم. وبالتالي، فإن الاختلافات في تسلسل الحمض النووي في جينومات الأفراد ستؤدي إلى اختلافات في توزيع مواقع التعرف على الإنزيمات المقيدة التي يمكن تصورها كأنماط نطاقات مميزة على الجل بعد الرحلان الكهربائي لجل الأغاروز. يقارن تحليل تعدد الأشكال في طول جزء التقييد (RFLP) أنماط نطاقات الحمض النووي لعينات الحمض النووي المختلفة بعد هضم التقييد (الشكل\(\PageIndex{3}\)).
يحتوي تحليل RFLP على العديد من التطبيقات العملية في كل من الطب وعلوم الطب الشرعي. على سبيل المثال، يستخدم علماء الأوبئة تحليل RFLP لتتبع وتحديد مصدر الكائنات الحية الدقيقة المحددة المتورطة في تفشي التسمم الغذائي أو بعض الأمراض المعدية. يمكن أيضًا استخدام تحليل RFLP على الحمض النووي البشري لتحديد أنماط وراثة الكروموسومات ذات الجينات المتغيرة، بما في ذلك تلك المرتبطة بالأمراض القابلة للتوريث أو لإثبات الأبوة.
يستخدم علماء الطب الشرعي تحليل RFLP كشكل من أشكال أخذ بصمات الحمض النووي، وهو مفيد لتحليل الحمض النووي الذي تم الحصول عليه من مسرح الجريمة والمشتبه بهم والضحايا. يتم جمع عينات الحمض النووي، ويتم زيادة عدد نسخ جزيئات الحمض النووي العينة باستخدام PCR، ثم يتم إخضاعها لتقييد هضم الإنزيم والترشيد الكهربائي لجل الأغاروز لتوليد أنماط نطاقات محددة. من خلال مقارنة أنماط النطاقات للعينات التي تم جمعها من مسرح الجريمة مع تلك التي تم جمعها من المشتبه بهم أو الضحايا، يمكن للمحققين تحديد ما إذا كانت أدلة الحمض النووي التي تم جمعها في مكان الحادث قد تركها المشتبه بهم أو الضحايا.
البقع الجنوبية والتعديلات
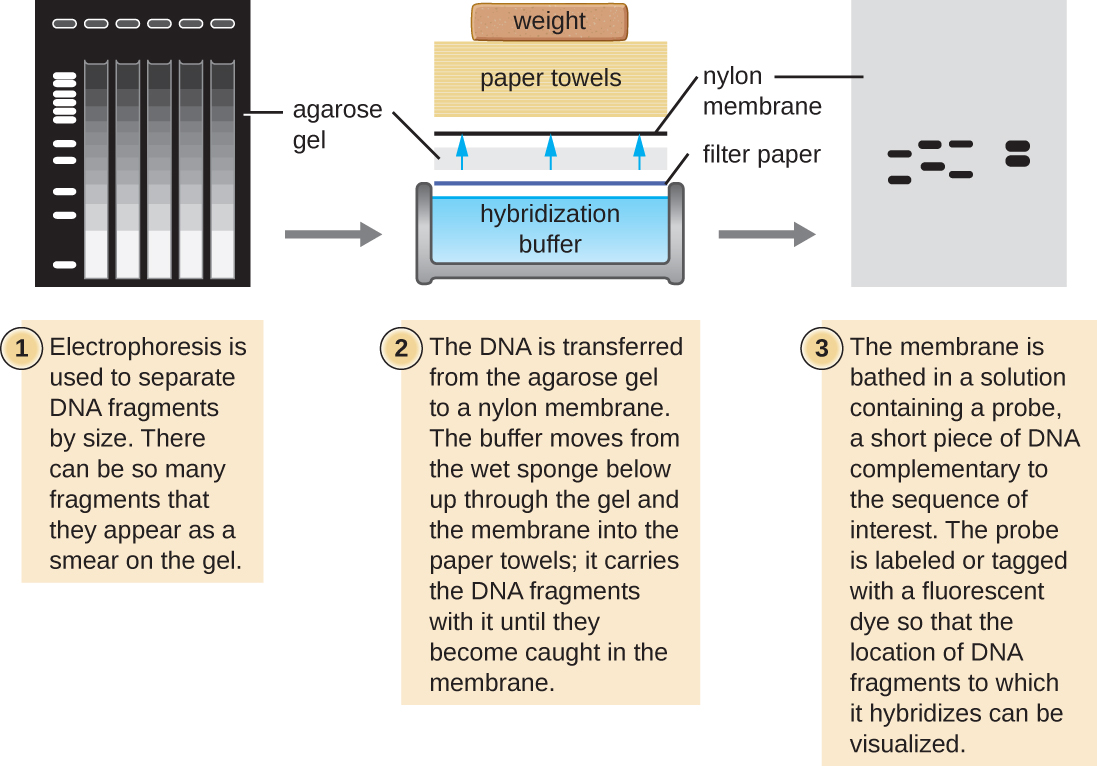
تستفيد العديد من التقنيات الجزيئية من تكامل التسلسل والتهجين بين الأحماض النووية للعينة ومجسات الحمض النووي. عادةً ما يكون فحص عينات الحمض النووي داخل الجل غير ناجح لأنه عندما يتغلغل مسبار الحمض النووي في الجل، تنتشر عينة الأحماض النووية داخل الجل. وبالتالي، تُستخدم تقنيات النشاف بشكل شائع لنقل الأحماض النووية إلى غشاء رقيق وإيجابي الشحنة مصنوع من النيتروسليلوز أو النايلون. في تقنية البقع الجنوبية، التي طورها السير إدوين ساوثرن في عام 1975، يتم فصل أجزاء الحمض النووي داخل العينة أولاً عن طريق الرحلان الكهربائي لهلام الأغاروز ثم يتم نقلها إلى الغشاء من خلال عمل الشعيرات الدموية (الشكل\(\PageIndex{4}\)). ثم تتعرض أجزاء الحمض النووي التي ترتبط بسطح الغشاء لمسبار DNA محدد أحادي الجديلة مُصنَّف بمنارة جزيئية مشعة أو فلورية للمساعدة في الكشف. يمكن استخدام البقع الجنوبية للكشف عن وجود تسلسلات معينة من الحمض النووي في عينة DNA معينة. بمجرد تصور الحمض النووي المستهدف داخل الغشاء، يمكن للباحثين قطع جزء الغشاء الذي يحتوي على الجزء لاستعادة جزء الحمض النووي المهم.
لا تتضمن الاختلافات في البقعة الجنوبية - البقعة النقطية، وصمة الفتحة، والنشاف البقعي - الرحلان الكهربائي، ولكنها بدلاً من ذلك تركز الحمض النووي من عينة إلى موقع صغير على الغشاء. بعد التهجين باستخدام مسبار الحمض النووي، يتم قياس شدة الإشارة المكتشفة، مما يسمح للباحث بتقدير كمية الحمض النووي المستهدف الموجود داخل العينة.
بقعة المستعمرة هي شكل آخر من البقع الجنوبية حيث يتم نقل المستعمرات التي تمثل مستنسخات مختلفة في مكتبة الجينوم إلى الغشاء عن طريق الضغط على الغشاء على لوحة الاستزراع. يتم تحلل الخلايا الموجودة على الغشاء ويمكن بعد ذلك فحص الغشاء لتحديد المستعمرات داخل المكتبة الجينومية التي تؤوي الجين المستهدف. نظرًا لأن المستعمرات الموجودة على اللوحة لا تزال تنمو، يمكن عزل الخلايا ذات الأهمية عن اللوحة.
في البقعة الشمالية، هناك نوع آخر من اللطخة الجنوبية، وهو الحمض النووي الريبي (وليس الحمض النووي) يتم تثبيته على الغشاء وفحصه. تُستخدم البقع الشمالية عادةً للكشف عن كمية الحمض النووي الريبي المصنوع من خلال التعبير الجيني داخل عينة الأنسجة أو الكائن الحي.
تحليل ميكروأراي
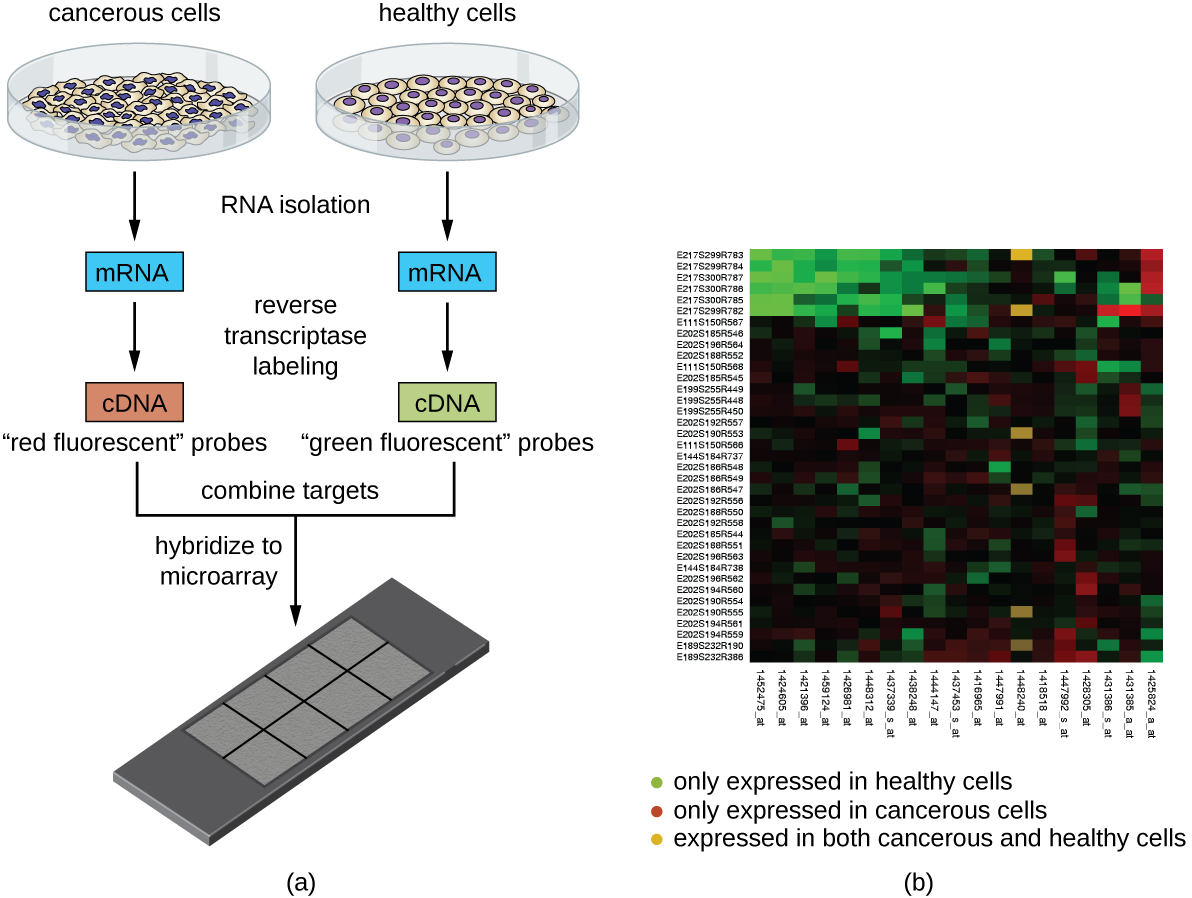
هناك أسلوب آخر يستفيد من التهجين بين تسلسلات الأحماض النووية التكميلية يسمى تحليل المصفوفة الدقيقة. يعد تحليل المصفوفة الدقيقة مفيدًا لمقارنة أنماط التعبير الجيني بين أنواع الخلايا المختلفة - على سبيل المثال، الخلايا المصابة بفيروس مقابل الخلايا غير المصابة، أو الخلايا السرطانية مقابل الخلايا السليمة (الشكل\(\PageIndex{5}\)).
عادةً ما يتم ترسيب الحمض النووي أو cDNA من عينة تجريبية على شريحة زجاجية جنبًا إلى جنب مع تسلسلات الحمض النووي المعروفة. يمكن أن تحتوي كل شريحة على أكثر من 30000 نوع مختلف من أجزاء الحمض النووي. يمكن رصد أجزاء الحمض النووي المميزة (التي تشمل المكتبة الجينومية الكاملة للكائن الحي) أو أجزاء cDNA (المقابلة للمكملات الكاملة للكائن الحي من الجينات المعبر عنها) بشكل فردي على شريحة زجاجية.
بمجرد إيداعه على الشريحة، يمكن عزل الحمض النووي الجيني أو mRNA من العينتين للمقارنة. إذا تم عزل mRNA، يتم نسخه عكسيًا إلى cDNA باستخدام النسخ العكسي. ثم يتم تصنيف عينتي الحمض النووي الجيني أو cDNA بأصباغ فلورية مختلفة (عادةً ما تكون حمراء وخضراء). يتم بعد ذلك دمج عينات الحمض النووي الجيني المصنفة بكميات متساوية، وإضافتها إلى شريحة المصفوفة الدقيقة، والسماح لها بالتهجين إلى نقاط تكميلية على المصفوفة الدقيقة.
يمكن مراقبة التهجين لعينة جزيئات الحمض النووي الجيني عن طريق قياس شدة الفلورة في نقاط معينة على المصفوفة الدقيقة. يمكن ملاحظة الاختلافات في كمية التهجين بين العينات بسهولة. إذا تم تهجين الأحماض النووية لعينة واحدة فقط إلى بقعة معينة على المصفوفة الدقيقة، فستظهر تلك البقعة إما باللون الأخضر أو الأحمر. ومع ذلك، إذا تم تهجين الأحماض النووية في كلتا العينتين، فستظهر البقعة باللون الأصفر بسبب مزيج الأصباغ الحمراء والخضراء.
على الرغم من أن تقنية microarray تسمح بإجراء مقارنة شاملة بين عينتين في وقت قصير، إلا أنها تتطلب معدات كشف متطورة (ومكلفة) وبرامج تحليل. بسبب التكلفة، تقتصر هذه التقنية عادةً على إعدادات البحث. استخدم الباحثون تحليل المصفوفة الدقيقة لدراسة كيفية تأثر التعبير الجيني في الكائنات الحية المصابة بالبكتيريا أو الفيروسات أو التي تخضع لعلاجات كيميائية معينة.
استكشف تقنية الرقائق الدقيقة في هذا الموقع التفاعلي.
التمارين\(\PageIndex{2}\)
- ما الذي يتكون منه مسبار الحمض النووي؟
- لماذا يتم استخدام اللطخة الجنوبية بعد الرحلان الكهربي الهلامي لهضم الحمض النووي؟
التحليل الجزيئي للبروتينات
في كثير من الحالات، قد لا يكون من المرغوب أو الممكن دراسة الحمض النووي أو الحمض النووي الريبي مباشرة. يمكن أن توفر البروتينات معلومات خاصة بالأنواع لتحديد الهوية بالإضافة إلى معلومات مهمة حول كيفية استجابة الخلية أو الأنسجة لوجود الكائنات الحية الدقيقة المسببة للأمراض وما إذا كانت. تتطلب البروتينات المختلفة طرقًا مختلفة للعزل والتوصيف.
بولي أكريلاميد جل إليكتروفوريسيس
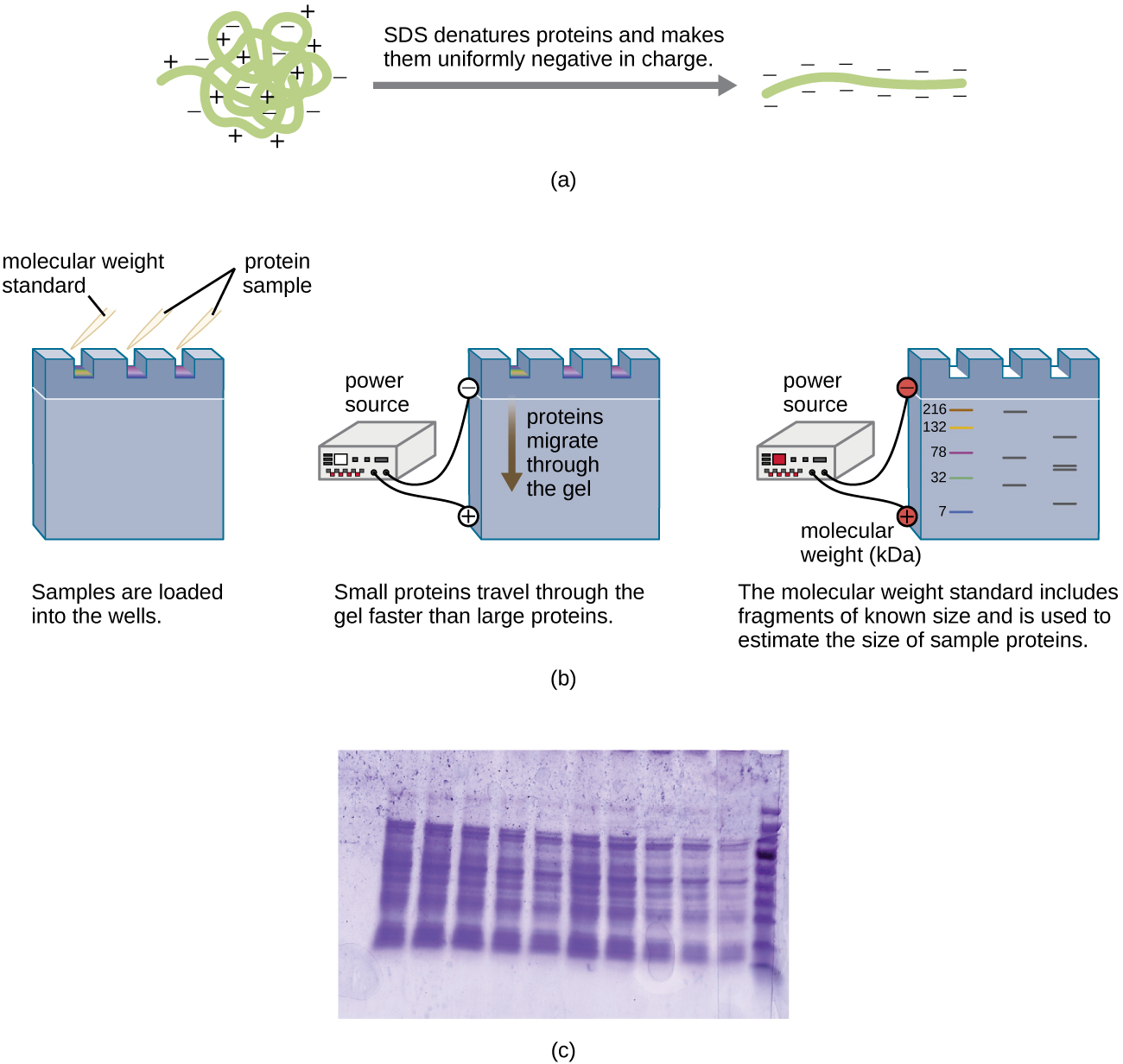
يشيع استخدام نوع مختلف من الرحلان الكهربي الهلامي، يسمى الرحلان الكهربي لجل بولي أكريلاميد (PAGE)، لفصل البروتينات. في PAGE، تكون مصفوفة الجل أكثر دقة وتتكون من بولي أكريلاميد بدلاً من الآغاروز. بالإضافة إلى ذلك، يتم إجراء PAGE عادةً باستخدام جهاز جل عمودي (الشكل\(\PageIndex{6}\)). بسبب الشحنات المختلفة المرتبطة بالسلاسل الجانبية للأحماض الأمينية، يمكن استخدام PAGE لفصل البروتينات السليمة بناءً على شحناتها الصافية. بدلاً من ذلك، يمكن تغيير طبيعة البروتينات وتغليفها بمنظف سالب الشحنة يسمى كبريتات دوديسيل الصوديوم (SDS)، مما يخفي الشحنات الأصلية ويسمح بالفصل بناءً على الحجم فقط. يمكن تعديل PAGE بشكل إضافي لفصل البروتينات بناءً على خاصيتين، مثل شحناتها عند درجات الحموضة المختلفة بالإضافة إلى حجمها، من خلال استخدام PAGE ثنائي الأبعاد. في أي من هذه الحالات، بعد الرحلان الكهربائي، يتم تصوير البروتينات من خلال التلوين، عادةً باستخدام بقعة كوماسي الزرقاء أو الفضية.
التمارين\(\PageIndex{3}\)
على أي أساس يتم فصل البروتينات في SDS-PAGE؟
التركيز السريري: الجزء 3
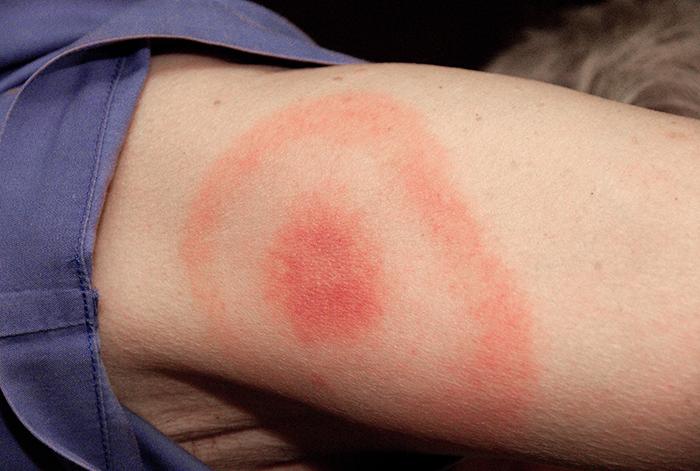
عندما وصفت كايلا أعراضها، اشتبه طبيبها في البداية في التهاب السحايا الجرثومي، وهو ما يتفق مع صداعها وتيبس الرقبة. ومع ذلك، سرعان ما استبعدت ذلك كاحتمال لأن التهاب السحايا عادة ما يتطور بسرعة أكبر مما كانت تعاني منه كايلا. لا تزال العديد من أعراضها موازية لأعراض التصلب الجانبي الضموري (ALS) والذئبة الحمامية الجهازية (SLE)، واعتبر الطبيب أيضًا مرض لايم احتمالًا نظرًا لمقدار الوقت الذي تقضيه كايلا في الغابة. لم تتذكر كايلا أي لدغات قراد حديثة (الوسيلة النموذجية التي ينتقل بها مرض لايم) ولم يكن لديها طفح عين الثور النموذجي المرتبط بمرض لايم (الشكل\(\PageIndex{7}\)). ومع ذلك، فإن 20-30٪ من المرضى الذين يعانون من مرض لايم لا يصابون بهذا الطفح الجلدي أبدًا، لذلك لم يرغب الطبيب في استبعاده.
طلب طبيب كايلا إجراء تصوير بالرنين المغناطيسي لدماغها، وتعداد الدم الكامل لاختبار فقر الدم، واختبارات الدم لتقييم وظائف الكبد والكلى، واختبارات إضافية لتأكيد أو استبعاد مرض الذئبة الحمراء أو مرض لايم. كانت نتائج اختبارها غير متسقة مع كل من SLE و ALS، وكانت نتيجة اختبار البحث عن الأجسام المضادة لمرض لايم «ملتبسة»، مما يعني أنها غير حاسمة. بعد استبعاد ALS و SLE، قرر طبيب كايلا إجراء اختبارات إضافية لمرض لايم.
التمارين\(\PageIndex{4}\)
- لماذا لا يزال طبيب كايلا يشك في مرض لايم حتى لو لم تكشف نتائج الاختبار عن الأجسام المضادة لمرض لايم في الدم؟
- ما نوع الاختبار الجزيئي الذي يمكن استخدامه للكشف عن الأجسام المضادة في الدم لمرض لايم؟
طرق تحليل الحمض النووي القائمة على التضخيم
يمكن استخدام طرق مختلفة للحصول على تسلسلات الحمض النووي، والتي تعتبر مفيدة لدراسة الكائنات الحية المسببة للأمراض. مع ظهور تقنية التسلسل السريع، نمت قاعدة معرفتنا بجينومات الكائنات المسببة للأمراض بالكامل بشكل هائل. نبدأ بوصف تفاعل البوليميراز المتسلسل، وهو ليس طريقة للتسلسل ولكنه سمح للباحثين والأطباء بالحصول على كميات كبيرة من الحمض النووي اللازمة للتسلسل والدراسات الأخرى. يزيل تفاعل البوليميراز المتسلسل اعتمادنا السابق على الخلايا لعمل نسخ متعددة من الحمض النووي، مما يحقق نفس النتيجة من خلال تفاعلات بسيطة نسبيًا خارج الخلية.
تفاعل البوليميراز المتسلسل (PCR)
تتطلب معظم طرق تحليل الحمض النووي، مثل هضم إنزيم التقييد والهلام الكهربي للأغاروز، أو تسلسل الحمض النووي كميات كبيرة من جزء معين من الحمض النووي. في الماضي، تم إنتاج كميات كبيرة من الحمض النووي من خلال نمو الخلايا المضيفة لمكتبة الجينوم. ومع ذلك، تستغرق المكتبات وقتًا وجهدًا للتحضير وغالبًا ما تأتي عينات الحمض النووي ذات الأهمية بكميات دقيقة. يسمح تفاعل البوليميراز المتسلسل (PCR) بالتضخيم السريع في عدد نسخ تسلسلات الحمض النووي المحددة لمزيد من التحليل (الشكل\(\PageIndex{8}\)). واحدة من أقوى التقنيات في البيولوجيا الجزيئية، تم تطوير PCR في عام 1983 من قبل كاري موليس أثناء وجودها في شركة Cetus Corporation. PCR له تطبيقات محددة في البحوث والطب الشرعي والمختبرات السريرية، بما في ذلك:
- تحديد تسلسل النيوكليوتيدات في منطقة معينة من الحمض النووي
- تضخيم المنطقة المستهدفة من الحمض النووي للاستنساخ إلى ناقل البلازميد
- تحديد مصدر عينة الحمض النووي المتبقية في مسرح الجريمة
- تحليل العينات لتحديد الأبوة
- مقارنة عينات الحمض النووي القديم مع الكائنات الحية الحديثة
- تحديد وجود الكائنات الحية الدقيقة التي يصعب استزراعها أو عدم استزراعها في البشر أو العينات البيئية
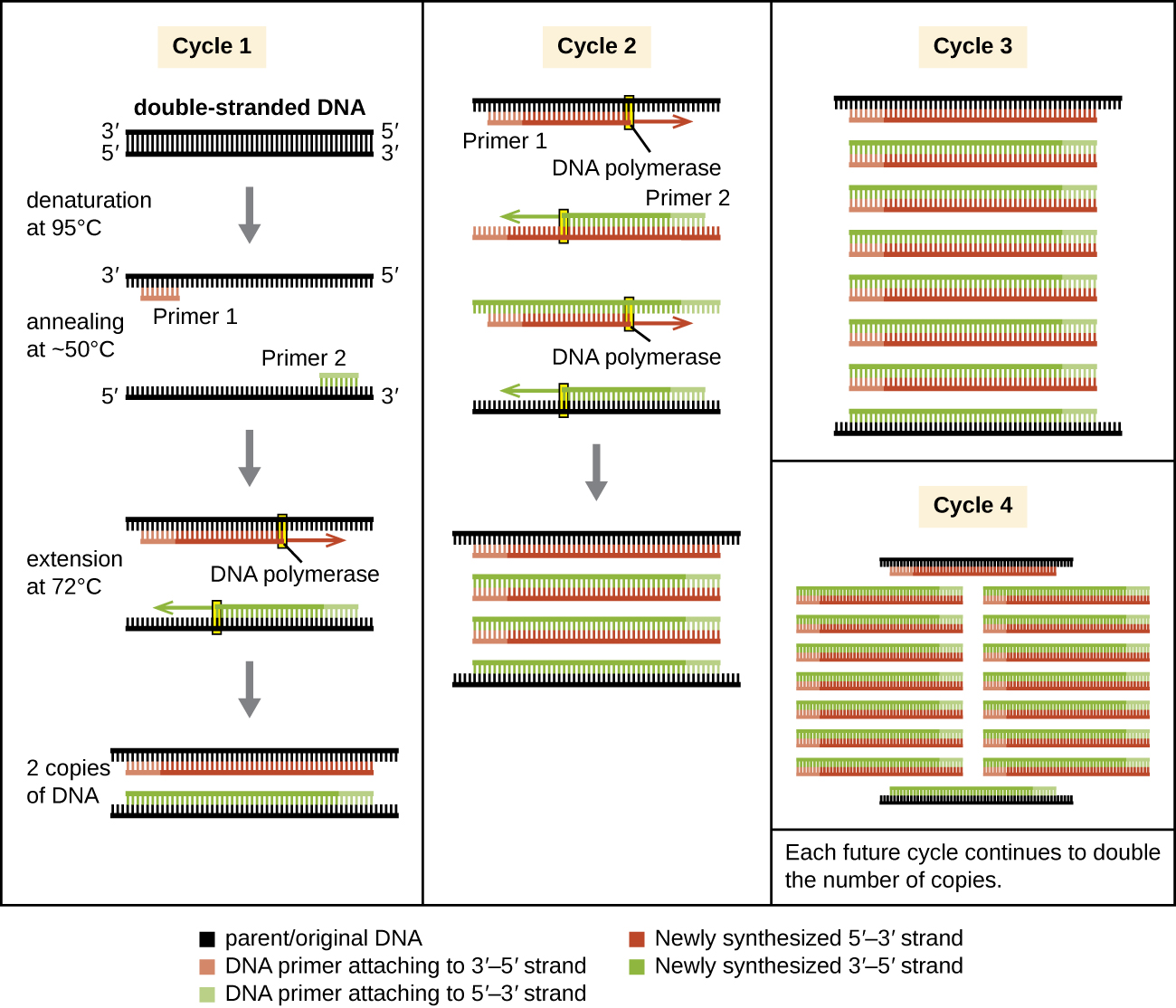
PCR هي تقنية معملية في المختبر تستفيد من العملية الطبيعية لتكرار الحمض النووي. إن إنزيمات بوليميراز الحمض النووي المستقرة للحرارة المستخدمة في PCR مشتقة من بدائيات النواة المحبة للحرارة. يُشتق بوليميراز Taq DNA، المستخدم بشكل شائع في PCR، من بكتيريا Thermus aquaticus المعزولة من الينابيع الساخنة في حديقة يلوستون الوطنية. يتطلب تكرار الحمض النووي استخدام المواد الأولية لبدء النسخ المتماثل للحصول على مجموعات 3-هيدروكسيل مجانية متاحة لإضافة النيوكليوتيدات بواسطة بوليميراز الحمض النووي. ومع ذلك، في حين أن المواد الأولية المكونة من RNA تُستخدم عادةً في الخلايا، يتم استخدام بادئات الحمض النووي لـ PCR. يُفضل استخدام بادئات الحمض النووي نظرًا لاستقرارها، ويمكن تصنيع بادئات الحمض النووي ذات التسلسلات المعروفة التي تستهدف منطقة معينة من الحمض النووي تجاريًا. تتشابه بادئات الحمض النووي هذه وظيفيًا مع مجسات الحمض النووي المستخدمة في تقنيات التهجين المختلفة الموصوفة سابقًا، وترتبط بأهداف محددة بسبب التكامل بين تسلسل الحمض النووي المستهدف والدليل التمهيدي.
يحدث PCR على مدار دورات متعددة، تحتوي كل منها على ثلاث خطوات: التمسخ والتلدين والإطالة. تُستخدم آلات تسمى الدورات الحرارية لـ PCR؛ يمكن برمجة هذه الآلات للتنقل تلقائيًا عبر درجات الحرارة المطلوبة في كل خطوة (الشكل 12.1). أولاً، يتم تغيير طبيعة الحمض النووي للقالب المزدوج الذي يحتوي على التسلسل المستهدف عند حوالي 95 درجة مئوية، ودرجة الحرارة المرتفعة المطلوبة لفصل خيوط الحمض النووي جسديًا (وليس إنزيميًا) هي السبب وراء الحاجة إلى بوليميراز الحمض النووي المستقر حراريًا. بعد ذلك، تنخفض درجة الحرارة إلى حوالي 50 درجة مئوية، مما يسمح لبادئات الحمض النووي المكملة لنهايات التسلسل المستهدف بالتصلب (الالتصاق) بخيوط القالب، مع تلدين تمهيدي واحد لكل خيط. أخيرًا، ترتفع درجة الحرارة إلى 72 درجة مئوية، وهي درجة الحرارة المثلى لنشاط بوليميراز الحمض النووي المستقر حراريًا، مما يسمح بإضافة النيوكليوتيدات إلى البرايمر باستخدام الهدف أحادي الجديلة كنموذج. تضاعف كل دورة عدد نسخ الحمض النووي المستهدفة ذات السلاسل المزدوجة. عادةً ما تتضمن بروتوكولات PCR 25-40 دورة، مما يسمح بتضخيم تسلسل هدف واحد بعشرات الملايين إلى أكثر من تريليون.
تم تصميم النسخ الطبيعي للحمض النووي لنسخ الجينوم بأكمله، ويبدأ في واحد أو أكثر من مواقع المنشأ. يتم إنشاء البادئات أثناء النسخ المتماثل، وليس قبله، ولا تتكون من بعض التسلسلات المحددة. يستهدف PCR مناطق محددة من عينة الحمض النووي باستخدام بادئات خاصة بالتسلسل. في السنوات الأخيرة، تم تطوير مجموعة متنوعة من طرق تضخيم PCR متساوية الحرارة التي تتحايل على الحاجة إلى التدوير الحراري، مع الاستفادة من البروتينات الإضافية التي تساعد في عملية تكرار الحمض النووي. مع استمرار تطوير هذه الأساليب وانتشار استخدامها في المختبرات البحثية والطب الشرعي والمختبرات السريرية، قد تصبح أجهزة التدوير الحراري قديمة.
قم بتعميق فهمك لتفاعل البوليميراز المتسلسل من خلال مشاهدة هذه الرسوم المتحركة والعمل من خلال تمرين تفاعلي.
اختلافات PCR
أدت العديد من التعديلات اللاحقة على PCR إلى زيادة فائدة هذه التقنية. يتم استخدام النسخ العكسي PCR (RT-PCR) للحصول على نسخ الحمض النووي لجزيء mRNA محدد. يبدأ RT-PCR باستخدام إنزيم النسخ العكسي لتحويل جزيئات mRNA إلى cDNA. يتم بعد ذلك استخدام cDNA كقالب لتضخيم PCR التقليدي. يمكن لـ RT-PCR اكتشاف ما إذا كان قد تم التعبير عن جين معين في عينة. تطبيق آخر حديث لـ PCR هو PCR في الوقت الفعلي، والمعروف أيضًا باسم PCR الكمي (qPCR). بروتوكولات PCR و RT-PCR القياسية ليست كمية لأن أيًا من الكواشف قد يصبح مقيدًا قبل اكتمال جميع الدورات داخل البروتوكول، ويتم تحليل العينات فقط في النهاية. نظرًا لتعذر تحديد الوقت الذي يصبح فيه كاشف معين مقيدًا في بروتوكول PCR أو RT-PCR، فلا يمكن معرفة عدد الدورات التي تم إكمالها قبل هذه النقطة، وبالتالي لا يمكن تحديد عدد جزيئات القالب الأصلية الموجودة في العينة في بداية PCR. ومع ذلك، في qPCR، يسمح استخدام الفلورة للمرء بمراقبة الزيادة في قالب مزدوج الشريط أثناء تفاعل PCR عند حدوثه. يمكن بعد ذلك استخدام بيانات الخواص الحركية هذه لتحديد مقدار التسلسل المستهدف الأصلي. أدى استخدام qPCR في السنوات الأخيرة إلى توسيع قدرات PCR، مما سمح للباحثين بتحديد عدد نسخ الحمض النووي، وأحيانًا الكائنات الحية، الموجودة في العينة. في البيئات السريرية، يتم استخدام QRT-PCR لتحديد الحمل الفيروسي في المرضى المصابين بفيروس نقص المناعة البشرية لتقييم فعالية علاجهم.
تسلسل الحمض النووي
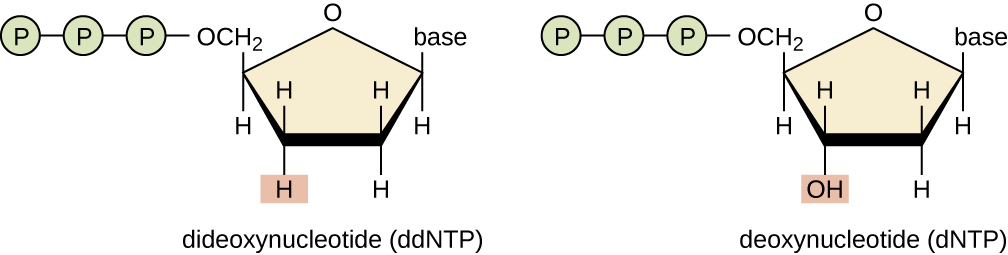
تقنية التسلسل الأساسية هي طريقة إنهاء السلسلة، والمعروفة أيضًا باسم طريقة الديديوكسي أو طريقة تسلسل الحمض النووي سانجر، التي طورها فريدريك سانجر في عام 1972. تتضمن طريقة إنهاء السلسلة تكرار الحمض النووي لقالب أحادي الشريط باستخدام مادة أولية للحمض النووي لبدء تخليق خيط مكمل، وبلمرة الحمض النووي، ومزيج من مونومرات الديوكسي نيوكليوتيد العادية الأربعة (DnTP)، ونسبة صغيرة من الديوكسي نيوكليوتيدات (DDNTPs)، كل منها يحمل علامة منارة جزيئية. DDNTPs هي مونومرات تفتقد إلى مجموعة هيدروكسيل (—OH) في الموقع الذي يرتبط فيه نيوكليوتيد آخر عادة لتشكيل سلسلة (الشكل\(\PageIndex{9}\)). في كل مرة يتم فيها دمج dDNTP عشوائيًا في الخيط التكميلي المتنامي، فإنه ينهي عملية تكرار الحمض النووي لهذا الخيط المحدد. ينتج عن هذا عدة سلاسل قصيرة من الحمض النووي المنسوخ والتي يتم إنهاء كل منها عند نقطة مختلفة أثناء النسخ المتماثل. عندما يتعرض خليط التفاعل إلى الرحلان الكهربي الهلامي، تشكل خيوط الحمض النووي المتعددة المنسوخة حديثًا سلمًا بأحجام مختلفة. نظرًا لأن DdNTPs مُصنَّف، فإن كل شريط على الجل يعكس حجم خيط الحمض النووي عندما أنهى dDNTP التفاعل.
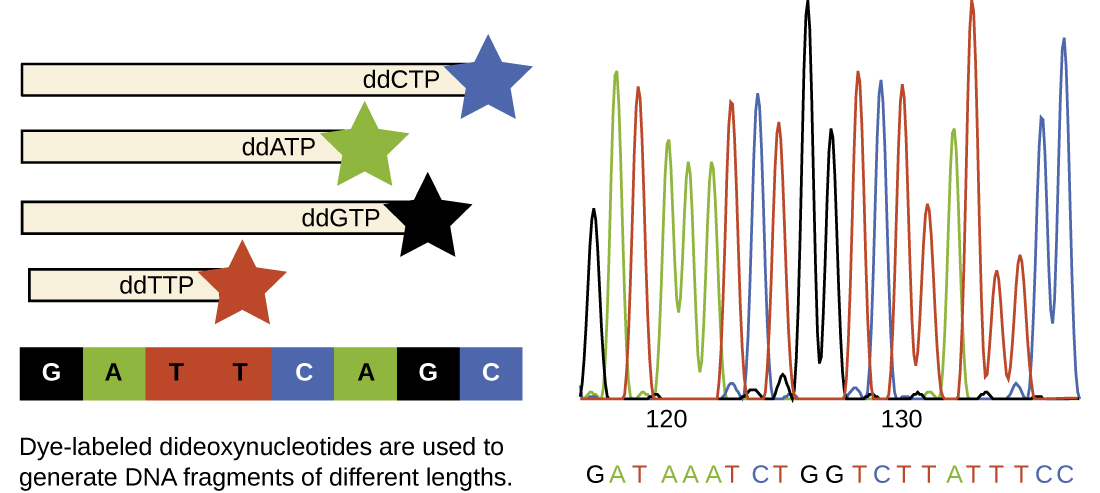
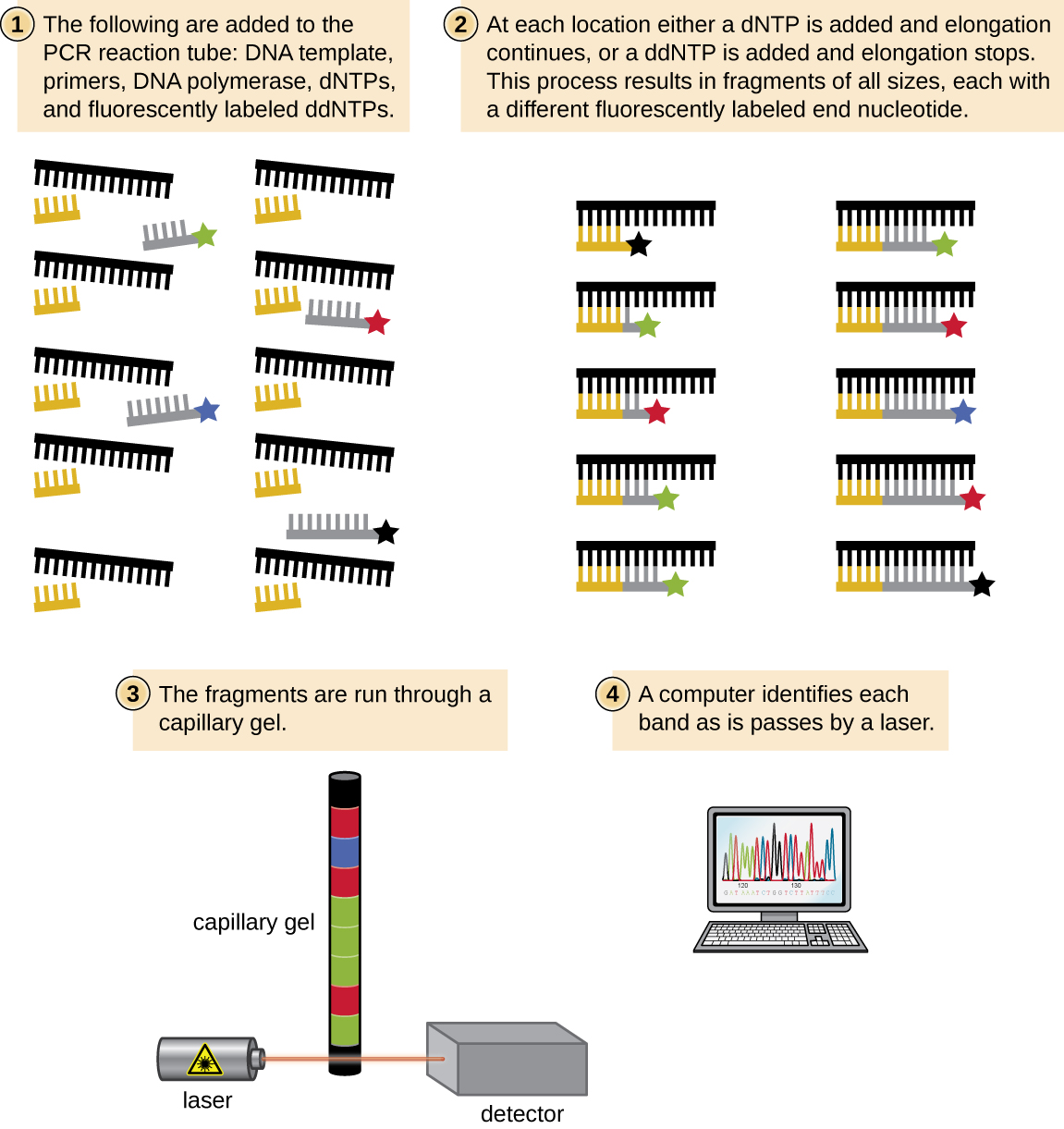
في يوم سانجر، تم إعداد أربعة تفاعلات لكل جزيء DNA يتم تسلسله، كل تفاعل يحتوي على واحد فقط من DDNTps الأربعة الممكنة. تم تصنيف كل DdNTP بجزيء الفوسفور المشع. ثم تم تشغيل نواتج التفاعلات الأربعة في حارات منفصلة جنبًا إلى جنب على جل PAGE الطويل والضيق، وتم اكتشاف النطاقات ذات الأطوال المختلفة عن طريق التصوير الشعاعي التلقائي. اليوم، تم تبسيط هذه العملية باستخدام DDNTps، كل منها مُصنّف بصبغة فلورسنت ملونة مختلفة أو فلوروكروم (الشكل\(\PageIndex{10}\))، في تفاعل تسلسلي واحد يحتوي على جميع DDNTPs الأربعة الممكنة لكل جزيء DNA يتم تسلسله (الشكل\(\PageIndex{11}\)). يتم الكشف عن هذه الفلوروكرومات عن طريق التحليل الطيفي الفلوري. ينتج عن تحديد لون الفلورة لكل نطاق أثناء مروره بواسطة الكاشف تسلسل النيوكليوتيد لخيط القالب.
منذ عام 2005، تندرج تقنيات التسلسل الآلي التي تستخدمها المختبرات تحت مظلة تسلسل الجيل التالي، وهو عبارة عن مجموعة من التقنيات الآلية المستخدمة لتسلسل الحمض النووي السريع. لقد أحدثت هذه الأساليب ثورة في مجال علم الوراثة الجزيئي لأن أجهزة التسلسل منخفضة التكلفة يمكنها توليد تسلسلات من مئات الآلاف أو الملايين من الأجزاء القصيرة (25 إلى 600 زوج أساسي) في يوم واحد فقط. على الرغم من أن العديد من المتغيرات لتقنيات التسلسل من الجيل التالي تصنعها شركات مختلفة (على سبيل المثال، التسلسل الحراري لـ 454 Life Sciences وتقنية Illumina's Solexa)، إلا أنها تسمح جميعًا بتسلسل ملايين القواعد بسرعة، مما يجعل تسلسل الجينوم بأكمله سهلًا نسبيًا وغير مكلف، وشائع. في التسلسل 454 (التسلسل الحراري)، على سبيل المثال، يتم تقسيم عينة الحمض النووي إلى أجزاء أحادية الجديلة تتراوح بين 400 و 600 نقطة في البوصة، ويتم تعديلها بإضافة محولات الحمض النووي إلى طرفي كل جزء. يتم بعد ذلك تثبيت كل جزء من الحمض النووي على حبة وتضخيمه بواسطة PCR، باستخدام مواد أولية مصممة للتصلب بالمحولات، مما يؤدي إلى تكوين حبة تحتوي على نسخ عديدة من جزء الحمض النووي هذا. ثم يتم وضع كل حبة في بئر منفصل يحتوي على إنزيمات متسلسلة. إلى البئر، تتم إضافة كل من النيوكليوتيدات الأربعة واحدة تلو الأخرى؛ وعندما يتم دمج كل منها، يتم إطلاق البيروفوسفات كمنتج ثانوي للبلمرة، مما ينبعث منه ومضة صغيرة من الضوء يتم تسجيلها بواسطة كاشف. يوفر هذا ترتيب النيوكليوتيدات المدمجة عند صنع خيط جديد من الحمض النووي وهو مثال على التسلسل التخليقي. تستخدم أجهزة التسلسل من الجيل التالي برامج متطورة لاجتياز العملية المرهقة المتمثلة في ترتيب جميع الأجزاء. بشكل عام، تستمر هذه التقنيات في التقدم بسرعة، مما يقلل من تكلفة التسلسل ويزيد من توافر بيانات التسلسل من مجموعة متنوعة من الكائنات الحية بسرعة.
يضم المركز الوطني لمعلومات التكنولوجيا الحيوية قاعدة بيانات للتسلسل الجيني مستخدمة على نطاق واسع تسمى GenBankحيث يقوم الباحثون بإيداع المعلومات الجينية للاستخدام العام. عند نشر بيانات التسلسل، يقوم الباحثون بتحميلها إلى GenBank، مما يتيح للباحثين الآخرين الوصول إلى المعلومات. يسمح التعاون للباحثين بمقارنة معلومات تسلسل العينات المكتشفة حديثًا أو غير المعروفة مع مجموعة واسعة من بيانات التسلسل الموجودة بالفعل.
شاهد رسمًا متحركًا حول تسلسل 454 لتعميق فهمك لهذه الطريقة.
استخدام NAAT لتشخيص عدوى C. العسيرة
عاد خافيير، وهو مريض يبلغ من العمر 80 عامًا وله تاريخ من أمراض القلب، مؤخرًا إلى المنزل من المستشفى بعد خضوعه لعملية رأب الأوعية لإدخال دعامة في شريان القلب. لتقليل احتمالية الإصابة بالعدوى، تم إعطاء خافيير المضادات الحيوية الوريدية واسعة الطيف أثناء الإجراء وبعده بفترة وجيزة. تم إطلاق سراحه بعد أربعة أيام من العملية، ولكن بعد أسبوع، بدأ يعاني من تشنج خفيف في البطن وإسهال مائي عدة مرات في اليوم. فقد شهيته، وأصيب بالجفاف الشديد، وأصيب بالحمى. كما لاحظ وجود دم في برازه. اتصلت زوجة خافيير بالطبيب الذي أمرها بأخذه إلى غرفة الطوارئ على الفور.
أجرى طاقم المستشفى عدة اختبارات ووجد أن مستويات الكرياتينين في الكلى لدى خافيير مرتفعة مقارنة بمستويات دمه، مما يشير إلى أن كليتيه لا تعملان بشكل جيد. تشير أعراض خافيير إلى احتمال الإصابة بعدوى بكتيريا كلوستريديوم ديفيسيل، وهي بكتيريا مقاومة للعديد من المضادات الحيوية. قام المستشفى بجمع وزرع عينة من البراز للبحث عن إنتاج السموم A و B بواسطة C. dificile، لكن النتائج جاءت سلبية. ومع ذلك، لم تكن النتائج السلبية كافية لاستبعاد عدوى المطثية العسيرة لأن زراعة المطثية العسيرة والكشف عن السموم المميزة لها يمكن أن تكون صعبة، خاصة في بعض أنواع العينات. لكي يكونوا آمنين، شرعوا في اختبار تشخيصي لتضخيم الحمض النووي (NAAT). تعد NaATs حاليًا المعيار الذهبي لأخصائي التشخيص السريري للكشف عن المواد الوراثية لمسببات الأمراض. في حالة خافيير، تم استخدام qPCR للبحث عن الجين الذي يشفر C. difile toxin B (TcDb). عندما جاء تحليل qPCR إيجابيًا، خلص الطبيب المعالج إلى أن خافيير كان يعاني بالفعل من عدوى المطثية العسيرة ووصف على الفور المضاد الحيوي فانكومايسين، ليتم إعطاؤه عن طريق الوريد. أزال المضاد الحيوي العدوى وتعافى خافيير تمامًا.
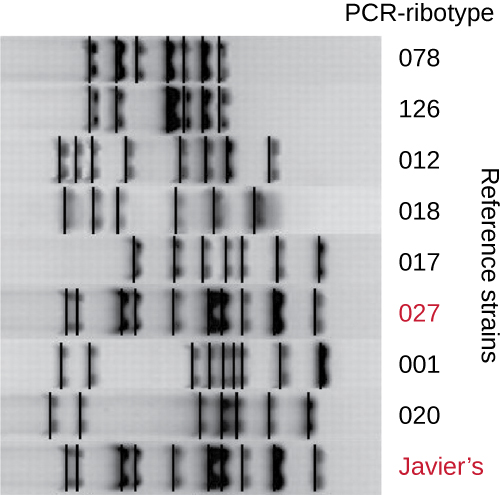
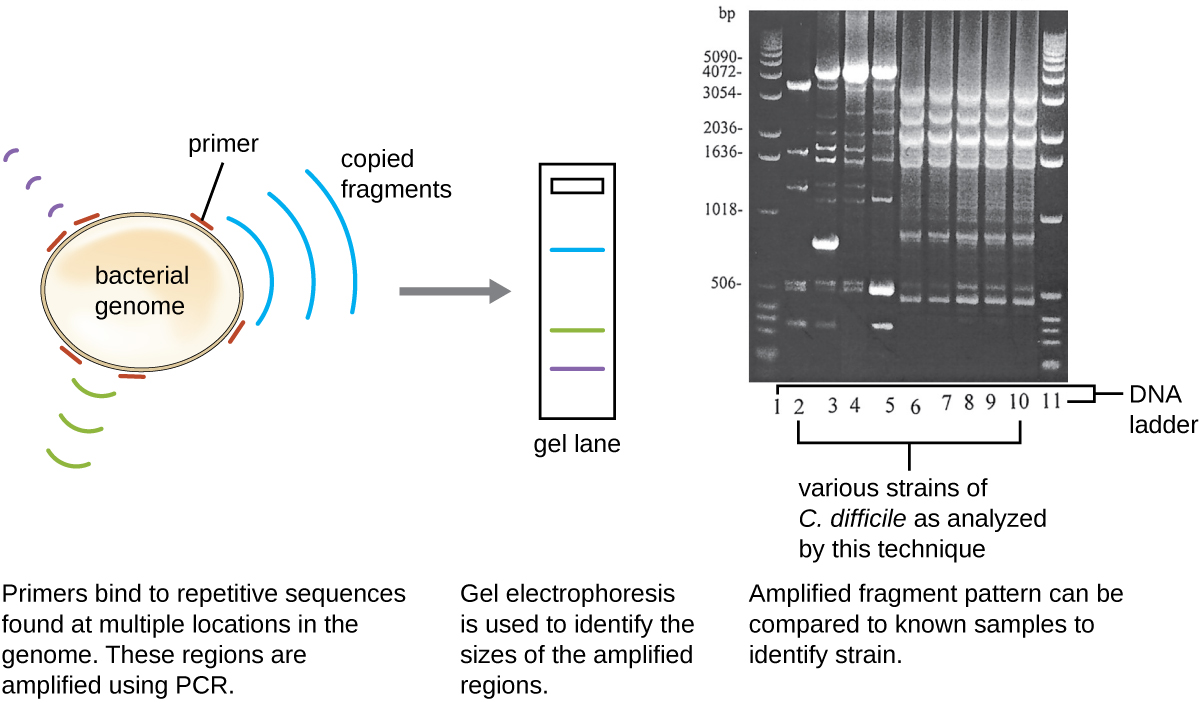
نظرًا لانتشار العدوى بـ C. dificile على نطاق واسع في مجتمع خافيير، تم تحليل العينة الخاصة به لمعرفة ما إذا كان من الممكن تحديد السلالة المحددة من C. dificile. تم إخضاع عينة براز خافيير للتنميط الريبوزي وتحليل PCR القائم على التسلسل المتكرر (REP-PCR). في التنميط الريبوزي، يتم تضخيم تسلسل قصير من الحمض النووي بين جينات RRNA 16S و 23S rRNA وتعريضه لعملية هضم مقيدة (الشكل\(\PageIndex{12}\)). ويختلف هذا التسلسل بين سلالات المطثية العسيرة، لذا فإن إنزيمات التقييد ستنخفض في أماكن مختلفة. في Rep-PCR، تم استخدام بادئات الحمض النووي المصممة للربط بالتسلسلات القصيرة الشائعة المتكررة داخل جينوم C. العسيرة في PCR. بعد الهضم المقيد، تم إجراء الرحلان الكهربائي لجل الأغاروز في كلا النوعين من التحليل لفحص أنماط النطاقات التي نتجت عن كل إجراء (الشكل\(\PageIndex{13}\)). يمكن استخدام REP-PCR لمزيد من الأنواع الفرعية المختلفة من أنواع الريبوبات، مما يزيد من الدقة للكشف عن الاختلافات بين السلالات. وُجد أن النمط الريبي للسلالة التي تصيب خافيير هو النمط الريبوتايب 27، وهي سلالة معروفة بزيادة ضراوتها ومقاومتها للمضادات الحيوية وزيادة انتشارها في الولايات المتحدة وكندا واليابان وأوروبا. 1
التمارين\(\PageIndex{5}\)
- كيف تختلف أنماط النطاقات بين سلالات المطثية العسيرة؟
- لماذا تعتقد أن الاختبارات المعملية لم تكن قادرة على اكتشاف إنتاج السموم مباشرة؟
التمارين\(\PageIndex{6}\)
- كيف يشبه PCR عملية تكرار الحمض النووي الطبيعي في الخلايا؟ كيف تختلف؟
- قارن RT-PCR و qPCR من حيث أغراض كل منهما.
- في تسلسل إنهاء السلسلة، كيف يتم تحديد هوية كل نيوكليوتيد في تسلسل؟
المفاهيم الأساسية والملخص
- يتطلب العثور على جين مهم داخل العينة استخدام مسبار الحمض النووي أحادي الجديلة المسمى بمنارة جزيئية (عادةً النشاط الإشعاعي أو الفلورة) التي يمكن أن تتهجين بحمض نووي تكميلي أحادي الجديلة في العينة.
- يسمح الرحلان الكهربائي لجل Agarose بفصل جزيئات الحمض النووي بناءً على الحجم.
- يسمح تحليل تعدد الأشكال في طول جزء التقييد (RFLP) بالتصور بواسطة الرحلان الكهربائي لهلام الأغاروز لمتغيرات متميزة من تسلسل الحمض النووي الناجم عن الاختلافات في مواقع التقييد.
- يسمح تحليل البقع الجنوبية للباحثين بالعثور على تسلسل معين من الحمض النووي داخل العينة بينما يسمح تحليل البقع الشمالية للباحثين باكتشاف تسلسل mRNA معين يتم التعبير عنه في العينة.
- تقنية Microarray هي تقنية تهجين الحمض النووي التي تسمح بفحص عدة آلاف من الجينات في وقت واحد للعثور على اختلافات في الجينات أو أنماط التعبير الجيني بين عينتين من الحمض النووي الجيني أو cDNA،
- يسمح الرحلان الكهربي لجل بولي أكريلاميد (PAGE) بفصل البروتينات حسب الحجم، خاصة إذا تم إخفاء شحنات البروتين الأصلية من خلال المعالجة المسبقة باستخدام SDS.
- يسمح تفاعل البوليميراز المتسلسل بالتضخيم السريع لتسلسل الحمض النووي المحدد. يمكن استخدام اختلافات PCR للكشف عن تعبير mRNA (النسخ العكسي PCR) أو لتحديد تسلسل معين في العينة الأصلية (PCR في الوقت الفعلي).
- على الرغم من أن تطوير تسلسل Sanger DNA كان ثوريًا، إلا أن التقدم في تسلسل الجيل التالي يسمح بالتسلسل السريع وغير المكلف لجينومات العديد من الكائنات الحية، مما يؤدي إلى تسريع حجم بيانات التسلسل الجديدة.
الحواشي
- 1 باتريزيا سبيغاغليا وفابريزيو باربانتي وآنا ماريا ديونيسي وباولا ماسترانتونيو. «عزلات الكلوستريديوم العسيرة المقاومة للفلوروكينولونات في إيطاليا: ظهور PCR Ribotype 018". مجلة علم الأحياء الدقيقة السريرية 48 رقم 8 (2010): 2892-2896.


