12.1: الميكروبات وأدوات الهندسة الوراثية
- Page ID
- 195315
أهداف التعلم
- تحديد أدوات علم الوراثة الجزيئية المشتقة من الكائنات الحية الدقيقة
- وصف الطرق المستخدمة لإنشاء جزيئات الحمض النووي المؤتلف
- وصف الطرق المستخدمة لإدخال الحمض النووي في الخلايا بدائية النواة
- ضع قائمة بأنواع المكتبات الجينومية ووصف استخداماتها
- وصف الطرق المستخدمة لإدخال الحمض النووي في الخلايا حقيقية النواة
التركيز السريري: الجزء الأول
كايلا، مهندسة كهربائية تبلغ من العمر 24 عامًا ومتحمسة للركض، انتقلت للتو من أريزونا إلى نيو هامبشاير لتولي وظيفة جديدة. في عطلات نهاية الأسبوع، تحب استكشاف محيطها الجديد، والذهاب لمسافات طويلة في غابات الصنوبر. في يوليو، أمضت أسبوعًا في التنزه عبر الجبال. في أوائل أغسطس، أصيبت كايلا بحمى منخفضة وصداع وآلام خفيفة في العضلات، وشعرت ببعض التعب. لم تفكر كثيرًا في الأمر، فقد تناولت بعض الإيبوبروفين لمكافحة أعراضها وتعهدت بالحصول على مزيد من الراحة.
التمارين\(\PageIndex{1}\)
ما أنواع الحالات الطبية التي قد تكون مسؤولة عن أعراض كايلا؟
علم استخدام الأنظمة الحية لصالح البشرية يسمى التكنولوجيا الحيوية. من الناحية الفنية، يعتبر تدجين النباتات والحيوانات من خلال ممارسات الزراعة والتربية نوعًا من التكنولوجيا الحيوية. ومع ذلك، بالمعنى المعاصر، نربط التكنولوجيا الحيوية بالتغيير المباشر لعلم الوراثة للكائن الحي لتحقيق الصفات المرغوبة من خلال عملية الهندسة الوراثية. تتضمن الهندسة الوراثية استخدام تقنية الحمض النووي المؤتلف، وهي العملية التي يتم من خلالها معالجة تسلسل الحمض النووي في المختبر، وبالتالي إنشاء جزيئات الحمض النووي المؤتلف التي تحتوي على مجموعات جديدة من المواد الجينية. ثم يتم إدخال الحمض النووي المؤتلف إلى كائن حي مضيف. إذا كان الحمض النووي الذي تم إدخاله يأتي من نوع مختلف، فإن الكائن الحي المضيف يعتبر الآن متحولًا وراثيًا.
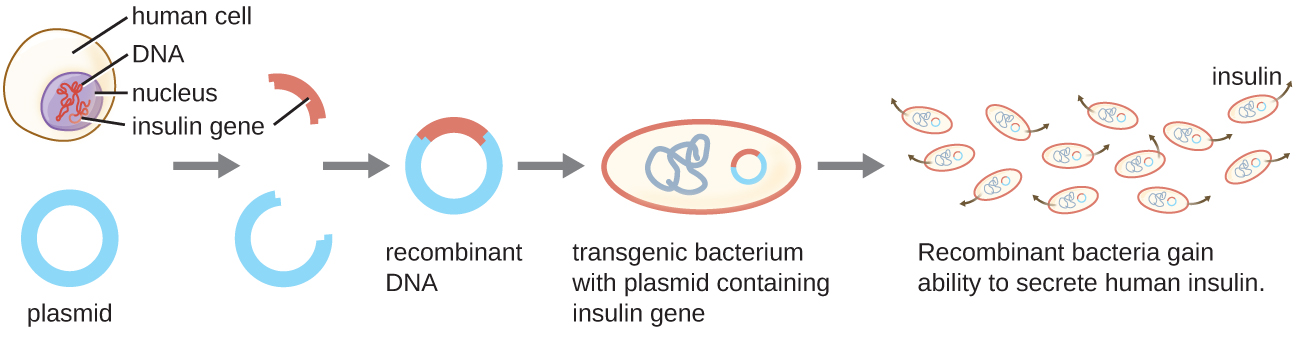
أحد الأمثلة على الكائنات الحية الدقيقة المعدلة وراثيًا هو السلالة البكتيرية التي تنتج الأنسولين البشري (الشكل\(\PageIndex{1}\)). تم إدخال جين الأنسولين من البشر في البلازميد. ثم تم إدخال بلازميد الحمض النووي المؤتلف هذا في البكتيريا. ونتيجة لذلك، فإن هذه الميكروبات المعدلة وراثيا قادرة على إنتاج وإفراز الأنسولين البشري. تستطيع العديد من بدائيات النواة الحصول على الحمض النووي الأجنبي ودمج الجينات الوظيفية في الجينوم الخاص بها من خلال «التزاوج» مع الخلايا الأخرى (الاقتران)، والعدوى الفيروسية (النقل)، وأخذ الحمض النووي من البيئة (التحول). تذكر أن هذه الآليات هي أمثلة على النقل الأفقي للجينات - نقل المواد الجينية بين خلايا من نفس الجيل.
الاستنساخ الجزيئي
أظهر هربرت بوير وستانلي كوهين لأول مرة عملية الاستنساخ الجزيئي الكاملة في عام 1973 عندما نجحوا في استنساخ الجينات من الضفدع الأفريقي المخالب (Xenopus laevis) إلى بلازميد بكتيري تم إدخاله بعد ذلك إلى المضيف البكتيري Escherichia coli. الاستنساخ الجزيئي هو مجموعة من الطرق المستخدمة لبناء الحمض النووي المؤتلف ودمجه في الكائن الحي المضيف؛ يستخدم عددًا من الأدوات الجزيئية المشتقة من الكائنات الحية الدقيقة.
إنزيمات التقييد والليغاز
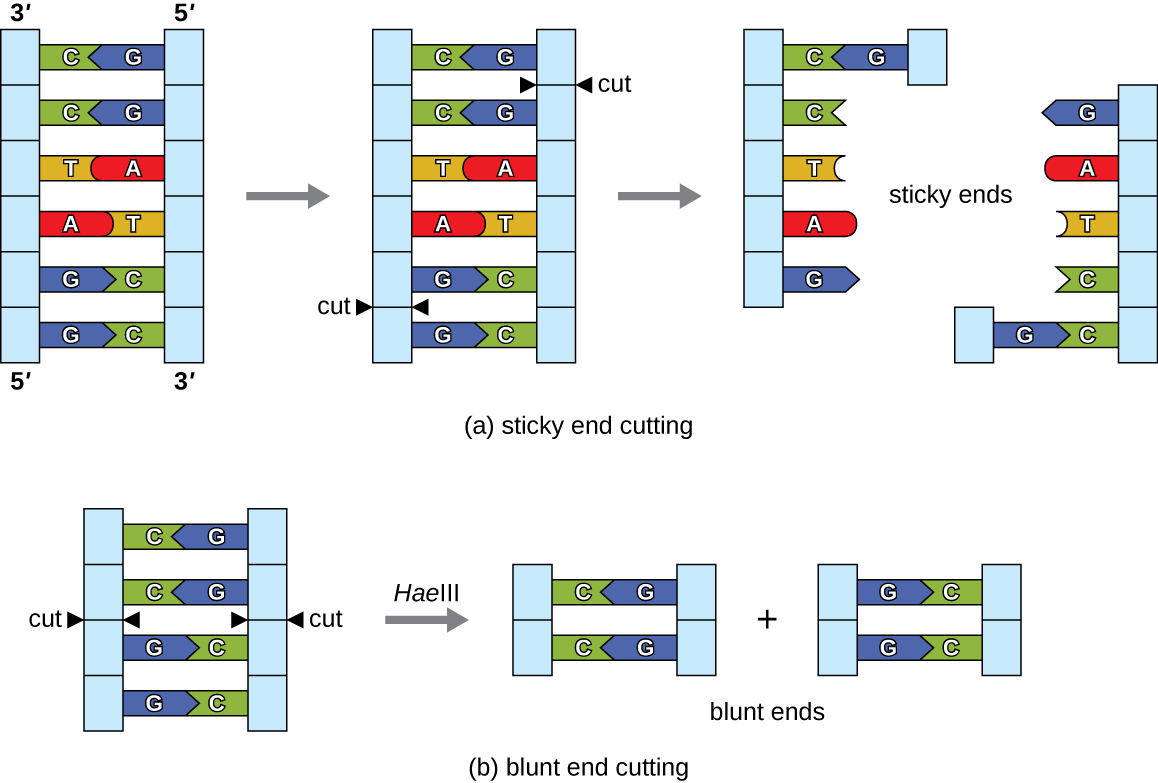
في تقنية الحمض النووي المؤتلف، يتم معالجة جزيئات الحمض النووي باستخدام إنزيمات طبيعية مشتقة أساسًا من البكتيريا والفيروسات. من الممكن تكوين جزيئات الحمض النووي المؤتلف بسبب استخدام كريات الدم البيضاء المقيِّدة التي تحدث بشكل طبيعي (إنزيمات التقييد)، والإنزيمات البكتيرية التي يتم إنتاجها كآلية حماية لقطع وتدمير الحمض النووي السيتوبلازمي الأجنبي الذي يكون في الغالب نتيجة لعدوى البكتيريا. اكتشف ستيوارت لين وفيرنر أربر إنزيمات التقييد في دراساتهما التي أجريت في الستينيات حول كيفية قيام الإشريكية القولونية بالحد من تكاثر البكتيريا عند العدوى. اليوم، نستخدم إنزيمات التقييد على نطاق واسع لقطع أجزاء الحمض النووي التي يمكن بعد ذلك تقسيمها إلى جزيء DNA آخر لتكوين جزيئات مؤتلفة. يقوم كل إنزيم تقييدي بقطع الحمض النووي في موقع التعرف على الخصائص، وهو تسلسل DNA محدد، عادة ما يكون متشابه، يتراوح طوله عادةً بين أربعة إلى ستة أزواج أساسية. المتباعد هو سلسلة من الحروف التي تقرأ نفس القراءة للأمام وللخلف. (كلمة «المستوى» هي مثال للمتلازمة المتناظرة.) تحتوي تسلسلات الحمض النووي المتناظر على نفس التسلسلات الأساسية في اتجاه 5إلى 3على خيط واحد كما هو الحال في الاتجاه 5إلى 3على الشريط التكميلي. يتعرف إنزيم التقييد على متلازمة الحمض النووي ويقطع كل عمود فقري في مواضع متطابقة في المتلازمة المتناظرة. تقطع بعض إنزيمات التقييد لإنتاج جزيئات ذات نتوءات تكميلية (أطراف لزجة) بينما تقطع أخرى دون توليد مثل هذه التراكمات، وبدلاً من ذلك تنتج نهايات حادة (الشكل\(\PageIndex{2}\)).
يمكن للجزيئات ذات الأطراف اللاصقة التكميلية أن تصلب بسهولة، أو تشكل روابط هيدروجينية بين القواعد التكميلية، في نهاياتها اللاصقة. تسمح خطوة التلدين بتهجين الأجزاء المتدلية أحادية الجديلة. يشير التهجين إلى الجمع بين خيطين مفردين متكاملين من الحمض النووي. يمكن أيضًا ربط الأطراف الحادة معًا، ولكن بشكل أقل كفاءة من الأطراف اللاصقة بسبب نقص التراكبات التكميلية التي تسهل العملية. في كلتا الحالتين، يمكن للربط بواسطة ليغاز الحمض النووي أن ينضم بعد ذلك إلى العمود الفقري للسكر والفوسفات في الحمض النووي من خلال الترابط التساهمي، مما يجعل الجزيء خيطًا مزدوجًا مستمرًا. في عام 1972، كان بول بيرج، عالم الكيمياء الحيوية بجامعة ستانفورد، أول من أنتج جزيء الحمض النووي المؤتلف باستخدام هذه التقنية، حيث جمع بين فيروس القرد SV40 مع E. coli bacteriophage lambda لإنشاء هجين.
البلازميدات
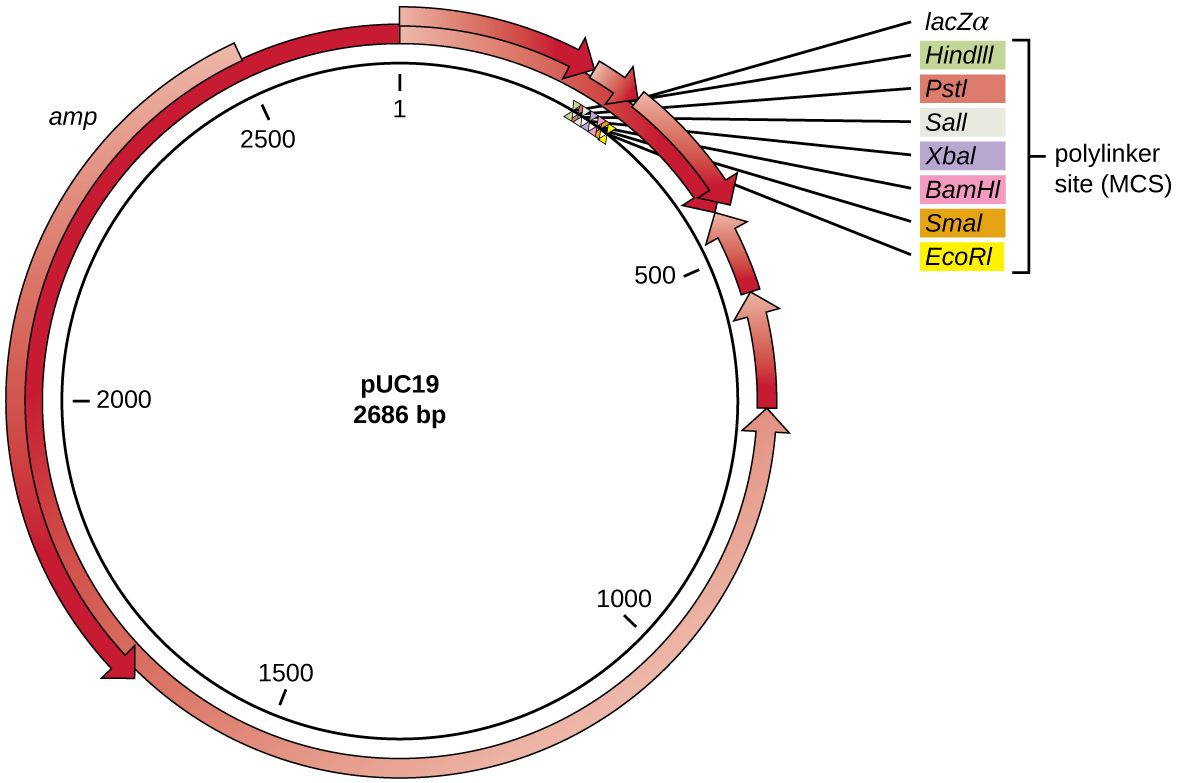
بعد الهضم التقييدي، يتم إدخال الجينات المهمة بشكل شائع في البلازميدات، وهي قطع صغيرة من الحمض النووي الدائري المزدوج الذي يتكرر بشكل مستقل عن الكروموسوم البكتيري (انظر الخصائص الفريدة للخلايا بدائية النواة). في تقنية الحمض النووي المؤتلف، غالبًا ما تستخدم البلازميدات كناقلات، وهي جزيئات الحمض النووي التي تحمل أجزاء الحمض النووي من كائن حي إلى آخر. يمكن للباحثين وشركات التوريد العلمية هندسة البلازميدات المستخدمة كناقلات وراثيًا للحصول على خصائص متخصصة، كما يتضح من ناقل البلازميد المستخدم بشكل شائع PUC19 (الشكل\(\PageIndex{3}\)). تحتوي بعض ناقلات البلازميد على جينات تمنح مقاومة للمضادات الحيوية؛ تسمح جينات المقاومة هذه للباحثين بالعثور بسهولة على المستعمرات المحتوية على البلازميد عن طريق طلائها على وسائط تحتوي على المضاد الحيوي المقابل. يقتل المضاد الحيوي جميع الخلايا المضيفة التي لا تؤوي ناقل البلازميد المطلوب، ولكن تلك التي تحتوي على الناقل قادرة على البقاء والنمو.
عادةً ما تحتوي ناقلات البلازميد المستخدمة في الاستنساخ على موقع متعدد الروابط أو موقع استنساخ متعدد (MCS). موقع polylinker هو تسلسل قصير يحتوي على العديد من مواقع التعرف على إنزيم التقييد الفريدة التي تُستخدم لإدخال الحمض النووي في البلازميد بعد هضم التقييد لكل من الحمض النووي والبلازميد. إن وجود مواقع التعرف على الإنزيمات المقيدة المتعددة داخل موقع polylinker يجعل ناقل البلازميد متعدد الاستخدامات، لذلك يمكن استخدامه للعديد من تجارب الاستنساخ المختلفة التي تتضمن إنزيمات تقييد مختلفة.
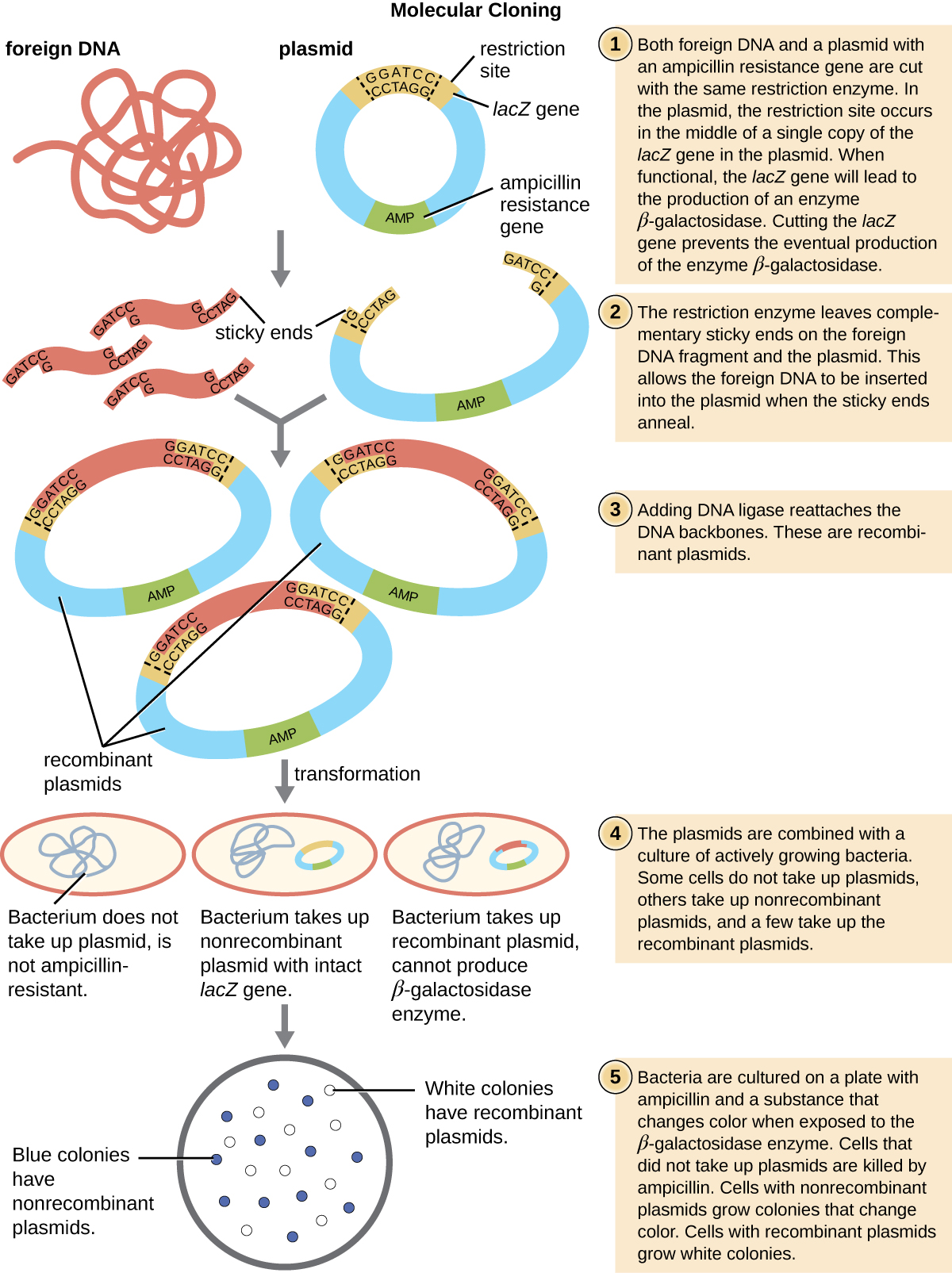
غالبًا ما يوجد موقع متعدد الروابط هذا داخل جين المراسل، وهو تسلسل جيني آخر تم هندسته بشكل مصطنع في البلازميد الذي يقوم بترميز البروتين الذي يسمح بتصور إدخال الحمض النووي. يسمح الجين المراسل للباحث بتمييز الخلايا المضيفة التي تحتوي على البلازميدات المؤتلفة مع شظايا الحمض النووي المستنسخة من الخلايا المضيفة التي تحتوي فقط على ناقل البلازميد غير المؤتلف. الجين المراسل الأكثر شيوعًا المستخدم في ناقلات البلازميد هو جين LaCz البكتيري الذي يشفر بيتا غالاكتوزيداز، وهو إنزيم يحلل اللاكتوز بشكل طبيعي ولكن يمكنه أيضًا تحلل نظير اصطناعي عديم اللون X-gal، وبالتالي ينتج مستعمرات زرقاء على وسائط تحتوي على X-Gal. يتم تعطيل جين مراسل LaCz عندما يتم ربط الحمض النووي المؤتلف في البلازميد. نظرًا لأن بروتين LaCz لا يتم إنتاجه عند تعطيل الجين، لا تتحلل X-gal ويتم إنتاج مستعمرات بيضاء، والتي يمكن بعد ذلك عزلها. يتم وصف طريقة الفحص بالأزرق والأبيض لاحقًا وتظهر في الشكل\(\PageIndex{4}\). بالإضافة إلى هذه الميزات، تأتي بعض البلازميدات مهضومة مسبقًا وبإنزيم مرتبط بالبلازميد الخطي للمساعدة في الربط بعد إدخال أجزاء الحمض النووي الأجنبية.
الاستنساخ الجزيئي باستخدام التحويل
الآلية الأكثر استخدامًا لإدخال البلازميدات الهندسية إلى الخلية البكتيرية هي التحول، وهي عملية تمتص فيها البكتيريا الحمض النووي الحر من محيطها. في الطبيعة، يأتي الحمض النووي الحر عادةً من الخلايا البكتيرية الأخرى المتحللة؛ في المختبر، يتم إدخال الحمض النووي الحر في شكل بلازميدات مؤتلفة إلى محيط الخلية.
بعض البكتيريا، مثل Bacillus spp.، مؤهلة بشكل طبيعي، مما يعني أنها قادرة على امتصاص الحمض النووي الأجنبي. ومع ذلك، ليست كل البكتيريا مؤهلة بشكل طبيعي. في معظم الحالات، يجب جعل البكتيريا مؤهلة صناعيًا في المختبر عن طريق زيادة نفاذية غشاء الخلية. يمكن تحقيق ذلك من خلال العلاجات الكيميائية التي تحيد الشحنات على غشاء الخلية أو عن طريق تعريض البكتيريا لمجال كهربائي يخلق مسامًا مجهرية في غشاء الخلية. تنتج هذه الطرق بكتيريا مختصة كيميائيًا أو بكتيرية كهربائية، على التوالي.
وفقًا لبروتوكول التحول، يتم طلاء الخلايا البكتيرية على وسط يحتوي على المضادات الحيوية لمنع نمو العديد من الخلايا المضيفة التي لم يتم تحويلها بواسطة البلازميد الذي يمنح مقاومة المضادات الحيوية. ثم يتم استخدام تقنية تسمى الفحص الأزرق والأبيض لناقلات البلازميد التي تقوم بترميز LaCz مثل PUC19. تحتوي المستعمرات الزرقاء على إنزيم بيتا غالاكتوزيداز الوظيفي لأن جين LaCz لا ينقطع، مع عدم إدخال الحمض النووي الأجنبي في موقع polylinker. تنتج هذه المستعمرات عادةً عن البلازميد المهضوم والخطي الذي يعود إلى نفسه. ومع ذلك، تفتقر المستعمرات البيضاء إلى إنزيم بيتا غالاكتوزيداز الوظيفي، مما يشير إلى إدخال الحمض النووي الأجنبي داخل موقع بوليلينكر لناقل البلازميد، وبالتالي تعطيل جين LaCz. وبالتالي، تحتوي المستعمرات البيضاء الناتجة عن هذا الفحص الأزرق والأبيض على بلازميدات مع ملحق ويمكن فحصها بشكل إضافي لتوصيف الحمض النووي الأجنبي. للتأكد من دمج الحمض النووي الصحيح في البلازميد، يمكن بعد ذلك ترتيب إدخال الحمض النووي.
شاهد رسمًا متحركًا للاستنساخ الجزيئي من مركز تعلم الحمض النووي.
التمارين\(\PageIndex{2}\)
في الفحص بالأزرق والأبيض، ماذا تعني المستعمرة الزرقاء ولماذا هي زرقاء؟
الاستنساخ الجزيئي باستخدام الاقتران أو النقل
يمكن أيضًا معالجة عملية الاقتران البكتيرية (انظر كيف تحقق بدائيات النواة اللاجنسية التنوع الجيني) من أجل الاستنساخ الجزيئي. يتم نقل بلازميدات F، أو بلازميدات الخصوبة، بين الخلايا البكتيرية من خلال عملية الاقتران. يمكن نقل الحمض النووي المؤتلف عن طريق الاقتران عندما يتم خلط الخلايا البكتيرية التي تحتوي على بلازميد F المؤتلف مع خلايا بكتيرية متوافقة تفتقر إلى البلازميد. تقوم بلازميدات F بتشفير بنية سطحية تسمى F pilus تسهل الاتصال بين خلية تحتوي على بلازميد F وأخرى بدون بلازميد F. عند التلامس، يتشكل جسر سيتوبلازمي بين الخليتين وتقوم الخلية المحتوية على البلازميد F بتكرار البلازميد الخاص بها، ونقل نسخة من البلازميد F المؤتلف إلى الخلية المتلقية. بمجرد استلام بلازميد F المؤتلف، يمكن للخلية المتلقية إنتاج خلايا F الخاصة بها وتسهيل نقل البلازميد F المؤتلف إلى خلية إضافية. يعد استخدام الاقتران لنقل بلازميدات F المؤتلفة إلى الخلايا المستقبلة طريقة فعالة أخرى لإدخال جزيئات الحمض النووي المؤتلف في الخلايا المضيفة.
بدلاً من ذلك، يمكن استخدام البكتيريا لإدخال الحمض النووي المؤتلف في الخلايا البكتيرية المضيفة من خلال التلاعب بعملية النقل (انظر كيف تحقق بدائيات النواة اللاجنسية التنوع الجيني). في المختبر، يمكن هندسة أجزاء الحمض النووي المهمة وتحويلها إلى بلعميات، وهي بلازميدات تحتوي على تسلسلات عامية تسمح بتعبئتها في كتل جرثومية. يمكن بعد ذلك إصابة الخلايا البكتيرية بهذه البكتيريا بحيث يمكن إدخال البلعمات المؤتلفة إلى الخلايا البكتيرية. اعتمادًا على نوع العاثية، قد يتم دمج الحمض النووي المؤتلف في الجينوم البكتيري المضيف (الليسوجيني)، أو قد يوجد كبلازميد في سيتوبلازم المضيف.
التمارين\(\PageIndex{2}\)
- ما الوظيفة الأصلية لإنزيم التقييد؟
- ما العمليتان اللتان يتم استغلالهما للحصول على الحمض النووي المؤتلف في خلية مضيفة بكتيرية؟
- ميّز استخدامات جين مقاومة المضادات الحيوية والجين المراسل في ناقل البلازميد.
إنشاء مكتبة جينومية
يمكن أيضًا استخدام الاستنساخ الجزيئي لإنشاء مكتبة جينومية. المكتبة عبارة عن نسخة كاملة (أو شبه كاملة) من جينوم الكائن الحي الموجود في شكل بلازميدات الحمض النووي المؤتلف المصممة في استنساخ فريد من البكتيريا. إن وجود مثل هذه المكتبة يسمح للباحث بإنشاء كميات كبيرة من كل جزء عن طريق تنمية المضيف البكتيري لهذا الجزء. يمكن استخدام هذه الأجزاء لتحديد تسلسل الحمض النووي ووظيفة أي جينات موجودة.
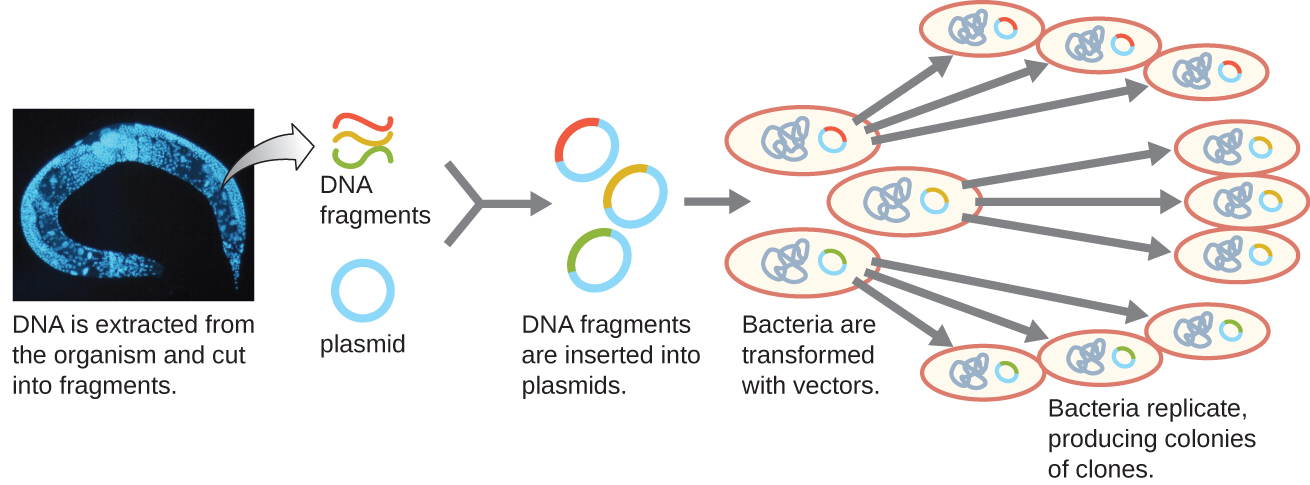
تتمثل إحدى طرق إنشاء مكتبة جينومية في ربط الأجزاء الجينومية المهضومة بالإنزيم المقيد الفردي في ناقلات بلازميد مقطوعة بنفس إنزيم التقييد (الشكل\(\PageIndex{5}\)). بعد التحول إلى مضيف بكتيري، تأخذ كل خلية بكتيرية محوّلة بلازميد مؤتلف واحد وتنمو لتصبح مستعمرة من الخلايا. جميع الخلايا في هذه المستعمرة هي مستنسخات متطابقة وتحمل نفس البلازميد المؤتلف. المكتبة الناتجة عبارة عن مجموعة من المستعمرات، تحتوي كل منها على جزء من جينوم الكائن الحي الأصلي، كل منها منفصل ومتميز ويمكن استخدام كل منها لمزيد من الدراسة. هذا يجعل من الممكن للباحثين فحص هذه الحيوانات المستنسخة المختلفة لاكتشاف تلك التي تحتوي على جين مهم من جينوم الكائن الحي الأصلي.
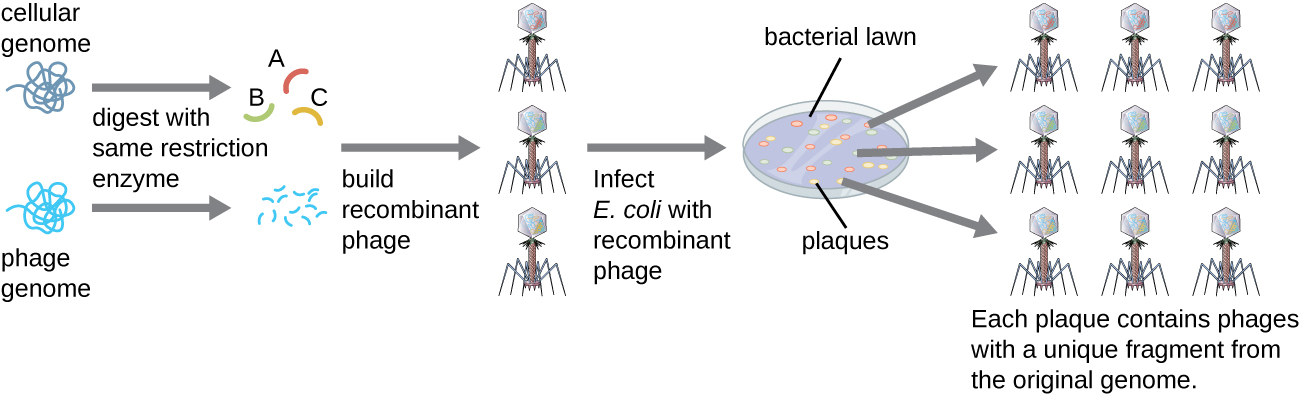
لإنشاء مكتبة جينومية باستخدام أجزاء أكبر من الحمض النووي الجيني، يمكن استخدام بكتيريا E. coli، مثل لامدا، كمضيف (الشكل\(\PageIndex{6}\)). يمكن قص الحمض النووي الجيني أو هضمه إنزيميًا وربطه في ناقل الحمض النووي اللامدا المهضوم مسبقًا. بعد ذلك، يمكن تجميع جزيئات الحمض النووي للعاثية المؤتلفة هذه في جزيئات العاثية واستخدامها لإصابة الخلايا المضيفة للإشريكية القولونية على لوحة. أثناء الإصابة داخل كل خلية، ستقوم كل عامية مؤتلفة بعمل نسخ عديدة من نفسها وتحطيم عشب E. coli، لتشكيل لوحة. وهكذا، فإن كل لوحة من مكتبة العاثية تمثل عاثية فريدة مؤتلفة تحتوي على جزء مميز من الحمض النووي الجيني. يمكن بعد ذلك فحص اللويحات بشكل أكبر للبحث عن الجينات ذات الأهمية. تتمثل إحدى مزايا إنتاج مكتبة باستخدام العاهات بدلاً من البلازميدات في أن جسيم العاثية يحتوي على كمية أكبر بكثير من الحمض النووي الأجنبي مقارنة بناقل البلازميد، مما يتطلب عددًا أقل بكثير من الثقافات لتمثيل الجينوم الكامل للكائن الحي الأصلي بشكل كامل.
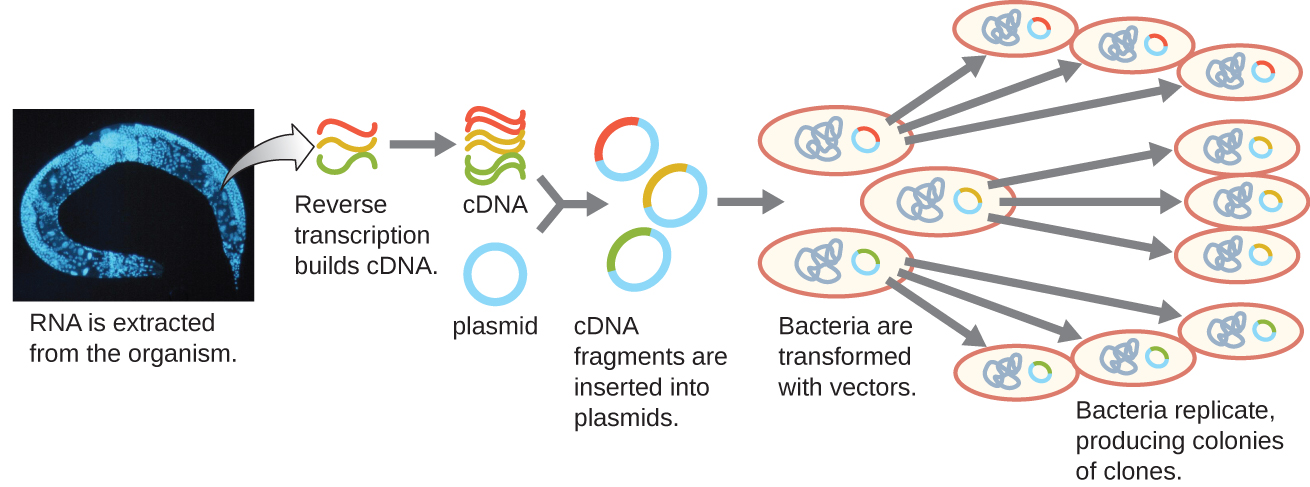
للتركيز على الجينات المعبر عنها في الكائن الحي أو حتى الأنسجة، يقوم الباحثون ببناء مكتبات باستخدام الحمض النووي الريبي المرسل للكائن الحي (mRNA) بدلاً من الحمض النووي الجيني الخاص به. في حين أن جميع الخلايا في كائن حي واحد سيكون لها نفس الحمض النووي الجيني، فإن الأنسجة المختلفة تعبر عن جينات مختلفة، وتنتج مكملات مختلفة من mRNA. على سبيل المثال، يحتوي الحمض النووي الجيني لجميع الخلايا البشرية على جين الأنسولين، ولكن الخلايا الموجودة في البنكرياس فقط هي التي تعبر عن الحمض النووي الريبي (mRNA) الذي يوجه إنتاج الأنسولين. نظرًا لأنه لا يمكن استنساخ mRNA مباشرة، يجب استخدام mRNA في المختبر كنموذج بواسطة النسخ العكسي لإنزيم الفيروسات القهقرية لصنع الحمض النووي التكميلي (cDNA). يمكن نسخ المكمل الكامل للخلية من mRNA بشكل عكسي إلى جزيئات cDNA، والتي يمكن استخدامها كنموذج لبوليميراز الحمض النووي لعمل نسخ من الحمض النووي المزدوج؛ يمكن لاحقًا ربط هذه الأجزاء إما في ناقلات البلازميد أو البكتيريا لإنتاج مكتبة cDNA. تكمن فائدة مكتبة cDNA في احتوائها على الحمض النووي من الجينات المعبر عنها فقط في الخلية. هذا يعني أن الإنترونات وتسلسلات التحكم مثل المروجين والحمض النووي غير المخصص للترجمة إلى بروتينات غير ممثلة في المكتبة. يعني التركيز على التسلسلات المترجمة أنه لا يمكن استخدام المكتبة لدراسة تسلسل وهيكل الجينوم بأكمله. يظهر إنشاء مكتبة جينومية لـ cDNA في الشكل\(\PageIndex{7}\).
التمارين\(\PageIndex{3}\)
- ما هي الأماكن المضيفة للمكتبات الجينومية الموصوفة؟
- ما هو cDNA؟
إدخال الجزيئات المؤتلفة إلى مضيفين حقيقيات النواة
وضع استخدام مضيفات البكتيريا في الهندسة الوراثية الأساس لتقنية الحمض النووي المؤتلف؛ ومع ذلك، كان لدى الباحثين أيضًا اهتمام كبير بالهندسة الوراثية للخلايا حقيقية النواة، وخاصة تلك الخاصة بالنباتات والحيوانات. يُطلق على إدخال جزيئات الحمض النووي المؤتلف إلى مضيفات حقيقية النواة اسم التحول. تعتبر النباتات المعدلة وراثيًا، والتي تسمى النباتات المعدلة وراثيًا، ذات أهمية كبيرة للأغراض الزراعية والصيدلانية. كان أول نبات معدّل وراثيًا يُباع تجاريًا هو طماطم Flavr Savr ذات النضج المتأخر، والتي دخلت السوق في عام 1994. كما تم إنتاج الثروة الحيوانية المعدلة وراثيًا بنجاح، مما أدى، على سبيل المثال، إلى الخنازير ذات القيمة الغذائية المتزايدة 1 والماعز التي تفرز المنتجات الصيدلانية في حليبها. 2
الإنزال الكهربائي
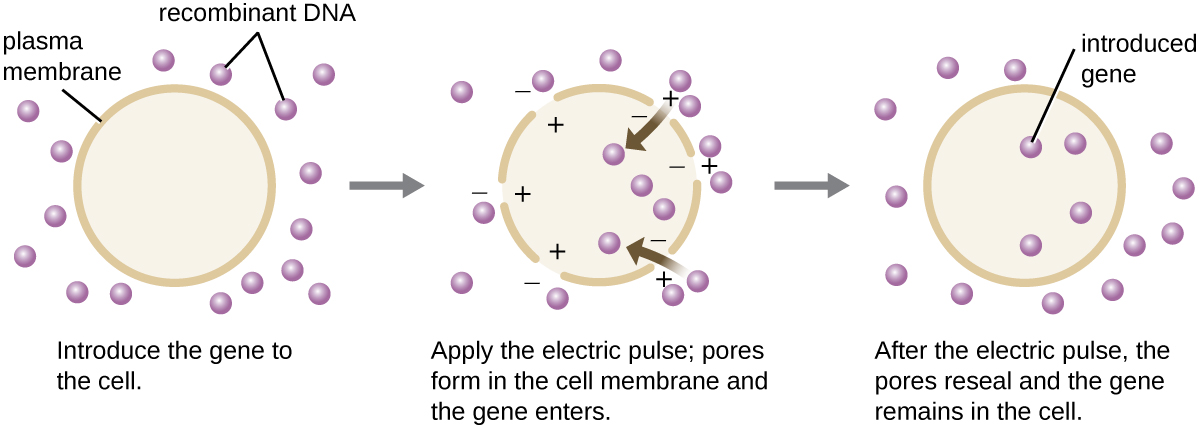
بالمقارنة مع الخلايا البكتيرية، تميل الخلايا حقيقية النواة إلى أن تكون أقل قابلية للتكيف كمضيف لجزيئات الحمض النووي المؤتلف. نظرًا لأن حقيقيات النوى ليست مؤهلة عادةً لأخذ الحمض النووي الأجنبي ولا قادرة على الحفاظ على البلازميدات، فإن نقل المضيفين حقيقيات النواة يمثل تحديًا أكبر بكثير ويتطلب تقنيات أكثر تطفلاً لتحقيق النجاح. تسمى إحدى الطرق المستخدمة لنقل الخلايا في زراعة الخلايا بالتيار الكهربائي. تحفز نبضة كهربائية قصيرة تكوين مسام عابرة في الطبقات الثنائية الفوسفورية للخلايا التي يمكن من خلالها إدخال الجين. في الوقت نفسه، يولد النبض الكهربائي شحنة موجبة قصيرة العمر على جانب واحد من داخل الخلية وشحنة سالبة على الجانب الآخر؛ يجذب فرق الشحنة جزيئات الحمض النووي سالبة الشحنة إلى الخلية (الشكل\(\PageIndex{8}\)).
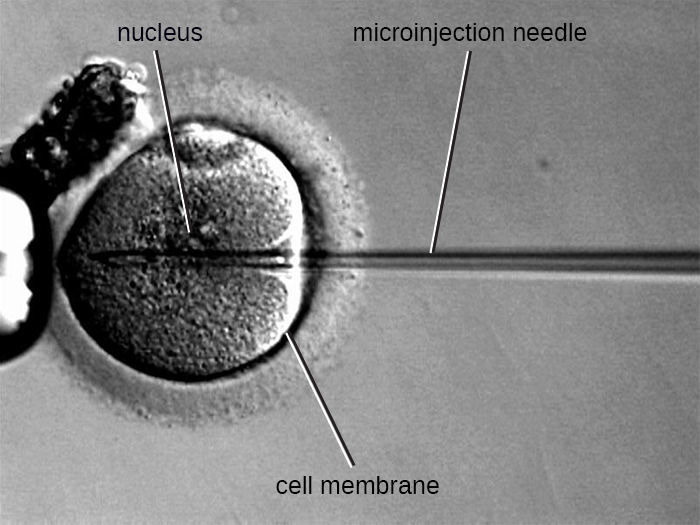
الحقن المجهري
طريقة بديلة للانتقال تسمى الحقن المجهري. نظرًا لأن الخلايا حقيقية النواة عادة ما تكون أكبر من تلك الموجودة في بدائيات النواة، يمكن أحيانًا حقن أجزاء الحمض النووي مباشرة في السيتوبلازم باستخدام ماصة زجاجية دقيقة، كما هو موضح في الشكل\(\PageIndex{9}\).
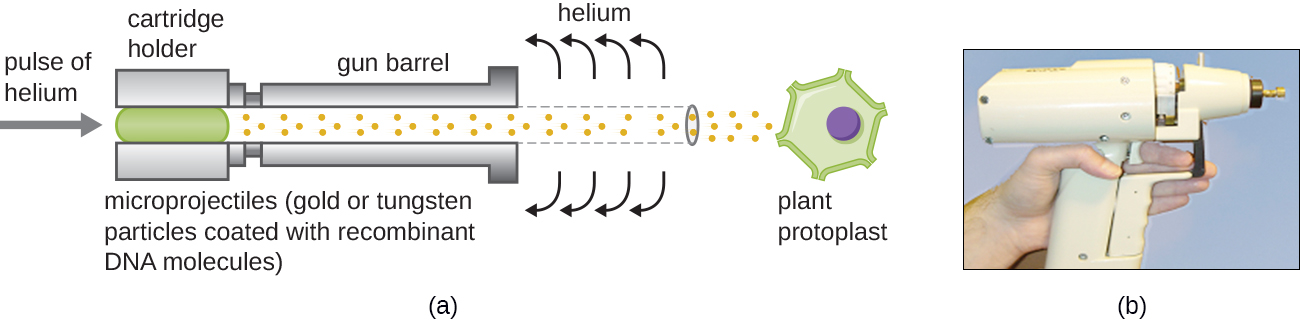
البنادق الجينية
يمكن أن يكون نقل الخلايا النباتية أكثر صعوبة من الخلايا الحيوانية بسبب جدران الخلايا السميكة. تتضمن إحدى الطرق معالجة الخلايا النباتية بالإنزيمات لإزالة جدران الخلايا وإنتاج البروتوبلاستات. بعد ذلك، يتم استخدام مسدس الجينات لإطلاق جزيئات الذهب أو التنجستن المطلية بجزيئات الحمض النووي المؤتلف في البروتوبلاستات النباتية بسرعات عالية. يمكن بعد ذلك استعادة خلايا بروتوبلاست المتلقية واستخدامها لتوليد نباتات جديدة معدلة وراثيًا (الشكل\(\PageIndex{10}\)).
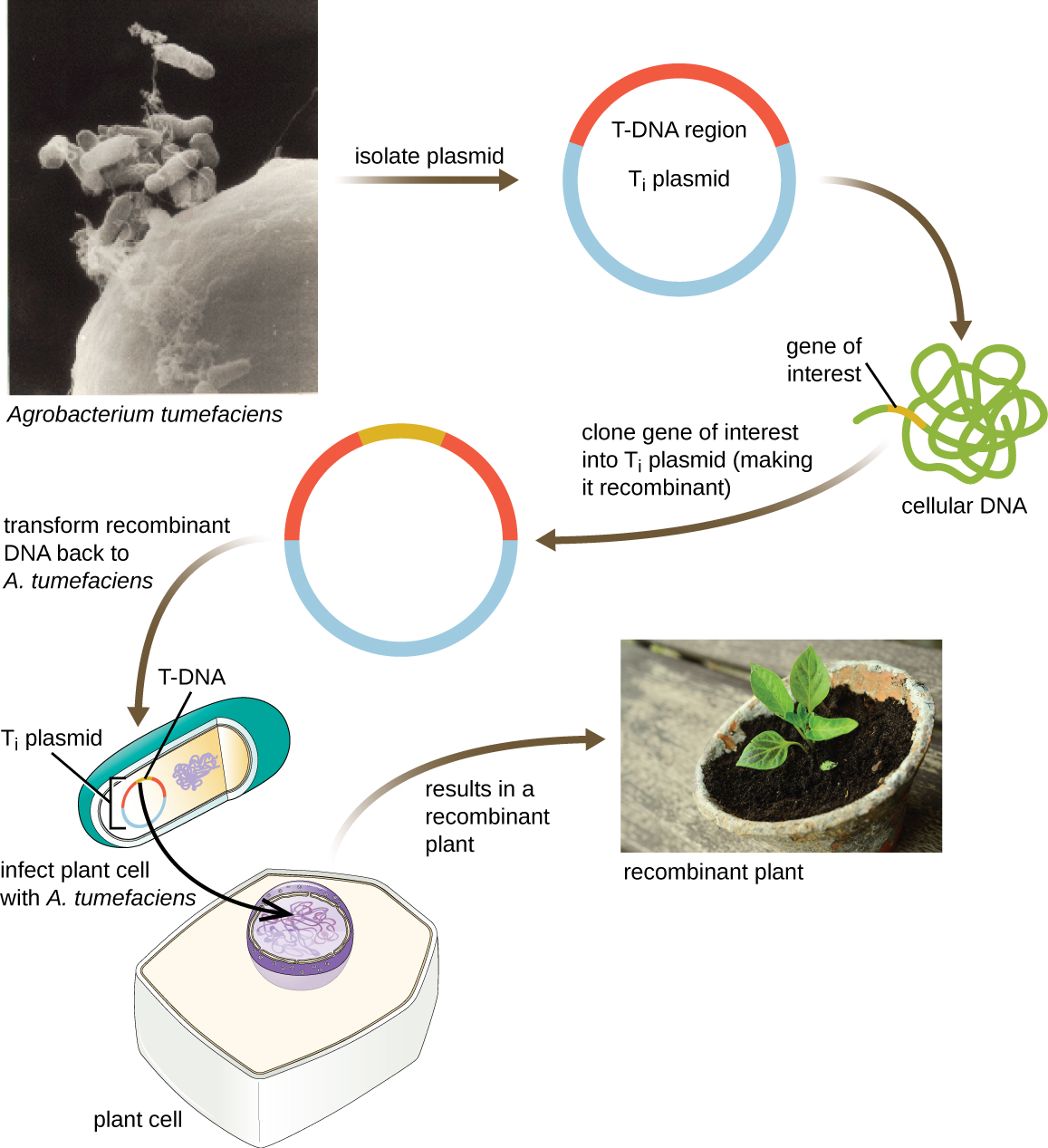
ناقلات المكوك
هناك طريقة أخرى لنقل النباتات تتضمن ناقلات مكوكية، وهي بلازميدات يمكنها الانتقال بين الخلايا البكتيرية وخلايا حقيقية النواة. تُستخدم البلازميدات المحفزة للورم (T i) الناشئة عن بكتيريا Agrobacterium tumefaciens بشكل شائع كناقلات مكوكية لدمج الجينات في النباتات (الشكل\(\PageIndex{11}\)). في الطبيعة، تتسبب بلازميدات T i i الموجودة في A. tumefaciens في إصابة النباتات بالأورام عند نقلها من الخلايا البكتيرية إلى الخلايا النباتية. تمكن الباحثون من معالجة هذه البلازميدات التي تحدث بشكل طبيعي لإزالة الجينات المسببة للورم وإدخال أجزاء الحمض النووي المرغوبة. يمكن نقل البلازميدات T i المؤتلفة الناتجة إلى جينوم النبات من خلال النقل الطبيعي لـ T i plasmids من البكتيريا إلى مضيف النبات. بمجرد دخول الخلية المضيفة للنبات، يتجمع الجين المثير للاهتمام في جينوم الخلية النباتية.
ناقلات فيروسية
يمكن أيضًا استخدام النواقل الفيروسية لنقل الخلايا حقيقية النواة. في الواقع، غالبًا ما تستخدم هذه الطريقة في العلاج الجيني (انظر العلاج الجيني) لإدخال جينات صحية للمرضى من البشر الذين يعانون من أمراض ناتجة عن طفرات جينية. يمكن حذف الجينات الفيروسية واستبدالها بالجين الذي سيتم تسليمه للمريض؛ 3 ثم يصيب الفيروس الخلية المضيفة ويسلم الحمض النووي الأجنبي إلى جينوم الخلية المستهدفة. غالبًا ما تستخدم الفيروسات الغدية لهذا الغرض لأنها يمكن أن تنمو إلى عيار مرتفع ويمكن أن تصيب الخلايا المضيفة غير المنقسمة والمنقسمة. ومع ذلك، فإن استخدام النواقل الفيروسية للعلاج الجيني يمكن أن يشكل بعض المخاطر للمرضى، كما تمت مناقشته في العلاج الجيني.
التمارين\(\PageIndex{4}\)
- ما هي الطرق المستخدمة لإدخال ناقلات الحمض النووي المؤتلف في الخلايا الحيوانية؟
- قارن وقارن بين ناقلات المكوك والناقلات الفيروسية.
المفاهيم الأساسية والملخص
- التكنولوجيا الحيوية هي علم استخدام الأنظمة الحية لصالح البشرية. في السنوات الأخيرة، أصبحت القدرة على تغيير جينوم الكائن الحي مباشرة من خلال الهندسة الوراثية ممكنة بسبب التقدم في تقنية الحمض النووي المؤتلف، والتي تسمح للباحثين بإنشاء جزيئات الحمض النووي المؤتلف بمجموعات جديدة من مادة وراثية.
- يتضمن الاستنساخ الجزيئي الطرق المستخدمة لبناء الحمض النووي المؤتلف وتسهيل تكراره في الكائنات الحية المضيفة. تتضمن هذه الطرق استخدام إنزيمات التقييد (لقطع كل من ناقلات الحمض النووي والبلازميد الأجنبية)، والربط (للصق أجزاء من الحمض النووي معًا)، وإدخال الحمض النووي المؤتلف في الكائن الحي المضيف (غالبًا البكتيريا).
- يسمح الفحص باللونين الأزرق والأبيض باختيار المحولات البكتيرية التي تحتوي على البلازميدات المؤتلفة باستخدام النمط الظاهري لجين المراسل الذي تم تعطيله عن طريق إدخال جزء الحمض النووي.
- يمكن إنشاء المكتبات الجينومية عن طريق استنساخ الأجزاء الجينومية من كائن حي واحد إلى ناقلات البلازميد أو إلى مرحلة البكتيريا.
- يمكن إنشاء مكتبات cDNA لتمثيل جزيئات mRNA المعبر عنها في خلية عند نقطة معينة.
- يمكن تحقيق انتقال المضيفين حقيقيات النواة من خلال طرق مختلفة باستخدام الإلتهاب الكهربائي، وبنادق الجينات، والحقن المجهري، وناقلات المكوك، والناقلات الفيروسية.
الحواشي
- 1 ليانغكسو لاي، جينغ إكس كانغ، رونغفنغ لي، جينغدونغ وانغ، ويليام تي ويت، هوان يول يونغ، يانهونغ هاو وآخرون. «جيل من الخنازير المستنسخة المعدلة وراثيًا الغنية بأحماض أوميغا 3 الدهنية.» التكنولوجيا الحيوية الطبيعية 24 رقم 4 (2006): 435-436.
- (2) ريلين راموس مورا، ولوسيانا ماغالهايس ميلو، وفيسنتي خوسيه دي فيغويريدو فريتاس. «إنتاج البروتينات المؤتلفة في حليب الماعز المعدلة وراثيا وغير المعدلة وراثيا.» الأرشيف البرازيلي للبيولوجيا والتكنولوجيا 54 رقم 5 (2011): 927-938.
- 3 ويليام إس إم وود وكارولي توث. «ناقلات الفيروسات الغدية للعلاج الجيني والتطعيم والعلاج الجيني للسرطان.» العلاج الجيني الحالي 13 رقم 6 (2013): 421.


