12.4: الهندسة الوراثية - المخاطر والفوائد والتصورات
- Page ID
- 195338
أهداف التعلم
- تلخيص الآليات والمخاطر والفوائد المحتملة للعلاج الجيني
- تحديد القضايا الأخلاقية المتعلقة بالعلاج الجيني والهيئات التنظيمية التي توفر الإشراف على التجارب السريرية
- قارن بين العلاج الجيني للخلايا الجسدية والخط الجرثومي
أسفرت العديد من أنواع الهندسة الوراثية عن فوائد واضحة مع بعض المخاطر الواضحة. قليلون قد يتساءلون، على سبيل المثال، عن قيمة إمداداتنا الوفيرة الآن من الأنسولين البشري الذي تنتجه البكتيريا المعدلة وراثيًا. ومع ذلك، فإن العديد من التطبيقات الناشئة للهندسة الوراثية أكثر إثارة للجدل، غالبًا لأن فوائدها المحتملة توضع في مواجهة مخاطر كبيرة، حقيقية أو متصورة. هذا بالتأكيد هو الحال بالنسبة للعلاج الجيني، وهو تطبيق سريري للهندسة الوراثية قد يوفر يومًا ما علاجًا للعديد من الأمراض ولكنه لا يزال إلى حد كبير نهجًا تجريبيًا للعلاج.
آليات ومخاطر العلاج الجيني
غالبًا ما يصعب علاج الأمراض البشرية الناتجة عن الطفرات الجينية بالأدوية أو غيرها من أشكال العلاج التقليدية لأن علامات وأعراض المرض تنتج عن تشوهات في جينوم المريض. على سبيل المثال، قد يكون لدى المريض طفرة جينية تمنع التعبير عن بروتين معين مطلوب للوظيفة الطبيعية لنوع معين من الخلايا. هذا هو الحال في المرضى الذين يعانون من نقص المناعة المشترك الشديد (SCID)، وهو مرض وراثي يضعف وظيفة بعض خلايا الدم البيضاء الأساسية لجهاز المناعة.
يحاول العلاج الجيني تصحيح التشوهات الجينية عن طريق إدخال جين وظيفي غير متحور في جينوم المريض. يقوم الجين غير المتحور بتشفير بروتين وظيفي لن يتمكن المريض من إنتاجه. تستخدم النواقل الفيروسية مثل الفيروس الغدي أحيانًا لإدخال الجين الوظيفي؛ تتم إزالة جزء من الجينوم الفيروسي واستبداله بالجين المطلوب (الشكل\(\PageIndex{1}\)). تحاول الأشكال الأكثر تقدمًا من العلاج الجيني تصحيح الطفرة في الموقع الأصلي في الجينوم، كما هو الحال مع علاج SCID.
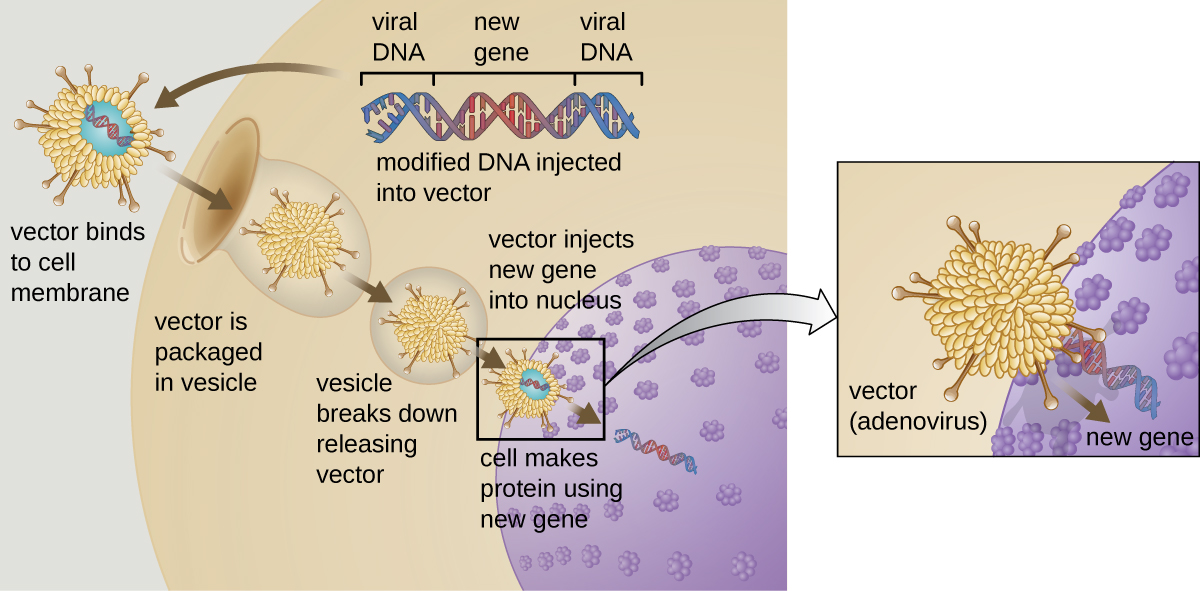
حتى الآن، أثبتت العلاجات الجينية عدم فعاليتها نسبيًا، مع الاستثناءات المحتملة لعلاجات التليف الكيسي ونقص أدينوزين ديميناز، وهو نوع من SCID. أظهرت تجارب أخرى المخاطر الواضحة لمحاولة التلاعب الجيني في الكائنات المعقدة متعددة الخلايا مثل البشر. في بعض المرضى، يمكن أن يؤدي استخدام ناقل الفيروس الغدي إلى استجابة التهابية غير متوقعة من الجهاز المناعي، مما قد يؤدي إلى فشل الأعضاء. علاوة على ذلك، نظرًا لأن الفيروسات غالبًا ما تستهدف أنواعًا متعددة من الخلايا، فقد تصيب ناقلات الفيروس الخلايا غير المستهدفة للعلاج، مما يؤدي إلى إتلاف هذه الخلايا الأخرى وربما يؤدي إلى أمراض مثل السرطان. خطر آخر محتمل هو أن الفيروس المعدل يمكن أن يعود إلى العدوى ويسبب المرض للمريض. أخيرًا، هناك خطر من أن الجين المُدخل يمكن أن يعطل عن غير قصد جينًا مهمًا آخر في جينوم المريض، مما يعطل الدورة الطبيعية للخلايا وربما يؤدي إلى تكوين الورم والسرطان. نظرًا لأن العلاج الجيني ينطوي على العديد من المخاطر، يجب أن يكون المرشحون للعلاج الجيني على دراية كاملة بهذه المخاطر قبل تقديم الموافقة المستنيرة للخضوع للعلاج.
تم إدراك مخاطر العلاج الجيني في حالة جيسي جيلسنغر عام 1999، وهو مريض يبلغ من العمر 18 عامًا تلقى علاجًا جينيًا كجزء من تجربة سريرية في جامعة بنسلفانيا. تلقى جيسي علاجًا جينيًا لحالة تسمى نقص أورنيثين ترانسكارباميلاز (OTC)، مما يؤدي إلى تراكم الأمونيا في الدم بسبب نقص معالجة الأمونيا. بعد أربعة أيام من العلاج، توفي جيسي بعد استجابة مناعية هائلة لناقل الفيروس الغدي. 1
حتى تلك اللحظة، لم يكن الباحثون يعتبرون حقًا الاستجابة المناعية للناقل خطرًا مشروعًا، ولكن عند التحقيق، يبدو أن الباحثين لديهم بعض الأدلة التي تشير إلى أن هذه كانت نتيجة محتملة. قبل علاج جيسي، عانى العديد من المرضى الآخرين من الآثار الجانبية للعلاج، وتوفيت ثلاثة قرود استخدمت في التجربة نتيجة الالتهاب واضطرابات التخثر. على الرغم من هذه المعلومات، يبدو أنه لم يتم إعلام جيسي أو عائلته بهذه النتائج عندما وافقوا على العلاج. كانت وفاة جيسي أول حالة وفاة للمريض بسبب العلاج الجيني وأدت إلى الوقف الفوري للتجربة السريرية التي شارك فيها، والتوقف اللاحق لجميع تجارب العلاج الجيني الأخرى في جامعة بنسلفانيا، والتحقيق في جميع تجارب العلاج الجيني الأخرى في الولايات المتحدة. ونتيجة لذلك، تمت إعادة فحص تنظيم العلاج الجيني والإشراف عليه بشكل عام، مما أدى إلى بروتوكولات تنظيمية جديدة لا تزال سارية حتى اليوم.
التمارين\(\PageIndex{1}\)
- اشرح كيف يعمل العلاج الجيني نظريًا.
- حدد بعض مخاطر العلاج الجيني.
الإشراف على العلاج الجيني
في الوقت الحاضر، هناك إشراف كبير على التجارب السريرية للعلاج الجيني. على المستوى الفيدرالي، تنظم ثلاث وكالات العلاج الجيني بالتوازي: إدارة الغذاء والدواء (FDA)، ومكتب حماية البحوث البشرية (OHRP)، واللجنة الاستشارية للحمض النووي المؤتلف (RAC) في المعاهد الوطنية للصحة (NIH). إلى جانب العديد من الوكالات المحلية، تتفاعل هذه الوكالات الفيدرالية مع مجلس المراجعة المؤسسية لضمان وجود بروتوكولات لحماية سلامة المرضى أثناء التجارب السريرية. يتم تطبيق الامتثال لهذه البروتوكولات في الغالب على المستوى المحلي بالتعاون مع الوكالات الفيدرالية. تخضع العلاجات الجينية حاليًا للمراجعة الفيدرالية والمحلية الأكثر شمولاً مقارنة بأنواع العلاجات الأخرى، والتي تخضع عادةً لمراجعة إدارة الغذاء والدواء فقط. يعتقد بعض الباحثين أن هذه اللوائح الشاملة تمنع بالفعل التقدم في أبحاث العلاج الجيني. في عام 2013، دعا معهد الطب (الآن الأكاديمية الوطنية للطب) المعاهد الوطنية للطب إلى تخفيف مراجعتها لتجارب العلاج الجيني في معظم الحالات. 2 ومع ذلك، لا يزال ضمان سلامة المرضى يمثل مصدر قلق كبير.
مخاوف أخلاقية
بالإضافة إلى المخاطر الصحية للعلاج الجيني، تطرح القدرة على التعديل الجيني للبشر عددًا من القضايا الأخلاقية المتعلقة بحدود مثل هذا «العلاج». بينما تركز الأبحاث الحالية على العلاج الجيني للأمراض الوراثية، قد يطبق العلماء يومًا ما هذه الأساليب لمعالجة الصفات الجينية الأخرى التي لا يُنظر إليها على أنها مرغوبة. هذا يثير أسئلة مثل:
التمارين\(\PageIndex{2}\)
- ما هي الصفات الجينية التي تستحق «تصحيحها»؟
- هل يجب استخدام العلاج الجيني لأسباب تجميلية أو لتعزيز القدرات البشرية؟
- هل يجب استخدام التلاعب الجيني لنقل الصفات المرغوبة إلى الجنين؟
- هل يحق للجميع الحصول على العلاج الجيني، أو هل يمكن أن تخلق تكلفة العلاج الجيني أشكالًا جديدة من عدم المساواة الاجتماعية؟
- من يجب أن يكون مسؤولاً عن تنظيم ومراقبة الاستخدام غير المناسب للعلاجات الجينية؟
إن القدرة على تغيير الخلايا التناسلية باستخدام العلاج الجيني يمكن أن تولد أيضًا معضلات أخلاقية جديدة. حتى الآن، تم استهداف الأنواع المختلفة من العلاجات الجينية للخلايا الجسدية، والخلايا غير التناسلية داخل الجسم. نظرًا لأن سمات الخلايا الجسدية ليست موروثة، فإن أي تغييرات جينية يتم تحقيقها عن طريق العلاج الجيني للخلايا الجسدية لن تنتقل إلى النسل. ومع ذلك، إذا نجح العلماء في إدخال جينات جديدة إلى الخلايا الجرثومية (البيض أو الحيوانات المنوية)، فقد تنتقل الصفات الناتجة إلى النسل. يمكن استخدام هذا النهج، المسمى بالعلاج الجيني الجرثومي، لمكافحة الأمراض الوراثية، ولكنه قد يؤدي أيضًا إلى عواقب غير مقصودة للأجيال القادمة. علاوة على ذلك، هناك مسألة الموافقة المستنيرة، لأن المتضررين من العلاج الجيني الجرثومي لا يولدون بعد وبالتالي لا يستطيعون اختيار ما إذا كانوا يتلقون العلاج أم لا. لهذه الأسباب، لا تمول حكومة الولايات المتحدة حاليًا مشاريع بحثية تبحث في العلاجات الجينية الجرثومية في البشر.
العلاجات الجينية الخطرة
على الرغم من عدم وجود علاجات جينية حاليًا في السوق في الولايات المتحدة، إلا أن العديد منها في طور الإعداد ومن المحتمل أن تتم الموافقة على بعضها في النهاية. مع التطورات الحديثة في العلاجات الجينية التي تستهدف p53، وهو جين كانت طفرات الخلايا الجسدية متورطة في أكثر من 50٪ من السرطانات البشرية، يمكن أن تصبح 3 علاجات للسرطان من خلال العلاجات الجينية أكثر انتشارًا بمجرد وصولها إلى السوق التجارية.
طرح أي علاج جديد في السوق أسئلة أخلاقية تضع الفوائد المتوقعة مقابل المخاطر. ما مدى السرعة التي يجب أن يتم بها طرح العلاجات الجديدة في السوق؟ كيف يمكننا التأكد من اختبار العلاجات الجديدة بشكل كافٍ من أجل السلامة والفعالية قبل تسويقها للجمهور؟ تؤدي العملية التي يتم من خلالها تطوير العلاجات الجديدة والموافقة عليها إلى تعقيد مثل هذه الأسئلة، حيث يتعرض المشاركون في عملية الموافقة غالبًا لضغوط كبيرة للحصول على موافقة علاج جديد حتى في مواجهة مخاطر كبيرة.
للحصول على موافقة إدارة الغذاء والدواء الأمريكية (FDA) على علاج جديد، يجب على الباحثين جمع بيانات معملية مهمة من التجارب على الحيوانات وتقديم طلب البحث عن عقار جديد (IND) إلى مركز تقييم الأدوية والبحوث (CDER) التابع لإدارة الغذاء والدواء (FDA). بعد فترة انتظار مدتها 30 يومًا تقوم خلالها إدارة الغذاء والدواء الأمريكية بمراجعة IND، قد تبدأ التجارب السريرية التي تشمل البشر. إذا لاحظت إدارة الغذاء والدواء الأمريكية وجود مشكلة قبل أو أثناء التجربة السريرية، يمكن لإدارة الغذاء والدواء أن تطلب «الحجز السريري» حتى تتم معالجة أي مشاكل. أثناء التجارب السريرية، يقوم الباحثون بجمع وتحليل البيانات حول فعالية العلاج وسلامته، بما في ذلك أي آثار جانبية تمت ملاحظتها. بمجرد أن يفي العلاج بمعايير إدارة الغذاء والدواء الأمريكية (FDA) للفعالية والسلامة، يمكن للمطورين تقديم تطبيق دوائي جديد (NDA) يوضح بالتفصيل كيفية تصنيع العلاج وتعبئته ومراقبته وإدارته.
نظرًا لأن العلاجات الجينية الجديدة غالبًا ما تكون نتيجة لسنوات عديدة (حتى عقود) من الأبحاث المختبرية والسريرية، فإنها تتطلب استثمارًا ماليًا كبيرًا. بحلول الوقت الذي يصل فيه العلاج إلى مرحلة التجارب السريرية، تكون المخاطر المالية عالية لشركات الأدوية ومساهميها. يؤدي هذا إلى تضارب محتمل في المصالح يمكن أن يؤثر أحيانًا على الحكم الموضوعي للباحثين ومموليهم وحتى المشاركين في التجربة. تعتبر قضية جيسي جيلسنغر (انظر الحالة في النقطة: العلاج الجيني حدث خطأ) مثالًا كلاسيكيًا. في مواجهة مرض يهدد الحياة وعدم توفر علاجات معقولة، من السهل معرفة سبب حرص المريض على المشاركة في تجربة سريرية بغض النظر عن المخاطر. من السهل أيضًا رؤية كيف يمكن للباحث أن ينظر إلى المخاطر قصيرة المدى لمجموعة صغيرة من المشاركين في الدراسة على أنها ثمن صغير يدفعه مقابل الفوائد المحتملة للعلاج الجديد الذي يغير قواعد اللعبة.
أدت وفاة جيلسنغر إلى زيادة التدقيق في العلاج الجيني، وأدت النتائج السلبية اللاحقة للعلاج الجيني إلى وقف مؤقت للتجارب السريرية في انتظار مزيد من التحقيق. على سبيل المثال، عندما بدأ الأطفال في فرنسا الذين عولجوا بالعلاج الجيني لـ SCID في الإصابة بسرطان الدم بعد عدة سنوات من العلاج، أوقفت إدارة الغذاء والدواء الأمريكية مؤقتًا التجارب السريرية لأنواع مماثلة من العلاج الجيني التي تحدث في الولايات المتحدة. 4 تسلط مثل هذه الحالات الضوء على حاجة الباحثين والمهنيين الصحيين ليس فقط إلى تقدير رفاهية الإنسان وحقوق المرضى على الربحية، ولكن أيضًا للحفاظ على الموضوعية العلمية عند تقييم مخاطر وفوائد العلاجات الجديدة.
التمارين\(\PageIndex{3}\)
- لماذا يتم تنظيم أبحاث العلاج الجيني بإحكام؟
- ما هو الشاغل الأخلاقي الرئيسي المرتبط بالعلاج الجيني الجرثومي؟
المفاهيم الأساسية والملخص
- في حين أن العلاج الجيني يبشر بالخير في علاج الأمراض الوراثية، إلا أن هناك أيضًا مخاطر كبيرة.
- هناك لوائح فيدرالية ومحلية كبيرة لتطوير العلاجات الجينية من قبل شركات الأدوية لاستخدامها في البشر.
- قبل أن يزداد استخدام العلاج الجيني بشكل كبير، هناك العديد من القضايا الأخلاقية التي يجب معالجتها من قبل المجتمعات الطبية والبحثية والسياسيين والمجتمع ككل.
الحواشي
- 1 باربرا سيبالد. «الموت ولكن نتيجة واحدة غير مقصودة لتجربة العلاج الجيني.» مجلة الجمعية الطبية الكندية 164 رقم 11 (2001): 1612-1612.
- 2 كيري جرينز. «تقرير: سهولة مراجعات العلاج الجيني.» ذا ساينتست، 9 ديسمبر 2013. http://www.the-scientist.com/?articl...erapy-Reviews/. تم الوصول إليه في 27 مايو 2016.
- 3 تشن وانغ ويي سون. «استهداف p53 للعلاج الجديد المضاد للسرطان.» علم الأورام الانتقالي 3، رقم 1 (2010): 1-12.
- 4 إريكا تشيك. «العلاج الجيني: نكسة مأساوية.» الطبيعة 420 رقم 6912 (2002): 116-118.


