7.4: البروتينات
- Page ID
- 194967
أهداف التعلم
- وصف البنية الأساسية للحمض الأميني
- وصف الهياكل الكيميائية للبروتينات
- لخص الخصائص الفريدة للبروتينات
في بداية هذا الفصل، تم وصف تجربة شهيرة قام فيها العلماء بتصنيع الأحماض الأمينية في ظل ظروف تحاكي تلك الموجودة على الأرض قبل وقت طويل من تطور الحياة كما نعرفها. هذه المركبات قادرة على الترابط معًا بشكل أساسي بأي رقم، وتنتج جزيئات من أي حجم تمتلك مجموعة واسعة من الخصائص الفيزيائية والكيميائية وتؤدي العديد من الوظائف الحيوية لجميع الكائنات الحية. يمكن أن تعمل الجزيئات المشتقة من الأحماض الأمينية كمكونات هيكلية للخلايا والكيانات دون الخلوية، وكمصادر للمغذيات، وكخزانات لتخزين الذرة والطاقة، وكأنواع وظيفية مثل الهرمونات والإنزيمات والمستقبلات وجزيئات النقل.
الأحماض الأمينية وروابط الببتيد
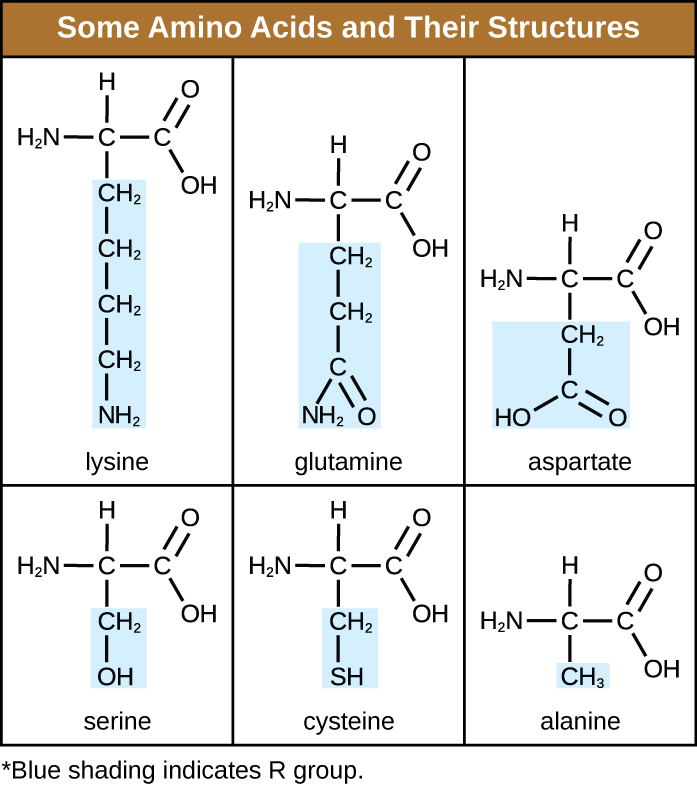
الحمض الأميني هو جزيء عضوي يتم فيه ربط كل من ذرة الهيدروجين ومجموعة الكربوكسيل (—COOH) والمجموعة الأمينية (—NH 2) بنفس ذرة الكربون، والتي تسمى كربون ألفا. تختلف المجموعة الرابعة المرتبطة بكربون ألفا بين الأحماض الأمينية المختلفة وتسمى البقايا أو السلسلة الجانبية، ممثلة في الصيغ الهيكلية بالحرف R. البقايا هي مونومر ينتج عندما يتحد اثنان أو أكثر من الأحماض الأمينية ويزيلان جزيئات الماء. يتكون الهيكل الأساسي للبروتين، سلسلة الببتيد، من بقايا الأحماض الأمينية. تسمح الخصائص الفريدة للمجموعات الوظيفية ومجموعات R لهذه المكونات من الأحماض الأمينية بتكوين روابط هيدروجينية وأيونية وثنائية كبريتيد، إلى جانب التفاعلات القطبية/غير القطبية اللازمة لتشكيل هياكل بروتينية ثانوية وثالثية ورباعية. تتكون هذه المجموعات بشكل أساسي من الكربون والهيدروجين والأكسجين والنيتروجين والكبريت، في شكل هيدروكربونات وأحماض وأميدات وكحولات وأمينات. يتم توفير بعض الأمثلة التي توضح هذه الاحتمالات في الشكل\(\PageIndex{1}\).
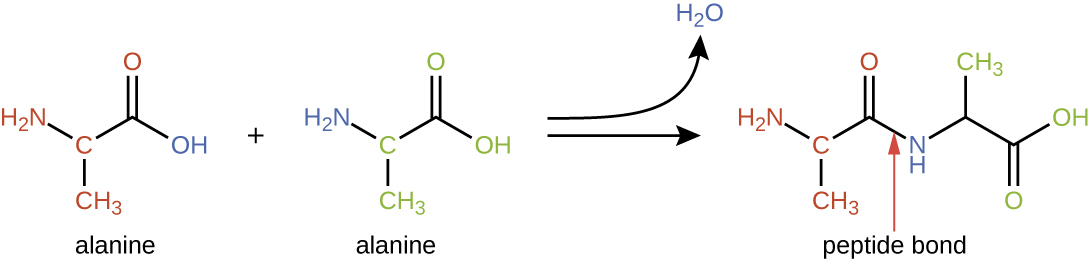
قد ترتبط الأحماض الأمينية كيميائيًا معًا عن طريق تفاعل مجموعة حمض الكربوكسيل لجزيء مع مجموعة الأمين في جزيء آخر. يشكل هذا التفاعل رابطة ببتيد وجزيء مائي وهو مثال آخر على تخليق الجفاف (الشكل\(\PageIndex{2}\)). تسمى الجزيئات المتكونة عن طريق الربط الكيميائي لأعداد متواضعة نسبيًا من الأحماض الأمينية (حوالي 50 أو أقل) الببتيدات، وغالبًا ما تستخدم البادئات لتحديد هذه الأرقام: ثنائي الببتيدات (اثنان من الأحماض الأمينية)، والببتيدات الثلاثية (ثلاثة أحماض أمينية)، وما إلى ذلك. بشكل عام، يتم تحديد العدد التقريبي للأحماض الأمينية: تتكون أوليغوببتيد من خلال ضم ما يصل إلى 20 حمضًا أمينيًا تقريبًا، بينما يتم تصنيع البولي ببتيدات من ما يصل إلى 50 حمضًا أمينيًا تقريبًا. عندما يصبح عدد الأحماض الأمينية المرتبطة ببعضها كبيرًا جدًا، أو عندما يتم استخدام العديد من الببتيدات المتعددة كوحدات فرعية للبناء، فإن الجزيئات الكبيرة الناتجة تسمى البروتينات. يسمح الطول المتغير باستمرار (عدد المونومرات) لهذه البوليمرات الحيوية، جنبًا إلى جنب مع تنوع مجموعات R الممكنة على كل حمض أميني، بتنوع غير محدود تقريبًا في أنواع البروتينات التي يمكن تشكيلها.
التمارين\(\PageIndex{1}\)
كم عدد الأحماض الأمينية الموجودة في بولي ببتيدات؟
هيكل البروتين
يعد الحجم (الطول) وتسلسل الأحماض الأمينية المحدد للبروتين من المحددات الرئيسية لشكله، وشكل البروتين أمر بالغ الأهمية لوظيفته. على سبيل المثال، في عملية التثبيت البيولوجي للنيتروجين (انظر الدورات البيوجيوكيميائية)، تتفاعل الكائنات الحية الدقيقة في التربة المعروفة مجتمعة باسم الريزوبيا بشكل تكافلي مع جذور النباتات البقولية مثل فول الصويا أو الفول السوداني أو الفول لتشكيل بنية جديدة تسمى العقدة على جذور النباتات. ينتج النبات بعد ذلك بروتينًا حاملًا يسمى ليغيموغلوبين، وهو بروتين يحمل النيتروجين أو الأكسجين. يرتبط Leghemoglobin بتقارب كبير جدًا مع الأكسجين الأساسي في منطقة معينة من البروتين حيث يكون الشكل وتسلسل الأحماض الأمينية مناسبين (الموقع النشط). إذا تم تغيير الشكل أو البيئة الكيميائية للموقع النشط، حتى ولو بشكل طفيف، فقد لا تتمكن الركيزة من الارتباط بقوة، أو قد لا ترتبط على الإطلاق. وبالتالي، لكي يكون البروتين نشطًا بشكل كامل، يجب أن يكون له الشكل المناسب لوظيفته.
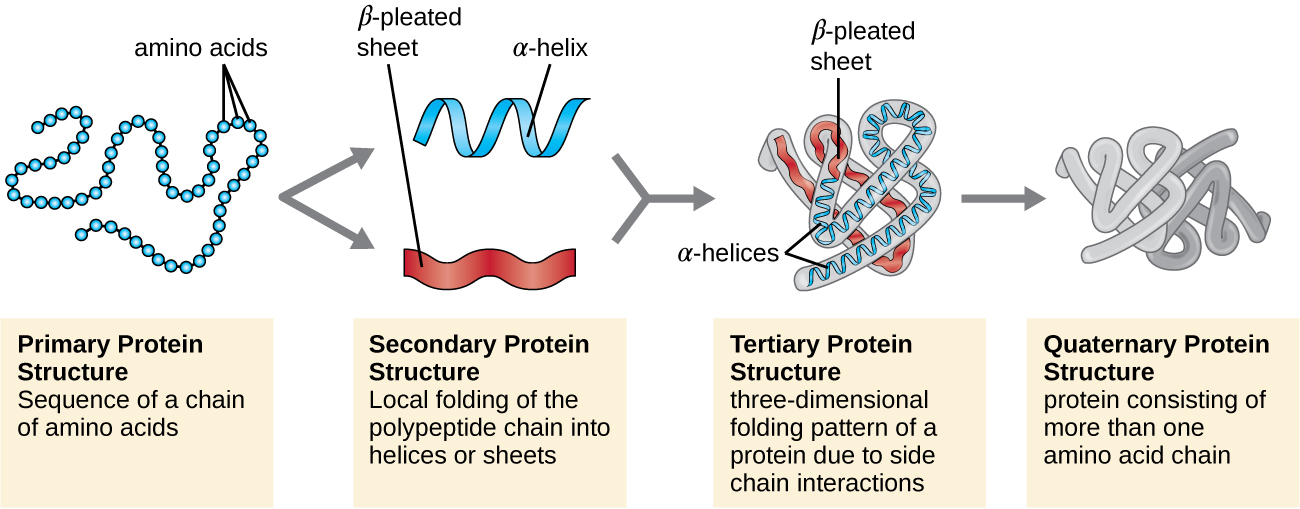
يتم تصنيف بنية البروتين من حيث أربعة مستويات: الابتدائية والثانوية والثالثية والرباعية. الهيكل الأساسي هو ببساطة تسلسل الأحماض الأمينية التي تشكل سلسلة البولي ببتيد. \(\PageIndex{3}\)يوضح الشكل البنية الأساسية للبروتين.
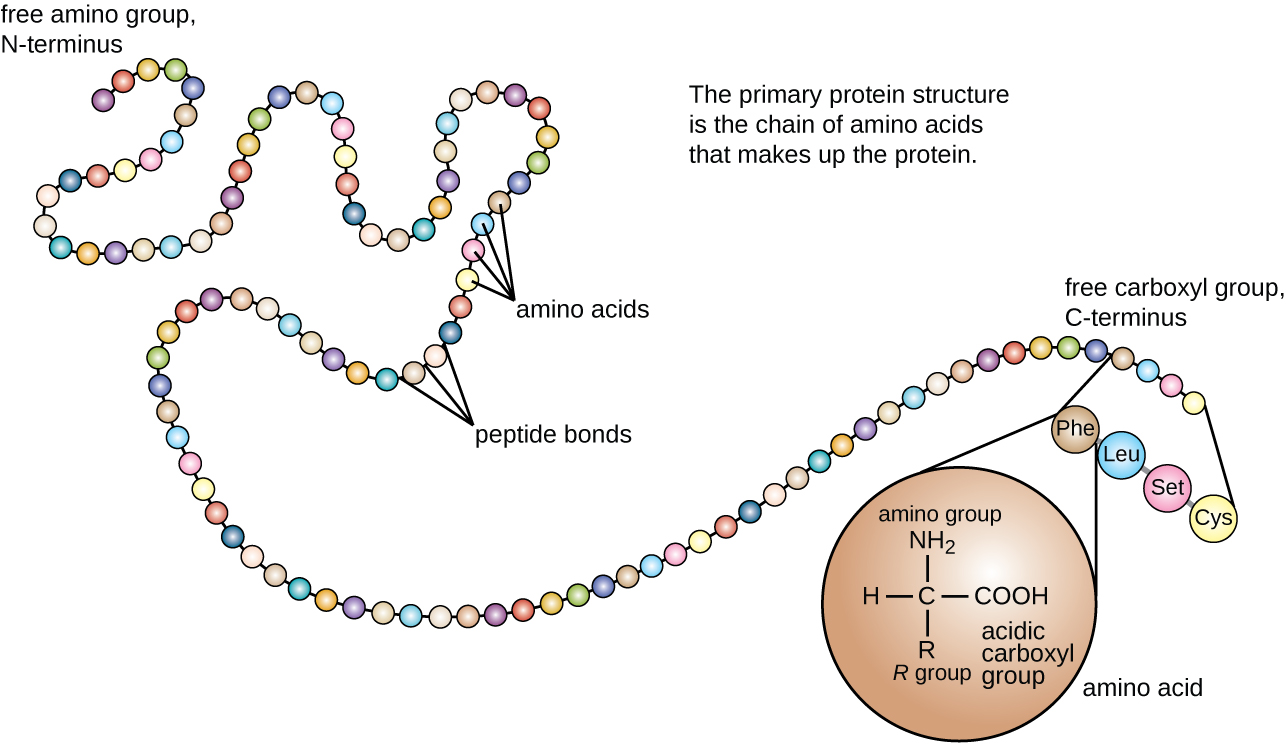
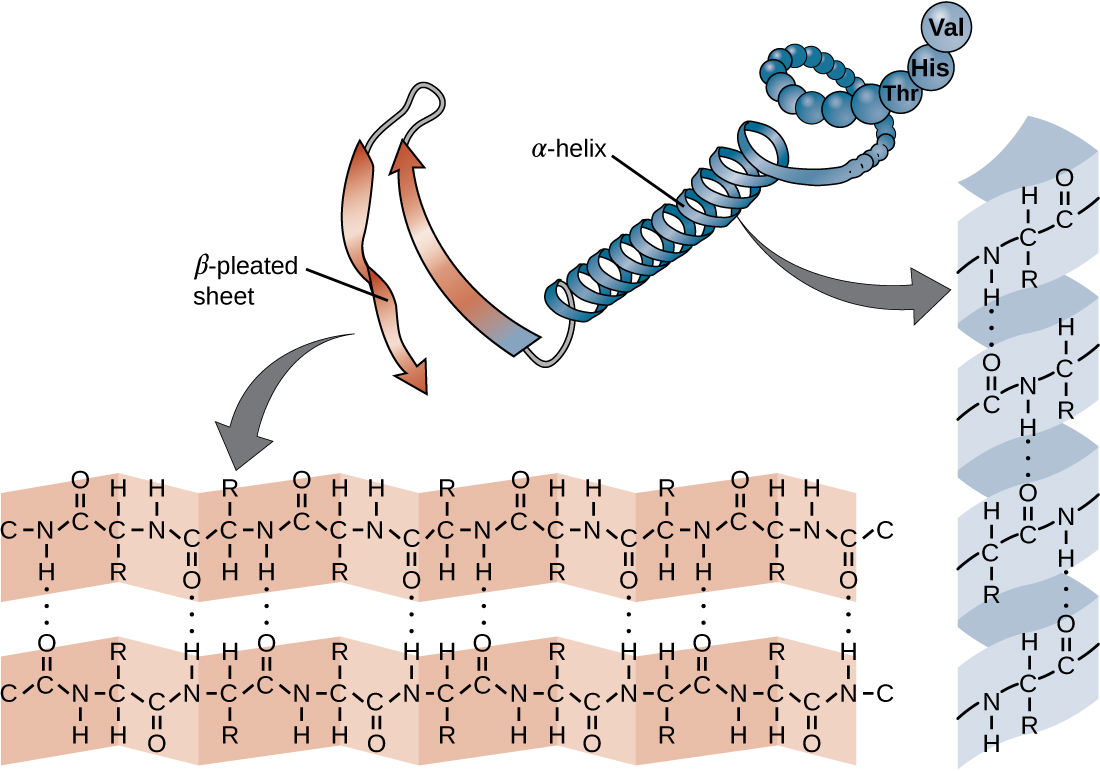
سلسلة الأحماض الأمينية التي تحدد البنية الأساسية للبروتين ليست صلبة، ولكنها بدلاً من ذلك مرنة بسبب طبيعة الروابط التي تربط الأحماض الأمينية معًا. عندما تكون السلسلة طويلة بما فيه الكفاية، قد يحدث الترابط الهيدروجيني بين المجموعات الوظيفية للأمين والكربونيل داخل العمود الفقري للببتيد (باستثناء المجموعة الجانبية R)، مما يؤدي إلى طي موضعي لسلسلة البولي ببتيد إلى حلزون وألواح. تشكل هذه الأشكال البنية الثانوية للبروتين. الهياكل الثانوية الأكثر شيوعًا هي اللولب ألفا والصفائح المطوية بيتا. في بنية ألفا الحلزون، يتم تثبيت اللولب بواسطة روابط هيدروجينية بين ذرة الأكسجين في مجموعة كربونيل من حمض أميني واحد وذرة الهيدروجين للمجموعة الأمينية التي تبعد أربع وحدات فقط من الأحماض الأمينية على طول السلسلة. في الورقة المطوية بالبيتا، تتكون الطيات من روابط هيدروجينية مماثلة بين التسلسلات المستمرة من مجموعات الكربونيل والمجموعات الأمينية التي يتم فصلها بشكل أكبر على العمود الفقري لسلسلة البولي ببتيد (الشكل\(\PageIndex{4}\)).
المستوى التالي من تنظيم البروتين هو البنية الثلاثية، وهي الشكل ثلاثي الأبعاد واسع النطاق لسلسلة بولي ببتيد واحدة. يتم تحديد البنية الثلاثية من خلال التفاعلات بين بقايا الأحماض الأمينية البعيدة في السلسلة. تؤدي مجموعة متنوعة من التفاعلات إلى تكوين التركيبة الثلاثية للبروتين، مثل جسور ثنائي كبريتيد، وهي روابط بين المجموعات الوظيفية للسلفهيدريل (—SH) في المجموعات الجانبية للأحماض الأمينية؛ والروابط الهيدروجينية؛ والروابط الأيونية؛ والتفاعلات الكارهة للماء بين السلاسل الجانبية غير القطبية. تتحد كل هذه التفاعلات، الضعيفة والقوية، لتحديد الشكل النهائي ثلاثي الأبعاد للبروتين ووظيفته (الشكل\(\PageIndex{5}\)).
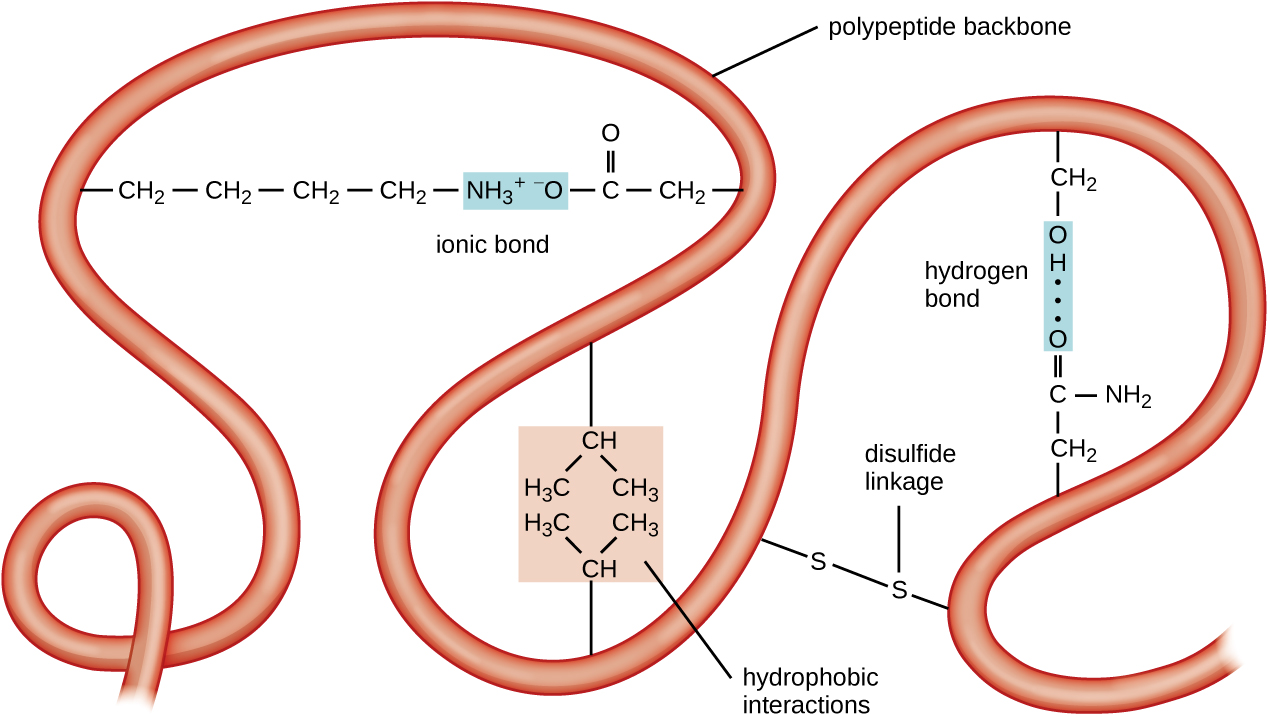
تسمى العملية التي تفترض بها سلسلة البولي ببتيد شكلًا ثلاثي الأبعاد واسع النطاق طي البروتين. يقال إن البروتينات المطوية التي تعمل بكامل طاقتها في دورها البيولوجي الطبيعي تمتلك بنية أصلية. عندما يفقد البروتين شكله ثلاثي الأبعاد، فقد لا يعمل. يتم تغيير طبيعة هذه البروتينات غير المطوية. يشير التشويه إلى فقدان البنية الثانوية والبنية الثالثة (والبنية الرباعية، إن وجدت) دون فقدان البنية الأولية.
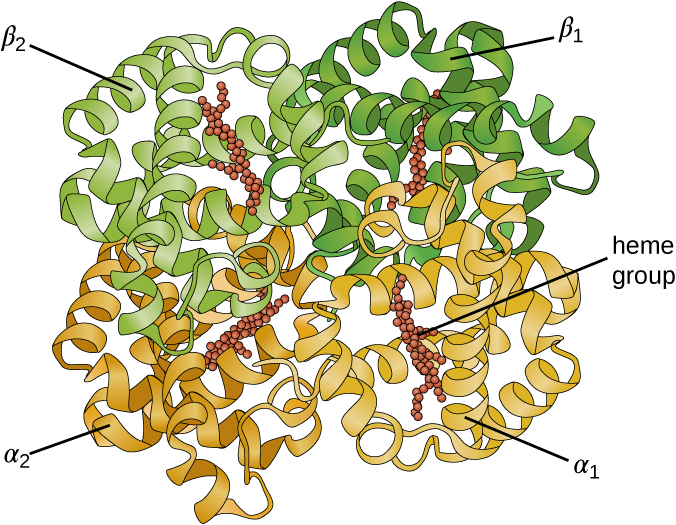
بعض البروتينات عبارة عن مجموعات من عدة بولي ببتيدات منفصلة، تُعرف أيضًا باسم وحدات البروتين الفرعية. تعمل هذه البروتينات بشكل مناسب فقط عند وجود جميع الوحدات الفرعية وتكوينها بشكل مناسب. تشكل التفاعلات التي تجمع هذه الوحدات الفرعية معًا البنية الرباعية للبروتين. تم استقرار الهيكل الرباعي العام من خلال التفاعلات الضعيفة نسبيًا. يحتوي الهيموجلوبين، على سبيل المثال، على بنية رباعية من أربع وحدات فرعية من البروتين الكروي: اثنان ألفا واثنين من بولي ببتيدات بيتا، تحتوي كل واحدة على الهيم القائم على الحديد (الشكل\(\PageIndex{6}\)).
فئة أخرى مهمة من البروتينات هي البروتينات المترافقة التي تحتوي على جزء غير بروتيني. إذا كان البروتين المترافق يحتوي على كربوهيدرات، فإنه يسمى بروتين سكري. إذا كان يحتوي على دهون، فإنه يسمى البروتين الدهني. هذه البروتينات هي مكونات مهمة للأغشية. \(\PageIndex{7}\)يلخص الشكل المستويات الأربعة لبنية البروتين.
التمارين\(\PageIndex{2}\)
ماذا يمكن أن يحدث إذا تم تغيير البنية الأولية أو الثانوية أو الثالثة أو الرباعية للبروتين؟
الهيكل الأساسي والبروتينات المختلة والتليف الكيسي
يتم تصنيف البروتينات المرتبطة بالأغشية البيولوجية على أنها خارجية أو جوهرية. ترتبط البروتينات الخارجية، والتي تسمى أيضًا البروتينات الطرفية، ارتباطًا وثيقًا بجانب واحد من الغشاء. البروتينات الجوهرية، أو البروتينات المتكاملة، مدمجة في الغشاء وغالبًا ما تعمل كجزء من أنظمة النقل كبروتينات عبر الغشاء. التليف الكيسي (CF) هو اضطراب وراثي بشري ناتج عن تغيير في البروتين عبر الغشاء. يؤثر في الغالب على الرئتين ولكنه قد يؤثر أيضًا على البنكرياس والكبد والكلى والأمعاء. يحدث التليف الكيسي بسبب فقدان الحمض الأميني فينيل ألانين في بروتين التليف الكيسي عبر الغشاء (CFTR). يؤدي فقدان أحد الأحماض الأمينية إلى تغيير البنية الأساسية للبروتين الذي يساعد عادة في نقل الملح والماء داخل وخارج الخلايا (الشكل\(\PageIndex{8}\)).
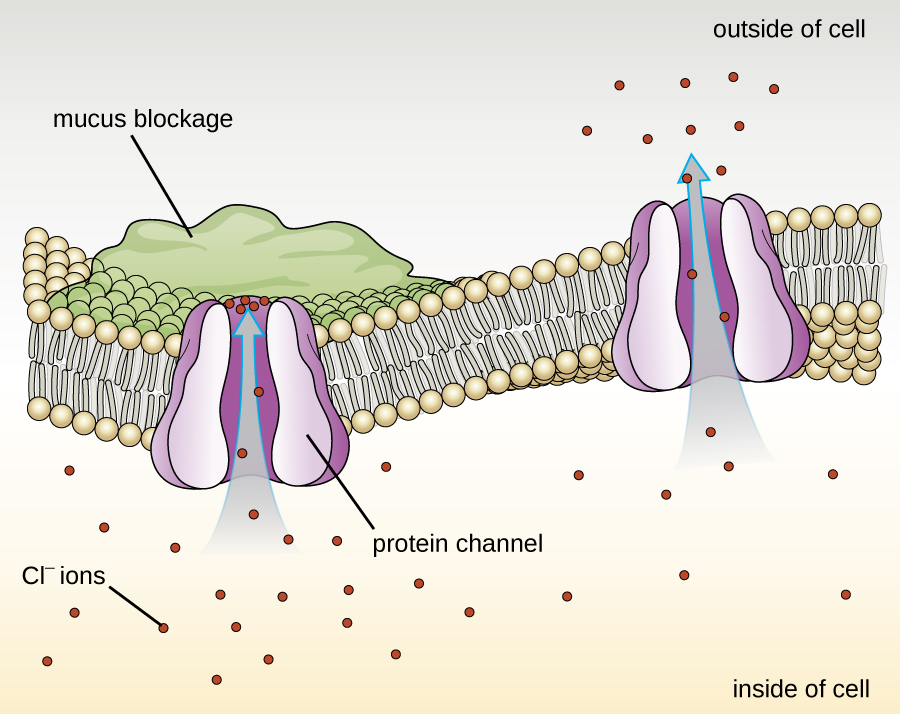
يمنع التغيير في البنية الأولية البروتين من العمل بشكل صحيح، مما يجعل الجسم ينتج مخاطًا سميكًا بشكل غير عادي يسد الرئتين ويؤدي إلى تراكم المخاط اللزج. يعيق المخاط البنكرياس ويمنع الإنزيمات الطبيعية من مساعدة الجسم على تكسير الطعام وامتصاص العناصر الغذائية الحيوية.
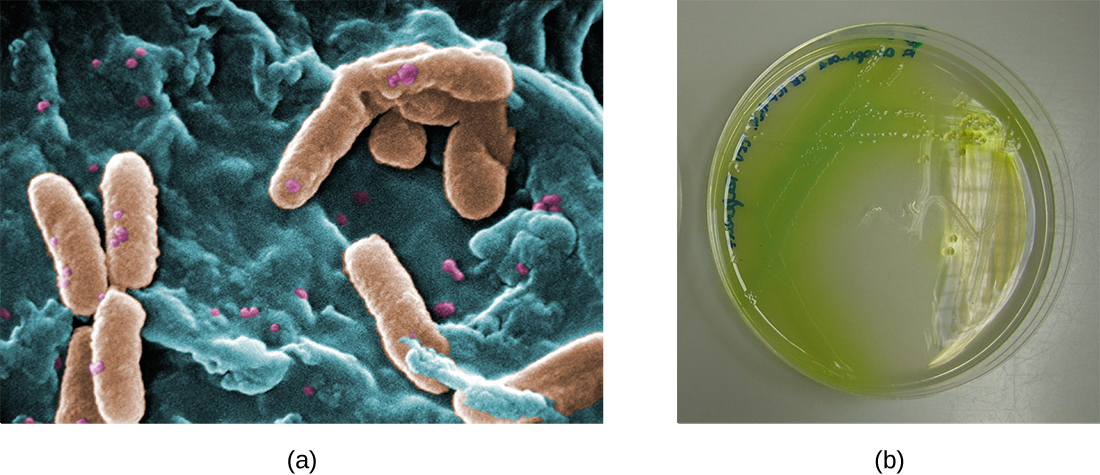
في رئتي الأفراد المصابين بالتليف الكيسي، يوفر المخاط المتغير بيئة يمكن للبكتيريا أن تزدهر فيها. يؤدي هذا الاستعمار إلى تكوين الأغشية الحيوية في الشعب الهوائية الصغيرة للرئتين. أكثر مسببات الأمراض شيوعًا الموجودة في رئتي مرضى التليف الكيسي هي Pseudomonas aeruginosa (الشكل\(\PageIndex{9}\)) و Burkholderia cepacia. تفرق الزائفة داخل الغشاء الحيوي في الرئة وتشكل مستعمرات كبيرة تسمى «الغشاء المخاطي» الزائفة. تحتوي المستعمرات على تصبغ فريد يظهر في الاختبارات المعملية (الشكل\(\PageIndex{9}\)) ويزود الأطباء بأول دليل على أن المريض مصاب بالتليف الكيسي (مثل هذه المستعمرات نادرة في الأفراد الأصحاء).
لمزيد من المعلومات حول التليف الكيسي، قم بزيارة موقع مؤسسة التليف الكيسي.
المفاهيم الأساسية والملخص
- الأحماض الأمينية هي جزيئات صغيرة ضرورية لجميع أشكال الحياة. يحتوي كل منها على كربون ألفا ترتبط به ذرة الهيدروجين ومجموعة الكربوكسيل ومجموعة الأمين. تختلف المجموعة الرابعة المرتبطة، التي يمثلها R، في التركيب الكيميائي والحجم والقطبية والشحنة بين الأحماض الأمينية المختلفة، مما يوفر تباينًا في الخصائص.
- الببتيدات عبارة عن بوليمرات تتكون من ربط الأحماض الأمينية عن طريق تخليق الجفاف. تسمى الروابط بين الأحماض الأمينية المرتبطة روابط الببتيد. قد يختلف عدد الأحماض الأمينية المرتبطة ببعضها البعض من عدد قليل إلى كثير.
- البروتينات عبارة عن بوليمرات تتكون من ربط عدد كبير جدًا من الأحماض الأمينية. وهي تؤدي العديد من الوظائف المهمة في الخلية، حيث تعمل كمغذيات وإنزيمات؛ وجزيئات تخزين الكربون والنيتروجين والطاقة؛ والمكونات الهيكلية.
- تعتبر بنية البروتين من المحددات الحاسمة لوظيفته ويتم وصفها من خلال التصنيف المتدرج: الابتدائي والثانوي والثالثي والرباعي. قد تتعطل البنية الأصلية للبروتين بسبب التشويه، مما يؤدي إلى فقدان تركيبته ذات الترتيب الأعلى ووظيفته البيولوجية.
- تتكون بعض البروتينات من عدة وحدات فرعية منفصلة للبروتين، وهي تفاعل هذه الوحدات الفرعية التي تشكل البنية الرباعية لمركب البروتين.
- تحتوي البروتينات المترافقة على جزء غير بولي ببتيد يمكن أن يكون كربوهيدرات (يشكل بروتين سكري) أو جزء دهني (يشكل بروتينًا شحميًا). هذه البروتينات هي مكونات مهمة للأغشية.


