6.3: العزلة والثقافة وتحديد الفيروسات
- Page ID
- 194556
أهداف التعلم
- ناقش سبب وصف الفيروسات في الأصل كعوامل قابلة للفلترة
- وصف زراعة الفيروسات وجمع العينات والتعامل معها
- قارن التقنيات في الجسم الحي وفي المختبر المستخدمة لزراعة الفيروسات
في بداية هذا الفصل، وصفنا كيف تم استخدام فلاتر Chamberland الخزفية ذات المسام الصغيرة بما يكفي للسماح للفيروسات بالمرور لاكتشاف TMV. اليوم، تم استبدال المرشحات الخزفية بمرشحات غشائية وأجهزة أخرى تستخدم لعزل الفيروسات وتحديدها.
عزل الفيروسات
على عكس البكتيريا، التي يمكن زراعة الكثير منها على وسط غذائي اصطناعي، تتطلب الفيروسات خلية مضيفة حية للتكاثر. يمكن زراعة الخلايا المضيفة المصابة (حقيقية النواة أو بدائية النواة) وتنميتها، ومن ثم يمكن حصاد وسط النمو كمصدر للفيروس. يمكن فصل الفيروسات الموجودة في الوسط السائل عن الخلايا المضيفة إما بالطرد المركزي أو الترشيح. يمكن للفلاتر أن تزيل فعليًا أي شيء موجود في المحلول أكبر من الفيروسات؛ يمكن بعد ذلك جمع الفيروسات في المرشح (الشكل\(\PageIndex{1}\)).
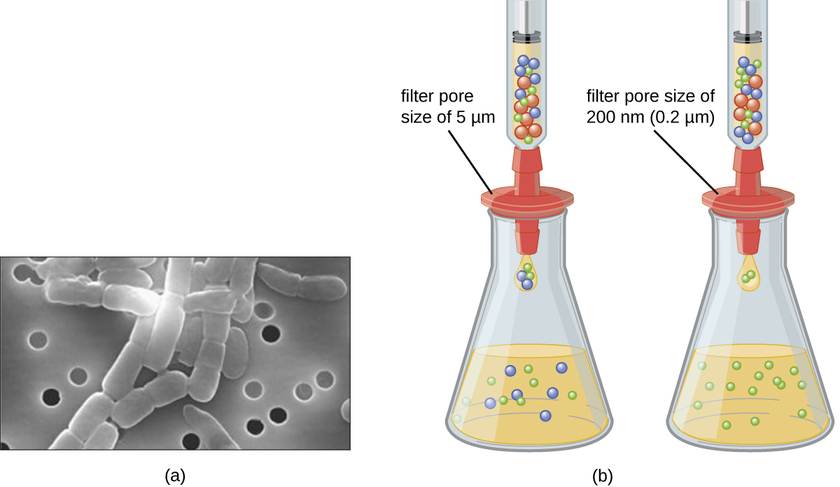
التمارين\(\PageIndex{1}\)
ما حجم مسام المرشح المطلوب لجمع الفيروس؟
زراعة الفيروسات
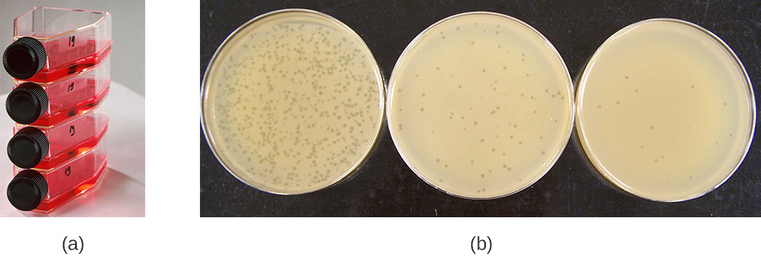
يمكن أن تنمو الفيروسات في الجسم الحي (داخل كائن حي كامل أو نبات أو حيوان) أو في المختبر (خارج الكائن الحي في الخلايا في بيئة اصطناعية، مثل أنبوب الاختبار أو قارورة زراعة الخلايا أو لوحة أجار). يمكن زراعة البكتيريا في وجود طبقة كثيفة من البكتيريا (تسمى أيضًا العشب البكتيري) تنمو في أجار ناعم بنسبة 0.7٪ في طبق بتري أو قارورة مسطحة (أفقية) (الشكل\(\PageIndex{2a}\)). يتم تقليل تركيز الأجار من 1.5٪ المستخدمة عادة في زراعة البكتيريا. يسمح الأجار الناعم بنسبة 0.7% للبكتريا بالانتشار بسهولة عبر الوسط. بالنسبة للبكتريا اللايتية، يمكن بعد ذلك ملاحظة تحلل المضيفين الجرثوميين بسهولة عند اكتشاف منطقة واضحة تسمى اللويحات (الشكل\(\PageIndex{1b}\)). نظرًا لأن البكتيريا تقتل البكتيريا، يتم ملاحظة العديد من اللويحات بين العشب البكتيري الغائم.
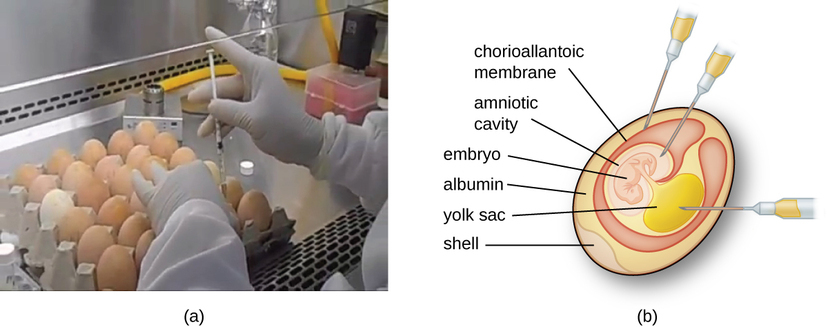
تتطلب الفيروسات الحيوانية خلايا داخل حيوان مضيف أو خلايا زراعة الأنسجة المشتقة من حيوان. تعتبر زراعة الفيروسات الحيوانية مهمة من أجل 1) تحديد وتشخيص الفيروسات المسببة للأمراض في العينات السريرية، 2) إنتاج اللقاحات، و 3) الدراسات البحثية الأساسية. يمكن أن تكون مصادر المضيف في الجسم الحي عبارة عن جنين متطور في بيضة طائر جنيني (مثل الدجاج والديك الرومي) أو حيوان كامل. على سبيل المثال، يتم زراعة معظم لقاح الإنفلونزا الذي يتم تصنيعه لبرامج التطعيم السنوية ضد الإنفلونزا في بيض الدجاج.
يعمل الجنين أو الحيوان المضيف كحاضنة للتكاثر الفيروسي (الشكل\(\PageIndex{3}\)). يعد الموقع داخل الجنين أو الحيوان المضيف أمرًا مهمًا. تحتوي العديد من الفيروسات على جاذبية الأنسجة، وبالتالي يجب إدخالها إلى موقع معين للنمو. داخل الجنين، تشمل المواقع المستهدفة التجويف الأمنيوسي أو الغشاء المشيمي الأنتوني أو كيس الصفار. قد تؤدي العدوى الفيروسية إلى تلف أغشية الأنسجة، وتنتج آفات تسمى الجدري؛ أو تعطل التطور الجنيني؛ أو تتسبب في موت الجنين.
بالنسبة للدراسات المختبرية، يمكن استخدام أنواع مختلفة من الخلايا لدعم نمو الفيروسات. يتم إعداد زراعة الخلايا الأولية حديثًا من الأعضاء أو الأنسجة الحيوانية. يتم استخراج الخلايا من الأنسجة عن طريق الكشط الميكانيكي أو الفرم لإطلاق الخلايا أو بطريقة إنزيمية باستخدام التربسين أو الكولاجيناز لتفتيت الأنسجة وإطلاق خلايا مفردة معلقة. نظرًا لمتطلبات الاعتماد على المرساة، تتطلب مزارع الخلايا الأولية وسيطًا استزراعيًا سائلًا في طبق بتري أو دورق زراعة الأنسجة بحيث يكون للخلايا سطح صلب مثل الزجاج أو البلاستيك للتعلق والنمو. عادة ما يكون للثقافات الأولية عمر محدود. عندما تخضع الخلايا في المزرعة الأولية للانقسام ويتم إنتاج كثافة كافية من الخلايا، تتلامس الخلايا مع الخلايا الأخرى. عندما يحدث هذا الاتصال من خلية إلى خلية، يتم تحفيز الانقسام الفتيلي للتوقف. وهذا ما يسمى بتثبيط الاتصال ويمنع كثافة الخلايا من أن تصبح عالية جدًا. لمنع تثبيط الاتصال، يجب نقل الخلايا من مزرعة الخلايا الأولية إلى وعاء آخر مع وسط نمو جديد. وهذا ما يسمى بزراعة الخلايا الثانوية. بشكل دوري، يجب تقليل كثافة الخلايا عن طريق سكب بعض الخلايا وإضافة وسيط جديد لتوفير المساحة والمواد الغذائية للحفاظ على نمو الخلايا. على عكس مزارع الخلايا الأولية، غالبًا ما تكون خطوط الخلايا المستمرة، المشتقة عادةً من الخلايا أو الأورام المحولة، قادرة على الزراعة الفرعية عدة مرات أو حتى نموها إلى أجل غير مسمى (في هذه الحالة تسمى الخالد). قد لا تظهر خطوط الخلايا المستمرة الاعتماد على الإرساء (ستنمو في حالة تعليق) وربما فقدت تثبيط الاتصال. ونتيجة لذلك، يمكن أن تنمو خطوط الخلايا المستمرة في أكوام أو كتل تشبه نمو الورم الصغير (الشكل\(\PageIndex{4}\)).
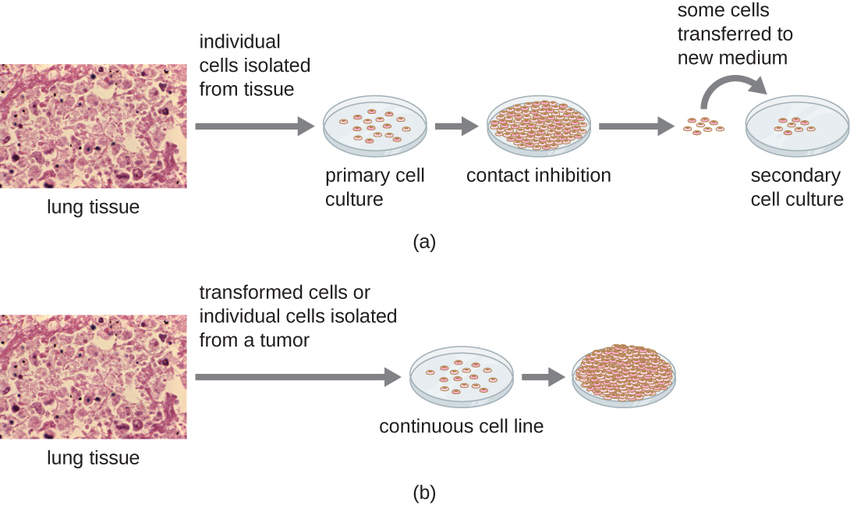
مثال على خط الخلايا الخالدة هو خط خلايا هيلا، الذي تم زراعته في الأصل من الخلايا السرطانية التي تم الحصول عليها من Henrietta Laces، وهي مريضة توفيت بسبب سرطان عنق الرحم في عام 1951. كانت خلايا هيلا أول خط مستمر لزراعة الأنسجة وتم استخدامها لتأسيس زراعة الأنسجة كتقنية مهمة للبحث في بيولوجيا الخلية وعلم الفيروسات والطب. قبل اكتشاف خلايا هيلا، لم يكن العلماء قادرين على إنشاء مزارع الأنسجة بأي موثوقية أو استقرار. بعد أكثر من ستة عقود، لا يزال هذا الخط الخلوي حيًا ويستخدم في الأبحاث الطبية. راجع خط الخلية الخالدة لـ Henrietta Les لقراءة المزيد عن خط الخلية المهم هذا والوسائل المثيرة للجدل التي تم الحصول عليها من خلالها.
التمارين\(\PageIndex{2}\)
ما هي خاصية الخلايا التي تجعل التخفيفات الدورية لثقافات الخلايا الأولية ضرورية؟
يفتقر خط الخلية الخالدة لـ Henrietta
في يناير 1951، تم تشخيص Henrietta Laces، وهي امرأة أمريكية من أصل أفريقي تبلغ من العمر 30 عامًا من بالتيمور، بسرطان عنق الرحم في مستشفى جون هوبكنز. نحن نعلم الآن أن سرطانها كان بسبب فيروس الورم الحليمي البشري (HPV). أدت التأثيرات السيتوباثية للفيروس إلى تغيير خصائص خلاياها في عملية تسمى التحول، والتي تمنح الخلايا القدرة على الانقسام باستمرار. أدت هذه القدرة بالطبع إلى ورم سرطاني أدى في النهاية إلى مقتل السيدة أكسس في أكتوبر عن عمر يناهز 31 عامًا. قبل وفاتها، تم أخذ عينات من خلاياها السرطانية دون علمها أو إذنها. انتهى الأمر بالعينات في نهاية المطاف في حوزة الدكتور جورج جاي، الباحث في الطب الحيوي في جامعة جونز هوبكنز. تمكنت Gey من زراعة بعض الخلايا من عينة Lacks، مما أدى إلى إنشاء ما يُعرف اليوم باسم خط خلايا Hela الخالد. تتمتع هذه الخلايا بالقدرة على العيش والنمو إلى أجل غير مسمى، وحتى اليوم، لا تزال تستخدم على نطاق واسع في العديد من مجالات البحث.
وفقًا لزوج لاكسس، لم تمنح Henrietta ولا الأسرة الإذن للمستشفى لجمع عينة الأنسجة الخاصة بها. في الواقع، لم تكن الأسرة على علم إلا بعد 20 عامًا من وفاة لاكسس بأن خلاياها لا تزال حية وتستخدم بنشاط لأغراض تجارية وبحثية. ومع ذلك، لعبت خلايا هيلا دورًا محوريًا في العديد من الاكتشافات البحثية المتعلقة بشلل الأطفال والسرطان والإيدز، من بين أمراض أخرى. كما تم تسويق الخلايا تجاريًا، على الرغم من أنها لم تحصل أبدًا على براءة اختراع. على الرغم من ذلك، لم تستفد ملكية Henrietta Lacks أبدًا من استخدام الخلايا، على الرغم من أنه في عام 2013، تم منح عائلة Laces السيطرة على نشر التسلسل الجيني لخلاياها.
تثير هذه الحالة العديد من القضايا الأخلاقية الحيوية المحيطة بموافقة المرضى المستنيرة والحق في المعرفة. في الوقت الذي تم فيه أخذ مناديل Laces، لم تكن هناك قوانين أو إرشادات حول الموافقة المستنيرة. هل هذا يعني أنها عوملت بإنصاف في ذلك الوقت? بالتأكيد وفقًا لمعايير اليوم، ستكون الإجابة لا. لا يعتبر حصاد الأنسجة أو الأعضاء من مريض يحتضر دون موافقته أمرًا غير أخلاقي فحسب، بل غير قانوني أيضًا، بغض النظر عما إذا كان مثل هذا الفعل يمكن أن ينقذ حياة مرضى آخرين. هل من الأخلاقي إذن أن يستمر العلماء في استخدام أنسجة Laxes للبحث، على الرغم من الحصول عليها بشكل غير قانوني وفقًا لمعايير اليوم؟
من الناحية الأخلاقية أم لا، تُستخدم خلايا Lackes على نطاق واسع اليوم للعديد من التطبيقات بحيث يستحيل إدراجها جميعًا. هل هذه هي الحالة التي تبرر فيها الغايات الوسائل؟ هل سيكون من دواعي سرورنا أن تعرف عن مساهمتها في العلوم وملايين الأشخاص الذين استفادوا؟ هل تريد تعويض عائلتها عن المنتجات التجارية التي تم تطويرها باستخدام خلاياها؟ أم أنها ستشعر بالانتهاك والاستغلال من قبل الباحثين الذين أخذوا جزءًا من جسدها دون موافقتها؟ لأنه لم يتم سؤالها أبدًا، لن نعرف أبدًا.
الكشف عن فيروس
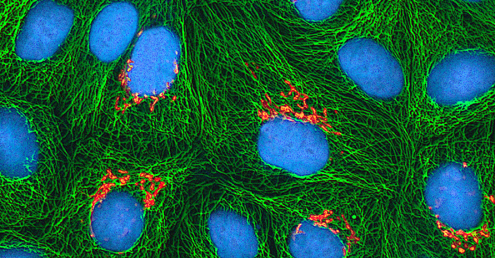
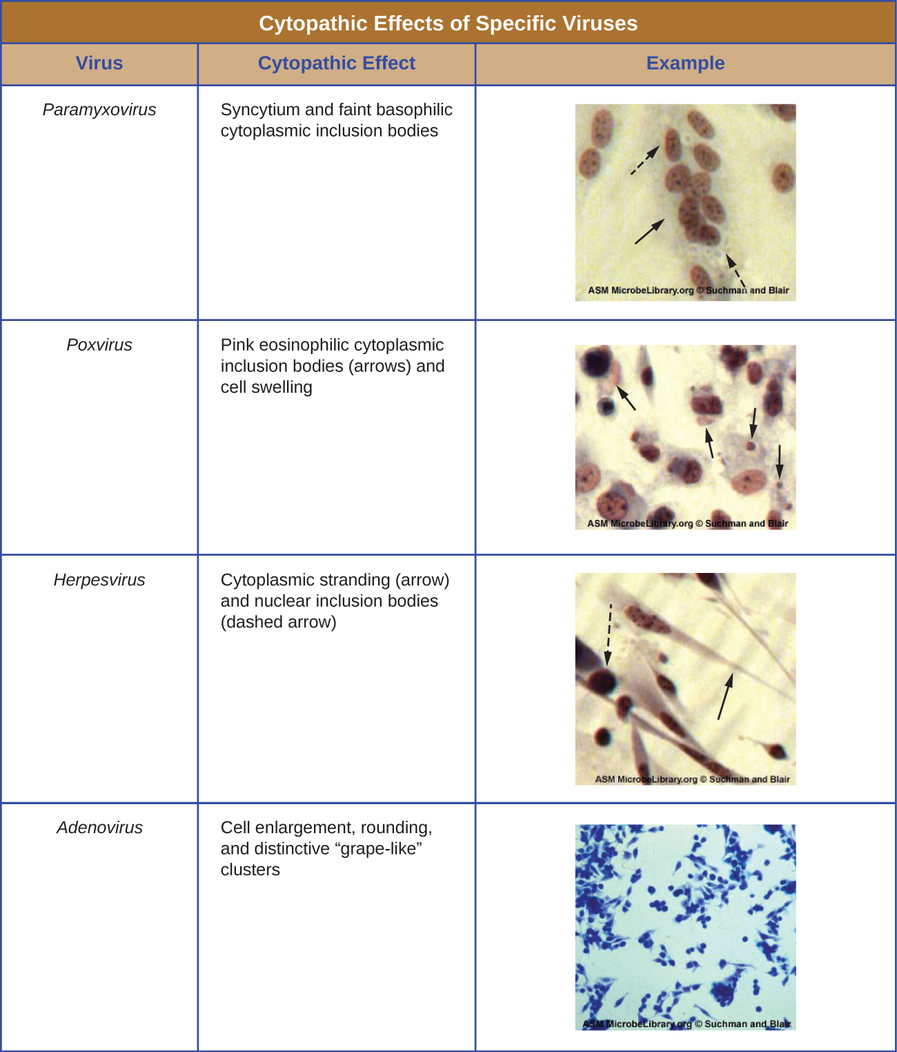
بغض النظر عن طريقة الزراعة، بمجرد إدخال الفيروس إلى الكائن الحي المضيف بأكمله أو الجنين أو خلية زراعة الأنسجة، يمكن تحضير عينة من المضيف المصاب أو الجنين أو خط الخلية لمزيد من التحليل تحت المجهر الضوئي أو الإلكترون أو المجهر الفلوري. التأثيرات السيتوباثية (CPEs) هي تشوهات خلوية مميزة يمكن ملاحظتها بسبب العدوى الفيروسية. يمكن أن تشمل CPEs فقدان الالتصاق بسطح الحاوية، والتغيرات في شكل الخلية من مسطحة إلى دائرية، وانكماش النواة، والفجوات في السيتوبلازم، واندماج الأغشية السيتوبلازمية وتشكيل الخلايا المخلومية متعددة النواة، وتضمين الأجسام في النواة أو السيتوبلازم، والتحلل الكامل للخلايا ( انظر الشكل\(\PageIndex{6}\)).
تشمل التغييرات المرضية الأخرى الاضطراب الفيروسي للجينوم المضيف وتغيير الخلايا الطبيعية إلى خلايا متحولة، وهي أنواع الخلايا المرتبطة بالسرطان والساركوما. يعتمد نوع أو شدة CPE على نوع الفيروس المعني. \(\PageIndex{6}\)يسرد الشكل CPE لفيروسات محددة.
شاهد هذا الفيديو للتعرف على تأثيرات الفيروسات على الخلايا.
فحص التراص الدموي
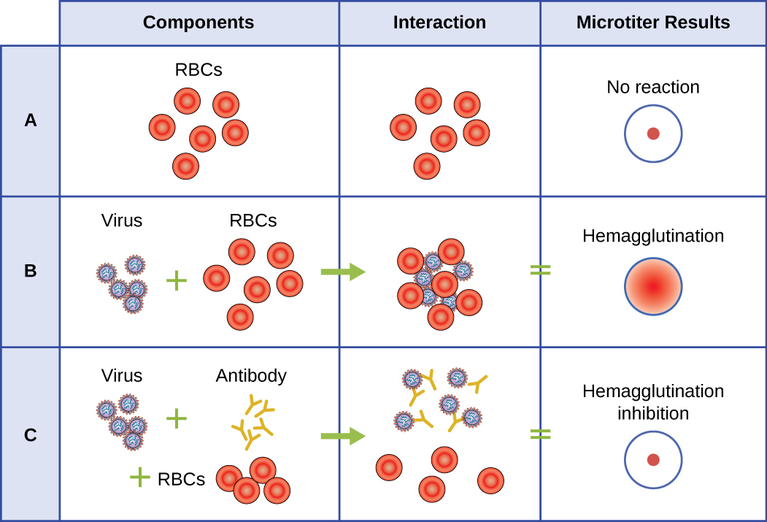
يتم استخدام الفحص المصلي للكشف عن وجود أنواع معينة من الفيروسات في مصل المريض. المصل هو الجزء السائل بلون القش من بلازما الدم الذي تمت إزالة عوامل التخثر منه. يمكن استخدام المصل في اختبار مباشر يسمى اختبار التراص الدموي للكشف عن أنواع معينة من الفيروسات في عينة المريض. التراص الدموي هو تراص (تكتل) كريات الدم الحمراء معًا. تنتج العديد من الفيروسات بروتينات سطحية أو طفرات تسمى الهيماغلوتينين التي يمكن أن ترتبط بالمستقبلات الموجودة على أغشية كريات الدم الحمراء وتتسبب في تراكم الخلايا. يمكن ملاحظة التراص الدموي دون استخدام المجهر، ولكن هذه الطريقة لا تفرق دائمًا بين الجسيمات الفيروسية المعدية وغير المعدية، حيث يمكن لكليهما تكديس كريات الدم الحمراء.
لتحديد فيروس ممرض معين باستخدام التراص الدموي، يجب علينا استخدام نهج غير مباشر. يمكن استخدام البروتينات التي تسمى الأجسام المضادة، والتي يولدها الجهاز المناعي للمريض لمحاربة فيروس معين، للربط بمكونات مثل الهيماغلوتينين التي ترتبط بشكل فريد بأنواع معينة من الفيروسات. يؤدي ارتباط الأجسام المضادة بالهيماجلوتينين الموجود في الفيروس لاحقًا إلى منع كريات الدم الحمراء من التفاعل المباشر مع الفيروس. لذلك عند إضافة كريات الدم الحمراء إلى الفيروسات المغلفة بالأجسام المضادة، لا يوجد أي ظهور للتراص؛ فقد تم منع التراص. نسمي هذه الأنواع من المقايسات غير المباشرة لمقايسات تثبيط تراص الدم للأجسام المضادة الخاصة بالفيروسات (HAI). يمكن استخدام HAI للكشف عن وجود الأجسام المضادة الخاصة بالعديد من أنواع الفيروسات التي قد تسبب أو تسببت في إصابة المريض حتى بعد أشهر أو سنوات من الإصابة (انظر الشكل\(\PageIndex{7}\)). تم وصف هذا الاختبار بمزيد من التفصيل في مقايسات الإلصاق.
التمارين\(\PageIndex{3}\)
ما هي نتيجة اختبار HIA الإيجابي؟
اختبار تضخيم الحمض النووي
تُستخدم اختبارات تضخيم الحمض النووي (NAAT) في البيولوجيا الجزيئية للكشف عن تسلسلات الحمض النووي الفريدة للفيروسات في عينات المرضى. تفاعل البوليميراز المتسلسل (PCR) هو NAAT يستخدم للكشف عن وجود الحمض النووي الفيروسي في أنسجة المريض أو عينة سوائل الجسم. PCR هي تقنية تضخيم (أي تجميع العديد من النسخ) لشريحة الحمض النووي الفيروسي ذات الأهمية. باستخدام PCR، ترتبط تسلسلات قصيرة من النوكليوتيدات تسمى المواد الأولية بتسلسلات محددة من الحمض النووي الفيروسي، مما يتيح التعرف على الفيروس.
النسخ العكسي - PCR (RT-PCR) هو NAAT يستخدم للكشف عن وجود فيروسات RNA. يختلف RT-PCR عن PCR في أن إنزيم النسخ العكسي (RT) يستخدم لصنع cDNA من كمية صغيرة من الحمض النووي الريبي الفيروسي في العينة. يمكن بعد ذلك تضخيم cDNA بواسطة PCR. يتم استخدام كل من PCR و RT-PCR لاكتشاف وتأكيد وجود الحمض النووي الفيروسي في عينات المرضى.
تخويف فيروس الورم الحليمي
جاءت ميشيل، طالبة تمريض تبلغ من العمر 21 عامًا، إلى العيادة الجامعية قلقة من احتمال تعرضها لمرض ينتقل عن طريق الاتصال الجنسي (STD). أصيب شريكها الجنسي مؤخرًا بعدة نتوءات على قاعدة قضيبه. لقد أرجأ الذهاب إلى الطبيب، لكن ميشيل تشتبه في أنها ثآليل تناسلية ناجمة عن فيروس الورم الحليمي البشري. إنها قلقة بشكل خاص لأنها تعرف أن فيروس الورم الحليمي البشري لا يسبب الثآليل فحسب، بل هو سبب بارز لسرطان عنق الرحم. تستخدم هي وشريكها دائمًا الواقي الذكري لمنع الحمل، لكنها ليست واثقة من أن هذا الاحتياط سيحميها من فيروس الورم الحليمي البشري.
لا يجد طبيب ميشيل أي علامات جسدية للثآليل التناسلية أو أي أمراض منقولة جنسيًا أخرى، لكنه يوصي ميشيل بإجراء مسحة عنق الرحم جنبًا إلى جنب مع اختبار فيروس الورم الحليمي البشري. ستقوم مسحة عنق الرحم بفحص خلايا عنق الرحم غير الطبيعية وأجهزة الوقاية الشخصية المرتبطة بفيروس الورم الحليمي البشري؛ سيختبر اختبار فيروس الورم الحليمي البشري وجود الفيروس. إذا كان كلا الاختبارين سلبيًا، فيمكن لميشيل أن تتأكد أكثر من أنها على الأرجح لم تصاب بفيروس الورم الحليمي البشري. ومع ذلك، يشير طبيبها إلى أنه قد يكون من الحكمة أن تحصل ميشيل على تطعيم ضد فيروس الورم الحليمي البشري لحماية نفسها من التعرض المحتمل في المستقبل.
التمارين\(\PageIndex{4}\)
لماذا يطلب طبيب ميشيل اختبارين مختلفين بدلاً من الاعتماد على أحدهما أو الآخر؟
اختبار الإنزيم المناعي
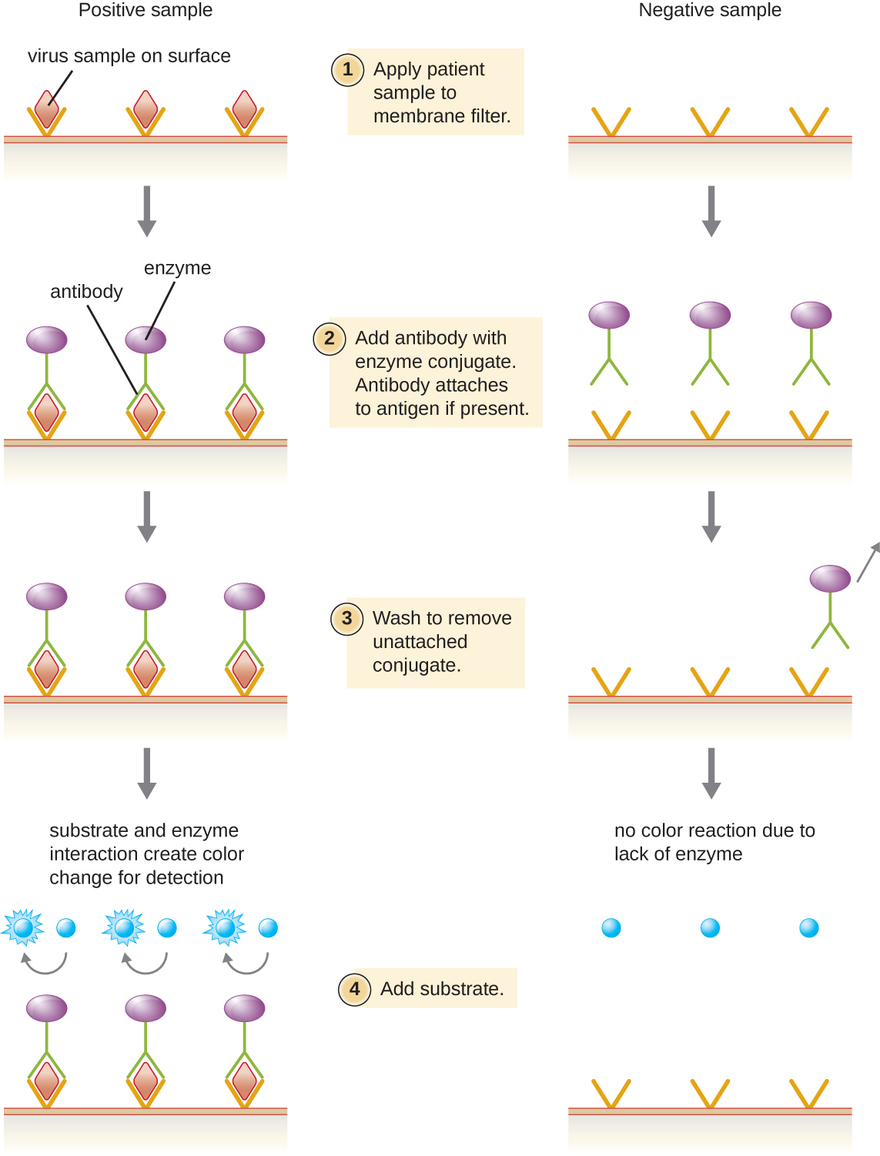
تعتمد المقايسات المناعية الإنزيمية (EIAs) على قدرة الأجسام المضادة على اكتشاف جزيئات حيوية محددة والارتباط بها تسمى المستضدات. يرتبط الجسم المضاد الكاشف بالمستضد المستهدف بدرجة عالية من الخصوصية فيما قد يكون مزيجًا معقدًا من الجزيئات الحيوية. يشتمل هذا النوع من الفحص أيضًا على إنزيم عديم اللون مرتبط بالجسم المضاد الكاشف. يعمل الإنزيم كعلامة على الجسم المضاد الكاشف ويمكن أن يتفاعل مع ركيزة عديمة اللون، مما يؤدي إلى إنتاج منتج نهائي ملون. غالبًا ما تعتمد EIAs على طبقات من الأجسام المضادة لالتقاط المستضدات والتفاعل معها، وكلها مرتبطة بفلتر غشائي (انظر الشكل\(\PageIndex{8}\)). غالبًا ما تُستخدم تقييمات الأثر البيئي للمستضدات الفيروسية كاختبارات فحص أولية. إذا كانت النتائج إيجابية، سيتطلب المزيد من التأكيد اختبارات بحساسية أكبر، مثل البقعة الغربية أو NAAT. تتم مناقشة تقييمات الأثر البيئي بمزيد من التفصيل في EIAs و ElisaS.
التمارين\(\PageIndex{5}\)
ما الذي يشير عادةً إلى اختبار EIA الإيجابي؟
التركيز السريري: الجزء 3
إلى جانب تحليل RT/PCR، تم جمع لعاب ديفيد أيضًا للزراعة الفيروسية. بشكل عام، لا يوجد اختبار تشخيصي واحد كافٍ للتشخيص قبل الوفاة، لأن النتائج ستعتمد على حساسية الفحص، وكمية الفيروسات الموجودة في وقت الاختبار، وتوقيت الفحص، لأن إطلاق الفيروسات في اللعاب يمكن أن يختلف. كما اتضح، كانت النتيجة سلبية للزراعة الفيروسية من اللعاب. هذا ليس مفاجئًا لطبيب ديفيد، لأن إحدى النتائج السلبية ليست مؤشرًا مطلقًا على عدم وجود عدوى. قد يكون عدد الفيروسات في اللعاب منخفضًا في وقت أخذ العينات. ليس من غير المعتاد تكرار الاختبار على فترات لتعزيز فرصة اكتشاف كميات أكبر من الفيروسات.
التمارين\(\PageIndex{6}\)
هل يجب على طبيب ديفيد تعديل مسار علاجه بناءً على نتائج الاختبار هذه؟
ملخص
- تتطلب الزراعة الفيروسية وجود شكل من أشكال الخلايا المضيفة (كائن حي كامل أو جنين أو ثقافة خلية).
- يمكن عزل الفيروسات من العينات عن طريق الترشيح.
- يعتبر المرشح الفيروسي مصدرًا غنيًا للفيريونات المنبعثة.
- يتم اكتشاف البكتيريا من خلال وجود لويحات واضحة على العشب البكتيري.
- يتم اكتشاف الفيروسات الحيوانية والنباتية من خلال تأثيرات الاعتلال الخلوي، والتقنيات الجزيئية (PCR، RT-PCR)، والمقايسات المناعية الإنزيمية، والفحوصات المصلية (مقايسة التراص الدموي، مقايسة تثبيط التراص الدموي).


