2.2: الماء
- Page ID
- 191593
هل تساءلت يومًا لماذا يقضي العلماء وقتًا في البحث عن الماء على كواكب أخرى؟ لأن الماء ضروري للحياة؛ حتى الآثار الدقيقة له على كوكب آخر يمكن أن تشير إلى أن الحياة يمكن أن تكون موجودة أو كانت موجودة بالفعل على هذا الكوكب. الماء هو أحد الجزيئات الأكثر وفرة في الخلايا الحية والأكثر أهمية للحياة كما نعرفها. يتكون ما يقرب من 60-70 بالمائة من جسمك من الماء. بدونها، لن تكون الحياة ببساطة موجودة.
الماء قطبي
تشكل ذرات الهيدروجين والأكسجين داخل جزيئات الماء روابط تساهمية قطبية. تقضي الإلكترونات المشتركة وقتًا مرتبطًا بذرة الأكسجين أكثر مما تقضيه مع ذرات الهيدروجين. لا توجد شحنة إجمالية لجزيء الماء، ولكن هناك شحنة موجبة طفيفة على كل ذرة هيدروجين وشحنة سالبة طفيفة على ذرة الأكسجين. بسبب هذه الشحنات، تتنافر ذرات الهيدروجين الموجبة قليلاً مع بعضها البعض وتشكل الشكل الفريد الموضح في الشكل 2.1.6. يجذب كل جزيء مائي جزيئات الماء الأخرى بسبب الشحنات الموجبة والسالبة في الأجزاء المختلفة من الجزيء. يجذب الماء أيضًا الجزيئات القطبية الأخرى (مثل السكريات)، مما يشكل روابط هيدروجينية. عندما تشكل المادة روابط هيدروجينية بسهولة بالماء، يمكن أن تذوب في الماء ويشار إليها باسم محبة للماء («محبة للماء»). لا تتشكل الروابط الهيدروجينية بسهولة باستخدام مواد غير قطبية مثل الزيوت والدهون (الشكل\(\PageIndex{1}\)). هذه المركبات غير القطبية كارهة للماء («تخشى الماء») ولن تذوب في الماء.

الماء يثبت درجة الحرارة
تسمح الروابط الهيدروجينية في الماء بامتصاص الطاقة الحرارية وإطلاقها بشكل أبطأ من العديد من المواد الأخرى. درجة الحرارة هي مقياس للحركة (الطاقة الحركية) للجزيئات. مع زيادة الحركة، تكون الطاقة أعلى وبالتالي تكون درجة الحرارة أعلى. تمتص المياه قدرًا كبيرًا من الطاقة قبل أن ترتفع درجة حرارتها. تؤدي زيادة الطاقة إلى تعطيل الروابط الهيدروجينية بين جزيئات الماء. نظرًا لأنه يمكن إنشاء هذه الروابط وتعطيلها بسرعة، فإن الماء يمتص الزيادة في الطاقة وتتغير درجة الحرارة بشكل ضئيل فقط. هذا يعني أن الماء يعدل التغيرات في درجات الحرارة داخل الكائنات الحية وفي بيئاتها. مع استمرار إدخال الطاقة، يتأرجح التوازن بين تكوين رابطة الهيدروجين والتدمير نحو جانب التدمير. يتم كسر المزيد من السندات مما يتم تكوينه. تؤدي هذه العملية إلى إطلاق جزيئات الماء الفردية على سطح السائل (مثل الجسم المائي أو أوراق النبات أو جلد الكائن الحي) في عملية تسمى التبخر. يسمح تبخر العرق، الذي يمثل 90 في المائة من الماء، بتبريد الكائن الحي، لأن كسر الروابط الهيدروجينية يتطلب مدخلًا من الطاقة ويزيل الحرارة من الجسم.
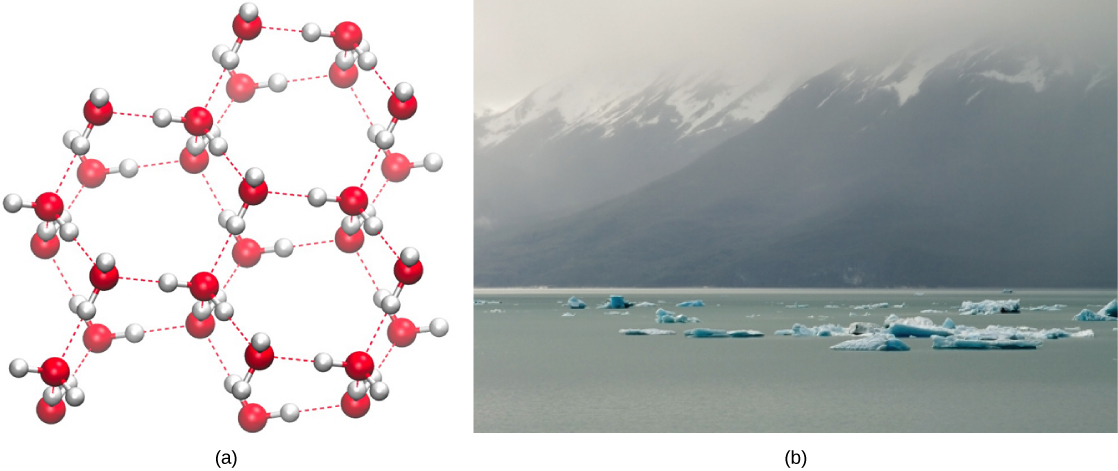
على العكس من ذلك، مع انخفاض الحركة الجزيئية وانخفاض درجات الحرارة، توجد طاقة أقل لكسر الروابط الهيدروجينية بين جزيئات الماء. تظل هذه الروابط سليمة وتبدأ في تشكيل هيكل صلب يشبه الشبكة (مثل الجليد) (الشكل\(\PageIndex{2}\) أ). عند التجميد، يكون الثلج أقل كثافة من الماء السائل (تكون الجزيئات بعيدة عن بعضها البعض). هذا يعني أن الجليد يطفو على سطح جسم مائي (الشكل\(\PageIndex{2}\) ب). في البحيرات والبرك والمحيطات، سيتشكل الجليد على سطح الماء، مما يخلق حاجزًا عازلًا لحماية الحياة الحيوانية والنباتية تحتها من التجمد في الماء. إذا لم يحدث ذلك، فإن النباتات والحيوانات التي تعيش في الماء ستتجمد في كتلة من الجليد ولا يمكنها التحرك بحرية، مما يجعل الحياة في درجات الحرارة الباردة صعبة أو مستحيلة.
الماء مذيب ممتاز
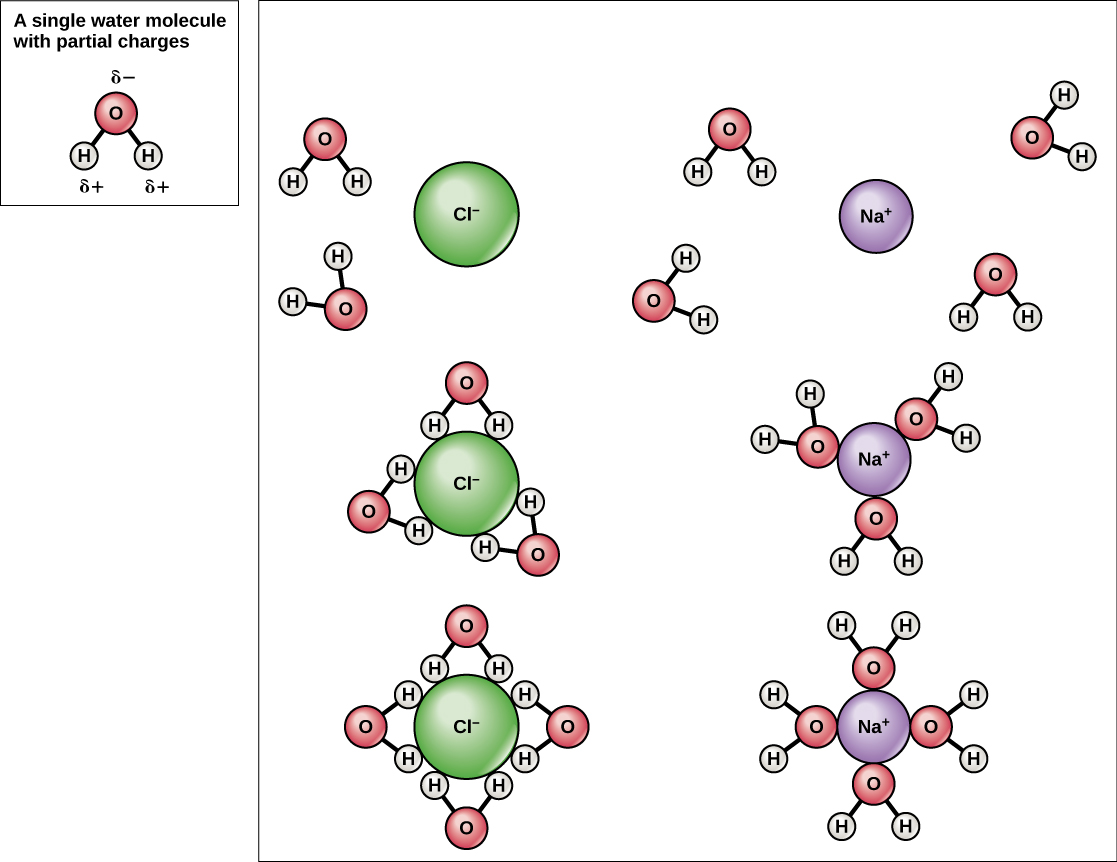
نظرًا لأن الماء قطبي وله شحنات موجبة وسالبة طفيفة، يمكن للمركبات الأيونية والجزيئات القطبية أن تذوب فيه بسهولة. لذلك، فإن الماء هو ما يشار إليه بالمذيب - مادة قادرة على إذابة مادة أخرى. ستشكل الجسيمات المشحونة روابط هيدروجينية مع طبقة محيطة من جزيئات الماء. يشار إلى هذا باسم مجال الترطيب ويعمل على إبقاء الجسيمات منفصلة أو منتشرة في الماء. في حالة ملح الطعام (NaCl) الممزوج بالماء (الشكل\(\PageIndex{3}\))، تنفصل أيونات الصوديوم والكلوريد، أو تتفكك، في الماء، وتتشكل كرات الترطيب حول الأيونات. يُحاط أيون الصوديوم الموجب الشحنة بالشحنات السالبة جزئيًا لذرات الأكسجين في جزيئات الماء. يُحاط أيون الكلوريد سالب الشحنة بالشحنات الموجبة جزئيًا لذرات الهيدروجين في جزيئات الماء. يشار إلى كرات الترطيب هذه أيضًا باسم قشور الترطيب. قطبية جزيء الماء تجعله مذيبًا فعالًا ومهمًا في أدواره العديدة في الأنظمة الحية.
الماء متماسك
هل سبق لك أن ملأت كوبًا من الماء إلى الأعلى ثم أضفت بضع قطرات أخرى ببطء؟ قبل أن يفيض الماء، يشكل الماء في الواقع شكلًا يشبه القبة فوق حافة الزجاج. يمكن أن تبقى هذه المياه فوق الزجاج بسبب خاصية التماسك. في التماسك، تنجذب جزيئات الماء لبعضها البعض (بسبب الترابط الهيدروجيني)، مما يحافظ على الجزيئات معًا عند واجهة الهواء السائل (الغاز)، على الرغم من عدم وجود مساحة أكبر في الزجاج. يؤدي التماسك إلى التوتر السطحي، وقدرة المادة على تحمل التمزق عند وضعها تحت التوتر أو الضغط. عندما تسقط قطعة صغيرة من الورق على قطرة ماء، تطفو الورقة فوق قطرة الماء، على الرغم من أن الجسم يكون أكثر كثافة (أثقل) من الماء. يحدث هذا بسبب التوتر السطحي الناتج عن جزيئات الماء. يحافظ التماسك والتوتر السطحي على سلامة جزيئات الماء والعنصر عائمًا في الأعلى. من الممكن أيضًا «تعويم» إبرة فولاذية فوق كوب من الماء إذا وضعتها برفق، دون كسر التوتر السطحي (الشكل\(\PageIndex{4}\)).

ترتبط هذه القوى المتماسكة أيضًا بخاصية التصاق الماء، أو التجاذب بين جزيئات الماء والجزيئات الأخرى. يُلاحظ ذلك عندما «يتسلق» الماء قشة موضوعة في كوب من الماء. ستلاحظ أن الماء يبدو أعلى على جانبي القش منه في المنتصف. هذا لأن جزيئات الماء تنجذب إلى القش وبالتالي تلتصق به.
القوى المتماسكة واللاصقة مهمة للحفاظ على الحياة. على سبيل المثال، بسبب هذه القوى، يمكن أن يتدفق الماء من الجذور إلى قمم النباتات لتغذية النبات.
مفهوم في العمل
لمعرفة المزيد عن المياه، قم بزيارة المسح الجيولوجي الأمريكي لعلوم المياه للمدارس: كل شيء عن الماء! الموقع الإلكتروني.
المواد العازلة ودرجة الحموضة والأحماض والقواعد
درجة الحموضة في المحلول هي مقياس لحموضته أو قلويته. ربما استخدمت ورق عباد الشمس، وهو ورق تمت معالجته بصبغة طبيعية قابلة للذوبان في الماء بحيث يمكن استخدامه كمؤشر لدرجة الحموضة، لاختبار كمية الحمض أو القاعدة (القلوية) الموجودة في المحلول. ربما استخدمت بعضًا منها للتأكد من معالجة المياه في حمام السباحة الخارجي بشكل صحيح. في كلتا الحالتين، يقيس اختبار درجة الحموضة هذا كمية أيونات الهيدروجين الموجودة في محلول معين. تنتج التركيزات العالية من أيونات الهيدروجين درجة حموضة منخفضة، بينما تؤدي المستويات المنخفضة من أيونات الهيدروجين إلى درجة حموضة عالية. يرتبط التركيز الكلي لأيونات الهيدروجين عكسيًا بدرجة الحموضة ويمكن قياسه على مقياس الأس الهيدروجيني (الشكل\(\PageIndex{5}\)). لذلك، كلما زاد عدد أيونات الهيدروجين، كلما انخفض الرقم الهيدروجيني؛ على العكس من ذلك، كلما قل عدد أيونات الهيدروجين، زادت درجة الحموضة.
يتراوح مقياس درجة الحموضة من 0 إلى 14. يمثل تغيير وحدة واحدة على مقياس pH تغيرًا في تركيز أيونات الهيدروجين بعامل 10، ويمثل التغيير في وحدتين تغيرًا في تركيز أيونات الهيدروجين بعامل 100. وبالتالي، فإن التغييرات الصغيرة في درجة الحموضة تمثل تغيرات كبيرة في تركيزات أيونات الهيدروجين. الماء النقي محايد. إنه ليس حمضيًا ولا أساسيًا، وله درجة حموضة 7.0. أي شيء أقل من 7.0 (يتراوح من 0.0 إلى 6.9) يكون حمضيًا، وأي شيء أعلى من 7.0 (من 7.1 إلى 14.0) يكون قلويًا. يكون الدم في الأوردة قلويًا قليلاً (pH = 7.4). البيئة في معدتك شديدة الحموضة (درجة الحموضة = 1 إلى 2). عصير البرتقال حامضي بشكل معتدل (pH = 3.5 تقريبًا)، في حين أن صودا الخبز أساسية (pH = 9.0).

الأحماض هي مواد توفر أيونات الهيدروجين (H +) ودرجة حموضة أقل، بينما توفر القواعد أيونات الهيدروكسيد (OH -) وترفع درجة الحموضة. كلما كان الحمض أقوى، زادت سهولة التبرع بـ H +. على سبيل المثال، حمض الهيدروكلوريك وعصير الليمون حمضيتان جدًا ويتخليان بسهولة عن H + عند إضافتهما إلى الماء. بالعكس, القواعد هي تلك المواد التي تتبرع بسهولة بـ OH -. تتحد أيونات OH مع H + لإنتاج الماء، مما يرفع درجة حموضة المادة. هيدروكسيد الصوديوم والعديد من المنظفات المنزلية قلوية جدًا وتتخلى عن OH - بسرعة عند وضعها في الماء، مما يؤدي إلى رفع درجة الحموضة.
تعمل معظم الخلايا في أجسامنا ضمن نافذة ضيقة جدًا من مقياس الأس الهيدروجيني، وتتراوح عادةً من 7.2 إلى 7.6 فقط. إذا كان الرقم الهيدروجيني للجسم خارج هذا النطاق، فإن الجهاز التنفسي يتعطل، كما تفعل الأجهزة الأخرى في الجسم. لم تعد الخلايا تعمل بشكل صحيح، وسوف تتحلل البروتينات. يمكن أن يؤدي الانحراف خارج نطاق درجة الحموضة إلى الغيبوبة أو حتى التسبب في الوفاة.
إذن كيف يمكننا تناول أو استنشاق المواد الحمضية أو الأساسية وعدم الموت؟ المخازن المؤقتة هي المفتاح. تمتص المواد العازلة بسهولة زيادة H + أو OH -، مع الحفاظ على درجة الحموضة في الجسم بعناية في النطاق الضيق المذكور أعلاه. يعد ثاني أكسيد الكربون جزءًا من نظام عازل بارز في جسم الإنسان؛ فهو يحافظ على درجة الحموضة ضمن النطاق المناسب. يتضمن هذا النظام العازل حمض الكربوليك (H 2 CO 3) وبيكربونات (HCO 3 -) أنيون. إذا دخل الكثير من H + إلى الجسم، فسوف يتحد البيكربونات مع H + لتكوين حمض الكربونك والحد من انخفاض درجة الحموضة. وبالمثل، إذا تم إدخال الكثير من OH - في النظام، فسوف يتفكك حمض الكربونك بسرعة إلى أيونات البيكربونات و H +. يمكن أن تتحد أيونات H + مع أيونات OH، مما يحد من الزيادة في درجة الحموضة. في حين أن حمض الكربونك منتج مهم في هذا التفاعل، إلا أن وجوده سريع الزوال لأن حمض الكربونك ينطلق من الجسم كغاز ثاني أكسيد الكربون في كل مرة نتنفس فيها. بدون هذا النظام العازل، سوف تتقلب درجة الحموضة في أجسامنا كثيرًا وسنفشل في البقاء على قيد الحياة.
ملخص
يحتوي الماء على العديد من الخصائص الضرورية للحفاظ على الحياة. إنه قطبي، مما يسمح بتكوين روابط هيدروجينية تسمح للأيونات والجزيئات القطبية الأخرى بالذوبان في الماء. لذلك، الماء مذيب ممتاز. تمنح الروابط الهيدروجينية بين جزيئات الماء الماء الماء القدرة على الاحتفاظ بالحرارة بشكل أفضل من العديد من المواد الأخرى. مع ارتفاع درجة الحرارة، تنكسر الروابط الهيدروجينية بين الماء وتتغير باستمرار، مما يسمح لدرجة الحرارة الإجمالية بالبقاء مستقرة، على الرغم من إضافة المزيد من الطاقة إلى النظام. تسمح قوى الماء المتماسكة بخاصية التوتر السطحي. كل هذه الخصائص الفريدة للمياه مهمة في كيمياء الكائنات الحية.
درجة الحموضة في المحلول هي مقياس لتركيز أيونات الهيدروجين في المحلول. يعتبر المحلول الذي يحتوي على عدد كبير من أيونات الهيدروجين حامضيًا وله قيمة pH منخفضة. يعتبر المحلول الذي يحتوي على عدد كبير من أيونات الهيدروكسيد أساسيًا وله قيمة pH عالية. يتراوح مقياس درجة الحموضة من 0 إلى 14، مع كون درجة الحموضة 7 محايدة. المحاليل العازلة هي حلول تعمل على تعديل تغيرات درجة الحموضة عند إضافة حمض أو قاعدة إلى النظام العازل. تعتبر المخازن المؤقتة مهمة في الأنظمة البيولوجية نظرًا لقدرتها على الحفاظ على ظروف درجة الحموضة الثابتة.
الحواشي
- 1 همفري، دبليو، دالك، أ. وشولتن، ك.، «VMD - الديناميكا الجزيئية البصرية»، جيه موليك. الرسومات، 1996، المجلد 14، الصفحات 33-38. http://www.ks.uiuc.edu/Research/vmd/
مسرد المصطلحات
- حامض
- مادة تتبرع بأيونات الهيدروجين وبالتالي تخفض درجة الحموضة
- التصاق
- التجاذب بين جزيئات الماء وجزيئات مادة مختلفة
- أساس
- مادة تمتص أيونات الهيدروجين وبالتالي ترفع درجة الحموضة
- مخفف صدمة
- محلول يقاوم التغير في درجة الحموضة عن طريق امتصاص أو إطلاق أيونات الهيدروجين أو الهيدروكسيد
- التماسك
- القوى بين الجزيئات بين جزيئات الماء الناتجة عن الطبيعة القطبية للمياه؛ تخلق التوتر السطحي
- تبخر
- إطلاق جزيئات الماء من الماء السائل لتشكيل بخار الماء
- محبة للماء
- يصف مادة تذوب في الماء؛ محبة للماء
- نافرة من الماء
- يصف مادة لا تذوب في الماء؛ خوفًا من الماء
- ورق عباد الشمس
- ورق فلتر تمت معالجته بصبغة طبيعية قابلة للذوبان في الماء بحيث يمكن استخدامه كمؤشر لدرجة الحموضة
- مقياس درجة الحموضة
- مقياس يتراوح من 0 إلى 14 يقيس التركيز التقريبي لأيونات الهيدروجين للمادة
- مذيب
- مادة قادرة على إذابة مادة أخرى
- التوتر السطحي
- القوة المتماسكة على سطح الجسم السائل التي تمنع الجزيئات من الانفصال
- درجة الحرارة
- مقياس الحركة الجزيئية



