2.1: اللبنات الأساسية للجزيئات
- Page ID
- 191582
في أبسط مستوياتها، تتكون الحياة من المادة. المادة تحتل الفضاء ولها كتلة. تتكون جميع المواد من عناصر ومواد لا يمكن تكسيرها أو تحويلها كيميائيًا إلى مواد أخرى. يتكون كل عنصر من الذرات، ولكل منها عدد ثابت من البروتونات والخصائص الفريدة. تم تحديد ما مجموعه 118 عنصرًا؛ ومع ذلك، يوجد 92 عنصرًا فقط بشكل طبيعي، ويوجد أقل من 30 عنصرًا في الخلايا الحية. العناصر الـ 26 المتبقية غير مستقرة، وبالتالي فهي غير موجودة لفترة طويلة جدًا أو نظرية ولم يتم اكتشافها بعد.
يتم تحديد كل عنصر برمزه الكيميائي (مثل H و N و O و C و Na)، ويمتلك خصائص فريدة. تسمح هذه الخصائص الفريدة للعناصر بالاندماج والترابط مع بعضها البعض بطرق محددة.
الذرات
الذرة هي أصغر مكون لعنصر يحتفظ بجميع الخصائص الكيميائية لهذا العنصر. على سبيل المثال، تحتوي ذرة هيدروجين واحدة على جميع خصائص عنصر الهيدروجين، مثل وجودها كغاز في درجة حرارة الغرفة، وترتبط بالأكسجين لتكوين جزيء مائي. لا يمكن تقسيم ذرات الهيدروجين إلى أي شيء أصغر مع الاحتفاظ بخصائص الهيدروجين. إذا تم تقسيم ذرة الهيدروجين إلى جزيئات دون ذرية، فلن تكون لها خصائص الهيدروجين بعد الآن.
على المستوى الأساسي، تتكون جميع الكائنات الحية من مزيج من العناصر. تحتوي على ذرات تتحد معًا لتكوين جزيئات. في الكائنات الحية متعددة الخلايا، مثل الحيوانات، يمكن أن تتفاعل الجزيئات لتشكيل الخلايا التي تتحد لتكوين الأنسجة، التي تشكل الأعضاء. تستمر هذه المجموعات حتى تتشكل كائنات حية متعددة الخلايا بأكملها.
تحتوي جميع الذرات على البروتونات والإلكترونات والنيوترونات (الشكل\(\PageIndex{1}\)). الاستثناء الوحيد هو الهيدروجين (H)، وهو مصنوع من بروتون واحد وإلكترون واحد. البروتون هو جسيم ذو شحنة موجبة يتواجد في نواة الذرة (جوهر الذرة) وكتلته 1 وشحنته +1. الإلكترون هو جسيم سالب الشحنة ينتقل في الفضاء المحيط بالنواة. وبعبارة أخرى، فهي موجودة خارج النواة. كتلته ضئيلة وشحنته —1.
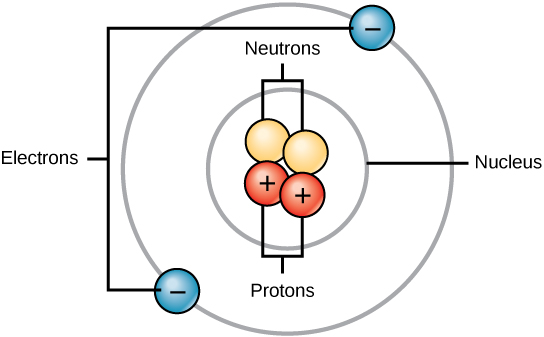
توجد النيوترونات، مثل البروتونات، في نواة الذرة. لديهم كتلة 1 وبدون تكلفة. تعمل الشحنات الموجبة (البروتونات) والسالبة (الإلكترونات) على موازنة بعضها البعض في ذرة محايدة ذات شحنة صافية صفرية.
نظرًا لأن كتلة كل من البروتونات والنيوترونات تبلغ 1، فإن كتلة الذرة تساوي عدد البروتونات والنيوترونات في تلك الذرة. لا يؤثر عدد الإلكترونات في الكتلة الكلية، لأن كتلتها صغيرة جدًا.
كما ذكرنا سابقًا، لكل عنصر خصائصه الفريدة. يحتوي كل منها على عدد مختلف من البروتونات والنيوترونات، مما يعطيها العدد الذري ورقم الكتلة الخاص بها. العدد الذري للعنصر يساوي عدد البروتونات التي يحتوي عليها العنصر. العدد الكتلي، أو الكتلة الذرية، هو عدد البروتونات بالإضافة إلى عدد النيوترونات لهذا العنصر. لذلك، من الممكن تحديد عدد النيوترونات بطرح العدد الذري من العدد الكتلي.
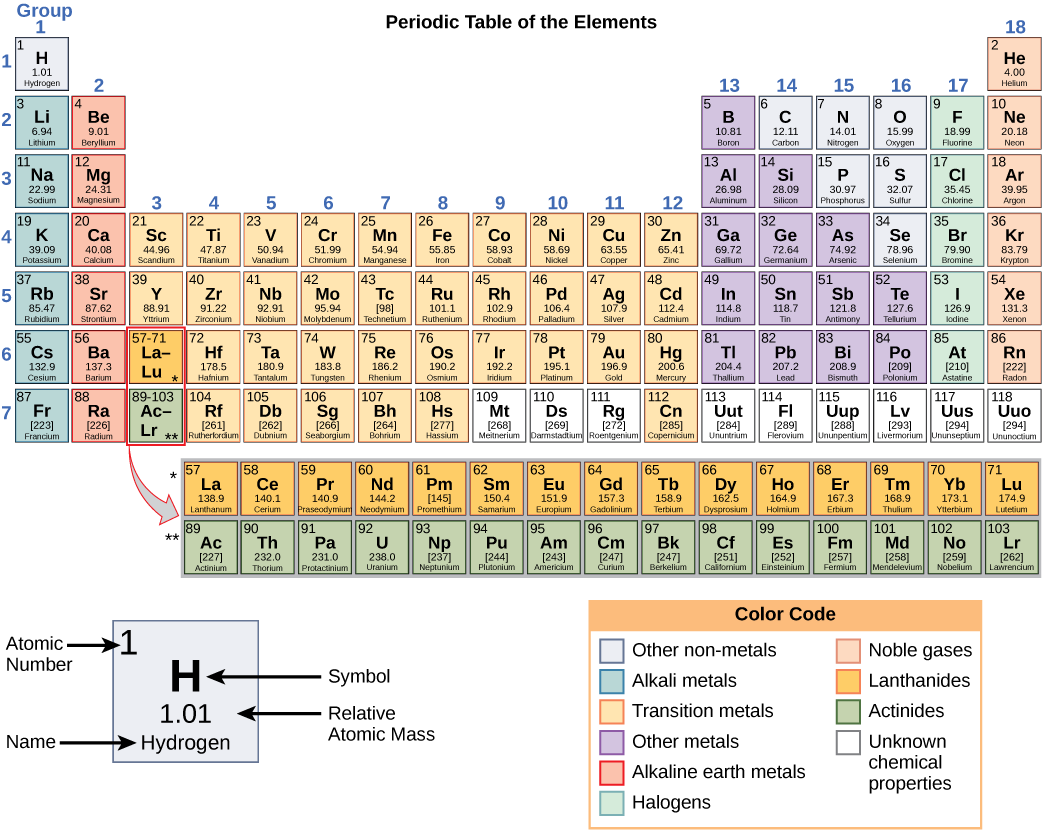
توفر هذه الأرقام معلومات حول العناصر وكيفية تفاعلها عند دمجها. تحتوي العناصر المختلفة على نقاط انصهار وغليان مختلفة، وهي في حالات مختلفة (سائلة أو صلبة أو غازية) في درجة حرارة الغرفة. كما أنها تتحد بطرق مختلفة. يشكل بعضها أنواعًا محددة من السندات، بينما لا يفعل البعض الآخر ذلك. تعتمد كيفية دمجها على عدد الإلكترونات الموجودة. بسبب هذه الخصائص، يتم ترتيب العناصر في الجدول الدوري للعناصر، وهو مخطط للعناصر يتضمن العدد الذري والكتلة الذرية النسبية لكل عنصر. يوفر الجدول الدوري أيضًا معلومات أساسية حول خصائص العناصر (الشكل\(\PageIndex{2}\)) - غالبًا ما يشار إليها بترميز الألوان. يوضح ترتيب الجدول أيضًا كيفية تنظيم الإلكترونات في كل عنصر ويوفر تفاصيل مهمة حول كيفية تفاعل الذرات مع بعضها البعض لتكوين الجزيئات.
النظائر هي أشكال مختلفة من نفس العنصر لها نفس عدد البروتونات، ولكن عددًا مختلفًا من النيوترونات. تحتوي بعض العناصر، مثل الكربون والبوتاسيوم واليورانيوم، على نظائر طبيعية. يحتوي الكربون 12، وهو أكثر نظائر الكربون شيوعًا، على ستة بروتونات وستة نيوترونات. لذلك، يبلغ عدد كتلته 12 (ستة بروتونات وستة نيوترونات) وعدد ذري 6 (مما يجعله كربونًا). يحتوي الكربون 14 على ستة بروتونات وثمانية نيوترونات. لذلك، يبلغ عدد كتلته 14 (ستة بروتونات وثمانية نيوترونات) والعدد الذري 6، مما يعني أنه لا يزال عنصر الكربون. هذان الشكلان البديلان من الكربون هما النظائر. بعض النظائر غير مستقرة وستفقد البروتونات أو الجسيمات دون الذرية الأخرى أو الطاقة لتشكيل عناصر أكثر استقرارًا. تسمى هذه النظائر المشعة أو النظائر المشعة.
آرت كونيكشن
ما عدد النيوترونات التي يحتويها (K) البوتاسيوم 39 والبوتاسيوم -40، على التوالي؟
التطور في العمل: تأريخ الكربون
الكربون 14 (14 درجة مئوية) هو نظير مشع طبيعي يتم إنشاؤه في الغلاف الجوي بواسطة الأشعة الكونية. هذه عملية مستمرة، لذلك يتم دائمًا إنشاء المزيد من 14 درجة مئوية. مع تطور الكائن الحي، فإن المستوى النسبي لـ 14 درجة مئوية في جسمه يساوي تركيز 14 درجة مئوية في الغلاف الجوي. عندما يموت كائن حي، لم يعد يتناول 14 درجة مئوية، وبالتالي ستنخفض النسبة. تتحلل درجة حرارة 14 درجة مئوية إلى 14 نيوتن من خلال عملية تسمى تحلل بيتا؛ وتنتج الطاقة في هذه العملية البطيئة.
بعد ما يقرب من 5730 عامًا، سيتم تحويل نصف تركيز البداية البالغ 14 درجة مئوية فقط إلى 14 نيوتن، ويُطلق على الوقت الذي يستغرقه نصف التركيز الأصلي للنظير للتحلل إلى شكله الأكثر استقرارًا اسم نصف عمره. نظرًا لأن عمر النصف البالغ 14 درجة مئوية طويل، فإنه يُستخدم لتحديد عمر الكائنات الحية سابقًا، مثل الحفريات. باستخدام نسبة تركيز 14 درجة مئوية الموجود في جسم ما إلى كمية 14 درجة مئوية المكتشفة في الغلاف الجوي، يمكن تحديد كمية النظائر التي لم تتحلل بعد. بناءً على هذا المبلغ، يمكن حساب عمر الحفرية بحوالي 50,000 عام (الشكل\(\PageIndex{3}\)). تستخدم النظائر ذات نصف العمر الأطول، مثل البوتاسيوم 40، لحساب أعمار الحفريات القديمة. من خلال استخدام التأريخ الكربوني، يمكن للعلماء إعادة بناء البيئة والجغرافيا الحيوية للكائنات الحية التي تعيش خلال 50,000 سنة الماضية.

مفهوم في العمل
لمعرفة المزيد عن الذرات والنظائر، وكيف يمكنك تمييز أحد النظائر عن الآخر، قم بزيارة هذا الموقع وقم بتشغيل المحاكاة.
روابط كيميائية
تعتمد كيفية تفاعل العناصر مع بعضها البعض على كيفية ترتيب إلكتروناتها وعدد فتحات الإلكترونات الموجودة في المنطقة الخارجية حيث توجد الإلكترونات في الذرة. توجد الإلكترونات عند مستويات الطاقة التي تشكل أصدافًا حول النواة. يمكن أن يحمل أقرب غلاف ما يصل إلى إلكترونين. يتم دائمًا ملء أقرب غلاف للنواة أولاً، قبل أن يتم ملء أي غلاف آخر. يحتوي الهيدروجين على إلكترون واحد؛ لذلك، يحتوي على بقعة واحدة فقط مشغولة داخل الغلاف السفلي. يحتوي الهيليوم على إلكترونين؛ لذلك يمكنه ملء الغلاف السفلي تمامًا بإلكترونين. إذا نظرت إلى الجدول الدوري، سترى أن الهيدروجين والهيليوم هما العنصران الوحيدان في الصف الأول. هذا لأنه لا يحتوي إلا على إلكترونات في غلافه الأول. الهيدروجين والهيليوم هما العنصران الوحيدان اللذان لهما أدنى غلاف ولا توجد أصداف أخرى.
يمكن لمستويي الطاقة الثاني والثالث استيعاب ما يصل إلى ثمانية إلكترونات. يتم ترتيب الإلكترونات الثمانية في أربعة أزواج ويتم ملء موضع واحد في كل زوج بإلكترون قبل اكتمال أي أزواج.
بالنظر إلى الجدول الدوري مرة أخرى (الشكل\(\PageIndex{2}\))، ستلاحظ أن هناك سبعة صفوف. تتوافق هذه الصفوف مع عدد الأصداف الموجودة في العناصر الموجودة في هذا الصف. تحتوي العناصر الموجودة داخل صف معين على أعداد متزايدة من الإلكترونات أثناء انتقال الأعمدة من اليسار إلى اليمين. على الرغم من أن كل عنصر له نفس عدد الأصداف، إلا أن جميع الأصداف لا تمتلئ بالكامل بالإلكترونات. إذا نظرت إلى الصف الثاني من الجدول الدوري، ستجد الليثيوم (Li) والبريليوم (Be) والبورون (B) والكربون (C) والنيتروجين (N) والأكسجين (O) والفلور (F) والنيون (Ne). تحتوي جميع هذه الإلكترونات على إلكترونات تشغل القذيفتين الأولى والثانية فقط. يحتوي الليثيوم على إلكترون واحد فقط في غلافه الخارجي، والبريليوم يحتوي على إلكترونين، والبورون ثلاثة، وهكذا، حتى يمتلئ الغلاف بأكمله بثمانية إلكترونات، كما هو الحال مع النيون.
لا تحتوي جميع العناصر على إلكترونات كافية لملء أقشفها الخارجية، ولكن الذرة تكون في أقصى حالاتها استقرارًا عندما تمتلئ جميع مواقع الإلكترون في الغلاف الخارجي. بسبب هذه الشواغر في الأصداف الخارجية، نرى تكوين روابط كيميائية، أو تفاعلات بين اثنين أو أكثر من العناصر نفسها أو المختلفة التي تؤدي إلى تكوين الجزيئات. لتحقيق قدر أكبر من الاستقرار، تميل الذرات إلى ملء غلافها الخارجي بالكامل وستترابط مع العناصر الأخرى لتحقيق هذا الهدف من خلال مشاركة الإلكترونات، وقبول الإلكترونات من ذرة أخرى، أو التبرع بالإلكترونات لذرة أخرى. نظرًا لأن الأصداف الخارجية للعناصر ذات الأعداد الذرية المنخفضة (حتى الكالسيوم والعدد الذري 20) يمكن أن تحتوي على ثمانية إلكترونات، يشار إلى ذلك بقاعدة الثمانية. يمكن للعنصر التبرع بالإلكترونات أو قبولها أو مشاركتها مع عناصر أخرى لملء غلافه الخارجي وتلبية قاعدة الثمانية.
عندما لا تحتوي الذرة على أعداد متساوية من البروتونات والإلكترونات، فإنها تسمى الأيون. نظرًا لأن عدد الإلكترونات لا يساوي عدد البروتونات، فإن كل أيون له شحنة صافية. تتكون الأيونات الموجبة عن طريق فقدان الإلكترونات وتسمى الكاتيونات. تتكون الأيونات السالبة من خلال اكتساب الإلكترونات وتسمى الأنيونات.
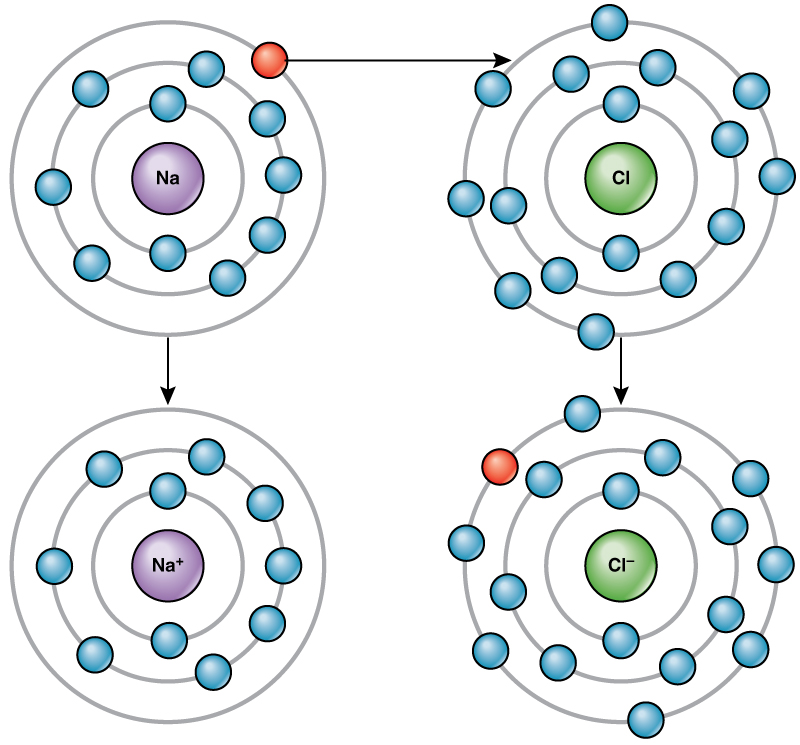
على سبيل المثال، يحتوي الصوديوم على إلكترون واحد فقط في غلافه الخارجي. يتطلب الصوديوم طاقة أقل للتبرع بهذا الإلكترون الواحد مقارنة بقبول سبعة إلكترونات أخرى لملء الغلاف الخارجي. إذا فقد الصوديوم إلكترونًا، فإنه يحتوي الآن على 11 بروتونًا و10 إلكترونات فقط، مما يجعله يحمل شحنة إجمالية قدرها +1. يطلق عليه الآن أيون الصوديوم.
تحتوي ذرة الكلور على سبعة إلكترونات في غلافها الخارجي. مرة أخرى، يعد اكتساب الكلور إلكترون واحدًا أكثر كفاءة في استخدام الطاقة بدلاً من فقدان سبعة. لذلك، تميل إلى اكتساب إلكترون لتكوين أيون يحتوي على 17 بروتونًا و 18 إلكترونًا، مما يمنحه شحنة سالبة صافية (—1). يطلق عليه الآن أيون الكلوريد. يشار إلى حركة الإلكترونات هذه من عنصر إلى آخر باسم نقل الإلكترون. كما\(\PageIndex{4}\) يوضح الشكل، تحتوي ذرة الصوديوم (Na) على إلكترون واحد فقط في غلافها الخارجي، بينما تحتوي ذرة الكلور (Cl) على سبعة إلكترونات في غلافها الخارجي. ستتبرع ذرة الصوديوم بإلكترون واحد لتفريغ غلافها، وستقبل ذرة الكلور هذا الإلكترون لملء غلافها، لتصبح كلورايد. يستوفي كلا الأيونين الآن قاعدة الثمانية ولديهما أصداف خارجية كاملة. نظرًا لأن عدد الإلكترونات لم يعد يساوي عدد البروتونات، أصبح كل منها الآن أيون وله شحنة +1 (صوديوم) أو —1 (كلوريد).
السندات الأيونية
هناك أربعة أنواع من الروابط أو التفاعلات: الروابط الأيونية، والتساهمية، والروابط الهيدروجينية، وتفاعلات فان دير فالس. الروابط الأيونية والتساهمية هي تفاعلات قوية تتطلب مدخلات طاقة أكبر للتفكك. عندما يتبرع عنصر بإلكترون من غلافه الخارجي، كما في مثال ذرة الصوديوم أعلاه، يتشكل أيون موجب. العنصر الذي يقبل الإلكترون أصبح الآن مشحونًا بشكل سلبي. نظرًا لأن الشحنات الموجبة والسالبة تتجاذب، تبقى هذه الأيونات معًا وتشكل رابطة أيونية أو رابطة بين الأيونات. ترتبط العناصر مع الإلكترون من عنصر واحد وتبقى في الغالب مع العنصر الآخر. عندما تتحد أيونات Na + و Cl لإنتاج NaCl، يبقى الإلكترون من ذرة الصوديوم مع السبعة الأخرى من ذرة الكلور، وتجذب أيونات الصوديوم والكلوريد بعضها البعض في شبكة من الأيونات بشحنة صافية صفرية.
السندات التساهمية
هناك نوع آخر من الروابط الكيميائية القوية بين ذرتين أو أكثر وهو الرابطة التساهمية. تتكون هذه الروابط عندما يتم تقاسم الإلكترون بين عنصرين وهي أقوى أشكال الرابطة الكيميائية وأكثرها شيوعًا في الكائنات الحية. تتكون الروابط التساهمية بين العناصر التي تشكل الجزيئات البيولوجية في خلايانا. على عكس الروابط الأيونية، لا تتفكك الروابط التساهمية في الماء.
ترتبط ذرات الهيدروجين والأكسجين التي تتحد لتكوين جزيئات الماء معًا بواسطة روابط تساهمية. يقسم الإلكترون من ذرة الهيدروجين وقته بين الغلاف الخارجي لذرة الهيدروجين والغلاف الخارجي غير المكتمل لذرة الأكسجين. لملء الغلاف الخارجي لذرة الأكسجين بالكامل، هناك حاجة إلى إلكترونين من ذرتي هيدروجين، ومن هنا يأتي الحرف «2" في H 2 O. ويتم تقاسم الإلكترونات بين الذرات، وتقسيم وقتها بينهما «لملء» الغلاف الخارجي لكل منها. هذه المشاركة هي حالة طاقة أقل لجميع الذرات المعنية مما لو كانت موجودة بدون امتلاء غلافها الخارجي.
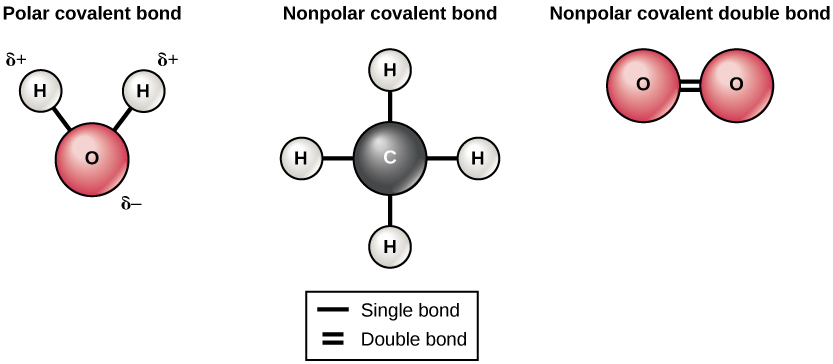
هناك نوعان من الروابط التساهمية: القطبية وغير القطبية. تتكون الروابط التساهمية غير القطبية بين ذرتين من نفس العنصر أو بين عناصر مختلفة تشترك في الإلكترونات بالتساوي. على سبيل المثال، يمكن لذرة الأكسجين أن ترتبط بذرة أكسجين أخرى لملء غلافها الخارجي. هذا الارتباط غير قطبي لأن الإلكترونات ستوزع بالتساوي بين كل ذرة أكسجين. تتكون رابطتان تساهميتان بين ذرتي الأكسجين لأن الأكسجين يتطلب إلكترونين مشتركين لملء غلافه الخارجي. ستشكل ذرات النيتروجين ثلاث روابط تساهمية (تسمى أيضًا التساهمية الثلاثية) بين ذرتين من النيتروجين لأن كل ذرة نيتروجين تحتاج إلى ثلاثة إلكترونات لملء غلافها الخارجي. يوجد مثال آخر على الرابطة التساهمية غير القطبية في جزيء الميثان (CH 4). تحتوي ذرة الكربون على أربعة إلكترونات في غلافها الخارجي وتحتاج إلى أربعة أخرى لملئها. تحصل على هذه الأربعة من أربع ذرات هيدروجين، كل ذرة توفر واحدة. تشترك جميع هذه العناصر في الإلكترونات بالتساوي، مما يؤدي إلى تكوين أربع روابط تساهمية غير قطبية (الشكل\(\PageIndex{5}\)).
في الرابطة التساهمية القطبية، تقضي الإلكترونات المشتركة بين الذرات وقتًا أقرب إلى نواة واحدة مقارنة بالنواة الأخرى. بسبب التوزيع غير المتكافئ للإلكترونات بين النوى المختلفة، تتطور شحنة موجبة قليلاً (Δ+) أو سالبة قليلاً (—). الروابط التساهمية بين ذرات الهيدروجين والأكسجين في الماء هي روابط تساهمية قطبية. تقضي الإلكترونات المشتركة وقتًا أطول بالقرب من نواة الأكسجين، مما يعطيها شحنة سالبة صغيرة، مما تقضيه بالقرب من نوى الهيدروجين، مما يعطي هذه الجزيئات شحنة موجبة صغيرة.
روابط هيدروجينية
الروابط الأيونية والتساهمية هي روابط قوية تتطلب طاقة كبيرة للكسر. ومع ذلك، ليست كل الروابط بين العناصر هي روابط أيونية أو تساهمية. يمكن أن تتشكل السندات الأضعف أيضًا. هذه هي عوامل الجذب التي تحدث بين الشحنات الموجبة والسالبة التي لا تتطلب الكثير من الطاقة للكسر. هناك رابطتان ضعيفتان تحدثان بشكل متكرر وهما الروابط الهيدروجينية وتفاعلات فان دير فال. تؤدي هذه الروابط إلى ظهور الخصائص الفريدة للمياه والهياكل الفريدة للحمض النووي والبروتينات.
عندما تتكون روابط تساهمية قطبية تحتوي على ذرة هيدروجين، فإن ذرة الهيدروجين في تلك الرابطة لها شحنة موجبة قليلاً. هذا لأن الإلكترون المشترك يتم سحبه بقوة أكبر نحو العنصر الآخر وبعيدًا عن نواة الهيدروجين. نظرًا لأن ذرة الهيدروجين موجبة قليلاً (Δ+)، فسوف تنجذب إلى الشحنات الجزئية السالبة المجاورة (—). عندما يحدث هذا، يحدث تفاعل ضعيف بين الشحنة Δ+ لذرة الهيدروجين لجزيء واحد وشحنة— للجزيء الآخر. هذا التفاعل يسمى رابطة الهيدروجين. هذا النوع من الروابط شائع؛ على سبيل المثال، تحدث الطبيعة السائلة للمياه بسبب الروابط الهيدروجينية بين جزيئات الماء (الشكل\(\PageIndex{6}\)). تمنح الروابط الهيدروجينية الماء الخصائص الفريدة التي تحافظ على الحياة. لولا الترابط الهيدروجيني، لكان الماء غازًا وليس سائلًا في درجة حرارة الغرفة.
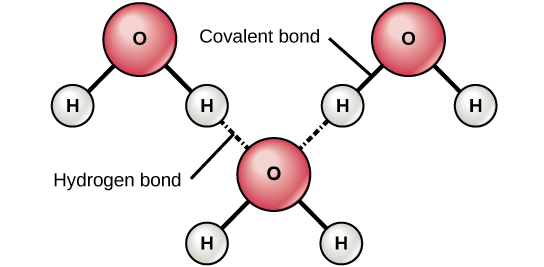
يمكن أن تتكون الروابط الهيدروجينية بين جزيئات مختلفة ولا يجب أن تتضمن دائمًا جزيء الماء. يمكن لذرات الهيدروجين في الروابط القطبية داخل أي جزيء أن تشكل روابط مع جزيئات مجاورة أخرى. على سبيل المثال، تربط الروابط الهيدروجينية خيطين طويلين من الحمض النووي لإعطاء جزيء الحمض النووي تركيبته المميزة ذات السلاسل المزدوجة. الروابط الهيدروجينية مسؤولة أيضًا عن بعض البنية ثلاثية الأبعاد للبروتينات.
تفاعلات فان دير فالس
مثل الروابط الهيدروجينية، تعتبر تفاعلات فان دير فال عوامل جذب أو تفاعلات ضعيفة بين الجزيئات. تحدث بين الذرات القطبية المرتبطة تساهميًا في جزيئات مختلفة. تحدث بعض عوامل الجذب الضعيفة هذه بسبب الشحنات الجزئية المؤقتة التي تشكلت عندما تتحرك الإلكترونات حول النواة. هذه التفاعلات الضعيفة بين الجزيئات مهمة في الأنظمة البيولوجية.
وظائف في العمل: فني التصوير الشعاعي
هل سبق لك أو لأي شخص تعرفه إجراء تصوير بالرنين المغناطيسي (MRI) أو تصوير الثدي بالأشعة السينية أو الأشعة السينية؟ تنتج هذه الاختبارات صورًا للأنسجة الرخوة والأعضاء (كما هو الحال مع التصوير بالرنين المغناطيسي أو التصوير الشعاعي للثدي) أو عظامك (كما يحدث في الأشعة السينية) باستخدام موجات الراديو أو النظائر الخاصة (الموسومة إشعاعيًا أو الموسومة بالفلور) التي يتم بلعها أو حقنها في الجسم. توفر هذه الاختبارات بيانات لتشخيص الأمراض من خلال إنشاء صور للأعضاء أو نظام الهيكل العظمي.
يعمل التصوير بالرنين المغناطيسي عن طريق تعريض نوى الهيدروجين، الموجودة بكثرة في الماء في الأنسجة الرخوة، لمجالات مغناطيسية متقلبة، مما يؤدي إلى انبعاث المجال المغناطيسي الخاص بها. ثم تتم قراءة هذه الإشارة بواسطة أجهزة الاستشعار الموجودة في الجهاز ويتم تفسيرها بواسطة الكمبيوتر لتشكيل صورة مفصلة.
يتخصص بعض تقنيي وفنيي التصوير الشعاعي في التصوير المقطعي والتصوير بالرنين المغناطيسي والتصوير الشعاعي للثدي. إنهم ينتجون أفلامًا أو صورًا للجسم تساعد المهنيين الطبيين على الفحص والتشخيص. يعمل أخصائيو الأشعة مباشرة مع المرضى، ويشرحون الآلات، ويجهزوهم للاختبارات، ويتأكدون من وضع الجسم أو أجزاء الجسم بشكل صحيح لإنتاج الصور المطلوبة. ثم يقوم الأطباء أو أخصائيو الأشعة بتحليل نتائج الاختبار.
يمكن لفنيي التصوير الشعاعي العمل في المستشفيات أو مكاتب الأطباء أو مراكز التصوير المتخصصة. يتم التدريب لتصبح فنيًا للتصوير الشعاعي في المستشفيات والكليات والجامعات التي تقدم شهادات أو درجات الزمالة أو درجات البكالوريوس في التصوير الشعاعي.
ملخص
المادة هي أي شيء يشغل الفضاء وله كتلة. وهي مكونة من ذرات من عناصر مختلفة. جميع العناصر الـ 92 التي تحدث بشكل طبيعي لها صفات فريدة تسمح لها بالدمج بطرق مختلفة لإنشاء مركبات أو جزيئات. الذرات، التي تتكون من البروتونات والنيوترونات والإلكترونات، هي أصغر وحدات العنصر الذي يحتفظ بجميع خصائص هذا العنصر. يمكن التبرع بالإلكترونات أو مشاركتها بين الذرات لإنشاء روابط، بما في ذلك الروابط الأيونية والتساهمية والهيدروجينية، بالإضافة إلى تفاعلات فان دير فال.
اتصالات فنية
الشكل\(\PageIndex{2}\): ما عدد النيوترونات التي يحتوي عليها البوتاسيوم 39 والبوتاسيوم 40 (K) على التوالي؟
- إجابة
-
يحتوي البوتاسيوم 39 على عشرين نيوترونًا. يحتوي البوتاسيوم 40 على واحد وعشرين نيوترونًا.
مسرد المصطلحات
- أنيون
- أيون سالب يتكون من اكتساب الإلكترونات
- عدد ذري
- عدد البروتونات في الذرة
- كاتيون
- أيون إيجابي يتكون من فقدان الإلكترونات
- رابطة كيميائية
- تفاعل بين عنصرين أو أكثر من العناصر نفسها أو المختلفة مما يؤدي إلى تكوين جزيئات
- رابطة تساهمية
- نوع من الروابط القوية بين عنصرين أو أكثر من نفس العناصر أو العناصر المختلفة؛ يتشكل عند مشاركة الإلكترونات بين العناصر
- إلكترون
- جسيم سالب الشحنة موجود خارج النواة في مدار الإلكترون؛ يفتقر إلى الكتلة الوظيفية وشحنته -1
- نقل الإلكترون
- حركة الإلكترونات من عنصر إلى آخر
- جزء
- واحدة من 118 مادة فريدة لا يمكن تقسيمها إلى مواد أصغر والاحتفاظ بخصائص تلك المادة؛ كل عنصر له عدد محدد من البروتونات والخصائص الفريدة
- رابطة هيدروجينية
- رابطة ضعيفة بين ذرات الهيدروجين ذات الشحنة الإيجابية جزئيًا والعناصر أو الجزيئات ذات الشحنة السالبة جزئيًا
- أيون
- ذرة أو مركب لا يحتوي على أعداد متساوية من البروتونات والإلكترونات، وبالتالي له شحنة صافية
- رابطة أيونية
- رابطة كيميائية تتكون بين أيونات الشحنات المعاكسة
- نظير
- شكل واحد أو أكثر لعنصر يحتوي على أعداد مختلفة من النيوترونات
- رقم الكتلة
- عدد البروتونات بالإضافة إلى النيوترونات في الذرة
- شيء
- أي شيء له كتلة ويحتل مساحة
- النيوترون
- جسيم بلا شحنة موجود في نواة الذرة؛ كتلته 1
- رابطة تساهمية غير قطبية
- نوع من الروابط التساهمية التي تتكون بين الذرات عندما يتم تقاسم الإلكترونات بالتساوي بين الذرات، مما يؤدي إلى عدم وجود مناطق ذات شحنات جزئية كما هو الحال في الروابط التساهمية القطبية
- نواة
- (الكيمياء) المركز الكثيف للذرة المكونة من البروتونات و (باستثناء حالة ذرة الهيدروجين) النيوترونات
- قاعدة الثمانيات
- ينص على أن الغلاف الخارجي لعنصر ذي عدد ذري منخفض يمكن أن يحمل ثمانية إلكترونات
- جدول دوري للعناصر
- مخطط تنظيمي للعناصر، يشير إلى العدد الذري والعدد الكتلي لكل عنصر؛ يوفر أيضًا معلومات أساسية حول خصائص العناصر
- رابطة تساهمية قطبية
- نوع من الروابط التساهمية التي يتم فيها سحب الإلكترونات نحو ذرة واحدة وبعيدًا عن الأخرى، مما يؤدي إلى مناطق مشحونة موجبة قليلاً وسالبة قليلاً من الجزيء
- بروتون
- جسيم ذو شحنة موجبة موجود في نواة الذرة؛ كتلته 1 وشحنته +1
- نظير مشع
- نظير يصدر تلقائيًا جزيئات أو طاقة لتشكيل عنصر أكثر استقرارًا
- تفاعل فان دير فال
- جاذبية ضعيفة أو تفاعل بين الجزيئات ناتج عن ذرات ذات شحنة موجبة قليلاً أو ذات شحنة سالبة قليلاً


