5.5: تكوين الخطوط الطيفية
- Page ID
- 197299
أهداف التعلم
في نهاية هذا القسم، ستكون قادرًا على:
- شرح كيفية تكوين أطياف خطوط الانبعاث وأطياف خط الامتصاص
- وصف ماهية الأيونات وكيفية تكوينها
- اشرح كيف يمكن للخطوط الطيفية ومستويات التأين في الغاز أن تساعدنا في تحديد درجة حرارته
يمكننا استخدام نموذج Bohr للذرة لفهم كيفية تكوين الخطوط الطيفية. يؤدي مفهوم مستويات الطاقة لمدارات الإلكترون في الذرة بشكل طبيعي إلى تفسير لماذا تمتص الذرات أو تنبعث منها فقط طاقات معينة أو أطوال موجية من الضوء.
طيف الهيدروجين
دعونا ننظر إلى ذرة الهيدروجين من منظور نموذج Bohr. لنفترض أن شعاعًا من الضوء الأبيض (يتكون من فوتونات من جميع الأطوال الموجية المرئية) يضيء عبر غاز الهيدروجين الذري. يحتوي الفوتون الذي يبلغ طوله الموجي 656 نانومترًا على الطاقة المناسبة لرفع الإلكترون في ذرة الهيدروجين من المدار الثاني إلى الثالث. وهكذا، مع تدفق جميع الفوتونات ذات الطاقات المختلفة (أو الأطوال الموجية أو الألوان) بواسطة ذرات الهيدروجين، يمكن امتصاص الفوتونات ذات الطول الموجي المحدد بواسطة تلك الذرات التي تدور إلكتروناتها في المستوى الثاني. عندما يتم امتصاصها، ستنتقل الإلكترونات في المستوى الثاني إلى المستوى الثالث، وسيفقد عدد من فوتونات هذا الطول الموجي والطاقة من التيار العام للضوء الأبيض.
ستمتلك الفوتونات الأخرى الطاقات المناسبة لرفع الإلكترونات من المدار الثاني إلى المدار الرابع، أو من المدار الأول إلى الخامس، وهكذا. يمكن امتصاص الفوتونات بهذه الطاقات الدقيقة فقط. ستتدفق جميع الفوتونات الأخرى عبر الذرات دون أن يمسها أحد. وهكذا، تمتص ذرات الهيدروجين الضوء بأطوال موجية معينة فقط وتنتج خطوطًا داكنة عند تلك الأطوال الموجية في الطيف الذي نراه.
لنفترض أن لدينا حاوية من غاز الهيدروجين تمر من خلالها سلسلة كاملة من الفوتونات، مما يسمح للعديد من الإلكترونات بالانتقال إلى مستويات أعلى. عندما نطفئ مصدر الضوء، فإن هذه الإلكترونات «تسقط» مرة أخرى من مدارات أكبر إلى مدارات أصغر وتصدر فوتونات ضوئية - ولكن مرة أخرى، فقط ضوء تلك الطاقات أو الأطوال الموجية التي تتوافق مع فرق الطاقة بين المدارات المسموح بها. يوضح الشكل التغيرات المدارية لإلكترونات الهيدروجين التي أدت إلى ظهور بعض الخطوط الطيفية\(\PageIndex{1}\).
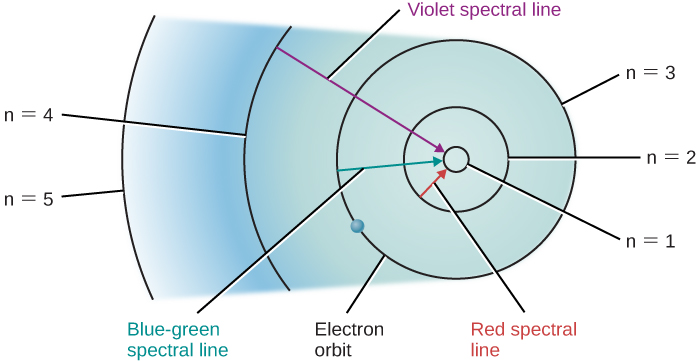
يمكن رسم صور مماثلة لذرات أخرى غير الهيدروجين. ومع ذلك، نظرًا لأن هذه الذرات الأخرى تحتوي عادةً على أكثر من إلكترون واحد لكل منها، فإن مدارات إلكتروناتها أكثر تعقيدًا بكثير، كما أن الأطياف أكثر تعقيدًا أيضًا. بالنسبة لأغراضنا، فإن الاستنتاج الرئيسي هو: كل نوع من أنواع الذرات له نمطه الفريد من مدارات الإلكترون، ولا توجد مجموعتان من المدارات متشابهتان تمامًا. وهذا يعني أن كل نوع من الذرات يُظهر مجموعته الفريدة من الخطوط الطيفية، التي تنتجها الإلكترونات التي تتحرك بين مجموعة مدارها الفريدة.
لقد عمل علماء الفلك والفيزيائيون بجد لتعلم الخطوط التي تتوافق مع كل عنصر من خلال دراسة الطريقة التي تمتص بها الذرات الضوء وتنبعث منه في المختبرات هنا على الأرض. ثم يمكنهم استخدام هذه المعرفة لتحديد العناصر في الأجرام السماوية. بهذه الطريقة، نعرف الآن التركيب الكيميائي ليس فقط لأي نجم، ولكن حتى لمجرات النجوم البعيدة جدًا لدرجة أن ضوءها بدأ في طريقه إلينا قبل وقت طويل من تشكل الأرض.
مستويات الطاقة والإثارة
كان نموذج Bohr لذرة الهيدروجين خطوة رائعة إلى الأمام في فهمنا للذرة. ومع ذلك، فإننا نعلم اليوم أنه لا يمكن تمثيل الذرات بصورة بسيطة للغاية. على سبيل المثال، مفهوم مدارات الإلكترون المحددة بشكل حاد ليس صحيحًا حقًا؛ ومع ذلك، على مستوى هذه الدورة التمهيدية، فإن فكرة السماح فقط ببعض الطاقات المنفصلة للذرة مفيدة جدًا. يمكن اعتبار مستويات الطاقة التي ناقشناها على أنها تمثل متوسط مسافات معينة لمدارات الإلكترون المحتملة من النواة الذرية.
عادةً ما تكون الذرة في حالة أقل طاقة ممكنة، أي حالتها الأرضية. في نموذج Bohr لذرة الهيدروجين، تتوافق الحالة الأرضية مع وجود الإلكترون في المدار الأعمق. يمكن للذرة أن تمتص الطاقة، مما يرفعها إلى مستوى طاقة أعلى (يتوافق، في صورة بوهر البسيطة، مع حركة الإلكترون إلى مدار أكبر) - ويشار إلى ذلك بالإثارة. ويقال بعد ذلك أن الذرة في حالة حماسية. بشكل عام، تظل الذرة متحمسة لفترة وجيزة جدًا. بعد فترة زمنية قصيرة، عادةً ما تكون جزءًا من مائة مليون من الثانية أو نحو ذلك، تعود تلقائيًا إلى حالتها الأرضية، مع انبعاث متزامن للضوء. قد تعود الذرة إلى أدنى حالة لها في قفزة واحدة، أو قد تقوم بالانتقال بخطوات قفزتين أو أكثر، وتتوقف عند مستويات متوسطة في طريقها إلى الأسفل. مع كل قفزة، يصدر فوتون بطول موجة يتوافق مع فرق الطاقة بين المستويات في بداية ونهاية تلك القفزة.
يوضح الشكل رسم تخطيطي لمستوى الطاقة لذرة الهيدروجين والعديد من التحولات الذرية المحتملة\(\PageIndex{2}\). عندما نقيس الطاقات المتضمنة عندما تقفز الذرة بين المستويات، نجد أن التحولات من أو إلى الحالة الأرضية، والتي تسمى سلسلة خطوط ليمان، تؤدي إلى انبعاث أو امتصاص الفوتونات فوق البنفسجية. لكن عمليات الانتقال من أو إلى حالة الإثارة الأولى (المُصنَّفة n = 2 في الجزء (أ) من الشكل\(\PageIndex{2}\))، والتي تُسمى سلسلة Balmer، تنتج الانبعاث أو الامتصاص في الضوء المرئي. في الواقع، كان شرح سلسلة Balmer هذه هو السبب الذي اقترح فيه Bohr لأول مرة نموذجه للذرة.
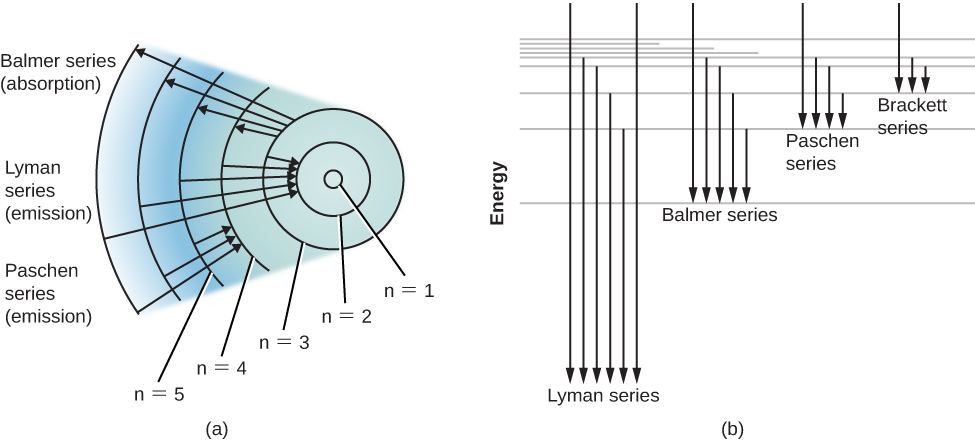
الذرات التي امتصت فوتونات معينة من شعاع عابر من الضوء الأبيض وبالتالي أصبحت متحمسة بشكل عام تزيل الإثارة نفسها وتصدر هذا الضوء مرة أخرى في وقت قصير جدًا. قد تتساءل إذن عن سبب إنتاج الخطوط الطيفية المظلمة على الإطلاق. بعبارة أخرى، لماذا لا يقوم هذا الضوء المعاد انبعاثه بسرعة «بملء» خطوط الامتصاص الداكنة؟
تخيل شعاعًا من الضوء الأبيض يأتي نحوك من خلال بعض الغاز البارد. يتم إرجاع بعض الضوء المعاد انبعاثه بالفعل إلى شعاع الضوء الأبيض الذي تراه، ولكن هذا يملأ خطوط الامتصاص فقط إلى حد طفيف. والسبب هو أن الذرات الموجودة في الغاز تعيد إرسال الضوء في جميع الاتجاهات، ولا يوجد سوى جزء صغير من الضوء المعاد انبعاثه في اتجاه الشعاع الأصلي (نحوك). في النجوم، يسير الكثير من الضوء المعاد انبعاثه فعليًا في الاتجاهات المؤدية إلى النجم، وهو ما لا يفيد المراقبين خارج النجم على الإطلاق.
\(\PageIndex{3}\)يلخص الشكل الأنواع المختلفة من الأطياف التي ناقشناها. ينتج المصباح المتوهج طيفًا مستمرًا. عندما يتم عرض هذا الطيف المستمر من خلال سحابة أرق من الغاز، يمكن رؤية طيف خط الامتصاص متراكبًا على الطيف المستمر. إذا نظرنا فقط إلى سحابة من ذرات الغاز المثارة (مع عدم وجود مصدر مستمر وراءها)، فإننا نرى أن الذرات المثارة تعطي طيف خط الانبعاث.
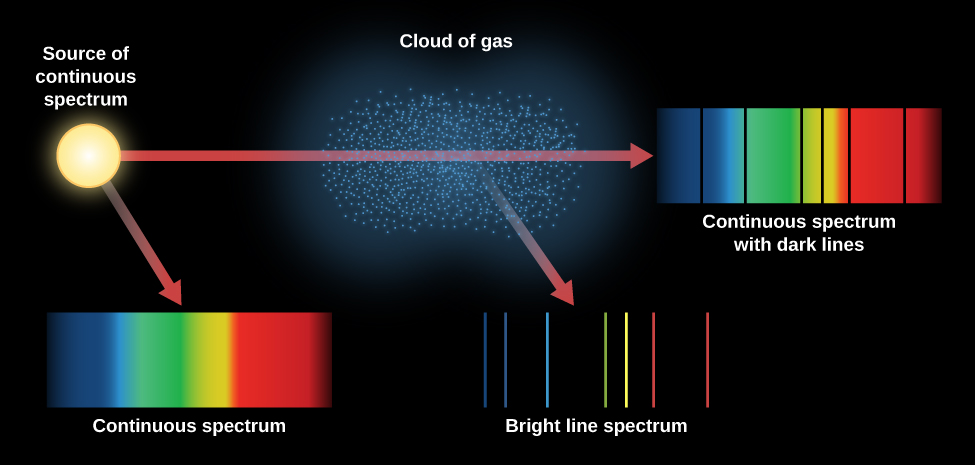
تتحرك الذرات في الغاز الساخن بسرعات عالية وتتصادم باستمرار مع بعضها البعض ومع أي إلكترونات سائبة. يمكن تحفيزها (انتقال الإلكترونات إلى مستوى أعلى) وإزالة الإثارة (تتحرك الإلكترونات إلى مستوى أقل) من خلال هذه التصادمات وكذلك عن طريق امتصاص الضوء وإصداره. تعتمد سرعة الذرات في الغاز على درجة الحرارة. عندما تكون درجة الحرارة أعلى، تزداد سرعة وطاقة التصادمات أيضًا. لذلك، كلما زادت حرارة الغاز، زادت احتمالية احتلال الإلكترونات للمدارات الخارجية، والتي تتوافق مع أعلى مستويات الطاقة. هذا يعني أن المستوى الذي تبدأ فيه الإلكترونات قفزاتها التصاعدية في الغاز يمكن أن يكون بمثابة مؤشر على مدى سخونة هذا الغاز. بهذه الطريقة، توفر خطوط الامتصاص في الطيف لعلماء الفلك معلومات حول درجة حرارة المناطق التي تنشأ فيها الخطوط.
استخدم هذه المحاكاة للعب مع ذرة الهيدروجين ومعرفة ما يحدث عندما تنتقل الإلكترونات إلى مستويات أعلى ثم تطلق فوتونات عند انتقالها إلى مستوى أقل.
التأين
لقد وصفنا كيف يمكن للذرة امتصاص كميات منفصلة معينة من الطاقة، ورفعها إلى حالة الإثارة وتحريك أحد إلكتروناتها بعيدًا عن نواتها. إذا تم امتصاص طاقة كافية، يمكن إزالة الإلكترون تمامًا من الذرة - وهذا ما يسمى بالتأين. ويقال بعد ذلك أن الذرة مؤينة. يُطلق على الحد الأدنى من الطاقة المطلوبة لإزالة إلكترون واحد من الذرة في حالتها الأرضية طاقة التأين.
لا يزال يتعين على الذرة المؤينة الآن (تسمى الأيون) امتصاص كميات أكبر من الطاقة لإزالة إلكترون إضافي أعمق في بنية الذرة. هناك حاجة إلى المزيد من الطاقات المتتالية لإزالة الإلكترونات الثالثة والرابعة والخامسة - وما إلى ذلك - من الذرة. في حالة توفر طاقة كافية، يمكن للذرة أن تتأين تمامًا، مما يؤدي إلى فقدان جميع إلكتروناتها. يمكن تأين ذرة الهيدروجين، التي تحتوي على إلكترون واحد فقط، مرة واحدة فقط؛ يمكن تأين ذرة الهيليوم مرتين؛ وذرة الأكسجين حتى ثماني مرات. عندما نفحص مناطق الكون حيث يوجد قدر كبير من الإشعاع النشط، مثل الأحياء التي تشكلت فيها النجوم الشابة الساخنة مؤخرًا، نرى الكثير من التأين يحدث.
فقدت الذرة التي أصبحت مؤينة بشكل إيجابي شحنة سالبة - الإلكترون المفقود - وبالتالي تُركت بشحنة موجبة صافية. لذلك فهي تمارس جاذبية قوية على أي إلكترون حر. في النهاية، سيتم التقاط إلكترون واحد أو أكثر وستصبح الذرة محايدة (أو متأينة بدرجة أقل) مرة أخرى. أثناء عملية التقاط الإلكترون، تصدر الذرة فوتونًا واحدًا أو أكثر. تعتمد الفوتونات المنبعثة على ما إذا كان الإلكترون يتم التقاطه مرة واحدة إلى أدنى مستوى طاقة للذرة أو يتوقف عند مستوى وسيط واحد أو أكثر في طريقه إلى أدنى مستوى متاح.
مثلما يمكن أن تنتج إثارة الذرة عن الاصطدام بذرة أو أيون أو إلكترون آخر (عادة ما تكون التصادمات مع الإلكترونات هي الأكثر أهمية)، فإن التأين يمكن أن يحدث أيضًا. يعتمد معدل حدوث مثل هذه التأينات التصادمية على سرعات الذرات وبالتالي على درجة حرارة الغاز - فكلما زادت درجة حرارة الغاز، زاد تأين ذراته.
يعتمد معدل إعادة تجميع الأيونات والإلكترونات أيضًا على سرعاتها النسبية - أي على درجة الحرارة. بالإضافة إلى ذلك، يعتمد ذلك على كثافة الغاز: فكلما ارتفعت الكثافة، زادت فرصة الاستعادة، لأن الأنواع المختلفة من الجسيمات تكون أكثر ازدحامًا معًا. من خلال معرفة درجة حرارة الغاز وكثافته، يمكن حساب جزء الذرات المؤينة مرة واحدة ومرتين وما إلى ذلك. في الشمس، على سبيل المثال، نجد أن معظم ذرات الهيدروجين والهيليوم في غلافها الجوي محايدة، في حين أن معظم ذرات الكالسيوم، وكذلك العديد من الذرات الثقيلة الأخرى، تتأين مرة واحدة.
تختلف مستويات الطاقة للذرة المؤينة تمامًا عن تلك الموجودة في نفس الذرة عندما تكون محايدة. في كل مرة يتم فيها إزالة إلكترون من الذرة، تتغير مستويات طاقة الأيون، وبالتالي الأطوال الموجية للخطوط الطيفية التي يمكن أن ينتجها. يساعد هذا علماء الفلك على التمييز بين أيونات عنصر معين. لا يمكن للهيدروجين المؤين، الذي لا يحتوي على إلكترون، إنتاج أي خطوط امتصاص.
المفاهيم الأساسية والملخص
عندما تنتقل الإلكترونات من مستوى طاقة أعلى إلى مستوى أدنى، تنبعث فوتونات ويمكن رؤية خط انبعاث في الطيف. تظهر خطوط الامتصاص عندما تمتص الإلكترونات الفوتونات وتنتقل إلى مستويات طاقة أعلى. نظرًا لأن كل ذرة لها مجموعتها المميزة من مستويات الطاقة، ترتبط كل منها بنمط فريد من الخطوط الطيفية. يسمح هذا لعلماء الفلك بتحديد العناصر الموجودة في النجوم وفي غيوم الغاز والغبار بين النجوم. توجد الذرة في أدنى مستوى للطاقة في حالة الأرض. إذا كان الإلكترون في مدار آخر غير المدار الأقل نشاطًا، يُقال إن الذرة متحمسة. إذا فقدت الذرة إلكترونًا واحدًا أو أكثر، فإنها تسمى الأيون ويقال إنها مؤينة. تبدو أطياف الأيونات المختلفة مختلفة ويمكن أن تخبر علماء الفلك عن درجات حرارة المصادر التي يراقبونها.
مسرد المصطلحات
- الإثارة
- عملية إعطاء ذرة أو أيون كمية من الطاقة أكبر مما لديها في أدنى حالة طاقة (أرضية)
- حالة الأرض
- أدنى حالة طاقة للذرة
- أيون
- ذرة أصبحت مشحونة كهربائيًا عن طريق إضافة أو فقدان إلكترون واحد أو أكثر
- التأين
- العملية التي من خلالها تكتسب الذرة الإلكترونات أو تفقدها


