5.4: بنية الذرة
- Page ID
- 197291
أهداف التعلم
في نهاية هذا القسم، ستكون قادرًا على:
- وصف بنية الذرات ومكونات النوى
- شرح سلوك الإلكترونات داخل الذرات وكيفية تفاعل الإلكترونات مع الضوء للتنقل بين مستويات الطاقة
إن فكرة أن المادة تتكون من جزيئات صغيرة تسمى الذرات عمرها 25 قرنًا على الأقل. ومع ذلك، استغرق الأمر حتى القرن العشرين حتى اخترع العلماء أدوات تسمح لهم بالبحث داخل الذرة ووجدوا أنها ليست صعبة وغير قابلة للتجزئة، كما كان يُعتقد. بدلاً من ذلك، فإن الذرة عبارة عن بنية معقدة تتكون من جزيئات أصغر.
سبر الذرة
تم اكتشاف أول هذه الجسيمات الصغيرة من قبل الفيزيائي البريطاني جيمس (J. J.) طومسون في عام 1897. يُطلق على هذا الجسيم اسم الإلكترون، ويتم شحنه بشكل سلبي. (إن تدفق هذه الجسيمات هو الذي ينتج تيارات الكهرباء، سواء في مسامير البرق أو في الأسلاك المؤدية إلى المصباح الخاص بك.) نظرًا لأن الذرة في حالتها الطبيعية محايدة كهربائيًا، يجب موازنة كل إلكترون في الذرة بنفس كمية الشحنة الموجبة.
كانت الخطوة التالية هي تحديد مكان الشحنات الموجبة والسالبة في الذرة. في عام 1911، ابتكر الفيزيائي البريطاني إرنست روثرفورد تجربة قدمت جزءًا من الإجابة على هذا السؤال. قام بقصف قطعة رقيقة للغاية من رقائق الذهب، سمكها حوالي 400 ذرة فقط، بشعاع من جزيئات ألفا (الشكل\(\PageIndex{1}\)). جسيمات ألفا (جزيئات ألفا) هي ذرات هيليوم فقدت إلكتروناتها وبالتالي يتم شحنها بشكل إيجابي. مرت معظم هذه الجسيمات عبر رقائق الذهب تمامًا كما لو كانت الذرات الموجودة فيها مساحة فارغة تقريبًا. ومع ذلك، فإن حوالي 1 من كل 8000 من جسيمات ألفا عكست اتجاهها تمامًا وارتدت للخلف من الرقاقة. كتب روثرفورد: «لقد كان الحدث الأكثر روعة الذي حدث لي في حياتي. كان الأمر مذهلاً تقريبًا كما لو أنك أطلقت قذيفة بحجم 15 بوصة على قطعة من المناديل الورقية وعادت وأصابتك».
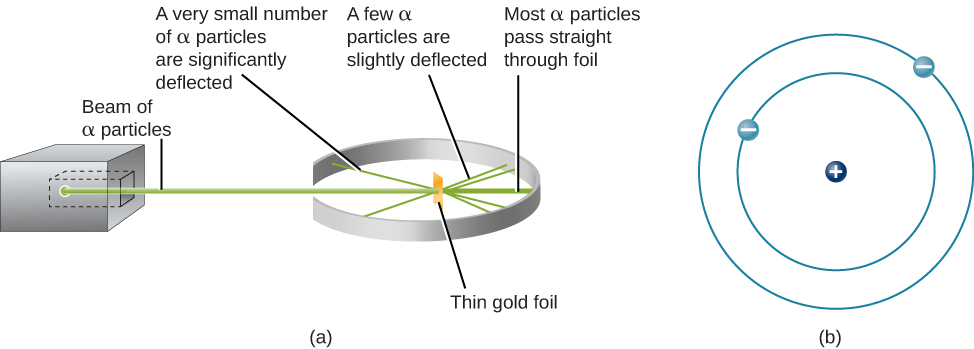
كانت الطريقة الوحيدة لحساب الجسيمات التي عكست اتجاهها عندما اصطدمت بالرقائق الذهبية هي افتراض أن كل الكتلة تقريبًا، بالإضافة إلى كل الشحنة الموجبة في كل ذرة ذهبية فردية، تتركز في مركز صغير أو نواة. عندما يصطدم جسيم ألفا الموجب الشحنة بالنواة، فإنه يعكس الاتجاه، تمامًا مثل كرة الإشارة لعكس الاتجاه عندما تصطدم بكرة بلياردو أخرى. وضع نموذج روثرفورد النوع الآخر من الشحنة - الإلكترونات السالبة - في مدار حول هذه النواة.
تطلب نموذج روثرفورد أن تكون الإلكترونات في حالة حركة. تجذب الشحنات الموجبة والسالبة بعضها البعض، لذلك ستسقط الإلكترونات الثابتة في النواة الموجبة. أيضًا، نظرًا لصغر كل من الإلكترونات والنواة، فإن معظم الذرة فارغة، وهذا هو السبب في أن جميع جزيئات روثرفورد تقريبًا كانت قادرة على المرور مباشرة عبر رقاقة الذهب دون الاصطدام بأي شيء. كان نموذج رذرفورد تفسيرًا ناجحًا جدًا للتجارب التي أجراها، على الرغم من أن العلماء سيكتشفون في النهاية أنه حتى النواة نفسها لها بنية.
النواة الذرية
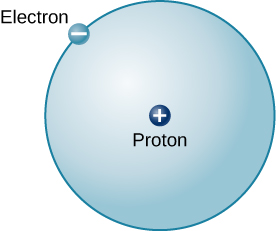
إن أبسط ذرة ممكنة (والأكثر شيوعًا في الشمس والنجوم) هي الهيدروجين. تحتوي نواة الهيدروجين العادي على بروتون واحد. يتحرك حول هذا البروتون إلكترون واحد. كتلة الإلكترون أصغر بحوالي 2000 مرة من كتلة البروتون؛ يحمل الإلكترون كمية من الشحنة تساوي تمامًا شحنة البروتون ولكنها معاكسة في الإشارة (الشكل\(\PageIndex{2}\)). تجذب الشحنات المتقابلة بعضها البعض، لذا فهي قوة كهرومغناطيسية تجمع البروتون والإلكترون معًا، تمامًا كما أن الجاذبية هي القوة التي تبقي الكواكب في مدار حول الشمس.
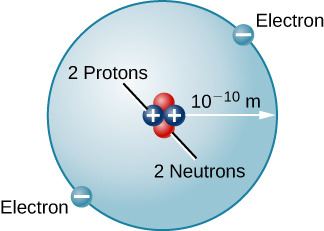
هناك العديد من أنواع الذرات الأخرى في الطبيعة. الهيليوم، على سبيل المثال، هو ثاني أكثر العناصر وفرة في الشمس. يحتوي الهيليوم على بروتونان في نواته بدلاً من البروتون الوحيد الذي يميز الهيدروجين. بالإضافة إلى ذلك، تحتوي نواة الهيليوم على نيوترونين، جسيمات ذات كتلة مماثلة لكتلة البروتون ولكن بدون شحنة كهربائية. يتحرك حول هذه النواة إلكترونان، وبالتالي فإن الشحنة الصافية الإجمالية لذرة الهيليوم هي أيضًا صفر (الشكل\(\PageIndex{3}\)).
من هذا الوصف للهيدروجين والهيليوم، ربما خمنت نمط بناء جميع العناصر (أنواع مختلفة من الذرات) التي نجدها في الكون. يتم تحديد نوع العنصر من خلال عدد البروتونات في نواة الذرة. على سبيل المثال، أي ذرة تحتوي على ستة بروتونات هي عنصر الكربون، وثمانية بروتونات هي الأكسجين، و 26 هو الحديد، و 92 هو اليورانيوم. على الأرض، تحتوي الذرة النموذجية على نفس عدد الإلكترونات الموجودة في البروتونات، وتتبع هذه الإلكترونات أنماطًا مدارية معقدة حول النواة. ومع ذلك، في أعماق النجوم، يكون الجو حارًا جدًا لدرجة أن الإلكترونات تنفصل عن النواة وتعيش (كما سنرى) حياة منفصلة ولكن منتجة.
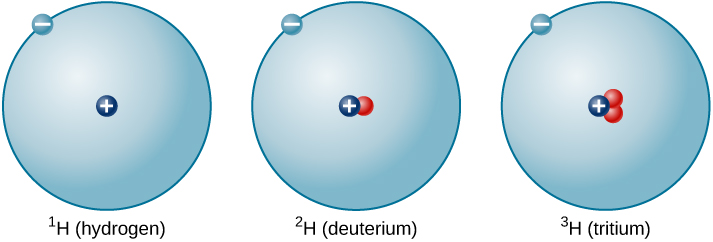
تزداد نسبة النيوترونات إلى البروتونات مع زيادة عدد البروتونات، ولكن كل عنصر فريد. ليس بالضرورة أن يكون عدد النيوترونات هو نفسه لجميع ذرات عنصر معين. على سبيل المثال، لا تحتوي معظم ذرات الهيدروجين على نيوترونات على الإطلاق. ومع ذلك، هناك ذرات هيدروجين تحتوي على بروتون واحد ونيوترون واحد، وأخرى تحتوي على بروتون واحد ونيوترونين. تسمى الأنواع المختلفة من نوى الهيدروجين بأعداد مختلفة من النيوترونات نظائر الهيدروجين (الشكل\(\PageIndex{4}\))، وجميع العناصر الأخرى لها نظائر أيضًا. يمكنك التفكير في النظائر كأشقاء في نفس عنصر «العائلة» - يرتبط ارتباطًا وثيقًا ولكن بخصائص وسلوكيات مختلفة.
لاستكشاف بنية الذرات، انتقل إلى موقع PhET Build an Atom حيث يمكنك إضافة البروتونات أو النيوترونات أو الإلكترونات إلى نموذج وسيظهر اسم العنصر الذي قمت بإنشائه. يمكنك أيضًا رؤية الشحنة الصافية، ورقم الكتلة، سواء كانت مستقرة أو غير مستقرة، وما إذا كانت ذرة أيون أم ذرة محايدة.
ذا بوهر أتوم
يحتوي نموذج رذرفورد للذرات على مشكلة خطيرة واحدة. تقول نظرية ماكسويل للإشعاع الكهرومغناطيسي أنه عندما تغير الإلكترونات السرعة أو اتجاه الحركة، يجب أن تنبعث منها طاقة. تعمل الإلكترونات المدارية باستمرار على تغيير اتجاه حركتها، لذلك يجب أن تصدر تيارًا ثابتًا من الطاقة. بتطبيق نظرية ماكسويل على نموذج روثرفورد، يجب أن تدور جميع الإلكترونات في نواة الذرة عندما تفقد الطاقة، ويجب أن يحدث هذا الانهيار بسرعة كبيرة - في حوالي 10 إلى 16 ثانية.
كان الفيزيائي الدنماركي نيلز بور (1885-1962) هو الذي حل لغز كيفية بقاء الإلكترونات في المدار. كان يحاول تطوير نموذج للذرة من شأنه أن يفسر أيضًا بعض الانتظامات التي لوحظت في طيف الهيدروجين. اقترح أنه يمكن فهم طيف الهيدروجين إذا افترضنا أن المدارات ذات الأحجام المحددة فقط ممكنة للإلكترون. افترض بوهر أيضًا أنه طالما أن الإلكترون يتحرك في واحد فقط من هذه المدارات المسموح بها، فإنه لا يشع أي طاقة: لن تتغير طاقته إلا إذا انتقل من مدار إلى آخر.
كان هذا الاقتراح، على حد تعبير مؤرخ العلوم أبراهام بايس، «أحد أكثر الفرضيات جرأة التي تم تقديمها في الفيزياء على الإطلاق». إذا كان هناك شيء مماثل في العمل في عالم الحياة اليومية، فقد تجد أنه أثناء المشي بعد حصة علم الفلك، سمحت لك الطبيعة بالسير خطوتين في الدقيقة، وخمس خطوات في الدقيقة، و12 خطوة في الدقيقة، ولكن بدون سرعات بينهما. بغض النظر عن الطريقة التي حاولت بها تحريك ساقيك، لن يُسمح إلا بسرعات مشي معينة. لجعل الأمور أكثر غرابة، لن يتطلب الأمر أي جهد للمشي بأي من السرعات المسموح بها، ولكن سيكون من الصعب التغيير من سرعة إلى أخرى. لحسن الحظ، لا تنطبق مثل هذه القواعد على مستوى السلوك البشري. ولكن على المستوى المجهري للذرة، أكدت التجربة تلو التجربة صحة فكرة بوهر الغريبة. أصبحت اقتراحات بوهر أحد أسس النموذج الجديد (والأكثر تعقيدًا) للعالم دون الذري المسمى ميكانيكا الكم.
في نموذج Bohr، إذا انتقل الإلكترون من مدار إلى آخر أقرب إلى النواة الذرية، فيجب أن يتخلى عن بعض الطاقة في شكل إشعاع كهرومغناطيسي. ومع ذلك، إذا انتقل الإلكترون من مدار داخلي إلى مدار أبعد عن النواة، فإنه يتطلب بعض الطاقة الإضافية. تتمثل إحدى طرق الحصول على الطاقة اللازمة في امتصاص الإشعاع الكهرومغناطيسي الذي قد يتدفق عبر الذرة من مصدر خارجي.
من السمات الرئيسية لنموذج Bohr أن كل مدارات الإلكترون المسموح بها حول ذرة معينة لها قيمة طاقة معينة؛ لذلك يمكننا التفكير في كل مدار كمستوى للطاقة. يتطلب الانتقال من مدار إلى آخر (والذي سيكون له قيمة طاقة محددة خاصة به) تغييرًا في طاقة الإلكترون - تغيير يحدده الفرق بين قيمتي الطاقة. إذا انتقل الإلكترون إلى مستوى أقل، فسيتم إعطاء فرق الطاقة؛ إذا انتقل الإلكترون إلى مستوى أعلى، يجب الحصول على فرق الطاقة من مكان آخر. كل قفزة (أو انتقال) إلى مستوى مختلف لها تغيير ثابت ومحدد في الطاقة مرتبط بها.
قد يكون التشبيه الفج لهذا الموقف هو الحياة في برج من الشقق الفاخرة حيث يتم تحديد الإيجار من خلال جودة المنظر. يحتوي هذا المبنى على مستويات أو طوابق مرقمة معينة ومحددة تقع عليها الشقق. لا يمكن لأحد أن يعيش في الطابق 5.37 أو 22.5. بالإضافة إلى ذلك، يرتفع الإيجار كلما صعدت إلى الطوابق العليا. إذا كنت ترغب في استبدال شقة في الطابق العشرين بواحدة في الطابق الثاني، فلن تكون مدينًا بنفس القدر من الإيجار. ومع ذلك، إذا كنت ترغب في الانتقال من الطابق الثالث إلى الطابق الخامس والعشرين، فسوف يزداد الإيجار. في الذرة أيضًا، يكون المكان «الأرخص» الذي يعيش فيه الإلكترون هو أدنى مستوى ممكن، والطاقة مطلوبة للانتقال إلى مستوى أعلى.
هنا لدينا واحدة من الحالات التي يسهل فيها التفكير في الإشعاع الكهرومغناطيسي كجسيمات (فوتونات) وليس كموجات. عندما تنتقل الإلكترونات من مستوى إلى آخر، فإنها تطلق أو تمتص حزمًا صغيرة من الطاقة. عندما ينتقل الإلكترون إلى مستوى أعلى، فإنه يمتص فوتون من الطاقة المناسبة فقط (بشرط توفر واحدة). عندما ينتقل إلى مستوى أقل، فإنه يصدر فوتون بكمية الطاقة الدقيقة التي لم يعد بحاجة إليها في «حالة المعيشة منخفضة التكلفة».
يجب أن تكون منظورات الفوتون والموجة متكافئة: الضوء هو الضوء، بغض النظر عن الطريقة التي ننظر بها إليه. وبالتالي، يحمل كل فوتون كمية معينة من الطاقة تتناسب مع التردد (\(f\)) للموجة التي يمثلها. يتم إعطاء قيمة طاقتها (\(E\)) بواسطة الصيغة
\[E=hf \nonumber\]
حيث يُطلق على ثابت التناسب اسم ثابت بلانك.\(h\)
تم تسمية الثابت باسم ماكس بلانك، الفيزيائي الألماني الذي كان أحد منشئي نظرية الكم (الشكل\(\PageIndex{5}\)). إذا تم استخدام الوحدات المترية (أي إذا تم قياس الطاقة بالجول والتردد بالهرتز)، فإن ثابت بلانك له قيمة\(h = 6.626 \times 10^{–34}\) جول ثانية (J-s). تتوافق الفوتونات ذات الطاقة العالية مع موجات التردد العالي (التي لها طول موجي أقصر)؛ الفوتونات منخفضة الطاقة هي موجات ذات تردد أقل.

لنأخذ مثالاً محددًا، ضع في اعتبارك ذرة الكالسيوم داخل الغلاف الجوي للشمس حيث يقفز الإلكترون من مستوى أدنى إلى مستوى أعلى. للقيام بذلك، يحتاج إلى حوالي 5 × 10-19 جول من الطاقة، والتي يمكن الحصول عليها بسهولة عن طريق امتصاص فوتون عابر من تلك الطاقة القادمة من أعماق الشمس. يعادل هذا الفوتون موجة من الضوء ترددها حوالي 7.5 × 10 14 هيرتز ويبلغ طولها الموجي حوالي 3.9 × 10-7 أمتار (393 نانومتر)، في الجزء البنفسجي العميق من طيف الضوء المرئي. على الرغم من أنه قد يبدو غريبًا في البداية التحول من تصوير الضوء كفوتون (أو حزمة طاقة) إلى تصويره كموجة، فقد أصبح هذا التبديل طبيعة ثانية لعلماء الفلك ويمكن أن يكون أداة مفيدة لإجراء حسابات حول الأطياف.
مثال\(\PageIndex{1}\): طاقة الفوتون
الآن بعد أن عرفنا كيفية حساب الطول الموجي والتردد للفوتون، يمكننا استخدام هذه المعلومات، جنبًا إلى جنب مع ثابت بلانك، لتحديد مقدار الطاقة التي يحملها كل فوتون. ما مقدار الطاقة التي يمتلكها الفوتون الأحمر الذي يبلغ طوله الموجي ٦٣٠ نانومترًا؟
الحل
أولاً، كما تعلمنا سابقًا، يمكننا العثور على تردد الفوتون:
\[f= \frac{c}{ \lambda} = \frac{3 \times 10^8 \text{ m/s}}{630 \times 10^{–9} \text{ m}} = 4.8 \times 10^{14} \text{ Hz} \nonumber\]
بعد ذلك، يمكننا استخدام ثابت بلانك لتحديد الطاقة (تذكر أن هرتز هو نفس 1/s):
\[E=hf= \left( 6.626 \times 10^{–34} \text{ J-s} \right) \left( 4.8 \times 10^{14} (1/\text{s}) \right)=3.2 \times 10^{–19} \text{ J} \nonumber\]
التمارين\(\PageIndex{1}\)
ما طاقة فوتون أصفر بتردد ٥٫٥ × ١٠ ١٤ هرتز؟
- إجابة
-
\[E=hf= \left(6.626 \times10^{–34} \right) \left(5.5 \times 10^{14} \right) = 3.6 \times 10^{–19} \text{ J} \nonumber\]
المفاهيم الأساسية والملخص
تتكون الذرات من نواة تحتوي على بروتون واحد أو أكثر من البروتونات الموجبة الشحنة. يمكن أن تحتوي جميع الذرات باستثناء الهيدروجين أيضًا على نيوترونات واحدة أو أكثر في النواة. تدور أيونات كهربائية سالبة الشحنة حول النواة. يحدد عدد البروتونات عنصرًا (يحتوي الهيدروجين على بروتون واحد، والهيليوم اثنان، وهكذا) من الذرة. النوى التي لها نفس عدد البروتونات ولكن الأعداد المختلفة من النيوترونات هي نظائر مختلفة لنفس العنصر. في نموذج Bohr للذرة، لا تصدر الإلكترونات في المدارات المسموح بها (أو مستويات الطاقة) أي إشعاع كهرومغناطيسي. ولكن عندما تنتقل الإلكترونات من مستويات أدنى إلى مستويات أعلى، يجب أن تمتص فوتون من الطاقة المناسبة تمامًا، وعندما تنتقل من مستويات أعلى إلى مستويات أدنى، فإنها تعطي فوتون من الطاقة المناسبة تمامًا. ترتبط طاقة الفوتون بتردد الموجة الكهرومغناطيسية التي يمثلها بصيغة بلانك،\(E=hf\).
مسرد المصطلحات
- مستوى الطاقة
- مستوى أو كمية معينة من الطاقة التي تمتلكها ذرة أو أيون فوق الطاقة التي تمتلكها في حالتها الأقل نشاطًا؛ تستخدم أيضًا للإشارة إلى حالات الطاقة التي يمكن أن يمتلكها الإلكترون في الذرة
- نظير
- أي من شكلين أو أكثر من نفس العنصر الذي تحتوي ذراته على نفس عدد البروتونات ولكن بأعداد مختلفة من النيوترونات
- نواة (ذرة)
- الجزء الضخم من الذرة، الذي يتكون في الغالب من البروتونات والنيوترونات، والذي تدور حوله الإلكترونات


