6.3: قوانين الديناميكا الحرارية
- Page ID
- 196361
مهارات التطوير
- ناقش مفهوم الإنتروبيا
- شرح القوانين الأولى والثانية للديناميكا الحرارية
تشير الديناميكا الحرارية إلى دراسة الطاقة ونقل الطاقة بما في ذلك المواد الفيزيائية. يتم تصنيف المادة وبيئتها ذات الصلة بحالة معينة من نقل الطاقة كنظام، وكل شيء خارج هذا النظام يسمى البيئة المحيطة. على سبيل المثال، عند تسخين وعاء من الماء على الموقد، يشتمل النظام على الموقد والوعاء والماء. يتم نقل الطاقة داخل النظام (بين الموقد والوعاء والماء). هناك نوعان من الأنظمة: المفتوحة والمغلقة. النظام المفتوح هو النظام الذي يمكن من خلاله نقل الطاقة بين النظام والمناطق المحيطة به. نظام الموقد مفتوح لأن الحرارة يمكن أن تضيع في الهواء. النظام المغلق هو النظام الذي لا يمكنه نقل الطاقة إلى محيطه.
الكائنات البيولوجية هي أنظمة مفتوحة. يتم تبادل الطاقة بينهم وبين محيطهم، حيث يستهلكون جزيئات تخزين الطاقة ويطلقون الطاقة إلى البيئة من خلال القيام بالعمل. مثل كل الأشياء في العالم المادي، تخضع الطاقة لقوانين الفيزياء. تحكم قوانين الديناميكا الحرارية نقل الطاقة داخل وبين جميع أنظمة الكون.
القانون الأول للديناميكا الحرارية
يتناول القانون الأول للديناميكا الحرارية إجمالي كمية الطاقة في الكون. تنص على أن هذه الكمية الإجمالية من الطاقة ثابتة. بعبارة أخرى، كانت هناك دائمًا، وستظل دائمًا، نفس كمية الطاقة في الكون. توجد الطاقة في العديد من الأشكال المختلفة. وفقًا للقانون الأول للديناميكا الحرارية، يمكن نقل الطاقة من مكان إلى آخر أو تحويلها إلى أشكال مختلفة، ولكن لا يمكن إنشاؤها أو تدميرها. تحدث عمليات نقل وتحولات الطاقة من حولنا طوال الوقت. تعمل المصابيح الكهربائية على تحويل الطاقة الكهربائية إلى طاقة ضوئية. تعمل مواقد الغاز على تحويل الطاقة الكيميائية من الغاز الطبيعي إلى طاقة حرارية. تقوم النباتات بأحد تحويلات الطاقة الأكثر فائدة بيولوجيًا على الأرض: تحويل طاقة ضوء الشمس إلى طاقة كيميائية مخزنة داخل الجزيئات العضوية (الشكل 2.3.b.1). تظهر بعض الأمثلة لتحولات الطاقة في الشكل\(\PageIndex{1}\).
يتمثل التحدي الذي تواجهه جميع الكائنات الحية في الحصول على الطاقة من محيطها بأشكال يمكنها نقلها أو تحويلها إلى طاقة قابلة للاستخدام للقيام بالعمل. لقد تطورت الخلايا الحية لمواجهة هذا التحدي بشكل جيد للغاية. يتم تحويل الطاقة الكيميائية المخزنة داخل الجزيئات العضوية مثل السكريات والدهون من خلال سلسلة من التفاعلات الكيميائية الخلوية إلى طاقة داخل جزيئات ATP. يمكن الوصول بسهولة إلى الطاقة في جزيئات ATP للقيام بالعمل. تشمل الأمثلة على أنواع العمل الذي تحتاج الخلايا إلى القيام به بناء جزيئات معقدة، ونقل المواد، وتشغيل الحركة النابضة للأهداب أو الأسواط، وتقلص ألياف العضلات لخلق الحركة، والتكاثر.

القانون الثاني للديناميكا الحرارية
قد تبدو المهام الأساسية للخلية الحية المتمثلة في الحصول على الطاقة وتحويلها واستخدامها للقيام بالعمل بسيطة. ومع ذلك، يشرح القانون الثاني للديناميكا الحرارية سبب صعوبة هذه المهام مما تبدو عليه. لا تعتبر أي من عمليات نقل الطاقة التي ناقشناها، إلى جانب جميع عمليات نقل الطاقة والتحولات في الكون، فعالة تمامًا. في كل عملية نقل للطاقة، يتم فقدان قدر من الطاقة في شكل غير قابل للاستخدام. في معظم الحالات، يكون هذا النموذج عبارة عن طاقة حرارية. من الناحية الديناميكية الحرارية، تُعرَّف الطاقة الحرارية بأنها الطاقة المنقولة من نظام إلى آخر لا تعمل. على سبيل المثال، عندما تطير طائرة في الهواء، يتم فقدان بعض طاقة الطائرة كطاقة حرارية بسبب الاحتكاك مع الهواء المحيط. يؤدي هذا الاحتكاك فعليًا إلى تسخين الهواء عن طريق زيادة سرعة جزيئات الهواء مؤقتًا. وبالمثل، يتم فقدان بعض الطاقة كطاقة حرارية أثناء التفاعلات الأيضية الخلوية. هذا جيد للمخلوقات ذات الدم الحار مثلنا، لأن الطاقة الحرارية تساعد في الحفاظ على درجة حرارة الجسم. بالمعنى الدقيق للكلمة، لا يوجد نقل للطاقة فعال تمامًا، لأن بعض الطاقة تضيع في شكل غير قابل للاستخدام.
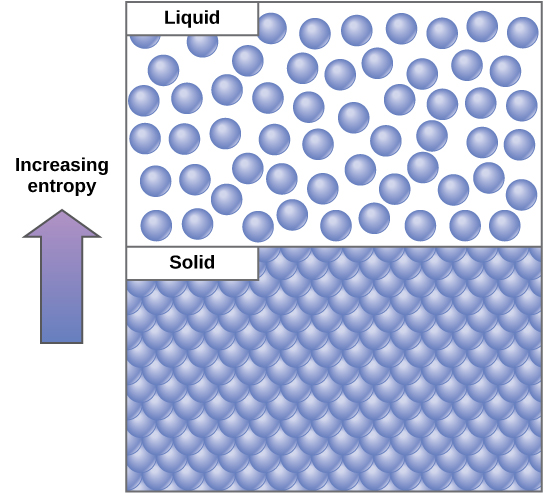
أحد المفاهيم المهمة في الأنظمة الفيزيائية هو النظام والاضطراب (المعروف أيضًا باسم العشوائية). فكلما زاد مقدار الطاقة التي يفقدها النظام في البيئة المحيطة به، كلما قل ترتيب النظام وأصبح النظام أكثر عشوائية. يشير العلماء إلى مقياس العشوائية أو الاضطراب داخل النظام باسم الإنتروبيا. الإنتروبيا العالية تعني الاضطراب العالي والطاقة المنخفضة (الشكل\(\PageIndex{2}\)). لفهم الإنتروبيا بشكل أفضل، فكر في غرفة نوم الطالب. إذا لم يتم توفير الطاقة أو العمل فيها، فستصبح الغرفة فوضوية بسرعة. سيكون موجودًا في حالة مضطربة للغاية، واحدة من الإنتروبيا العالية. يجب وضع الطاقة في النظام، في شكل قيام الطالب بالعمل ووضع كل شيء بعيدًا، من أجل إعادة الغرفة إلى حالة النظافة والنظام. هذه الحالة هي حالة إنتروبيا منخفضة. وبالمثل، يجب صيانة السيارة أو المنزل باستمرار مع العمل من أجل الحفاظ عليها في حالة مرتبة. إذا تُرك الإنتروبيا في المنزل أو السيارة بمفردها، فإنها تزداد تدريجيًا من خلال الصدأ والتدهور. تحتوي الجزيئات والتفاعلات الكيميائية على كميات متفاوتة من الإنتروبيا أيضًا. على سبيل المثال، عندما تصل التفاعلات الكيميائية إلى حالة توازن، تزداد الإنتروبيا، ومع انتشار الجزيئات ذات التركيز العالي في مكان واحد وانتشارها، تزداد الإنتروبيا أيضًا.
الاتصال العلمي: نقل الطاقة والإنتروبيا الناتجة
قم بإعداد تجربة بسيطة لفهم كيفية نقل الطاقة وكيفية حدوث تغيير في الإنتروبيا.
- خذ كتلة من الثلج. هذا هو الماء في شكل صلب، لذلك له ترتيب هيكلي مرتفع. هذا يعني أن الجزيئات لا يمكن أن تتحرك كثيرًا وهي في وضع ثابت. تبلغ درجة حرارة الجليد 0 درجة مئوية، ونتيجة لذلك تكون إنتروبيا النظام منخفضة.
- دع الثلج يذوب في درجة حرارة الغرفة. ما حالة الجزيئات في الماء السائل الآن؟ كيف تم نقل الطاقة؟ هل إنتروبيا النظام أعلى أم أقل؟ لماذا؟
- قم بتسخين الماء إلى درجة الغليان. ماذا يحدث لإنتروبيا النظام عند تسخين الماء؟
يمكن التفكير في جميع الأنظمة الفيزيائية بهذه الطريقة: الكائنات الحية مرتبة للغاية، وتتطلب مدخلات طاقة ثابتة للحفاظ عليها في حالة الإنتروبيا المنخفضة. عندما تستوعب الأنظمة الحية جزيئات تخزين الطاقة وتحولها من خلال التفاعلات الكيميائية، فإنها تفقد قدرًا من الطاقة القابلة للاستخدام في هذه العملية، نظرًا لعدم وجود تفاعل فعال تمامًا. كما أنها تنتج نفايات ومنتجات ثانوية ليست مصادر طاقة مفيدة. تزيد هذه العملية من إنتروبيا محيط النظام. نظرًا لأن جميع عمليات نقل الطاقة تؤدي إلى فقدان بعض الطاقة القابلة للاستخدام، فإن القانون الثاني للديناميكا الحرارية ينص على أن كل نقل أو تحويل للطاقة يزيد من إنتروبيا الكون. على الرغم من أن الكائنات الحية مرتبة للغاية وتحافظ على حالة من الإنتروبيا المنخفضة، فإن إنتروبيا الكون في المجموع تتزايد باستمرار بسبب فقدان الطاقة القابلة للاستخدام مع كل نقل للطاقة يحدث. في الأساس، تخوض الكائنات الحية معركة شاقة مستمرة ضد هذه الزيادة المستمرة في الإنتروبيا العالمية.
ملخص
في دراسة الطاقة، يستخدم العلماء مصطلح «النظام» للإشارة إلى المادة وبيئتها المشاركة في عمليات نقل الطاقة. كل شيء خارج النظام يسمى المناطق المحيطة. الخلايا المفردة هي أنظمة بيولوجية. يمكن اعتبار الأنظمة على أنها تحتوي على قدر معين من الطلب. يتطلب الأمر طاقة لجعل النظام أكثر ترتيبًا. كلما زاد ترتيب النظام، انخفضت إنتروبيا. الإنتروبيا هي مقياس لاضطراب النظام. عندما يصبح النظام أكثر اضطرابًا، كلما انخفضت طاقته وزادت إنتروبيا.
تصف سلسلة من القوانين، تسمى قوانين الديناميكا الحرارية، خصائص وعمليات نقل الطاقة. ينص القانون الأول على أن الكمية الإجمالية للطاقة في الكون ثابتة. هذا يعني أنه لا يمكن إنشاء الطاقة أو تدميرها، بل نقلها أو تحويلها فقط. ينص القانون الثاني للديناميكا الحرارية على أن كل عملية نقل للطاقة تنطوي على فقدان بعض الطاقة في شكل غير قابل للاستخدام، مثل الطاقة الحرارية، مما يؤدي إلى نظام أكثر اضطرابًا. بمعنى آخر، لا يوجد نقل للطاقة فعال تمامًا ويميل إلى الاضطراب.
مسرد المصطلحات
- الإنتروبيا (S)
- قياس العشوائية أو الاضطراب داخل النظام
- حرارة
- طاقة الطاقة المنقولة من نظام إلى آخر والتي لا تعمل (طاقة حركة الجزيئات أو الجسيمات)
- الديناميكا الحرارية
- دراسة الطاقة ونقل الطاقة بما في ذلك المواد الفيزيائية


