6.2: الطاقة الكامنة والحركية والحرة والتنشيط
- Page ID
- 196333
المهارات اللازمة للتطوير
- تعريف «الطاقة»
- اشرح الفرق بين الطاقة الحركية والطاقة الكامنة
- ناقش مفاهيم الطاقة الحرة وطاقة التنشيط
- وصف التفاعلات الهوائية والمجهدة
يتم تعريف الطاقة على أنها القدرة على القيام بالعمل. كما تعلمت، توجد الطاقة بأشكال مختلفة. على سبيل المثال، الطاقة الكهربائية والطاقة الضوئية والطاقة الحرارية كلها أنواع مختلفة من الطاقة. في حين أن هذه كلها أنواع مألوفة من الطاقة التي يمكن للمرء رؤيتها أو الشعور بها، إلا أن هناك نوعًا آخر من الطاقة أقل واقعية بكثير. ترتبط هذه الطاقة بشيء بسيط مثل كائن مثبت فوق الأرض. من أجل تقدير الطريقة التي تتدفق بها الطاقة داخل وخارج الأنظمة البيولوجية، من المهم فهم المزيد عن أنواع الطاقة المختلفة الموجودة في العالم المادي.
أنواع الطاقة
عندما يكون الجسم في حالة حركة، هناك طاقة مرتبطة بهذا الكائن. في مثال الطائرة أثناء الطيران، هناك قدر كبير من الطاقة المرتبطة بحركة الطائرة. هذا لأن الأجسام المتحركة قادرة على إحداث تغيير أو القيام بعمل. فكر في كرة مدمرة. حتى كرة التدمير البطيئة الحركة يمكن أن تسبب قدرًا كبيرًا من الضرر للأشياء الأخرى. ومع ذلك، فإن الكرة المحطمة غير المتحركة غير قادرة على أداء العمل. الطاقة المرتبطة بالأجسام المتحركة تسمى الطاقة الحركية. تحتوي كل من الرصاصة المسرعة والشخص المتحرك والحركة السريعة للجزيئات في الهواء (التي تنتج الحرارة) والإشعاع الكهرومغناطيسي مثل الضوء على طاقة حركية.
الآن ماذا لو تم رفع نفس الكرة المدمرة التي لا تتحرك بطابقين فوق سيارة ذات رافعة؟ إذا كانت كرة التدمير المعلقة غير متحركة، فهل هناك طاقة مرتبطة بها؟ الجواب هو نعم. تحتوي كرة التدمير المعلقة على طاقة مرتبطة بها تختلف اختلافًا جوهريًا عن الطاقة الحركية للأجسام المتحركة. ينتج هذا الشكل من الطاقة عن حقيقة أن هناك إمكانية لعمل كرة التدمير. إذا تم إصداره، فإنه سيعمل بالفعل. نظرًا لأن هذا النوع من الطاقة يشير إلى إمكانية القيام بالعمل، فإنه يسمى الطاقة الكامنة. تنقل الأجسام طاقتها بين الحركية والجهد بالطريقة التالية: عندما تتدلى الكرة المحطمة بلا حراك، فإنها تحتوي على 0 طاقة حركية و100 بالمائة من الطاقة الكامنة. بمجرد إطلاقه، تبدأ طاقته الحركية في الزيادة لأنه يبني السرعة بسبب الجاذبية. في الوقت نفسه، عندما تقترب من الأرض، تفقد الطاقة الكامنة. في مكان ما في منتصف الخريف، تحتوي على 50 بالمائة من الطاقة الحركية و 50 بالمائة من الطاقة الكامنة فقبل اصطدامها بالأرض، فقدت الكرة تقريبًا طاقتها الكامنة ولديها طاقة حركية تقترب من الحد الأقصى. تشمل الأمثلة الأخرى للطاقة الكامنة طاقة المياه الموجودة خلف السد (الشكل\(\PageIndex{1}\))، أو الشخص الذي على وشك القفز بالمظلات من طائرة.

لا ترتبط الطاقة الكامنة فقط بموقع المادة (مثل الطفل الذي يجلس على فرع شجرة)، ولكن أيضًا بهيكل المادة. يحتوي الزنبرك الموجود على الأرض على طاقة كامنة إذا تم ضغطه؛ وكذلك الشريط المطاطي الذي يتم سحبه بإحكام. يعتمد وجود الخلايا الحية بشكل كبير على الطاقة الهيكلية الكامنة. على المستوى الكيميائي، تمتلك الروابط التي تربط ذرات الجزيئات معًا طاقة كامنة. تذكر أن المسارات الخلوية الابتنائية تتطلب طاقة لتكوين جزيئات معقدة من جزيئات أبسط، وأن المسارات التقويضية تطلق الطاقة عند تكسير الجزيئات المعقدة. تشير حقيقة أن الطاقة يمكن إطلاقها عن طريق انهيار روابط كيميائية معينة إلى أن هذه الروابط لديها طاقة محتملة. في الواقع، هناك طاقة كامنة مخزنة داخل روابط جميع جزيئات الطعام التي نتناولها، والتي يتم تسخيرها في النهاية للاستخدام. هذا لأن هذه الروابط يمكن أن تطلق الطاقة عند كسرها. يُطلق على نوع الطاقة الكامنة الموجودة داخل الروابط الكيميائية، والتي يتم إطلاقها عند كسر هذه الروابط، الطاقة الكيميائية (الشكل\(\PageIndex{2}\)). الطاقة الكيميائية مسؤولة عن تزويد الخلايا الحية بالطاقة من الغذاء. يتم إطلاق الطاقة عن طريق كسر الروابط الجزيئية داخل جزيئات الوقود.

رابط إلى التعلم

قم بزيارة هذا الموقع وحدد «بندول بسيط» في القائمة (ضمن «الحركة التوافقية») لمشاهدة الحركة الحركية المتغيرة (K) والطاقة الكامنة (U) للبندول أثناء الحركة.
طاقة مجانية
بعد معرفة أن التفاعلات الكيميائية تطلق الطاقة عند كسر روابط تخزين الطاقة، فإن السؤال التالي المهم هو كيف يتم قياس الطاقة المرتبطة بالتفاعلات الكيميائية والتعبير عنها؟ كيف يمكن مقارنة الطاقة المنبعثة من تفاعل ما بالطاقة المنبعثة من تفاعل آخر؟ يتم استخدام قياس الطاقة الحرة لقياس عمليات نقل الطاقة هذه. يُطلق على الطاقة الحرة اسم الطاقة الحرة لجيبس (يُختصر بحرف G) نسبة إلى جوشيا ويلارد جيبس، العالم الذي طور القياس. تذكر أنه وفقًا للقانون الثاني للديناميكا الحرارية، تنطوي جميع عمليات نقل الطاقة على فقدان كمية من الطاقة في شكل غير قابل للاستخدام مثل الحرارة، مما يؤدي إلى الإنتروبيا. تشير طاقة جيبس الحرة على وجه التحديد إلى الطاقة المرتبطة بالتفاعل الكيميائي المتاح بعد حساب الإنتروبيا. بعبارة أخرى، الطاقة الحرة لجيبس هي طاقة قابلة للاستخدام، أو طاقة متاحة للقيام بالعمل.
يتضمن كل تفاعل كيميائي تغييرًا في الطاقة الحرة، يسمى دلتا G (G). يمكن حساب التغيير في الطاقة الحرة لأي نظام يخضع لمثل هذا التغيير، مثل التفاعل الكيميائي. لحساب G، اطرح كمية الطاقة المفقودة بسبب الإنتروبيا (المُشار إليها بـ S) من إجمالي التغيُّر في طاقة النظام. هذا التغيير الكلي للطاقة في النظام يسمى المحتوى الحراري ويشار إليه بـ H. صيغة حساب G هي كما يلي، حيث يشير الرمز T إلى درجة الحرارة المطلقة بالكلفن (درجة مئوية + 273):
شاهد رسمًا متحركًا للانتقال من الطاقة المجانية إلى الحالة الانتقالية في هذا الموقع.
من أين تأتي طاقة التنشيط التي تتطلبها المفاعلات الكيميائية؟ عادةً ما يكون مصدر طاقة التنشيط اللازمة لدفع التفاعلات إلى الأمام هو الطاقة الحرارية من المناطق المحيطة. تعمل الطاقة الحرارية (طاقة الرابطة الكلية للمتفاعلات أو المنتجات في تفاعل كيميائي) على تسريع حركة الجزيئات، مما يزيد من التردد والقوة التي تصطدم بها؛ كما أنها تحرك الذرات والروابط داخل الجزيء قليلاً، مما يساعدها على الوصول إلى حالتها الانتقالية. لهذا السبب، سيؤدي تسخين النظام إلى تفاعل المواد الكيميائية داخل هذا النظام بشكل متكرر. زيادة الضغط على النظام لها نفس التأثير. بمجرد أن تمتص المواد المتفاعلة طاقة حرارية كافية من محيطها للوصول إلى الحالة الانتقالية، سيستمر التفاعل.
تحدد طاقة التنشيط لتفاعل معين المعدل الذي سيستمر عنده. كلما زادت طاقة التنشيط، كلما كان التفاعل الكيميائي أبطأ. يوضح مثال صدأ الحديد تفاعلًا بطيئًا بطبيعته. يحدث هذا التفاعل ببطء بمرور الوقت بسبب ارتفاع E A. بالإضافة إلى ذلك، فإن حرق العديد من أنواع الوقود، وهو أمر شاق للغاية، سيحدث بمعدل ضئيل ما لم يتم التغلب على طاقة التنشيط الخاصة بها بالحرارة الكافية من الشرارة. ولكن بمجرد أن تبدأ التفاعلات الكيميائية في الاحتراق، تطلق التفاعلات الكيميائية حرارة كافية لمواصلة عملية الاحتراق، مما يوفر طاقة التنشيط لجزيئات الوقود المحيطة. مثل هذه التفاعلات خارج الخلايا، تكون طاقة التنشيط لمعظم التفاعلات الخلوية عالية جدًا بحيث لا يمكن للطاقة الحرارية التغلب عليها بمعدلات فعالة. بمعنى آخر، من أجل حدوث تفاعلات خلوية مهمة بمعدلات ملموسة (عدد التفاعلات لكل وحدة زمنية)، يجب خفض طاقات التنشيط الخاصة بها (الشكل\(\PageIndex{1}\)\(\PageIndex{5}\))؛ يشار إلى هذا بالحفز. هذا أمر جيد جدًا فيما يتعلق بالخلايا الحية. تخزن الجزيئات الكبيرة المهمة، مثل البروتينات والحمض النووي والحمض النووي الريبي، قدرًا كبيرًا من الطاقة، ويكون تفككها مجهودًا. إذا كانت درجات الحرارة الخلوية وحدها توفر طاقة حرارية كافية لهذه التفاعلات المجهدة للتغلب على حواجز التنشيط الخاصة بها، فإن المكونات الأساسية للخلية سوف تتفكك.
آرت كونيكشن
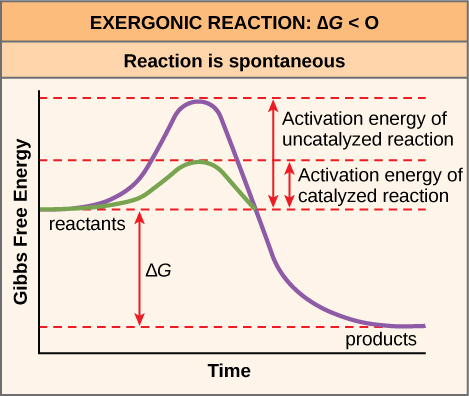
إذا لم تكن هناك حاجة إلى طاقة تنشيط لتحطيم السكروز (سكر المائدة)، فهل ستتمكن من تخزينه في وعاء سكر؟
ملخص
تأتي الطاقة في العديد من الأشكال المختلفة. تقوم الأجسام المتحركة بعمل بدني، والطاقة الحركية هي طاقة الأجسام المتحركة. قد تكون الأجسام غير المتحركة قادرة على القيام بعمل، وبالتالي، لديها طاقة كامنة. تحتوي الجزيئات أيضًا على طاقة كامنة لأن كسر الروابط الجزيئية لديه القدرة على إطلاق الطاقة. تعتمد الخلايا الحية على حصاد الطاقة الكامنة من الروابط الجزيئية لأداء العمل. الطاقة الحرة هي مقياس للطاقة المتاحة للقيام بالعمل. تتغير الطاقة الحرة للنظام أثناء عمليات نقل الطاقة مثل التفاعلات الكيميائية، ويشار إلى هذا التغيير باسم G.
يمكن أن يكون G للتفاعل سالبًا أو إيجابيًا، مما يعني أن التفاعل يطلق طاقة أو يستهلك طاقة، على التوالي. يُطلق على التفاعل ذو القيمة السالبة G الذي يعطي طاقة اسم التفاعل المجهد. يسمى التفاعل الإندروجيني الموجب الذي يتطلب إدخال الطاقة بتفاعل إندرغوني. يُقال إن التفاعلات الخارجية عفوية، لأن منتجاتها تحتوي على طاقة أقل من المواد المتفاعلة. تتمتع منتجات التفاعلات الأندرونية بحالة طاقة أعلى من المواد المتفاعلة، وبالتالي فهذه تفاعلات غير عفوية. ومع ذلك، تتطلب جميع التفاعلات (بما في ذلك تفاعلات -G العفوية) إدخالًا أوليًا للطاقة من أجل الوصول إلى الحالة الانتقالية، التي ستستمر عندها. هذه المدخلات الأولية للطاقة تسمى طاقة التنشيط.
اتصالات فنية
الشكل\(\PageIndex{3}\): انظر إلى كل عملية من العمليات المعروضة، وحدد ما إذا كانت داخلية أم مجهدة. في كل حالة، هل يزداد المحتوى الحراري أم ينقص، وهل تزيد الإنتروبيا أم تنقص؟
- إجابة
-
تحلل كومة السماد عملية شاقة؛ يزداد المحتوى الحراري (يتم إطلاق الطاقة) وتزداد الإنتروبيا (تنقسم الجزيئات الكبيرة إلى جزيئات أصغر). إن نمو الطفل من بويضة مخصبة هو عملية داخلية؛ وينخفض المحتوى الحراري (يتم امتصاص الطاقة) وتنخفض الإنتروبيا. إن تدمير الفن الرملي هو عملية شاقة؛ لا يوجد تغيير في المحتوى الحراري، لكن الإنتروبيا تزداد. تدحرج الكرة إلى أسفل هي عملية شاقة؛ وينخفض المحتوى الحراري (يتم إطلاق الطاقة)، ولكن لا يوجد تغيير في المحتوى الحراري.
الشكل\(\PageIndex{5}\): إذا لم تكن هناك حاجة إلى طاقة تنشيط لتحطيم السكروز (سكر المائدة)، فهل ستتمكن من تخزينه في وعاء سكر؟
- إجابة
-
لا. يمكننا تخزين الطاقة الكيميائية بسبب الحاجة إلى التغلب على الحاجز الذي يحول دون انهيارها.
مسرد المصطلحات
- طاقة التنشيط
- الطاقة اللازمة لحدوث ردود الفعل
- طاقة كيميائية
- الطاقة الكامنة في الروابط الكيميائية التي يتم إطلاقها عند كسر هذه الروابط
- بطانة الرحم
- يصف التفاعلات الكيميائية التي تتطلب إدخال الطاقة
- المحتوى الحراري
- إجمالي طاقة النظام
- مجهد
- يصف التفاعلات الكيميائية التي تطلق طاقة حرة
- طاقة مجانية
- الطاقة الحرة لجيبس هي الطاقة القابلة للاستخدام، أو الطاقة المتاحة للقيام بالعمل.
- طاقة حرارية
- إجمالي طاقة الرابطة للمتفاعلات أو المنتجات في تفاعل كيميائي
- طاقة حركية
- نوع الطاقة المرتبطة بالأجسام أو الجسيمات المتحركة
- طاقة محتملة
- نوع الطاقة التي لديها القدرة على القيام بالعمل؛ الطاقة المخزنة
- حالة انتقالية
- حالة عالية الطاقة وغير مستقرة (شكل وسيط بين الركيزة والمنتج) تحدث أثناء التفاعل الكيميائي


