11.1: מחשוף פרוטאוליטי
- Page ID
- 208605
השינוי הנפוץ ביותר הוא מחשוף פרוטאוליטי. חלק מהפוליפפטידים שלפני המחשוף נבקעים מיד, בעוד שאחרים מאוחסנים כמבשרים לא פעילים ליצירת מאגר אנזימים (או סוגים אחרים של חלבונים) שניתן להפעיל מהר מאוד, בטווח זמן של שניות עד דקות, בהשוואה לצורך לעבור שעתוק ותרגום, או אפילו רק תרגום. מעניין שלמרות שמתיונין (Met) היא באופן אוניברסלי חומצת האמינו הראשונה של פוליפפטיד שסונתז לאחרונה, לחלבונים רבים יש את המתיונין הזה התנתק (נכון גם לגבי F-met פרוקריוטי כלשהו).
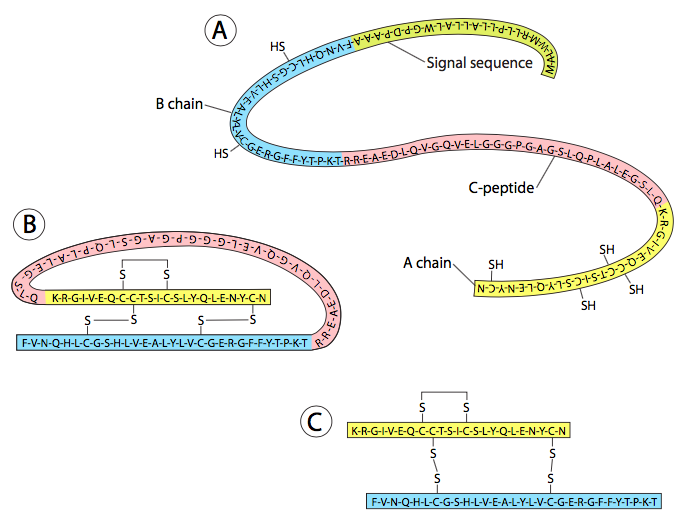
הפעלת חלבונים על ידי ביקוע של מבשרים היא נושא נפוץ: החלבון המבשר נקרא פרופרוטאין, והפפטיד שנבקע ממנו כדי להפעיל את החלבון נקרא פרופפטיד. בין הדוגמאות הידועות יותר לחלבונים שמקורם בפרופרוטאינים ניתן למנות את ההורמון אינסולין, משפחת חלבוני המוות של התא של caspases, והחלבון העצבי β-עמילואיד הקשור לאלצהיימר. אינסולין הוא דוגמה מעניינת (איור\(\PageIndex{1}\)) ביונקים: פרפרואינסולין (לא פעיל כהורמון) מתורגם לראשונה מה-mRNA של האינסולין. לאחר מחשוף שמסיר רצף N-טרמינלי, נוצר פרואינסולין (עדיין לא פעיל). הפרואינסולין יוצר כמה קשרי דיסולפיד פנימיים, וכאשר מתרחשת הפעולה הפרוטאוליטית הסופית, נלקח נתח משמעותי (הנקרא C-peptide) מאמצע הפרואינסולין. מכיוון שהחלבון נקשר באופן פנימי לדיסולפיד, שני חלקי הקצה נשארים מחוברים כדי להפוך להורמון האינסולין הפעיל.
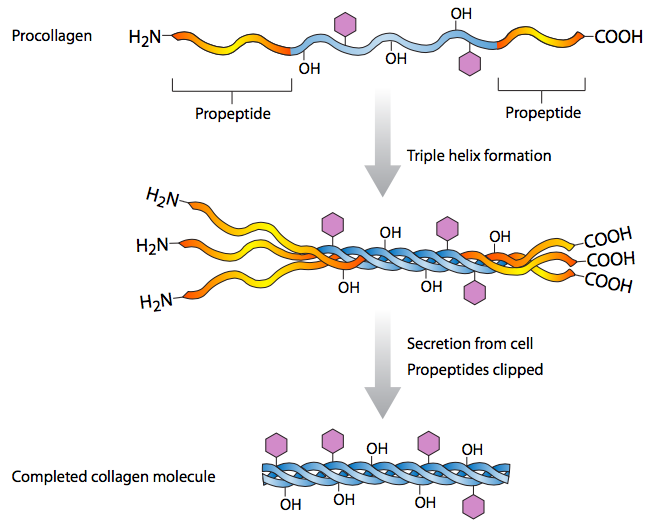
דוגמה מעניינת נוספת לעיבוד חלבון היא זו של הרכבת קולגן (איור\(\PageIndex{2}\)). כפי שתקראו בפרק 13, קולגן הוא חלבון מופרש גדול מאוד המספק מבנה וספיגת זעזועים למטריצה החוץ -תאית בבעלי חיים. אתה יכול למצוא אותו בעור, פרסות, סחוס ורקמות חיבור שונות. חלבון קולגן בודד הוא למעשה סליל משולש מעוות של שלוש יחידות משנה. יחידות המשנה של הקולגן מיוצרות כפרוקולגן, והפרופפטידים מנותקים משני N- ו- C- termini כדי ליצור את החלבון הסופי. עם זאת, הם אינם מנותקים עד לאחר ששלוש יחידות המשנה מתאספות זו סביב זו. למעשה, תת-יחידות קולגן שכבר עובדו אינן מתאספות לחלבונים משולשים-סליליים. רצפי הפרופפטיד נחוצים בבירור להרכבה יעילה של קומפלקס החלבון הסופי.