10.8: הסדרת התרגום
- Page ID
- 208431
ביטוי הגנים מוסדר בעיקר ברמה הטרום-תעתיק, אך ישנם גם מספר מנגנונים לוויסות התרגום. מערכת אחת של בעלי חיים שנחקרה היטב היא החלבון המחייב RNA הרגיש לברזל, המסדיר את ביטוי הגנים המעורבים בוויסות רמות תוך-תאיות של יוני ברזל. שניים מהגנים הללו, פריטין, המסדר בבטחה יוני ברזל בתוך התאים, וטרנספרין, המעביר ברזל מהדם לתא, שניהם מנצלים את מערכת ויסות התרגום הזו בלולאת משוב כדי להגיב לריכוז הברזל התוך תאי, אך הם מגיבים בדרכים הפוכות. האינטראקציה המרכזית היא בין רכיבי תגובת הברזל (IRE), שהם רצפים של mRNA היוצרים מבנים קצרים של לולאת גזע, לבין IRE-BP, החלבון שמזהה ונקשר ל- IREs. במקרה של הגן פריטין, רצפי IRE ממוקמים במעלה הזרם של קודון ההתחלה. כאשר יש ברזל גבוה, ה- IRE-BP אינו פעיל, ומבני לולאת הגזע נמסים ומוצפים על ידי הריבוזום, ומאפשרים תרגום של פריטין, שהוא חלבון קושר ברזל. כאשר ריכוז הברזל יורד, ה- IRE-BP מופעל ונקשר סביב מבני לולאת הגזע של IRE, מייצב אותם ומונע את המשך הריבוזום. זה מונע ייצור של פריטין כאשר יש מעט ברזל לקשור.
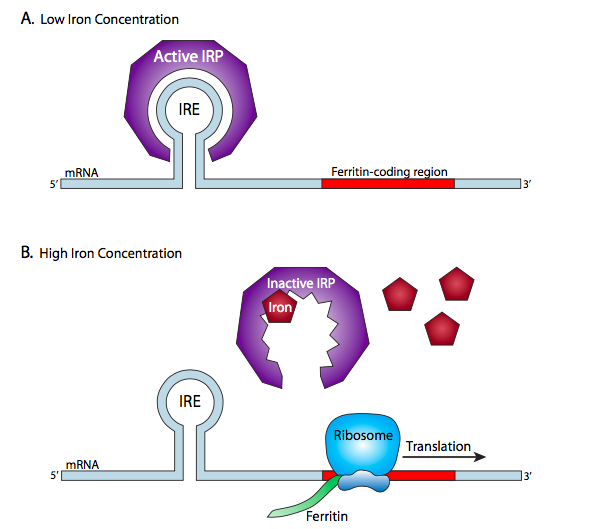
טרנספרין משתמש גם באלמנטים של תגובת ברזל ובחלבונים קושרי IR, אך במנגנון שונה מאוד. רצפי ה- IRE של הגן הטרנספרין ממוקמים במורד הזרם של קודון העצירה, ואינם ממלאים תפקיד ישיר בהתרת או במניעת תרגום.
עם זאת, כאשר יש ברזל תוך תאי נמוך ויש צורך בטרנספרין נוסף בכדי להכניס ברזל לתא, ה- IRE-BP מופעל כמו במקרה הקודם, והוא נקשר ל- IREs כדי לייצב את מבני לולאת הגזע. במקרה זה; עם זאת, זה מונע את השפלה של זנב poly-A 3' שבדרך כלל תתרחש לאורך זמן. ברגע שזנב ה- poly-A מתפרק, שאר ה- mRNA נהרס זמן קצר לאחר מכן. כפי שהוזכר בפרק התעתיק, זנבות הפולי-A הארוכים יותר קשורים להתמדה רבה יותר בציטופלזמה, ומאפשרים תרגום רב יותר לפני שהם נהרסים. מערכת IRE-BP במקרה זה מאריכה חיצונית את חיי ה- mRNA כאשר יש צורך במוצר הגן הזה בכמויות גבוהות יותר.
מכיוון ש-mRNA היא חומצת גרעין חד-גדילית ובכך מסוגלת לקשור רצף משלים, אין זה מפתיע מדי לגלות שאחת הדרכים שבהן תא יכול לווסת את התרגום היא שימוש בפיסת RNA אחרת. מיקרו RNA (miRNAs) התגלו כגנים קצרים מאוד (~ 20 נוקלאוטידים) שאינם מקודדי חלבון בנמטודה, C. elegans. מאז גילוים הראשוני (Lee et al, תא 75: 843-54, 1993), נמצאו מאות באיקריוטים שונים, כולל בני אדם. דפוס הביטוי של גני ה-miRNA הוא מאוד ספציפי לרקמות ולשלב ההתפתחותי. רבים צפויים ליצור מבנים של לולאת גזע, ונראה שהם מכליאים לרצפים 3'לא מתורגמים של mRNA ובכך חוסמים את התחלת התרגום על אותן מולקולות mRNA. הם עשויים גם לעבוד באמצעות מנגנון דומה ל-siRNA שנדון להלן, אך ישנן עדויות ברורות לכך שרמות ה-mRNA אינן משתנות בהכרח על ידי בקרת תרגום מכוונת מירנה.
מיקרו-רנ"א נמצאים כעת בחקירה על תפקידיהם כאונקוגנים או מדכאי גידולים (נסקרו ב-Garzon et al, Ann. הכומר מד. 60: 167-79, 2009). כמחצית מה-miRNAs האנושיים הידועים ממוקמים באתרים שבירים, נקודות שבירה ואזורים אחרים הקשורים לסרטן (Calin et al, Proc. נט. אקד. מדע. (ארה"ב) 101: 2999-3004, 2004). לדוגמה, miR-21 אינו מווסת רק במספר גידולים, ביטוי היתר שלו חוסם אפופטוזיס - צעד הכרחי כדי לאפשר לתאים חריגים להמשיך לחיות ולהתחלק ולא למות. לעומת זאת, miR-15a מדוכא באופן משמעותי בחלק מתאי הגידול, וביטוי יתר יכול להאט או לעצור את מחזור התא, ואפילו לגרום לאפופטוזיס.
מנגנון נוסף לבקרת תרגום המשתמש במולקולות RNA קטנות הוא הפרעות RNA (RNA i). זה התגלה לראשונה כדיכוי ניסיוני של תרגום כאשר מולקולות RNA דו-גדיליות קצרות, באורך של כמה מאות נוקלאוטידים ומכילות את אותו רצף כמו mRNA מטרה, הוכנסו לתאים. ההשפעה הייתה דרמטית: רוב ה- mRNA עם רצף המטרה נהרס במהירות. המודל המכניסטי הנוכחי של דיכוי RNA i הוא שראשית, המולקולות הדו-גדיליות נבקעות על ידי אנדונוקלאז הנקרא Dicer, המתבקע עם קצוות 3' חד-גדילים תלויים יתר על המידה. זה מאפשר לשברים הקצרים (siRNA, ~ 20nt ארוך) ליצור קומפלקס עם מספר חלבונים (RISC, קומפלקס השתקה המושרה על ידי RNA). ה-RISC מפצל את השברים הדו-גדיליים לגדילים בודדים, שאחד מהם הוא השלמה מדויקת ל-mRNA. בגלל ההשלמה, זוהי אינטראקציה יציבה, ונראה שהאזור הדו-גדילי מאותת לאנדונוקלאז להרוס את ההיברידית mRNA/siRNA.
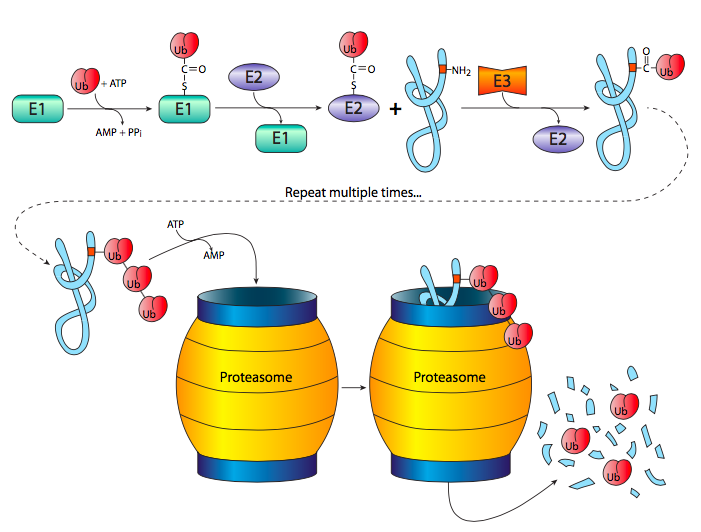
השיטה הסופית לשליטה ברמות ביטוי הגנים היא שליטה לאחר מעשה, כלומר על ידי הרס ממוקד של חלבון תוצר הגן. בעוד שחלק מהחלבונים ממשיכים לעבוד עד שהם מתפרקים, אחרים מיועדים רק לשימוש לטווח קצר (למשל לאותת על שלב קצר במחזור התא) ויש להסירם כדי שהתא יתפקד כראוי. הסרה, במובן זה, תהיה לשון נקייה לקצוץ ולמחזור. מערכת Ubiquitin-proteasome היא מנגנון תיוג והרס שבו חלבונים ששרדו את התועלת שלהם הם פוליוביקווינטים. Ubiquitin הוא חלבון אוקריוטי קטן (76 חומצות אמינו, ~ 5.6 kDa), שמור מאוד (96% בין רצפי אדם ושמרים) (איור\(\PageIndex{9}\)) שניתן לחבר לחלבונים אחרים באמצעות פעולה של שלושה שלבים אנזימטיים רציפים, שכל אחד מהם מזורז על ידי אנזים אחר.
E1 מפעיל את האוביקוויטין על ידי שילובו עם ATP ליצירת יוביקוויטין-אדנילט, ולאחר מכן מעביר את האוביקוויטין לעצמו באמצעות קשר תיואסטר ציסטאין. באמצעות תגובת אסטריפיקציה טרנס (thio), האוביקוויטין מועבר לאחר מכן לציסטאין באנזים E2, הידוע גם בשם אנזים מצומד יוביקוויטין. לבסוף, E3, או ליגאז יוביקוויטין, מקיים אינטראקציה הן עם E2-ubiquitin והן עם החלבון המיועד להשמדה, ומעביר את האוביקוויטין לחלבון המטרה. לאחר מספר סיבובים, החלבון polyubiquitinated נשלח לפרוטאזום להשמדה.
מוטציות בגנים E3 יכולות לגרום למגוון הפרעות רפואיות אנושיות כגון הפרעות נוירו-התפתחותיות תסמונת אנג'למן, תסמונת היפל-לינדאו או הפרעת הגדילה הכללית המכונה תסמונת 3-M. מנגנונים המקשרים תקלה במסלולי Ubiquitination ותסמינים של הפרעות אלה אינם ידועים כיום.
פרוטאזומים הם מתחמי חלבון גדולים מאוד המסודרים כחבית ארבע שכבות (יחידת המשנה 20S) המכוסה על ידי יחידת משנה רגולטורית (19S) בכל קצה. שתי הטבעות החיצוניות מורכבות כל אחת מ-7 יחידות משנה α המתפקדות כשערי כניסה לטבעות המרכזיות, שכל אחת מהן מורכבת מ-7 יחידות משנה β, ומכילות לאורך המשטח הפנימי 6 אתרים פרוטאוליטיים. יחידות הרגולציה 19S שולטות בפתיחה ובסגירה של השערים לחבית הקטליטית של 20S. הפרוטאזום כולו מכונה לפעמים חלקיק 26S.
חלבון polyubiquitinated נקשר תחילה ליחידה הרגולטורית 19S בתגובה תלויה ב- ATP (ה- 19S מכיל פעילות ATPase). יחידת 19S פותחת את שערי יחידת 20S, אולי כרוכה בהידרוליזה של ATP, ומנחה את החלבון לתא הפרוטאוליטי המרכזי. פעילות הפרוטאז של הפרוטאזומים ייחודית בכך שהיא פרוטאז תראונין, והיא חותכת את רוב החלבונים לפוליפפטידים רגילים של 8-9 שאריות, אם כי זה יכול להשתנות.
כפי שנראה בפרק מחזור התא, פרוטאזומים הם מרכיב מכריע לוויסות מדויק של תפקודי החלבון.

