18.5: חיסונים
- Page ID
- 208858
מטרות למידה
- השווה בין סוגים שונים של חסינות מלאכותית
- הבדילו בין שונות לחיסון
- תאר סוגים שונים של חיסונים והסבר את היתרונות והחסרונות שלהם
עבור מחלות רבות, מניעה היא צורת הטיפול הטובה ביותר, ומעט אסטרטגיות למניעת מחלות יעילות כמו חיסון. חיסון הוא סוג של חסינות מלאכותית. על ידי גירוי מלאכותי של ההגנה החיסונית האדפטיבית, חיסון מעורר ייצור תאי זיכרון בדומה לזה שיתרחש במהלך תגובה ראשונית. בכך, המטופל מסוגל להעלות תגובה משנית חזקה עם חשיפה לפתוגן - אך מבלי שיצטרך לסבול תחילה מזיהום ראשוני. בחלק זה נחקור מספר סוגים שונים של חסינות מלאכותית יחד עם סוגים שונים של חיסונים והמנגנונים שבאמצעותם הם מעוררים חסינות מלאכותית.
סיווגים של חסינות מסתגלת
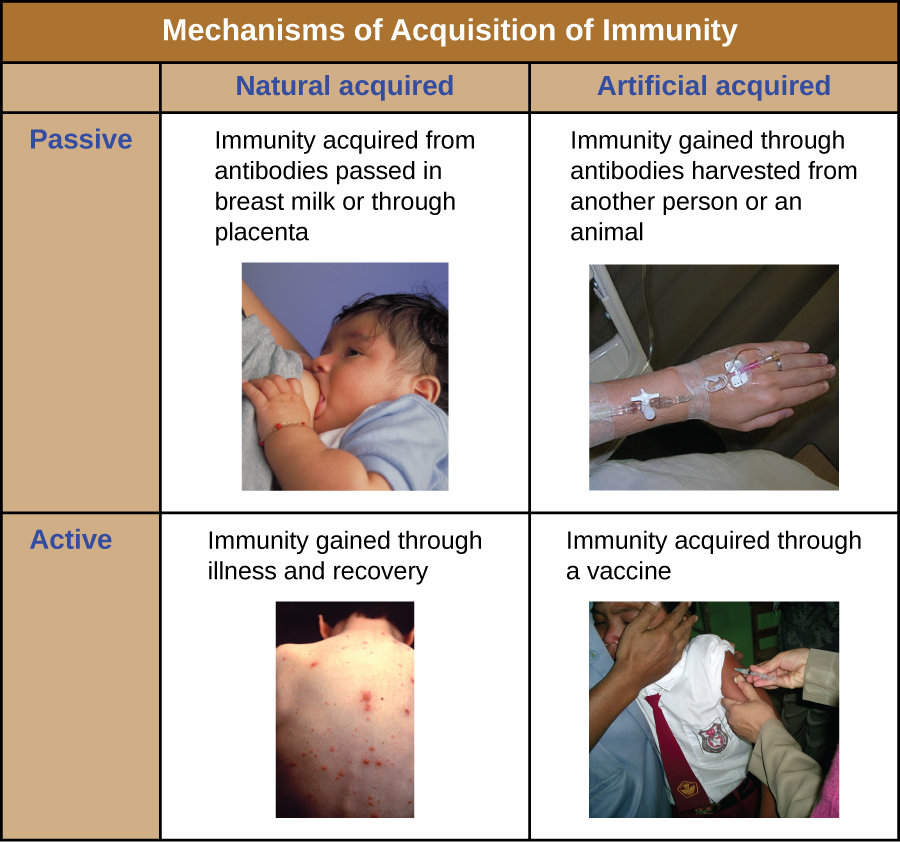
ניתן לתאר את כל צורות החסינות ההסתגלותית כאקטיביות או פסיביות. חסינות פעילה מתייחסת להפעלת ההגנה החיסונית ההסתגלותית של הפרט, ואילו חסינות פסיבית מתייחסת להעברת הגנות חיסוניות אדפטיביות מאדם או בעל חיים אחר. ניתן לחלק עוד יותר את החסינות הפעילה והפסיבית על סמך האם ההגנה נרכשת באופן טבעי או מלאכותי.
חסינות פעילה טבעית היא חסינות אדפטיבית המתפתחת לאחר חשיפה טבעית לפתוגן (איור\(\PageIndex{1}\)). דוגמאות לכך כוללות את החסינות לכל החיים המתפתחת לאחר החלמה מאבעבועות רוח או זיהום חצבת (אם כי לא תמיד יש צורך בזיהום חריף להפעלת חסינות אדפטיבית). משך הזמן שבו אדם מוגן יכול להשתנות במידה ניכרת בהתאם לפתוגן ולאנטיגנים המעורבים. לדוגמה, הפעלה של חסינות אדפטיבית על ידי מבני ספייק חלבון במהלך זיהום ויראלי תוך תאי יכולה להפעיל חסינות לכל החיים, בעוד שהפעלה על ידי אנטיגנים של כמוסות פחמימות במהלך זיהום חיידקי חוץ תאי עשויה להפעיל חסינות לטווח קצר יותר.
חסינות פסיבית טבעית כוללת מעבר טבעי של נוגדנים מאם לילדה לפני הלידה ואחריה. IgG הוא סוג הנוגדנים היחיד שיכול לחצות את השליה מדם האם לאספקת הדם העוברית. העברת השליה של IgG היא הגנה חיסונית פסיבית חשובה לתינוק, הנמשכת עד שישה חודשים לאחר הלידה. ניתן להעביר IgA הפרשה מאם לתינוק דרך חלב אם.
חסינות פסיבית מלאכותית מתייחסת להעברת נוגדנים המיוצרים על ידי תורם (אדם או בעל חיים) לאדם אחר. העברה זו של נוגדנים עשויה להיעשות כאמצעי מניעתי (כלומר, למניעת מחלות לאחר חשיפה לפתוגן) או כאסטרטגיה לטיפול בזיהום פעיל. לדוגמה, חסינות פסיבית מלאכותית משמשת בדרך כלל לטיפול מונע לאחר חשיפה נגד כלבת, הפטיטיס A, הפטיטיס B ואבעבועות רוח (אצל אנשים בסיכון גבוה). זיהומים פעילים המטופלים על ידי חסינות פסיבית מלאכותית כוללים זיהומים ציטומגלווירוס בחולים מדוכאי חיסון וזיהומים בנגיף אבולה. בשנת 1995, שמונה חולים ברפובליקה הדמוקרטית של קונגו עם זיהומי אבולה פעילים טופלו בעירויי דם מחולים שהחלימו מאבולה. רק אחד משמונת החולים נפטר (שיעור תמותה של 12.5%), שהיה נמוך בהרבה משיעור התמותה הצפוי של 80% מאבולה בחולים שלא טופלו. 1 חסינות פסיבית מלאכותית משמשת גם לטיפול במחלות הנגרמות על ידי רעלנים חיידקיים, כולל טטנוס, בוטוליזם ודיפטריה.
חסינות פעילה מלאכותית היא הבסיס לחיסון. זה כרוך בהפעלת חסינות אדפטיבית באמצעות חשיפה מכוונת של אדם לפתוגנים מוחלשים או מומתים, או תכשירים המורכבים מאנטיגנים מרכזיים של פתוגנים.
תרגיל \(\PageIndex{1}\)
- מה ההבדל בין חסינות אקטיבית לפאסיבית?
- איזה סוג של חסינות ניתנת על ידי חיסון?
חסינות עדר
ארבעת סוגי החסינות שתוארו זה עתה נובעים ממערכת החיסון ההסתגלותית של הפרט. עבור כל מחלה נתונה, אדם עשוי להיחשב חסין או רגיש בהתאם ליכולתו להעלות תגובה חיסונית יעילה עם החשיפה. לפיכך, סביר להניח שלכל אוכלוסייה נתונה יהיו כמה אנשים חסינים ואנשים אחרים הרגישים. אם לאוכלוסייה יש מעט מאוד פרטים רגישים, אפילו אותם אנשים רגישים יהיו מוגנים על ידי תופעה הנקראת חסינות עדר. לחסינות העדר אין שום קשר ליכולתו של אדם להגיב לתגובה חיסונית יעילה; במקום זאת, זה קורה מכיוון שיש מעט מדי אנשים רגישים באוכלוסייה כדי שהמחלה תתפשט ביעילות.
תוכניות חיסון יוצרות חסינות עדר על ידי צמצום משמעותי של מספר האנשים הרגישים באוכלוסייה. גם אם חלק מהאנשים באוכלוסייה אינם מחוסנים, כל עוד אחוז מסוים חסין (באופן טבעי או מלאכותי), סביר להניח שהפרטים הרגישים המעטים לא ייחשפו לפתוגן. עם זאת, מכיוון שאנשים חדשים נכנסים כל הזמן לאוכלוסיות (למשל דרך לידה או מעבר דירה), יש צורך בתוכניות חיסון לשמירה על חסינות העדר.
חיסון: חובה או בחירה
מספר גדל והולך של הורים בוחרים שלא לחסן את ילדיהם. הם מכונים "antivaxxers", ורובם מאמינים כי חיסונים הם גורם לאוטיזם (או מצבי מחלה אחרים), קשר שכעת הופרך ביסודיות. אחרים מתנגדים לחיסונים מטעמים דתיים או מוסריים (למשל, הטענה שחיסון גרדאסיל נגד HPV עשוי לקדם הפקרות מינית), מטעמים אתיים אישיים (למשל, התנגדות מצפונית לכל התערבות רפואית), או מטעמים פוליטיים (למשל, הרעיון שחיסוני חובה הם הפרה של חירויות הפרט). 2
ההערכה היא שמספר הולך וגדל זה של אנשים לא מחוסנים הוביל להתפרצויות חדשות של שיעול וחצבת. היינו מצפים שחסינות העדר תגן על אלה שאינם מחוסנים באוכלוסייתנו, אך ניתן לשמור על חסינות העדר רק אם מספיק אנשים מחוסנים.
חיסון מועיל בבירור לבריאות הציבור. אך מנקודת מבטו של ההורה הבודד ההשקפה יכולה להיות עכורה יותר. לחיסונים, כמו כל ההתערבויות הרפואיות, יש סיכונים נלווים, ולמרות שהסיכונים לחיסון עשויים להיות נמוכים ביותר בהשוואה לסיכוני ההדבקה, ייתכן שההורים לא תמיד מבינים או מקבלים את הקונצנזוס של הקהילה הרפואית. האם להורים כאלה יש זכות למנוע חיסון מילדיהם? האם יש לאפשר להם לסכן את ילדיהם - ואת החברה בכללותה - בסיכון?
ממשלות רבות מתעקשות על חיסוני ילדות כתנאי לכניסה לבית הספר הציבורי, אך ברוב המדינות הפך קל לבטל את הסכמתם לדרישה או להרחיק ילדים מהמערכת הציבורית. מאז שנות השבעים, מערב וירג'יניה ומיסיסיפי קיבלו דרישה מחמירה לחיסון ילדים, ללא יוצא מן הכלל, ולאף מדינה לא היה מקרה של חצבת מאז תחילת שנות התשעים. מחוקקים בקליפורניה העבירו לאחרונה חוק דומה בתגובה להתפרצות חצבת בשנת 2015, מה שמקשה הרבה יותר על ההורים לבטל את הסכמתם לחיסונים אם ילדיהם לומדים בבתי ספר ציבוריים. בהתחשב ברקורד זה ובמאמצי החקיקה המחודשים, האם מדינות אחרות צריכות לאמץ דרישות מחמירות באותה מידה?
איזה תפקיד צריכים ספקי שירותי בריאות למלא בקידום או אכיפה של חיסון אוניברסלי? מחקרים הראו שניתן לשנות את דעתם של הורים רבים בתגובה למידע שנמסר על ידי עובדי שירותי הבריאות, אך האם זה מקומם של עובדי שירותי הבריאות לנסות לשכנע את ההורים לחסן את ילדיהם? חלק מספקי שירותי הבריאות אינם ששים באופן מובן לטפל בחולים לא מחוסנים. האם יש להם זכות לסרב לשירות לחולים המסרבים חיסונים? האם חברות הביטוח יש את הזכות לשלול כיסוי antivaxxers? כל אלה הן שאלות אתיות שקובעי המדיניות עשויים להיאלץ להתייחס אליהם ככל שיותר הורים עוקפים את נורמות החיסון.
שונות וחיסון
לפני אלפי שנים, הוכר לראשונה כי אנשים ששרדו זיהום באבעבועות שחורות היו חסינים מפני זיהומים הבאים. נראה כי הנוהג של חיסון אנשים כדי להגן עליהם באופן פעיל מפני אבעבועות שחורות מקורו במאה ה -10 בסין, כאשר תואר תרגול השונות (איור). \(\PageIndex{2}\) וריאציה מתייחסת לחיסון מכוון של אנשים עם חומר זיהומי מגלדים או פסטולות של נפגעי אבעבועות שחורות. חומרים זיהומיים הוזרקו לעור או הוכנסו דרך דרך האף. הזיהום שהתפתח היה בדרך כלל מתון יותר מאבעבועות שחורות שנרכשו באופן טבעי, וההחלמה מהזיהום הקל יותר סיפקה הגנה מפני המחלה החמורה יותר.
למרות שרוב האנשים שטופלו על ידי וריאולציה פיתחו זיהומים קלים בלבד, התרגול לא היה נטול סיכונים. אכן התרחשו זיהומים חמורים יותר ולעיתים קטלניים, ומכיוון שאבעבועות שחורות היו מדבקות, זיהומים הנובעים משונות עלולים להוביל למגיפות. אף על פי כן, תרגול השונות למניעת אבעבועות שחורות התפשט לאזורים אחרים, כולל הודו, אפריקה ואירופה.

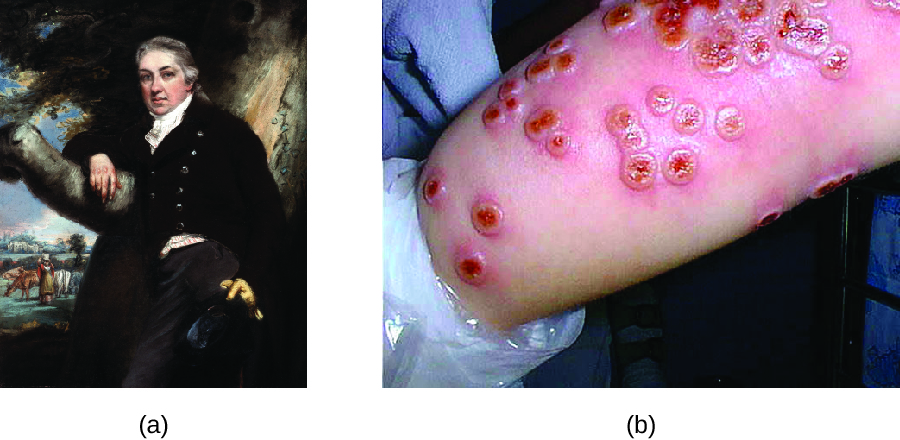
למרות ששונות נהוגה במשך מאות שנים, הרופא האנגלי אדוארד ג'נר (1749—1823) זוכה בדרך כלל לפיתוח תהליך החיסון המודרני. ג'נר הבחין כי חולבות שפיתחו אבעבועות פרה, מחלה הדומה לאבעבועות שחורות אך מתונה יותר, היו חסינות מפני אבעבועות שחורות חמורות יותר. זה הוביל את ג'נר לשער שחשיפה לפתוגן פחות ארסי יכולה לספק הגנה חיסונית מפני פתוגן ארסי יותר, ולספק חלופה בטוחה יותר לשונות. בשנת 1796, ג'נר בדק את השערתו על ידי השגת דגימות זיהומיות מנגע אבעבועות פרה פעיל של עוזרת חלב והזרקת החומרים לילד צעיר (איור). \(\PageIndex{3}\) הילד פיתח זיהום קל שכלל חום בדרגה נמוכה, אי נוחות בבית השחי שלו (בית השחי) ואובדן תיאבון. כאשר הילד נדבק מאוחר יותר בדגימות זיהומיות מנגעי אבעבועות שחורות, הוא לא נדבק באבעבועות שחורות. 3 גישה חדשה זו כונתה חיסון, שם הנובע משימוש באבעבועות פרה (לטינית vacca שפירושה "פרה") להגנה מפני אבעבועות שחורות. כיום אנו יודעים שהחיסון של ג'נר עבד מכיוון שנגיף אבעבועות הפרה קשור גנטית ואנטיגנית לנגיפי הווריולה שגרמו לאבעבועות שחורות. חשיפה לאנטיגנים של אבעבועות פרה הביאה לתגובה ראשונית וייצור תאי זיכרון זהים או קשורים לאפיטופים של נגיף Variola בחשיפה מאוחרת יותר לאבעבועות שחורות.
הצלחת חיסון האבעבועות השחורות של ג'נר הובילה מדענים אחרים לפתח חיסונים למחלות אחרות. אולי הבולט ביותר היה לואי פסטר, שפיתח חיסונים נגד כלבת, כולרה ואנתרקס. במהלך המאות ה-20 וה-21 פותחו חיסונים יעילים למניעת מגוון רחב של מחלות הנגרמות על ידי וירוסים (למשל אבעבועות רוח ורעפים, הפטיטיס, חצבת, חזרת, פוליו וקדחת צהובה) וחיידקים (למשל, דיפטריה, דלקת ריאות פנאומוקוקלית, טטנוס ושיעול).
תרגיל \(\PageIndex{2}\)
- מה ההבדל בין וריאולציה לחיסון לאבעבועות שחורות?
- הסבירו מדוע החיסון פחות מסוכן מאשר שונות.
כיתות חיסונים
כדי שחיסון יספק הגנה מפני מחלה, עליו לחשוף אדם לאנטיגנים ספציפיים לפתוגן שיעוררו תגובה חיסונית אדפטיבית מגנה. מעצם טבעו, זה כרוך בסיכון מסוים. כמו בכל תרופה פרמצבטית, לחיסונים יש פוטנציאל לגרום לתופעות לוואי. עם זאת, החיסון האידיאלי אינו גורם לתופעות לוואי חמורות ואינו מהווה סיכון להידבק במחלה שהיא נועדה למנוע. סוגים שונים של חיסונים פותחו מתוך מחשבה על מטרות אלה. סוגים שונים אלה של חיסונים מתוארים בסעיף הבא ומסוכמים בטבלה\(\PageIndex{1}\).
חיסונים חיים מוחלשים
חיסונים חיים מוחלשים חושפים אדם לזן מוחלש של פתוגן במטרה לבסס זיהום תת קליני שיפעיל את ההגנה החיסונית ההסתגלותית. פתוגנים מוחלשים כדי להפחית את ארסיותם באמצעות שיטות כגון מניפולציה גנטית (לחיסול גורמי ארסיות מרכזיים) או תרבות ארוכת טווח במארח או בסביבה לא טבעיים (כדי לקדם מוטציות ולהפחית ארסיות).
על ידי ביסוס זיהום פעיל, חיסונים חיים מוחלשים מעוררים תגובה חיסונית מקיפה יותר מאשר סוגים אחרים של חיסונים. חיסונים חיים מוחלשים מפעילים חסינות תאית והומורלית כאחד וממריצים את התפתחות הזיכרון לחסינות ארוכת טווח. במקרים מסוימים, חיסון של אדם אחד עם פתוגן מוחלש חי יכול אפילו להוביל להעברה טבעית של הפתוגן המוחלש לאנשים אחרים. זה יכול לגרום לאנשים האחרים לפתח גם זיהום פעיל ותת-קליני המפעיל את ההגנה החיסונית ההסתגלותית שלהם.
החסרונות הקשורים לחיסונים חיים מוחלשים כוללים את האתגרים הקשורים לאחסון והובלה לטווח ארוך, כמו גם את הפוטנציאל של מטופל לפתח סימנים ותסמינים של מחלה במהלך הזיהום הפעיל (במיוחד בחולים עם דכאי חיסון). קיים גם סיכון שהפתוגן המוחלש יחזור לארסיות מלאה. הטבלה \(\PageIndex{1}\) מפרטת דוגמאות לחיסונים חיים מוחלשים.
חיסונים מומתים
חיסונים מומתים מכילים פתוגנים שלמים שנהרגו או הושבתו באמצעות חום, כימיקלים או קרינה. כדי שחיסונים מומתים יהיו יעילים, אסור שתהליך ההשבתה ישפיע על מבנה האנטיגנים המרכזיים על הפתוגן.
מכיוון שהפתוגן נהרג או לא פעיל, חיסונים מומתים אינם מייצרים זיהום פעיל, והתגובה החיסונית המתקבלת חלשה ופחות מקיפה מזו שמעוררת חיסון חי מוחלש. בדרך כלל התגובה כוללת רק חסינות הומורלית, ולא ניתן להעביר את הפתוגן לאנשים אחרים. בנוסף, חיסונים מומתים דורשים בדרך כלל מינונים גבוהים יותר ומאיצים מרובים, מה שעלול לגרום לתגובות דלקתיות במקום ההזרקה.
למרות החסרונות הללו, לחיסונים מומתים יש יתרונות של יציבות אחסון לטווח ארוך וקלות הובלה. כמו כן, אין סיכון לגרום לזיהומים פעילים חמורים. עם זאת, חיסונים מומתים אינם נטולי תופעות הלוואי שלהם. הטבלה \(\PageIndex{1}\) מפרטת דוגמאות לחיסונים מומתים.
חיסוני יחידת משנה
בעוד שחיסונים חיים מוחלשים ולא פעילים חושפים אדם לפתוגן מוחלש או מת, חיסוני תת-יחידות חושפים את המטופל רק לאנטיגנים המרכזיים של פתוגן - לא לתאים שלמים או וירוסים. ניתן לייצר חיסוני תת-יחידות על ידי פירוק כימי של פתוגן ובידוד האנטיגנים המרכזיים שלו או על ידי ייצור האנטיגנים באמצעות הנדסה גנטית. מכיוון שחיסונים אלה מכילים רק את האנטיגנים החיוניים של פתוגן, הסיכון לתופעות לוואי נמוך יחסית. הטבלה \(\PageIndex{1}\) מפרטת דוגמאות לחיסונים של יחידות משנה.
חיסונים לטוקסואידים
בדומה לחיסוני תת-יחידות, חיסונים נגד רעלים אינם מכניסים לחולה פתוגן שלם; הם מכילים רעלנים חיידקיים לא פעילים, הנקראים טוקסואידים. חיסונים לטוקסואידים משמשים למניעת מחלות בהן רעלים חיידקיים ממלאים תפקיד חשוב בפתוגנזה. חיסונים אלה מפעילים חסינות הומוריסטית המנטרלת את הרעלים. הטבלה \(\PageIndex{1}\) מפרטת דוגמאות לחיסונים לטוקסואידים.
חיסונים מצומדים
חיסון מצומד הוא סוג של חיסון תת-יחידה המורכב מחלבון המצומד לפוליסכריד כמוסה. חיסונים מצומדים פותחו כדי לשפר את היעילות של חיסוני תת-יחידות נגד פתוגנים שיש להם כמוסות פוליסכריד מגנות המסייעות להם להתחמק מפגוציטוזיס, ולגרום לזיהומים פולשניים העלולים להוביל לדלקת קרום המוח ולמצבים חמורים אחרים. חיסוני יחידת המשנה כנגד פתוגנים אלה מציגים אנטיגנים פוליסכרידים קפסולריים בלתי תלויים ב- T, המביאים לייצור נוגדנים שיכולים להפוך את הקפסולה ובכך להילחם בזיהום; עם זאת, ילדים מתחת לגיל שנתיים אינם מגיבים ביעילות לחיסונים אלה. ילדים אכן מגיבים ביעילות כאשר הם מחוסנים בחיסון המצומד, שבו חלבון עם אנטיגנים תלויי T מצומד לפוליסכריד הקפסולה. האנטיגן המצומד של חלבון-פוליסכריד ממריץ ייצור נוגדנים הן נגד החלבון והן נגד פוליסכריד הקפסולה. הטבלה \(\PageIndex{1}\) מפרטת דוגמאות לחיסונים מצומדים.
| כיתה | תיאור | יתרונות | חסרונות | דוגמאות |
|---|---|---|---|---|
| חי מוחלש | זן מוחלש של פתוגן שלם | חסינות סלולרית והומורלית | קשה לאחסן ולהעביר | אבעבועות רוח, חצבת גרמנית, חצבת, חזרת, שחפת, קדחת טיפוס, קדחת צהובה |
| חסינות לאורך זמן | סיכון לזיהום בחולים מדוכאי חיסון | |||
| שידור לאנשי קשר | סכנת היפוך | |||
| לא הופעל | פתוגן שלם נהרג או מושבת עם חום, כימיקלים או קרינה | קלות אחסון והובלה | חסינות חלשה יותר (הומוריסטית בלבד) | כולרה, הפטיטיס A, שפעת, מגיפה, כלבת |
| אין סיכון לזיהום פעיל חמור | מינונים גבוהים יותר ויותר מאיצים נדרשים | |||
| יחידת משנה | אנטיגנים אימונוגניים | סיכון נמוך יותר לתופעות לוואי | אריכות ימים מוגבלת | אנתרקס, הפטיטיס B, שפעת, דלקת קרום המוח, וירוס הפפילומה, דלקת ריאות פנאומוקוקלית, שיעול |
| מינונים מרובים נדרשים | ||||
| אין הגנה מפני וריאציה אנטיגנית | ||||
| טוקסואיד | רעלן חיידקי לא פעיל | חסינות הומורלית לנטרול רעלן | אינו מונע זיהום | בוטוליזם, דיפתריה, שעלת, טטנוס |
| מצומד | פוליסכריד קפסולה מצומד לחלבון | תגובה תלויה T לקפסולה | יקר לייצר |
דלקת קרום המוח (המופילוס אינפלואנזה, סטרפטוקוקוס דלקת ריאות, מנינגיטיס נייסריה) |
| אין הגנה מפני וריאציה אנטיגנית | ||||
| תגובה טובה יותר בילדים צעירים | עלול להפריע לחיסונים אחרים |
תרגיל \(\PageIndex{3}\)
- מה הסיכון הכרוך בחיסון מוחלש חי?
- מדוע יש צורך בחיסון מצומד במקרים מסוימים?
חיסוני DNA מייצגים גישה חדשה ומבטיחה יחסית לחיסון. חיסון DNA מיוצר על ידי שילוב גנים לאנטיגנים בחיסון פלסמיד רקומביננטי. הכנסת חיסון ה-DNA לחולה מובילה לספיגה של הפלסמיד הרקומביננטי על ידי חלק מתאי המטופל, ולאחר מכן שעתוק ותרגום של אנטיגנים והצגת אנטיגנים אלו עם MHC I להפעלת חסינות אדפטיבית. התוצאה היא גירוי של חסינות הומורלית ותאית כאחד ללא סיכון למחלות פעילות הקשורות לחיסונים מוחלשים חיים.
למרות שרוב חיסוני ה-DNA לבני אדם עדיין בפיתוח, סביר להניח שהם יהפכו נפוצים יותר בעתיד הקרוב כאשר חוקרים עובדים על הנדסת חיסוני DNA שיפעילו חסינות אדפטיבית נגד מספר פתוגנים שונים בבת אחת. חיסוני DNA מהדור הראשון שנבדקו בשנות התשעים נראו מבטיחים במודלים של בעלי חיים אך היו מאכזבים כאשר נבדקו בנבדקים אנושיים. ספיגה תאית לקויה של פלסמידים ה- DNA הייתה אחת הבעיות העיקריות שהשפיעו על יעילותם. ניסויים של חיסוני DNA מהדור השני היו מבטיחים יותר הודות לטכניקות חדשות לשיפור הספיגה התאית ואופטימיזציה של אנטיגנים. חיסוני DNA לסוגי סרטן שונים ופתוגנים נגיפיים כמו HIV, HPV והפטיטיס B ו- C נמצאים כעת בפיתוח.
חלק מחיסוני ה- DNA כבר נמצאים בשימוש. בשנת 2005 אושר חיסון DNA נגד נגיף הנילוס המערבי לשימוש בסוסים בארצות הברית. קנדה אישרה גם חיסון DNA כדי להגן על דגים מפני וירוס נמק hematopoietic זיהומיות. 4 חיסון DNA נגד נגיף דלקת המוח היפנית אושר לשימוש בבני אדם בשנת 2010 באוסטרליה.
מיקוד קליני: רזולוציה
בהתבסס על הסימפטומים של אוליביה, הרופא שלה ביצע אבחנה ראשונית של דלקת קרום המוח החיידקית מבלי להמתין לזיהוי חיובי מדגימות הדם וה- CSF שנשלחו למעבדה. אוליביה אושפזה בבית החולים וטופלה באנטיביוטיקה רחבת טווח תוך ורידי וטיפול בהתייבשות. במהלך הימים הבאים, מצבה החל להשתפר, ודגימות דם חדשות ודגימות ניקוב מותני הראו היעדר חיידקים בדם וב- CSF כאשר רמות תאי הדם הלבנים חזרו לשגרה. במהלך תקופה זו, המעבדה הפיקה זיהוי חיובי של Neisseria meningitidis, הגורם הסיבתי לדלקת קרום המוח מנינגוקוקלית, במדגם ה- CSF המקורי שלה.
N. meningitidis מייצר כמוסת פוליסכריד המשמשת כגורם ארסיות. N. meningitidis נוטה להשפיע על תינוקות לאחר שהם מתחילים לאבד את החסינות הפסיבית הטבעית שמספקים נוגדנים אימהיים. בגיל שנה, נוגדני ה- IgG האימהיים של אוליביה היו נעלמים, והיא לא הייתה מפתחת תאי זיכרון המסוגלים לזהות אנטיגנים הקשורים לקפסולת הפוליסכריד של N. meningitidis. כתוצאה מכך, מערכת החיסון ההסתגלותית שלה לא הצליחה לייצר נוגדנים מגנים כדי להילחם בזיהום, וללא אנטיביוטיקה יתכן שהיא לא שרדה. סביר להניח שהזיהום של אוליביה היה נמנע לחלוטין אילו הייתה מחוסנת. חיסון מצומד למניעת דלקת קרום המוח מנינגוקוקלית זמין ומאושר לתינוקות עד גיל חודשיים. עם זאת, לוחות הזמנים הנוכחיים לחיסונים בארצות הברית ממליצים לתת את החיסון בגיל 11-12 עם בוסטר בגיל 16.
במדינות עם מערכות בריאות ציבוריות מפותחות, חיסונים רבים ניתנים באופן שגרתי לילדים ולמבוגרים. לוחות הזמנים של החיסונים משתנים מעת לעת, בהתבסס על מידע חדש ותוצאות מחקר שנאספו על ידי סוכנויות בריאות הציבור. בארצות הברית, ה- CDC מפרסם לוחות זמנים ומידע מעודכן אחר על חיסונים.
מושגי מפתח וסיכום
- ניתן לחלק את החסינות ההסתגלותית לארבעה סיווגים מובחנים: חסינות פעילה טבעית, חסינות פסיבית טבעית, חסינות פסיבית מלאכותית וחסינות אקטיבית מלאכותית.
- חסינות פעילה מלאכותית היא הבסיס לחיסון ופיתוח חיסונים. תוכניות חיסון לא רק מעניקות חסינות מלאכותית ליחידים, אלא גם מטפחות חסינות עדר באוכלוסיות.
- השונות נגד אבעבועות שחורות מקורה במאה ה -10 בסין, אך ההליך היה מסוכן מכיוון שהוא עלול לגרום למחלה שהיא נועדה למנוע. החיסון המודרני פותח על ידי אדוארד ג'נר, שפיתח את הנוהג של חיסון חולים עם חומרים זיהומיים מנגעי אבעבועות פרה למניעת אבעבועות שחורות.
- חיסונים חיים מוחלשים וחיסונים מומתים מכילים פתוגנים שלמים שהם חלשים, נהרגים או מושבתים. חיסוני תת-יחידות, חיסונים לטוקסואידים וחיסונים מצומדים מכילים רכיבים תאיים עם אנטיגנים המעוררים תגובה חיסונית.
הערות שוליים
- 1 ק 'מופאפה, מ' מסמבה, ק 'קיבאדי, ק 'קיבולה, א 'בוואקה, מ' קיפאסה, ר 'קולבונדרס, ג'יי ג'יי מוימבה-טמפום. "טיפול בקדחת דימום אבולה עם עירויי דם מחולי הבראה." כתב העת למחלות זיהומיות 179 הספקה (1999): S18 — S23.
- 2 אליזבת ייל. "מדוע לעולם לא ניתן לאלף תנועות נגד חיסון." דת ופוליטיקה, 22 ביולי 2014. דת ופוליטיקה. org/2014/... לעולם לא להיות מאולף.
- 3 נ 'ג'יי וויליס. "אדוארד ג'נר ומיגור האבעבועות השחורות." כתב העת הרפואי הסקוטי 42 (1997): 118—121.
- 4 מ 'אלונסו וג'יי סי לאונג. "חיסוני DNA מורשים נגד נגיף נמק המטופואטי זיהומי (IHNV)." פטנטים אחרונים על רצפי DNA וגנים (הופסקו) 7 מס '1 (2013): 62—65, issn 1872-2156/2212-3431. דוי 10.2174/1872215611307010009.
- 5 ס. ב הלסטד וס 'ג'יי תומאס. "חיסונים חדשים לדלקת המוח היפנית: חלופות לייצור במוח העכבר." סקירת מומחים של חיסונים 10 מס '3 (2011): 355—64.


