18.3: לימפוציטים מסוג T
- Page ID
- 208855
מטרות למידה
- תאר את תהליך ההתבגרות של תאי T ובחירה תימית
- הסבר את האירועים הגנטיים המובילים למגוון של קולטני תאי T
- השווה והשוואה בין המחלקות והתת-סוגים השונים של תאי T מבחינת הפעלה ותפקוד
- הסבר את המנגנון שבאמצעותו סופר-אנטיגנים משפיעים על הפעלה לא מוסדרת של תאי T
כפי שהוסבר בסקירה כללית של חסינות אדפטיבית ספציפית, הנוגדנים המעורבים בחסינות הומורלית קושרים לעתים קרובות פתוגנים ורעלים לפני שהם יכולים להיצמד לתאי מארח ולפלוש אליהם. לפיכך, חסינות הומורלית עוסקת בעיקר בלחימה בפתוגנים בחללים חוץ תאיים. עם זאת, פתוגנים שכבר קיבלו כניסה לתאי מארח מוגנים במידה רבה מפני ההגנות המתווכות על ידי נוגדנים הומורליים. חסינות סלולרית, לעומת זאת, מכוונת ומבטלת פתוגנים תוך תאיים באמצעות פעולות של לימפוציטים T, או תאי T (איור\(\PageIndex{1}\)). תאי T ממלאים גם תפקיד מרכזי יותר בתזמור התגובה החיסונית ההסתגלותית הכוללת (הומורלית כמו גם תאית) יחד עם ההגנות התאיות של חסינות מולדת.

ייצור תאי T והתבגרות
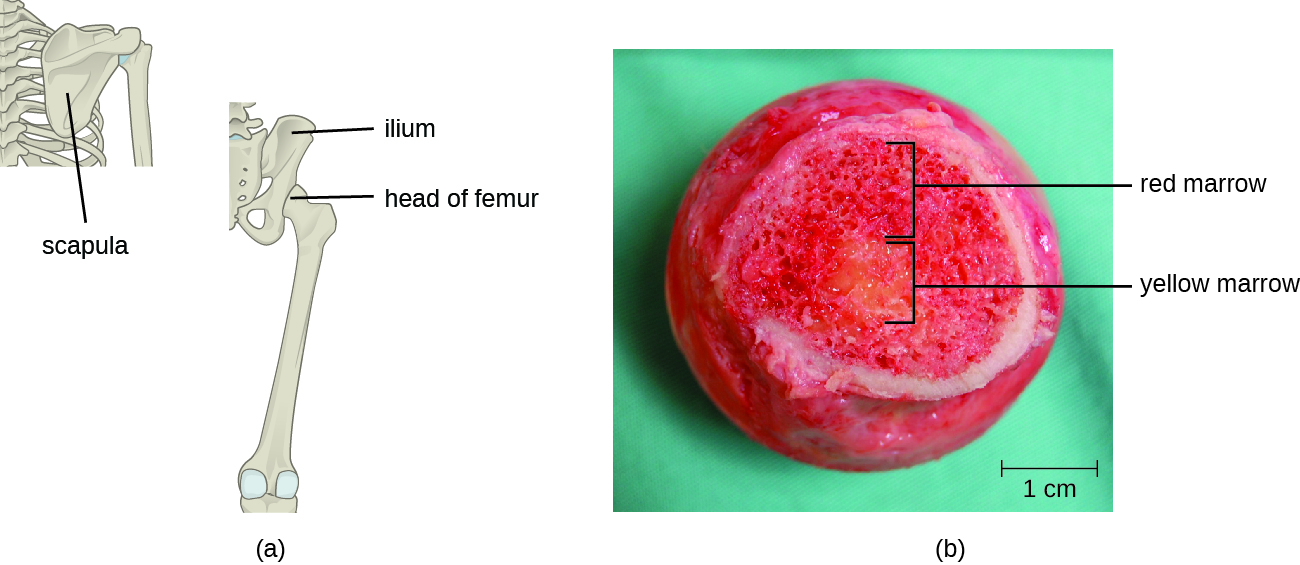
תאי T, כמו כל תאי הדם הלבנים האחרים המעורבים בחסינות מולדת ומסתגלת, נוצרים מתאי גזע המטופואטיים רב-פוטנטיים (HSCs) במח העצם (ראה איור 17.3.1). עם זאת, בניגוד לתאי הדם הלבנים של חסינות מולדת, תאי T בסופו של דבר מתמיינים תחילה לתאי גזע לימפואידים שהופכים לאחר מכן ללימפוציטים קטנים ולא בשלים, הנקראים לפעמים לימפובלסטים. השלבים הראשונים של ההתמיינות מתרחשים במח העצמות האדום (איור\(\PageIndex{2}\)), ולאחר מכן לימפוציטים T לא בשלים נכנסים לזרם הדם ונוסעים לתימוס לשלבי ההתבגרות האחרונים (איור\(\PageIndex{3}\)). ברגע שהם נמצאים בתימוס, לימפוציטים T לא בשלים מכונים תימוציטים.
ניתן לחלק את ההתבגרות של התימוציטים בתוך התימוס לשלבים קריטיים של עצים של ברירה חיובית ושלילית, המכונה ביחד בחירה תימית. השלב הראשון של הבחירה התימית מתרחש בקליפת המוח של התימוס וכולל פיתוח קולטן תפקודי של תאי T (TCR) הנדרש להפעלה על ידי APCs. תימוציטים עם TCR פגומים מוסרים על ידי בחירה שלילית באמצעות אינדוקציה של אפופטוזיס (מוות תאים מבוקר מתוכנת). השלב השני של הבחירה התימית מתרחש גם בקליפת המוח וכולל בחירה חיובית של תימוציטים שיתקשרו כראוי עם מולקולות MHC. תימוציטים שיכולים לקיים אינטראקציה מתאימה עם מולקולות MHC מקבלים גירוי חיובי שמעביר אותם הלאה בתהליך ההתבגרות, ואילו תימוציטים שאינם מתקשרים כראוי אינם מעוררים ומבוטלים על ידי אפופטוזיס. השלב השלישי והאחרון של הבחירה התימית מתרחש הן בקליפת המוח והן במדולה וכולל בחירה שלילית להסרת תימוציטים המגיבים לעצמם, אלה המגיבים לאנטיגנים עצמיים, על ידי אפופטוזיס. שלב אחרון זה מכונה לעתים סובלנות מרכזית מכיוון שהוא מונע מתאי T המגיבים לעצמם להגיע לזרם הדם ועלול לגרום למחלה אוטואימונית, המתרחשת כאשר מערכת החיסון תוקפת תאים "עצמיים" בריאים.
למרות הסובלנות המרכזית, כמה תאי T בעלי תגובה עצמית בדרך כלל בורחים מהתימוס ונכנסים לזרם הדם ההיקפי. לכן, יש צורך בקו הגנה שני הנקרא סובלנות היקפית כדי להגן מפני מחלות אוטואימוניות. סובלנות היקפית כוללת מנגנונים של אנרגיה ועיכוב של תאי T בעלי תגובה עצמית על ידי תאי T מווסתים. אנרגיה מתייחסת למצב של חוסר היענות לגירוי אנטיגן. במקרה של תאי T בעלי תגובה עצמית הנמלטים מהתימוס, היעדר אות גירוי משותף חיוני הנדרש להפעלה גורם לאנרגיה ומונע הפעלה אוטואימונית. תאי T רגולטוריים משתתפים בסובלנות היקפית על ידי עיכוב ההפעלה והתפקוד של תאי T בעלי תגובה עצמית ועל ידי הפרשת ציטוקינים אנטי דלקתיים.
לא מובן לחלוטין אילו אירועים מכוונים במיוחד התבגרות של תימוציטים לתאי T מווסתים. התיאוריות הנוכחיות מצביעות על כך שהאירועים הקריטיים עשויים להתרחש במהלך השלב השלישי של הבחירה התימית, כאשר רוב תאי ה-T המגיבים לעצמם מסולקים. תאי T רגולטוריים עשויים לקבל אות ייחודי שנמצא מתחת לסף הנדרש כדי למקד אותם לבחירה שלילית ואפופטוזיס. כתוצאה מכך, תאים אלה ממשיכים להתבגר ואז יוצאים מהתימוס, חמושים כדי לעכב את ההפעלה של תאי T בעלי תגובה עצמית.
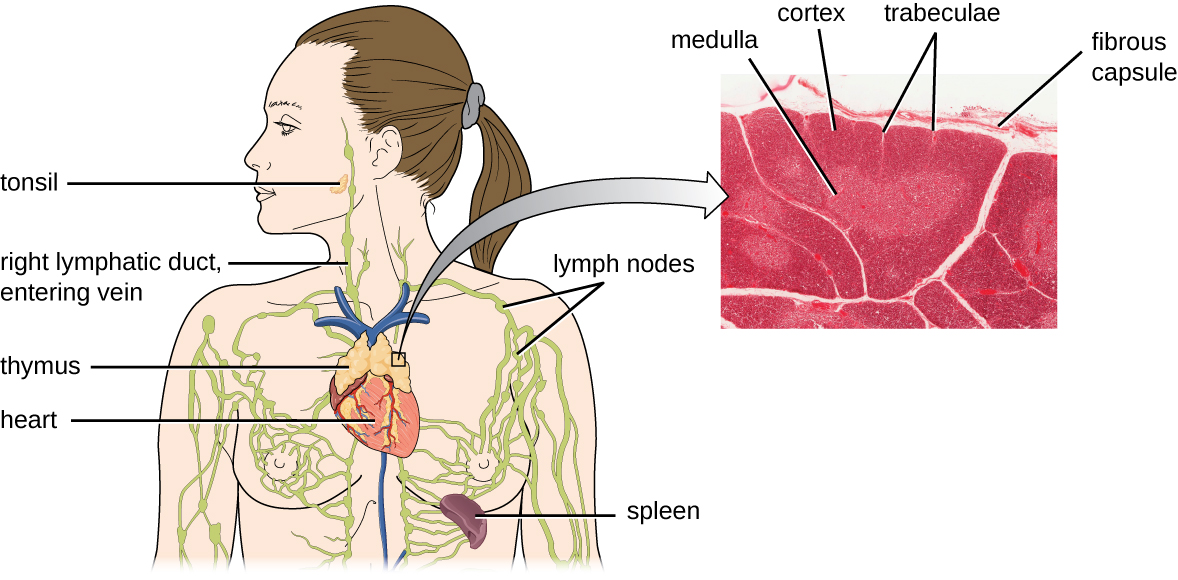
ההערכה היא כי שלושת השלבים של בחירה תימית מבטלים 98% מהתימוציטים. 2% הנותרים היוצאים מהתימוס נודדים דרך זרם הדם ומערכת הלימפה לאתרים של איברים/רקמות לימפואידיות משניות, כגון בלוטות הלימפה, הטחול והשקדים (איור\(\PageIndex{3}\)), שם הם ממתינים להפעלה באמצעות הצגת אנטיגנים ספציפיים על ידי APCs. עד שהם מופעלים, הם ידועים כתאי T נאיביים בוגרים.
תרגיל \(\PageIndex{1}\)
- אילו אתרים אנטומיים מעורבים בייצור והתבגרות של תאי T?
- מהם שלושת השלבים הכרוכים בבחירה התימית?
- מדוע סובלנות מרכזית וסובלנות היקפית חשובים? מה הם מונעים?
כיתות של תאי T
ניתן לסווג תאי T לשלוש מחלקות נפרדות: תאי T עוזרים, תאי T מווסתים ותאי T ציטוטוקסיים. מחלקות אלה נבדלות על סמך ביטוין של מולקולות משטח מסוימות, אופן ההפעלה שלהן ותפקידיהן התפקודיים בחסינות אדפטיבית (טבלה\(\PageIndex{1}\)).
כל תאי ה-T מייצרים מקבץ של מולקולות בידול (CD), גליקופרוטאינים משטח התא שניתן להשתמש בהם כדי לזהות ולהבחין בין סוגי תאי הדם הלבנים השונים. למרות שתאי T יכולים לייצר מגוון מולקולות CD, CD4ו- CD8 הם שני החשובים ביותר המשמשים להתמיינות המחלקות. תאי T עוזרים ותאי T מווסתים מאופיינים בביטוי של CD4 על פני השטח שלהם, בעוד שתאי T ציטוטוקסיים מאופיינים בביטוי של CD8.
ניתן להבחין בין מחלקות של תאי T גם על ידי מולקולות MHC ו-APCs הספציפיות איתן הן מקיימות אינטראקציה להפעלה. תאי T עוזרים ותאי T מווסתים יכולים להיות מופעלים רק על ידי APCs המציגים אנטיגנים הקשורים ל-MHC II. לעומת זאת, תאי T ציטוטוקסיים מזהים אנטיגנים המוצגים בשיתוף עם MHC I, על ידי APCs או על ידי תאים בעלי גרעין הנגועים בפתוגן תוך תאי.
המחלקות השונות של תאי T ממלאות גם תפקידים תפקודיים שונים במערכת החיסון. תאי T עוזרים משמשים כמתזמרים מרכזיים המסייעים להפעיל ולכוון פונקציות של חסינות הומורלית ותאית. בנוסף, תאי T עוזרים משפרים את תפקודי הרג הפתוגנים של מקרופאגים ותאי NK בעלי חסינות מולדת. לעומת זאת, התפקיד העיקרי של תאי T מווסתים הוא למנוע תגובות חיסוניות לא רצויות ועלולות להזיק. תפקידם בסובלנות היקפית, למשל, מגן מפני הפרעות אוטואימוניות, כפי שנדון קודם לכן. לבסוף, תאי T ציטוטוקסיים הם תאי האפקטור העיקריים לחסינות תאית. הם מזהים ומכוונים לתאים שנדבקו בפתוגנים תוך תאיים, ומשמידים תאים נגועים יחד עם הפתוגנים שבתוכם.
| כיתה | מולקולות CD משטח | הפעלה | פונקציות |
|---|---|---|---|
| תאי T עוזרים | CD4 | APCs המציגים אנטיגנים הקשורים ל- MHC II | תזמור חסינות הומוריסטית וסלולרית |
| מעורב בהפעלת מקרופאגים ותאי NK | |||
| תאי T רגולטוריים | CD4 | APCs המציגים אנטיגנים הקשורים ל- MHC II | מעורב בסובלנות היקפית ומניעת תגובות אוטואימוניות |
| תאי T ציטוטוקסיים | CD8 | APCs או תאים בעלי גרעין נגועים המציגים אנטיגנים הקשורים ל- MHC I | הרס תאים הנגועים בפתוגנים תוך תאיים |
תרגיל \(\PageIndex{2}\)
- מהן הפונקציות הייחודיות של שלוש המחלקות של תאי T?
- אילו תאי T יכולים להיות מופעלים על ידי אנטיגנים המוצגים על ידי תאים שאינם APCs?
קולטני תאי T
הן עבור תאי T עוזרים והן עבור תאי T ציטוטוקסיים, הפעלה היא תהליך מורכב הדורש אינטראקציות של מולקולות מרובות וחשיפה לציטוקינים. הקולטן לתאי T (TCR) מעורב בשלב הראשון של זיהוי אפיטופ פתוגן במהלך תהליך ההפעלה.
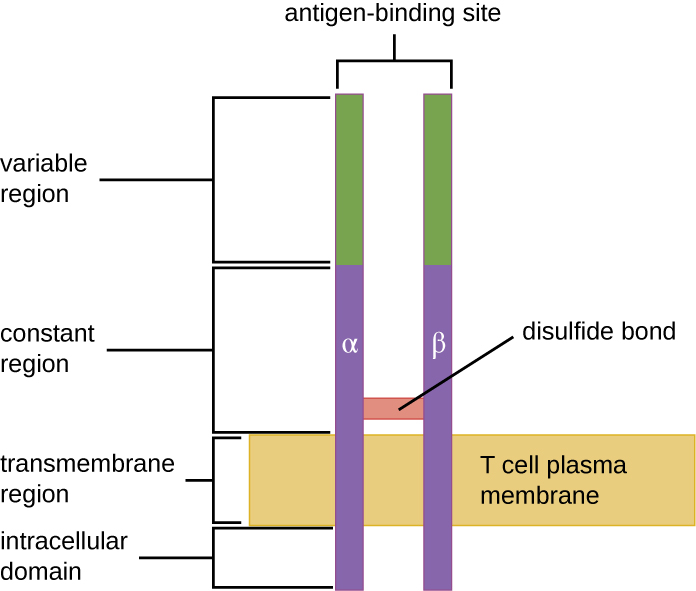
ה- TCR מגיע מאותה משפחת קולטנים כמו הנוגדנים IgD ו- IgM, קולטני האנטיגן על פני קרום תא B, ובכך חולק אלמנטים מבניים משותפים. בדומה לנוגדנים, ל-TCR יש אזור משתנהואזור קבוע, והאזור המשתנה מספק את האתר המחייב אנטיגן (איור). \(\PageIndex{4}\) עם זאת, המבנה של TCR קטן ופחות מורכב ממולקולות האימונוגלובולין (איור 18.1.4). בעוד שלאימונוגלובולינים יש ארבע שרשראות פפטידים ומבנים בצורת Y, ה-TCR מורכב משתי שרשראות פפטידים בלבד (שרשראות α ו-β), שתיהן משתרעות על הממברנה הציטופלזמית של תא ה-T.
TCR הם ספציפיים לאפיטופים, וההערכה היא ש-25 מיליון תאי T עם TCR ייחודיים המחייבים אפיטופים נדרשים כדי להגן על אדם מפני מגוון רחב של פתוגנים מיקרוביאליים. מכיוון שהגנום האנושי מכיל רק כ -25,000 גנים, אנו יודעים שלא ניתן לקודד כל TCR ספציפי על ידי קבוצת גנים משלו. זה מעלה את השאלה כיצד ניתן להשיג אוכלוסייה כה עצומה של תאי T עם מיליוני TCR ספציפיים. התשובה היא תהליך הנקרא סידור מחדש גנטי, המתרחש בתימוס בשלב הראשון של הבחירה התימית.
הגנים המקודדים לאזורים המשתנים של ה-TCR מחולקים לקטעי גנים נפרדים הנקראים מקטעי משתנים (V), גיוון (D) ומצטרפים (J). מקטעי הגנים הקשורים לשרשרת α של ה-TCR מורכבים מ-70 מקטעי V α שונים או יותר ו-61 מקטעי J α שונים. מקטעי הגנים הקשורים לשרשרת β של ה-TCR מורכבים מ-52 מקטעי V β שונים, שני מקטעי D β שונים ו-13 מקטעי J β שונים. במהלך פיתוח ה- TCR הפונקציונלי בתימוס, סידור מחדש גנטי בתא T מפגיש קטע V α אחד וקטע J α אחד לקודד לאזור המשתנה של שרשרת α. באופן דומה, סידור גנטי מפגיש את אחד מקטעי V β יחד עם אחד מקטעי D β ואחד ממקטעי TJ β לקודד לאזור המשתנה של שרשרת β. כל השילובים האפשריים של סידורים מחדש בין מקטעים שונים של V, D ו-J מספקים את המגוון הגנטי הנדרש לייצור מיליוני TCR עם אזורים משתנים ייחודיים ספציפיים לאפיטופ.
תרגיל \(\PageIndex{3}\)
- מהם הדמיון וההבדלים בין TCR לאימונוגלובולינים?
- באיזה תהליך משתמשים כדי לספק מיליוני אתרי קישור ייחודיים של TCR?
הפעלה והתמיינות של תאי T עוזרים
תאי T עוזרים יכולים להיות מופעלים רק על ידי APCs המציגים אפיטופים זרים מעובדים בשיתוף עם MHC II. השלב הראשון בתהליך ההפעלה הוא זיהוי TCR של האפיטופ הזר הספציפי המוצג בתוך השסע המחייב אנטיגן MHC II. השלב השני כולל אינטראקציה של CD4 בתא T המסייע עם אזור של מולקולת MHC II הנפרד מהסדק המחייב אנטיגן. אינטראקציה שנייה זו מעגנת את קומפלקס MHC II-TCR ומבטיחה שתא T העוזר מזהה הן את האפיטופ הזר ("הלא עצמי") והן את האנטיגן "העצמי" של ה- APC; שתי ההכרות נדרשות להפעלת התא. בשלב השלישי, תא ה-APC וה-T מפרישים ציטוקינים המפעילים את תא ה-T המסייע. תא T העוזר המופעל מתרבה לאחר מכן, ומתחלק על ידי מיטוזה לייצור תאי T עוזרים נאיביים משובטים המתמיינים לתתי סוגים בעלי פונקציות שונות (איור). \(\PageIndex{5}\)
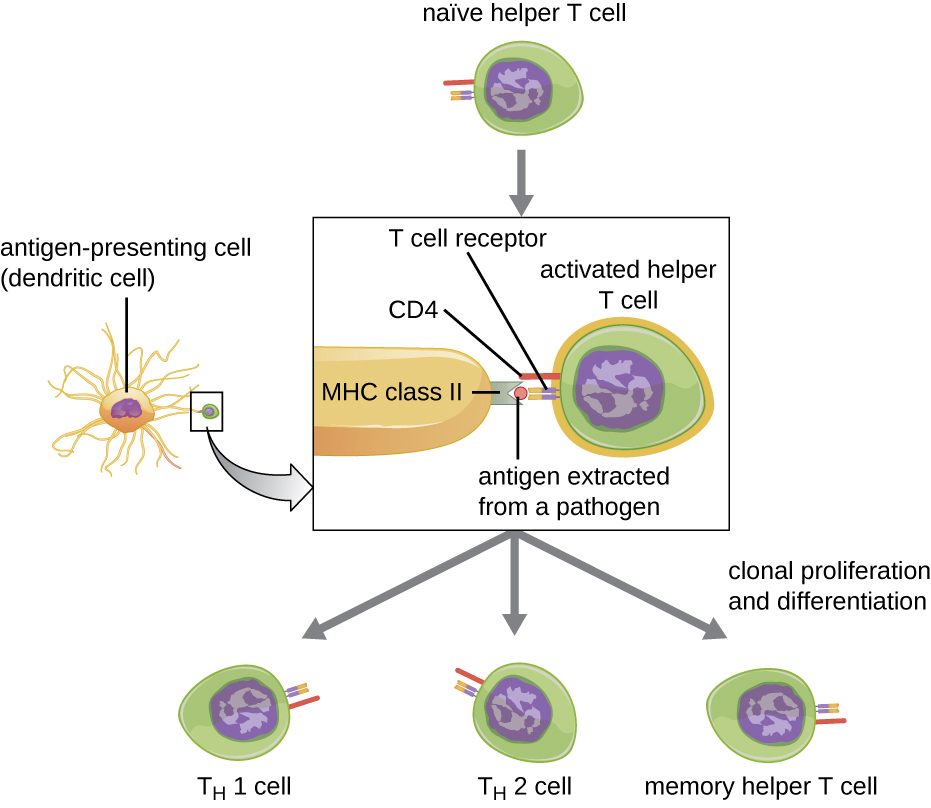
תאי T עוזרים מופעלים יכולים להתמיין לאחד מארבעה תת-סוגים נפרדים, המסוכמים בטבלה\(\PageIndex{2}\). תהליך הבידול מכוון על ידי ציטוקינים המופרשים על ידי APC. תלוי אילו ציטוקינים המופרשים על ידי APC מקיימים אינטראקציה עם תא T עוזר מופעל, התא עשוי להתמיין לתא עוזר T 1 (T H 1), תא עוזר T 2 (T H 2) או תא T עוזר זיכרון. שני סוגי תאי T עוזרים הם תאי אפקטור קצרי מועד יחסית, כלומר הם מבצעים פונקציות שונות של התגובה החיסונית המיידית. לעומת זאת, תאי T עוזרים לזיכרון הם בעלי חיים ארוכים יחסית; הם מתוכנתים "לזכור" אנטיגן או אפיטופ ספציפי על מנת להעלות תגובה מהירה, חזקה ומשנית לחשיפות הבאות.
תאי T H 1 מפרישים ציטוקינים משלהם המעורבים בגירוי ותזמור תאים אחרים המעורבים בחסינות אדפטיבית ומולדת. לדוגמה, הם מעוררים תאי T ציטוטוקסיים, משפרים את הריגתם של תאים נגועים ומקדמים התמיינות לתאי T ציטוטוקסיים בזיכרון. תאי T H 1 גם מעוררים מקרופאגים ונויטרופילים להיות יעילים יותר בהריגתם של חיידקים תוך תאיים. הם יכולים גם לעורר תאי NK להיות יעילים יותר בהריגת תאי מטרה.
תאי T H 2 ממלאים תפקיד חשוב בתזמור התגובה החיסונית ההומורלית באמצעות הפרשת ציטוקינים המפעילים תאי B ומכוונים התמיינות תאי B וייצור נוגדנים. ציטוקינים שונים המיוצרים על ידי תאי T H 2 מתזמרים החלפת מחלקות נוגדנים, המאפשרת לתאי B לעבור בין ייצור IgM, IgG, IgA ו- IgE לפי הצורך לביצוע פונקציות נוגדנים ספציפיות ולספק תגובות חיסוניות הומורליות ספציפיות לפתוגן.
תת-סוג שלישי של תאי T עוזרים הנקראים תאי T H 17 התגלה באמצעות תצפיות שחסינות לזיהומים מסוימים אינה קשורה לתאי T H 1 או T H 2. נראה כי תאי T H 17 והציטוקינים שהם מייצרים אחראים באופן ספציפי להגנת הגוף מפני זיהומים ריריים כרוניים. חולים שחסרים להם מספיק תאי T H 17 ברירית (למשל, חולי HIV) עשויים להיות רגישים יותר לחיידק ולזיהומים במערכת העיכול. 1
| תת-סוג | פונקציות |
|---|---|
| T H 1 תאים | לעורר תאי T ציטוטוקסיים ולייצר תאי T ציטוטוקסיים בזיכרון |
| לעורר מקרופאגים ונויטרופילים (PMNs) להרג תוך תאי יעיל יותר של פתוגנים | |
| לעורר תאי NK להרוג בצורה יעילה יותר | |
| T H 2 תאים | לעורר הפעלה והתמיינות של תאי B לתאי פלזמה ותאי B זיכרון |
| החלפת מחלקה ישירה של נוגדנים בתאי B | |
| T H 17 תאים | לעורר חסינות לזיהומים ספציפיים כגון זיהומים ריריים כרוניים |
| תאי T עוזר זיכרון | "זכור" פתוגן ספציפי ועלה תגובה משנית חזקה ומהירה עם חשיפה חוזרת |
הפעלה והתמיינות של תאי T ציטוטוקסיים
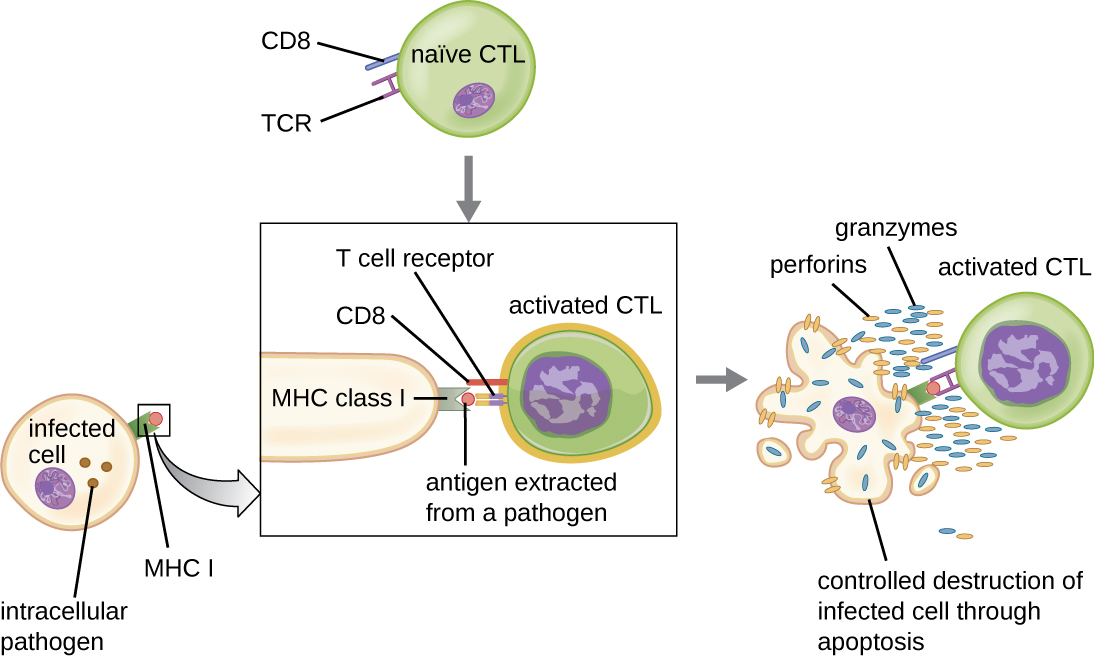
תאי T ציטוטוקסיים (המכונים גם לימפוציטים T ציטוטוקסיים, או CTLs) מופעלים על ידי APCs בתהליך בן שלושה שלבים הדומה לזה של תאי T עוזרים. ההבדל העיקרי הוא שההפעלה של תאי T ציטוטוקסיים כרוכה בזיהוי של אנטיגן המוצג עם MHC I (בניגוד ל-MHC II) ואינטראקציה של CD8 (בניגוד ל-CD4) עם קומפלקס הקולטן. לאחר ההכרה המשותפת המוצלחת של אפיטופ זר ואנטיגן עצמי, ייצור ציטוקינים על ידי ה-APC ותא ה-T הציטוטוקסי מפעילים התפשטות והתמיינות משובטים. תאי T ציטוטוקסיים מופעלים יכולים להתמיין לתאי T ציטוטוקסיים אפקטור המכוונים לפתוגנים להרס או לתאי זיכרון שמוכנים להגיב לחשיפות הבאות.
כפי שצוין, התפשטות והתמיינות של תאי T ציטוטוקסיים מגורה גם על ידי ציטוקינים המופרשים מתאי T H 1 המופעלים על ידי אותו אפיטופ זר. הגירוי המשותף שמגיע מתאי T H 1 אלה מסופק על ידי ציטוקינים המופרשים. למרות שניתן להפעיל תאי T ציטוטוקסיים ללא גירוי מתאי T H 1, ההפעלה אינה יעילה או ארוכת טווח.
לאחר הפעלתם, תאי T ציטוטוקסיים משמשים כתאי האפקטור של חסינות תאית, ומזהים והורגים תאים הנגועים בפתוגנים תוך תאיים באמצעות מנגנון דומה מאוד לזה של תאי NK. עם זאת, בעוד שתאי NK מזהים אותות לא ספציפיים של מתח או חריגה בתאים, תאי T ציטוטוקסיים מזהים תאים נגועים באמצעות הצגת אנטיגן של אפיטופים ספציפיים לפתוגן הקשורים ל-MHC I. לאחר זיהוי תא נגוע, ה-TCR של תא ה-T הציטוטוקסי נקשר לאפיטופ ומשחרר פרפורין וגרנזימים ההורסים את התא הנגוע (איור). \(\PageIndex{6}\) פרפורין הוא חלבון היוצר נקבוביות בתא המטרה, וגרנזימים הם פרוטאזות שנכנסות לנקבוביות ומעוררות אפופטוזיס. מנגנון זה של מוות תאים מתוכנת הוא אמצעי מבוקר ויעיל להשמדה והסרה של תאים נגועים מבלי לשחרר את הפתוגנים בפנים כדי להדביק תאים שכנים, כפי שעלול להתרחש אם התאים הנגועים פשוט היו מסולקים.
בסרטון זה, ניתן לראות תא T ציטוטוקסי הגורם לאפופטוזיס בתא מטרה.
תרגיל \(\PageIndex{4}\)
- השווה והשוואה בין ההפעלה של תאי T עוזרים ותאי T ציטוטוקסיים.
- מהן הפונקציות השונות של תת-סוגי תאי T עוזרים?
- מהו המנגנון של הרס בתיווך CTL של תאים נגועים?
סופר אנטיגנים והפעלה לא מוסדרת של תאי T
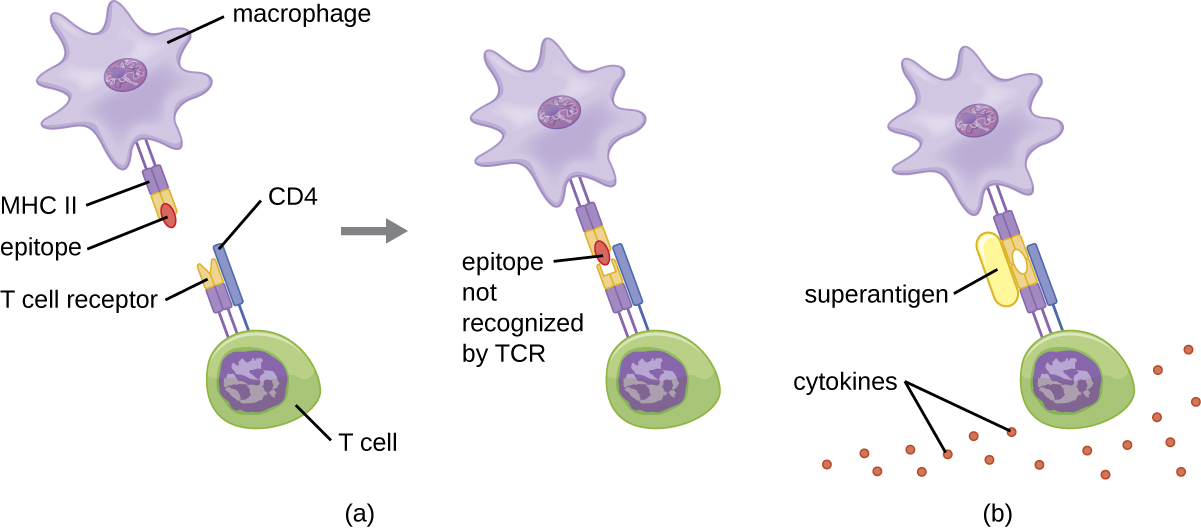
כאשר הפעלת תאי T נשלטת ומווסתת, התוצאה היא תגובת מגן היעילה במאבק בזיהומים. עם זאת, אם הפעלת תאי T אינה מוסדרת ומוגזמת, התוצאה עלולה להיות מסכנת חיים. פתוגנים חיידקיים וויראליים מסוימים מייצרים רעלים המכונים סופר-אנטיגנים (ראה גורמי ארסיות של פתוגנים חיידקיים ונגיפיים) שיכולים לעורר תגובה כה לא מוסדרת. סופר-אנטיגנים חיידקיים ידועים כוללים רעלן לתסמונת הלם רעיל (TSST), אנטרוטוקסינים סטפילוקוקליים, רעלים פירוגניים סטרפטוקוקליים, סופראנטיגן סטרפטוקוקלי והאקסוטוקסין המיטוגני סטרפטוקוקלי. וירוסים הידועים כמייצרים סופר-אנטיגנים כוללים וירוס אפשטיין-בר (הרפס וירוס אנושי 4), ציטומגלווירוס (הרפס וירוס אנושי 5) ואחרים.
מנגנון הפעלת תאי T על ידי סופר-אנטיגנים כרוך בקשירה בו זמנית למולקולות MHC II של APCs ולאזור המשתנה של שרשרת TCR β. קישור זה מתרחש מחוץ לשסע המחייב אנטיגן של MHC II, כך שהסופר-אנטיגן יגשר יחד ויפעיל MHC II ו-TCR ללא זיהוי אפיטופים זרים ספציפיים (איור). \(\PageIndex{7}\) התוצאה היא שחרור מוגזם ובלתי מבוקר של ציטוקינים, המכונה לעתים קרובות סערת ציטוקינים, המגרה תגובה דלקתית מוגזמת. זה יכול להוביל לירידה מסוכנת בלחץ הדם, הלם, כשל רב איברים, ואולי, מוות.
תרגיל \(\PageIndex{5}\)
- מהן דוגמאות לסופר-אנטיגנים?
- כיצד סופראנטיגן מפעיל תא T עוזר?
- איזו השפעה יש לסופר-אנטיגן על תא T?
מקרה לדוגמה: סופר אנטיגנים
מליסה, אישה בריאה אחרת בת 22, מובאת לחדר המיון על ידי החבר המודאג שלה. היא מתלוננת על הופעה פתאומית של חום גבוה, הקאות, שלשולים וכאבי שרירים. בראיון הראשוני שלה היא מספרת לרופא המטפל שהיא נמצאת במניעת הריון הורמונלית וגם נמצאת יומיים בחלק הווסת במחזור שלה. היא אינה נוטלת תרופות אחרות ואינה מתעללת בסמים או באלכוהול. היא לא מעשנת. היא אינה סוכרתית ואין לה כרגע זיהום מכל סוג שהוא למיטב ידיעתה.
בזמן ההמתנה בחדר המיון, לחץ הדם של מליסה מתחיל לרדת באופן דרמטי ומצבה הנפשי מתדרדר לבלבול כללי. הרופא סבור שהיא ככל הנראה סובלת מתסמונת הלם רעיל (TSS). TSS נגרם על ידי הרעלן TSST-1, סופר-אנטיגן הקשור ל- Staphylococcus aureus, ושימוש לא נכון בטמפון הוא גורם שכיח לזיהומים המובילים ל- TSS. הסופר-אנטיגן מגרה באופן בלתי הולם הפעלה נרחבת של תאי T ושחרור מוגזם של ציטוקינים, וכתוצאה מכך תגובה דלקתית מסיבית ומערכתית שעלולה להיות קטלנית.
ניתן ליטול ספוגיות בנרתיק או צוואר הרחם כדי לאשר את נוכחות החיידק, אך בדיקות אלה אינן קריטיות לביצוע על סמך הסימפטומים וההיסטוריה הרפואית של מליסה. הרופא רושם התייבשות, טיפול תומך ואנטיביוטיקה כדי לבלום את הזיהום החיידקי. היא גם רושמת תרופות להגברת לחץ הדם של מליסה. מליסה מבלה שלושה ימים בבית החולים בטיפול; בנוסף, תפקוד הכליות שלה מנוטר בגלל הסיכון הגבוה לאי ספיקת כליות הקשורה ל- TSS. לאחר 72 שעות, מליסה מספיק טובה כדי להשתחרר כדי להמשיך את החלמתה בבית.
תרגיל \(\PageIndex{6}\)
באיזה אופן טיפול אנטיביוטי יעזור להילחם בסופר-אנטיגן?
מיקוד קליני: חלק 2
בלוטות הלימפה הנפוחות של אוליביה, הבטן והטחול מעידות על תגובה חיסונית חזקה לזיהום מערכתי בתהליך. בנוסף, אוליביה הקטנה לא ששה להפנות את ראשה ונראה שהיא חווה כאבי צוואר עזים. הרופא מזמין ספירת דם מלאה, תרבית דם וניקור מותני. הנוזל השדרתי (CSF) המתקבל נראה מעונן ומוערך עוד יותר על ידי הערכת כתם גראם ותרבית עבור פתוגנים חיידקיים פוטנציאליים. ספירת הדם המלאה מצביעה על מספר גבוה של תאי דם לבנים בזרם הדם של אוליביה. עליות תאי הדם הלבנים נרשמות ב 28.5 K/μL (טווח נורמלי: 6.0-17.5 K/μL). אחוז הנויטרופילים נרשם כ -60% (טווח נורמלי: 23-45%). רמות הגלוקוז ב- CSF נרשמו ב 30 מ"ג/100 מ"ל (טווח נורמלי: 50-80 מ"ג/100 מ"ל). ספירת ה- WBC ב- CSF הייתה 1,163/מ"מ3 (טווח נורמלי: 5-20/מ"מ 3).
תרגיל \(\PageIndex{7}\)
- בהתבסס על תוצאות אלה, האם יש לך אבחנה ראשונית?
- מהו טיפול מומלץ המבוסס על אבחנה ראשונית זו?
מושגי מפתח וסיכום
- לימפוציטים T לא בשלים מיוצרים במח העצם האדום ונוסעים לתימוס לצורך התבגרות.
- בחירה תימית היא תהליך בן שלושה שלבים של ברירה שלילית וחיובית הקובע אילו תאי T יתבגרו ויצאו מהתימוס לזרם הדם ההיקפי.
- סובלנות מרכזית כרוכה בבחירה שלילית של תאי T בעלי תגובה עצמית בתימוס, וסובלנות היקפית כוללת אנרגיה ותאי T רגולטוריים המונעים תגובות חיסוניות תגובתיות עצמית ואוטואימוניות.
- ה - TCR דומה במבנהו לאימונוגלובולינים, אך פחות מורכב. מיליוני TCRs ייחודיים המחייבים אפיטופים מקודדים באמצעות תהליך של סידור מחדש גנטי של מקטעי גנים V, D ו-J.
- ניתן לחלק תאי T לשלוש מחלקות - תאי T עוזרים, תאי T ציטוטוקסיים ותאי T רגולטוריים - על סמך הביטוי שלהם ל- CD4 או CD8, מולקולות MHC איתן הן מקיימות אינטראקציה להפעלה ותפקודיהן בהתאמה.
- תאי T עוזרים מופעלים מתמיינים לסוגי תאי T H 1, T H 2, T H 17 או תאי T זיכרון. הבידול מכוון על ידי הציטוקינים הספציפיים אליהם הם נחשפים. T H 1, T H 2 ו- T H 17 מבצעים פונקציות שונות הקשורות לגירוי של הגנות חיסוניות אדפטיביות ומולדות. תאי T זיכרון הם תאים ארוכי חיים שיכולים להגיב במהירות לחשיפות משניות.
- לאחר הפעלתם, תאי T ציטוטוקסיים מכוונים והורגים תאים הנגועים בפתוגנים תוך תאיים. הריגה דורשת זיהוי של אפיטופים פתוגניים ספציפיים המוצגים על פני התא באמצעות מולקולות MHC I. הריגה מתווכת על ידי פרפורין וגרנזימים המעוררים אפופטוזיס.
- סופר אנטיגנים הם חלבונים חיידקיים או ויראליים הגורמים להפעלה לא ספציפית של תאי T עוזרים, מה שמוביל לשחרור מוגזם של ציטוקינים (סערת ציטוקינים) ולתגובה דלקתית מערכתית שעלולה להיות קטלנית.
הערות שוליים
- 1 בלאשיץ סי, רפאטלו מ '"ציטוקינים Th17 ומחסום רירית המעיים." ג'יי קלין אימונול מרץ 2010; 30 (2): 196-203. דוי: 10.1007/s10875-010-9368-7.


