17.4: זיהוי פתוגנים ופגוציטוזיס
- Page ID
- 209175
מטרות למידה
- הסבר כיצד לויקוציטים נודדים מדם היקפי לרקמות נגועות
- הסבר את המנגנונים שבאמצעותם לויקוציטים מזהים פתוגנים
- הסבר את תהליך הפגוציטוזיס ואת המנגנונים שבאמצעותם פגוציטים הורסים ומפרקים פתוגנים
ניתן לתאר כמה מסוגי התאים שנדונו בסעיף הקודם כפגוציטים - תאים שתפקידם העיקרי הוא לחפש, לבלוע ולהרוג פתוגנים. תהליך זה, הנקרא פגוציטוזיס, נצפה לראשונה בכוכבי ים בשנות ה -80 של המאה ה -19 על ידי הזואולוג זוכה פרס נובל איליה מטשניקוף (1845—1916), שיצר את הקשר לתאי דם לבנים (WBC) בבני אדם ובעלי חיים אחרים. באותה תקופה, פסטר ומדענים אחרים האמינו כי WBC מפיצים פתוגנים במקום להרוג אותם (וזה נכון לגבי מחלות מסוימות, כגון שחפת). אך ברוב המקרים, פגוציטים מספקים הגנה חזקה, מהירה ויעילה מפני מגוון רחב של חיידקים, מה שהופך אותם למרכיב קריטי בחסינות לא ספציפית מולדת. חלק זה יתמקד במנגנונים שבאמצעותם פגוציטים מסוגלים לחפש, לזהות ולהשמיד פתוגנים.
אקסטרבסציה (דיאפדיזיס) של לויקוציטים
חלק מהפגוציטים הם לויקוציטים (WBCs) שבדרך כלל מסתובבים בזרם הדם. כדי להגיע לפתוגנים הממוקמים ברקמה נגועה, לויקוציטים חייבים לעבור דרך דפנות כלי הדם הנימים הקטנים בתוך הרקמות. תהליך זה, הנקרא extravasation, או diapedesis, מתחיל על ידי גורם משלים C5a, כמו גם ציטוקינים המשתחררים לסביבה הקרובה על ידי מקרופאגים ותאי רקמה תושבים המגיבים לנוכחות הגורם הזיהומי (איור). \(\PageIndex{1}\) בדומה ל-C5a, רבים מהציטוקינים הללו הם פרו-דלקתיים וכימוטקטיים, והם נקשרים לתאים של כלי דם נימיים קטנים, ומתחילים תגובה בתאי האנדותל המצפים את החלק הפנימי של דפנות כלי הדם. תגובה זו כוללת וויסות וביטוי של מולקולות וקולטנים שונים של הידבקות תאית. לויקוציטים העוברים דרכם ידבקו מעט למולקולות ההדבקה, יאטו ויתגלגלו לאורך דפנות כלי הדם בסמוך לאזור הנגוע. כאשר הם מגיעים לצומת תאי, הם ייקשרו לעוד יותר ממולקולות ההדבקה הללו, ישתטחו החוצה ויסחטו דרך הצומת הסלולרי בתהליך המכונה נדידת טרנסנדותל. מנגנון זה של "הידבקות מתגלגלת" מאפשר ללוקוציטים לצאת מזרם הדם ולהיכנס לאזורים הנגועים, שם הם יכולים להתחיל לפגוציטוזה של הפתוגנים הפולשים.
שים לב כי אקסטרבסציה אינה מתרחשת בעורקים או בוורידים. כלי דם אלה מוקפים בקירות מגן עבים ורב-שכבתיים, בניגוד לדפנות הדקיקות בשכבה חד-תאית של נימים. יתר על כן, זרימת הדם בעורקים סוערת מכדי לאפשר הידבקות מתגלגלת. כמו כן, כמה leukocytes נוטים להגיב לזיהום מהר יותר מאחרים. הראשונים להגיע בדרך כלל הם נויטרופילים, לרוב תוך שעות מרגע זיהום חיידקי. על פי חוזה, מונוציטים עשויים לקחת מספר ימים לעזוב את זרם הדם ולהתמיין למקרופאגים.
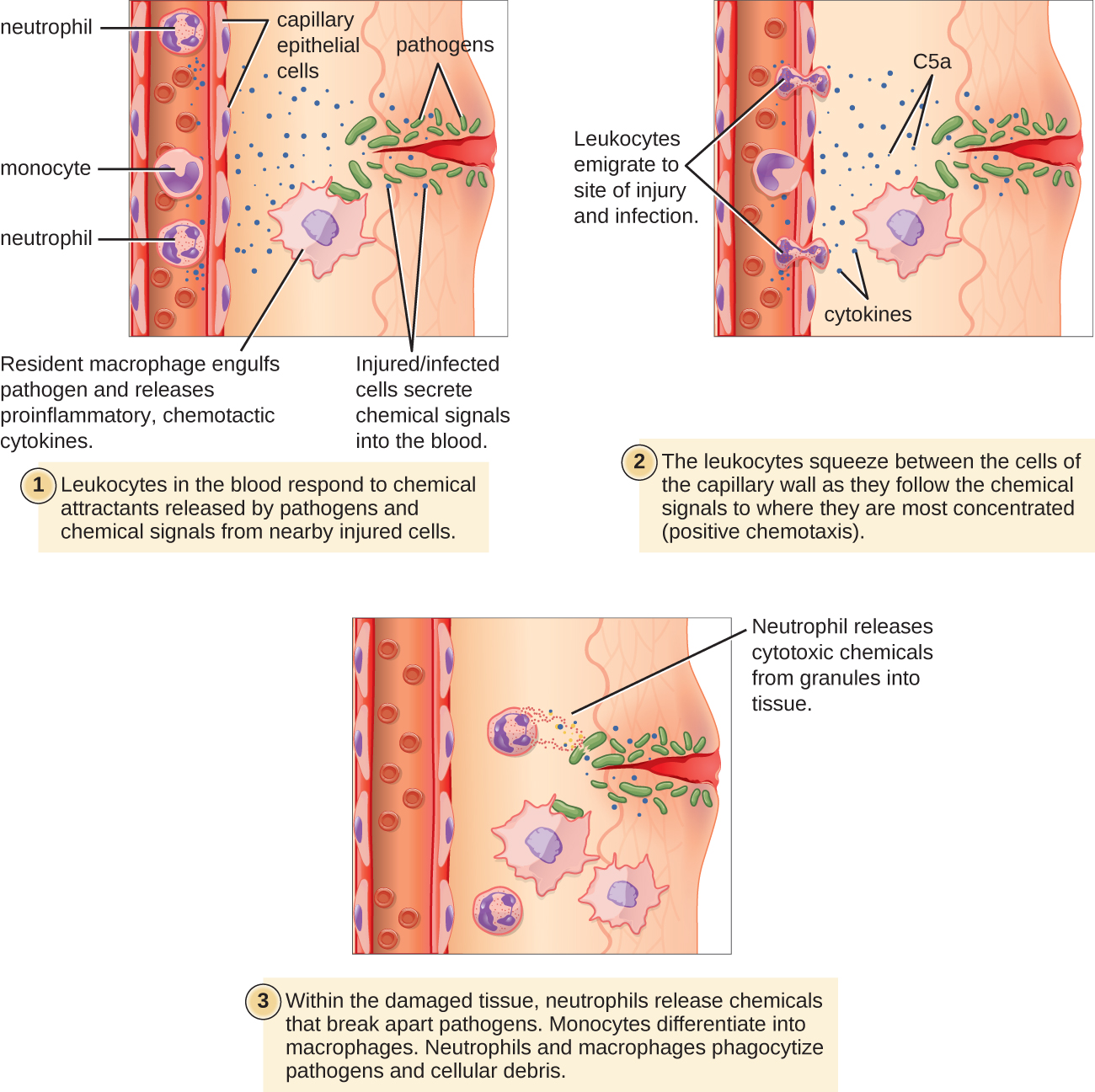
צפה בסרטונים הבאים על הוצאת לויקוציטים וגלגול לויקוציטים למידע נוסף.
תרגיל \(\PageIndex{1}\)
הסבר את תפקידן של מולקולות הדבקה בתהליך החצנה.
זיהוי פתוגן
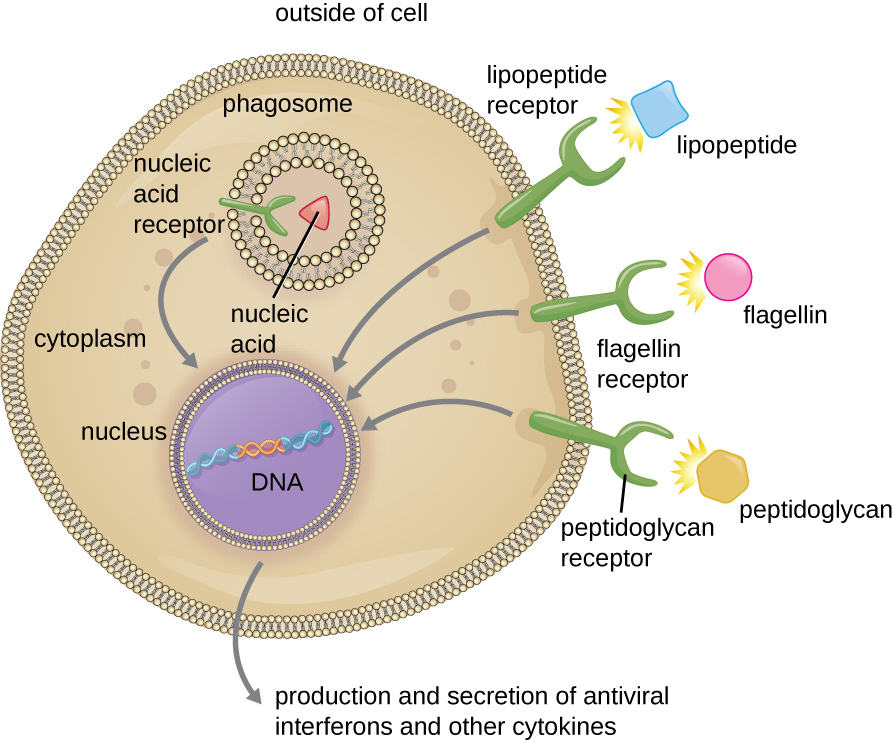
כפי שתואר בסעיף הקודם, אופסוניזציה של פתוגנים על ידי נוגדן; גורמים משלימים C1q, C3b ו- C4b; ולקטינים יכולים לסייע לתאים פגוציטים בזיהוי פתוגנים והתקשרות ליזום פגוציטוזיס. עם זאת, לא כל זיהוי הפתוגנים תלוי באופסונין. פגוציטים יכולים גם לזהות מבנים מולקולריים המשותפים לקבוצות רבות של חיידקים פתוגניים. מבנים כאלה נקראים דפוסים מולקולריים הקשורים לפתוגן (PAMPs). PAMPs נפוצים כוללים את הדברים הבאים:
- פפטידוגליקן, המצוי בדפנות תאים חיידקיים;
- פלגלין, חלבון המצוי בדגלים חיידקיים;
- ליפופוליסכריד (LPS) מהקרום החיצוני של חיידקים שליליים גרם;
- ליפופפטידים, מולקולות המתבטאות על ידי רוב החיידקים; ו
- חומצות גרעין כגון DNA ויראלי או RNA.
כמו PAMPs רבים אחרים, חומרים אלה הם חלק בלתי נפרד מהמבנה של סוגים רחבים של חיידקים.
המבנים המאפשרים לתאים פגוציטים לזהות PAMPs נקראים קולטני זיהוי תבניות (PRRs). קבוצה אחת של PRRs היא הקולטנים דמויי האגרה (TLRs), הנקשרים ל-PAMPs שונים ומתקשרים עם גרעין הפגוציט כדי לעורר תגובה. TLRs רבים (ו-PRRs אחרים) ממוקמים על פני השטח של פגוציט, אך חלקם יכולים להימצא מוטבעים גם בממברנות של תאים פנימיים ואברונים (איור). \(\PageIndex{2}\) PRRs פנימיים אלה יכולים להיות שימושיים לקשירה וזיהוי של פתוגנים תוך תאיים שאולי קיבלו גישה לחלק הפנימי של התא לפני שהפגוציטוזיס יכול להתרחש. חומצות גרעין ויראליות, למשל, עשויות להיתקל ב- PRR פנימי, מה שמעורר ייצור של אינטרפרון הציטוקינים האנטי-ויראלי.
בנוסף למתן השלב הראשון של זיהוי פתוגנים, האינטראקציה בין PAMPs ו-PRRs על מקרופאגים מספקת אות תוך תאי המפעיל את הפגוציט, וגורם לו לעבור ממצב רדומה של מוכנות והתפשטות איטית למצב של היפראקטיביות, התפשטות, ייצור/הפרשת ציטוקינים והרג תוך תאי משופר. PRRs על מקרופאגים מגיבים גם לאותות מצוקה כימיים מתאי פגומים או לחוצים. זה מאפשר למקרופאגים להרחיב את תגובותיהם מעבר להגנה מפני מחלות זיהומיות לתפקיד רחב יותר בתגובה הדלקתית המתחילה מפציעות או מחלות אחרות.
תרגיל \(\PageIndex{2}\)
- ציין ארבעה דפוסים מולקולריים הקשורים לפתוגן (PAMPs).
- תאר את תהליך הפעלת הפגוציטים.
השפלה של פתוגן
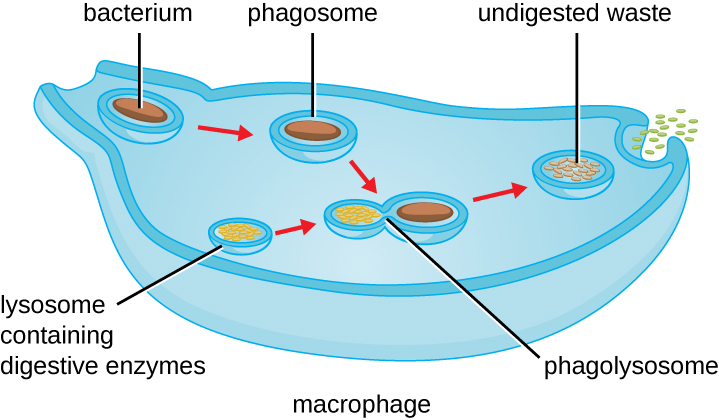
ברגע שמתרחשת זיהוי והתקשרות של פתוגן, הפתוגן נבלע בשלפוחית ומובא לתא הפנימי של הפגוציט בתהליך הנקרא פגוציטוזיס (איור). \(\PageIndex{3}\) PRRs יכולים לסייע בפגוציטוזיס על ידי קשירה ראשונה לפני השטח של הפתוגן, אך פגוציטים מסוגלים גם לבלוע פריטים סמוכים גם אם הם אינם קשורים לקולטנים ספציפיים. כדי לבלוע את הפתוגן, הפגוציט יוצר פסאודופוד העוטף את הפתוגן ואז צובט אותו לתוך שלפוחית ממברנה הנקראת פגוזום. החמצת הפגוזום (pH יורד לטווח של 4-5) מספקת מנגנון אנטיבקטריאלי מוקדם חשוב. הפגוזום המכיל את הפתוגן מתמזג עם ליזוזום אחד או יותר ויוצר פגוליזוזום. היווצרות הפגוליזוזום משפרת את ההחמצה, החיונית להפעלה של אנזימים ליזוזומליים עיכול תלויי pH וייצור מי חמצן ומיני חמצן תגובתיים רעילים. אנזימים ליזוזומליים כגון ליזוזים, פוספוליפאז ופרוטאזות מעכלים את הפתוגן. אנזימים אחרים מעורבים פרץ נשימתי. במהלך פרץ הנשימה, פגוציטים יגדילו את ספיגתם וצריכת החמצן שלהם, אך לא לייצור אנרגיה. צריכת החמצן המוגברת מתמקדת בייצור אניון סופראוקסיד, מי חמצן, רדיקלים הידרוקסיל ומיני חמצן תגובתיים אחרים שהם אנטיבקטריאליים.
בנוסף למין החמצן התגובתי המיוצר על ידי פרץ הנשימה, יכולות להיווצר גם תרכובות חנקן תגובתיות בעלות פוטנציאל ציטוטוקסי (הרג תאים). לדוגמה, תחמוצת החנקן יכולה להגיב עם סופראוקסיד ליצירת פרוקסיניטריט, תרכובת חנקן תגובתית ביותר עם יכולות פירוק הדומות לאלו של מיני החמצן התגובתי. חלק מהפגוציטים אפילו מכילים מחסן פנימי של חלבוני דיפנסין מיקרוביצידים (למשל, גרגירי נויטרופילים). כוחות הרסניים אלה יכולים להשתחרר לאזור סביב התא כדי לפרק חיידקים חיצונית. נויטרופילים, במיוחד, יכולים להיות יעילים למדי במנגנון האנטי-מיקרוביאלי המשני הזה.
לאחר השלמת הפירוק, שאריות פסולת מופרשות מהתא בשלפוחית אקסוציטית. עם זאת, חשוב לציין כי לא כל שרידי הפתוגן מופרשים כפסולת. מקרופאגים ותאים דנדריטים הם גם תאים המציגים אנטיגן המעורבים בתגובה החיסונית ההסתגלותית הספציפית. תאים אלה מעבדים עוד יותר את שרידי הפתוגן המושפל ומציגים אנטיגנים מרכזיים (חלבוני פתוגן ספציפיים) על פני התא שלהם. זהו שלב חשוב לגירוי של כמה תגובות חיסוניות אדפטיביות, כפי שיידון ביתר פירוט בפרק הבא.
בקר בקישור זה כדי לצפות בפגוציט שרודף ובולע פתוגן.
תרגיל \(\PageIndex{3}\)
מה ההבדל בין פגוזום לליזוזום?
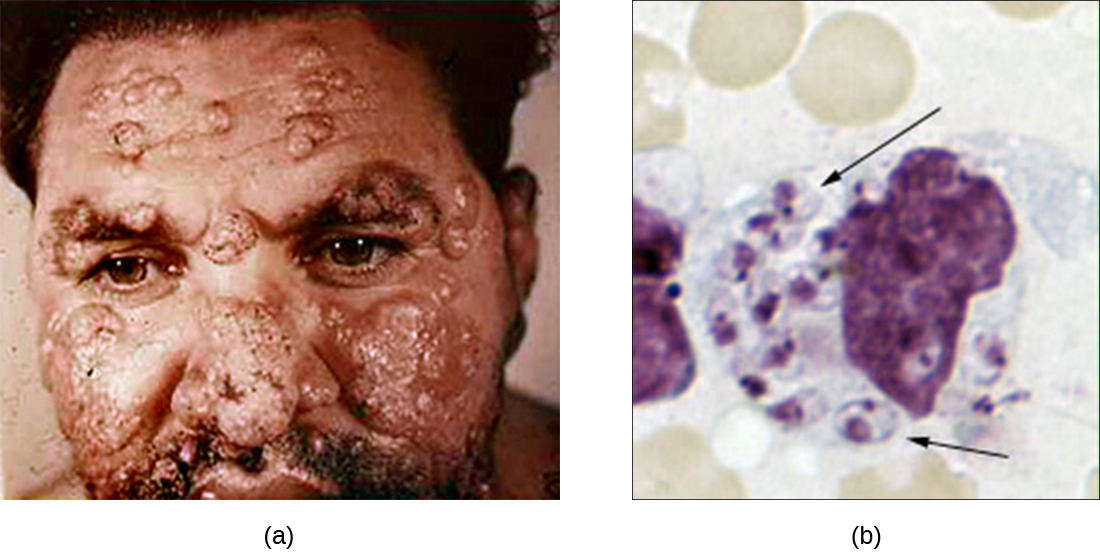
למרות שפגוציטוזיס הורסת בהצלחה פתוגנים רבים, חלקם מסוגלים לשרוד ואף לנצל את מנגנון ההגנה הזה כדי להתרבות בגוף ולגרום לזיהום נרחב. פרוטוזואנים של הסוג לישמניה הם דוגמה אחת. טפילים תאיים מחייבים אלה הם דגלים המועברים לבני אדם על ידי עקיצת זבוב חול. זיהומים גורמים לפצעים וכיבים חמורים ולעיתים מעוותים בעור וברקמות אחרות (איור\(\PageIndex{4}\)). ברחבי העולם, כ -1.3 מיליון בני אדם נדבקים לאחרונה בלישמניאזיס מדי שנה. 1
פפטידים רוק מזבוב החול מפעילים מקרופאגים מארחים באתר הנשיכה שלהם. המסלול הקלאסי או החלופי להפעלת משלים מתרחש עם אופסוניזציה של C3b של הטפיל. תאי לישמניה עוברים פגוציטוזה, מאבדים את הדגל שלהם ומתרבים בצורה המכונה אמסטיגוטה (גוף לישמן-דונובן) בתוך הפגוליסוזום. למרות שפתוגנים רבים אחרים נהרסים בפגוליזוזום, הישרדותם של האמסטיגוטים של לישמניה נשמרת על ידי נוכחות של ליפופוספוגליקן פני השטח ופוספטאז חומצי. חומרים אלה מעכבים את פרץ הנשימה המקרופאג ואת האנזימים הליזוזומליים. לאחר מכן הטפיל מתרבה בתוך התא ומפרק את המקרופאג הנגוע, ומשחרר את האמסטיגוטים להדביק מקרופאגים אחרים בתוך אותו מארח. אם זבוב חול אחר נושך אדם נגוע, הוא עלול לבלוע אמסטיגוטים ואז להעביר אותם לאדם אחר דרך נגיסה אחרת.
ישנן מספר צורות שונות של לישמניאזיס. הנפוצה ביותר היא צורה עורית מקומית של המחלה הנגרמת על ידי L. tropica, שבדרך כלל נפתרת באופן ספונטני לאורך זמן אך עם חדירת לימפוציטים משמעותית וצלקות קבועות. צורה רירית של המחלה, הנגרמת על ידי L. viannia brasilienfsis, מייצר נגעים ברקמת האף והפה ויכול להיות מסכן חיים. צורה קרבית של המחלה יכולה להיגרם על ידי כמה ממיני לישמניה השונים. זה משפיע על מערכות איברים שונות וגורם להגדלה לא תקינה של הכבד והטחול. חום לא סדיר, אנמיה, תפקוד לקוי של הכבד וירידה במשקל הם כולם סימנים ותסמינים של לישמניאזיס קרביים. אם לא מטופלים, זה בדרך כלל קטלני.
מושגי מפתח וסיכום
- פגוציטים הם תאים המזהים פתוגנים ומשמידים אותם באמצעות פגוציטוזיס.
- ההכרה מתרחשת לעתים קרובות על ידי שימוש בקולטני פגוציטים הקושרים מולקולות הנפוצות על פתוגנים, המכונים דפוסים מולקולריים הקשורים לפתוגן (PAMPs).
- הקולטנים הקושרים PAMPs נקראים קולטני זיהוי תבניות, או PRRs. קולטנים דמויי אגרה (TLRs) הם סוג אחד של PRR המצוי על פגוציטים.
- הוצאת תאי דם לבנים מזרם הדם לרקמה נגועה מתרחשת בתהליך של נדידת טרנסנדותל.
- פגוציטים מפרקים פתוגנים באמצעות פגוציטוזיס, הכוללת בליעת הפתוגן, הרג ועיכול בתוך פגוליסוזום, ולאחר מכן הפרשת חומר לא מעוכל.
הערות שוליים
- 1 ארגון הבריאות העולמי. "לישמניאזיס". 2016. http://www.who.int/mediacentre/factsheets/fs375/en/.


