13.4: בדיקת יעילותם של חומרי חיטוי וחיטוי
- Page ID
- 209082
מטרות למידה
- תאר מדוע נעשה שימוש במקדם הפנול
- השווה והשוואה בין שיטות דיפוזיה, דילול שימוש ושיטות בשימוש לבדיקת היעילות של חומרי חיטוי, חומרי חיטוי ועיקרים
יעילותם של חומרי חיטוי כימיים שונים באה לידי ביטוי במונחים המשמשים לתיאורם. חומרי חיטוי כימיים מקובצים לפי כוח פעילותם, כאשר כל קטגוריה משקפת את סוגי החיידקים והנגיפים שחומרי החיטוי המרכיבים שלה יעילים נגדם. לקוטלי חיידקים ברמה גבוהה יש את היכולת להרוג תאים צמחיים, פטריות, וירוסים ואנדוספורים, מה שמוביל לעיקור, בשימוש ממושך. קוטלי חיידקים ברמה בינונית, כפי ששמם מרמז, פחות יעילים נגד אנדוספורים ווירוסים מסוימים, וקוטלי חיידקים ברמה נמוכה הורגים רק תאים וגטטיביים ווירוסים עטופים מסוימים, ואינם יעילים נגד אנדוספורים.
עם זאת, מספר תנאים סביבתיים משפיעים על עוצמתו של חומר אנטי-מיקרוביאלי ועל יעילותו. לדוגמה, אורך החשיפה חשוב במיוחד, כאשר חשיפה ארוכה יותר מגבירה את היעילות. באופן דומה, ריכוז החומר הכימי חשוב גם הוא, כאשר ריכוזים גבוהים יותר יעילים מאשר נמוכים יותר. טמפרטורה, pH וגורמים אחרים יכולים גם להשפיע על העוצמה של סוכן חיטוי.
שיטה אחת לקביעת היעילות של חומר כימי כוללת ניקוי משטחים לפני ואחרי השימוש כדי לאשר אם שדה סטרילי נשמר במהלך השימוש. בדיקות נוספות מתוארות בסעיפים הבאים. בדיקות אלו מאפשרות שמירה על פרוטוקולי חיטוי מתאימים במסגרות קליניות, שליטה בצמיחה מיקרוביאלית כדי להגן על חולים, עובדי בריאות והקהילה.
מקדם פנול
ניתן לקבוע את יעילותו של חומר חיטוי או חיטוי במספר דרכים. מבחינה היסטורית, יעילותו של חומר כימי הושוותה לעתים קרובות לזו של פנול, החומר הכימי הראשון בו השתמש ג'וזף ליסטר. בשנת 1903 הקימו הכימאים הבריטים סמואל רידאל (1863—1929) וג'יי טי איינסלי ווקר (1868—1930) פרוטוקול להשוואת היעילות של מגוון כימיקלים לזו של פנול, תוך שימוש כאורגניזמי הבדיקה שלהם Staphylococcus aureus (חיידק גרם חיובי) ו סלמונלה אנטריקה serovar Typhi (חיידק גרם שלילי). הם חשפו את חיידקי הבדיקה לתמיסות הכימיות האנטי-מיקרוביאליות המדוללות במים למשך 7.5 דקות. לאחר מכן הם חישבו מקדם פנול עבור כל כימיקל עבור כל אחד משני החיידקים שנבדקו. מקדם פנול של 1.0 פירושו שלחומר הכימי יש אותה רמת יעילות כמו פנול. סוכן כימי עם מקדם פנול של פחות מ 1.0 הוא פחות יעיל מאשר פנול. דוגמה לכך היא פורמלין, עם מקדמי פנול של 0.3 (S. aureus) ו- 0.7 (S. enterica serovar טיפי). סוכן כימי עם מקדם פנול גדול מ 1.0 הוא יעיל יותר מאשר פנול, כגון כלורמין, עם מקדמי פנול של 133 ו 100, בהתאמה. למרות שמקדם הפנול היה פעם מדד שימושי ליעילות, הוא כבר לא נפוץ מכיוון שהתנאים והאורגניזמים בהם נעשה שימוש נבחרו באופן שרירותי.
תרגיל \(\PageIndex{1}\)
מה ההבדלים בין שלוש רמות יעילות החיטוי?
שיטת דיפוזיה של דיסק
שיטת דיפוזיה הדיסק כוללת החלת כימיקלים שונים על דיסקי נייר סינון סטריליים נפרדים (איור\(\PageIndex{1}\)). לאחר מכן מניחים את הדיסקים על צלחת אגר שחוסנה עם החיידק הממוקד והכימיקלים מתפזרים מתוך הדיסקים לתוך האגר שבו חוסנו החיידקים. ככל ש"הדשא "של החיידקים גדל, נצפים אזורי עיכוב של צמיחת חיידקים כאזורים ברורים סביב הדיסקים. למרות שישנם גורמים נוספים התורמים לגדלים של אזורי עיכוב (למשל, האם הסוכן מסיס במים ומסוגל להתפזר באגר), אזורים גדולים יותר מתואמים בדרך כלל ליעילות עיכוב מוגברת של החומר הכימי. הקוטר על פני כל אזור נמדד במילימטרים.
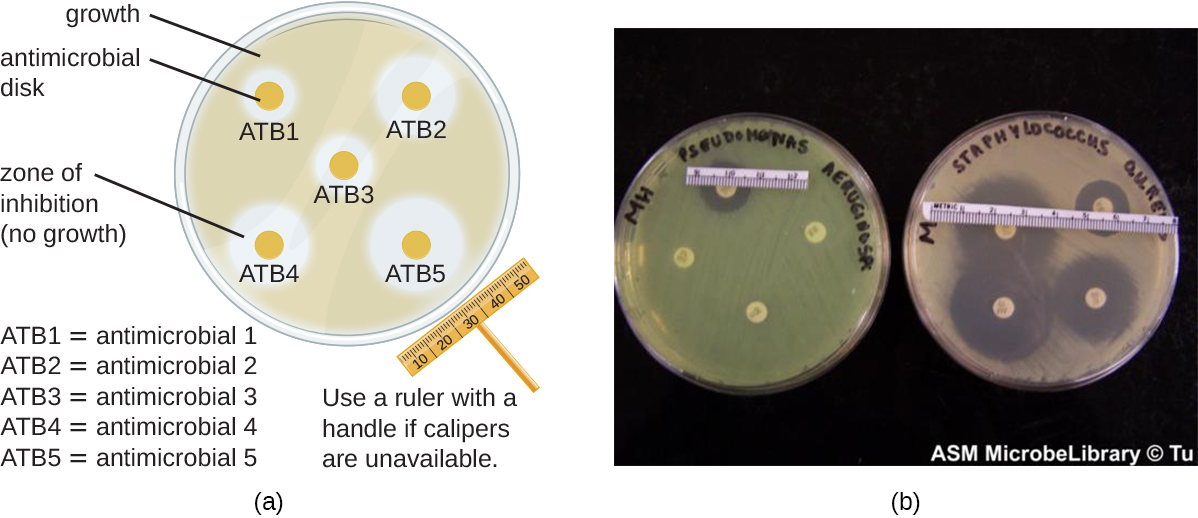
תרגיל \(\PageIndex{2}\)
כאשר משווים את הפעילות של שני חומרי חיטוי כנגד אותו חיידק, תוך שימוש במבחן דיפוזיה של הדיסק, ובהנחה ששניהם מסיסים במים ויכולים להתפזר בקלות באגר, האם לחומר חיטוי יעיל יותר יהיה אזור עיכוב גדול יותר או קטן יותר?
בדיקת דילול שימוש
שיטות אחרות משמשות גם למדידת יעילותו של חומר כימי במסגרות קליניות. בדיקת דילול השימוש משמשת בדרך כלל לקביעת יעילות החיטוי של כימיקל על משטח דומם. לבדיקה זו טובלים גליל נירוסטה בתרבית של המיקרואורגניזם הממוקד ואז מייבשים אותו. לאחר מכן טובלים את הגליל בתמיסות של חומר חיטוי בריכוזים שונים למשך זמן מוגדר. לבסוף, הצילינדר מועבר למבחנה חדשה המכילה מדיום סטרילי טרי שאינו מכיל חומר חיטוי, ומבחנה זו מודגרת. הישרדות חיידקים מודגמת על ידי נוכחות של עכירות במדיום, בעוד שהרג של אורגניזם המטרה על הגליל על ידי חומר החיטוי לא יפיק עכירות.
איגוד הכימאים החקלאיים הרשמיים הבינלאומי (AOAC), קבוצה ללא מטרות רווח הקובעת תקני פרוטוקול רבים, קבעה כי מינימום של 59 מתוך 60 שכפולים אינם חייבים להראות צמיחה בבדיקה כזו כדי להשיג תוצאה חולפת, והתוצאות חייבות להיות ניתנות לחזרה מקבוצות שונות של חומר חיטוי וכאשר הן מבוצעות בימים שונים. יצרני חיטוי מבצעים בדיקות דילול שימוש כדי לאמת את טענות היעילות למוצריהם, כפי שנקבעו על ידי ה- EPA.
תרגיל \(\PageIndex{3}\)
האם בדיקת דילול השימוש מבוצעת במסגרת קלינית? למה?
מבחן בשימוש
בדיקה בשימוש יכולה לקבוע אם פתרון פעיל של חומר חיטוי בסביבה קלינית מזוהם מבחינה מיקרוביאלית (איור). \(\PageIndex{2}\) דגימה של 1 מ"ל של חומר החיטוי המשומש מדוללת ל-9 מ"ל של מדיום מרק סטרילי המכיל גם תרכובת להשבתת חומר החיטוי. עשר טיפות, בהיקף של כ-0.2 מ"ל מתערובת זו, מחוסנות לאחר מכן על כל אחת משתי צלחות אגר. צלחת אחת מודגרת ב-37 מעלות צלזיוס למשך 3 ימים והשנייה מודגרת בטמפרטורת החדר למשך 7 ימים. הלוחות מנוטרים לצמיחה של מושבות מיקרוביאליות. גידול של חמש מושבות או יותר בכל אחת מהצלחות מצביע על כך שתאים מיקרוביאליים ברי קיימא היו קיימים בתמיסת החיטוי וכי היא מזוהמת. בדיקות כאלה בשימוש עוקבות אחר יעילותם של חומרי חיטוי במסגרת הקלינית.
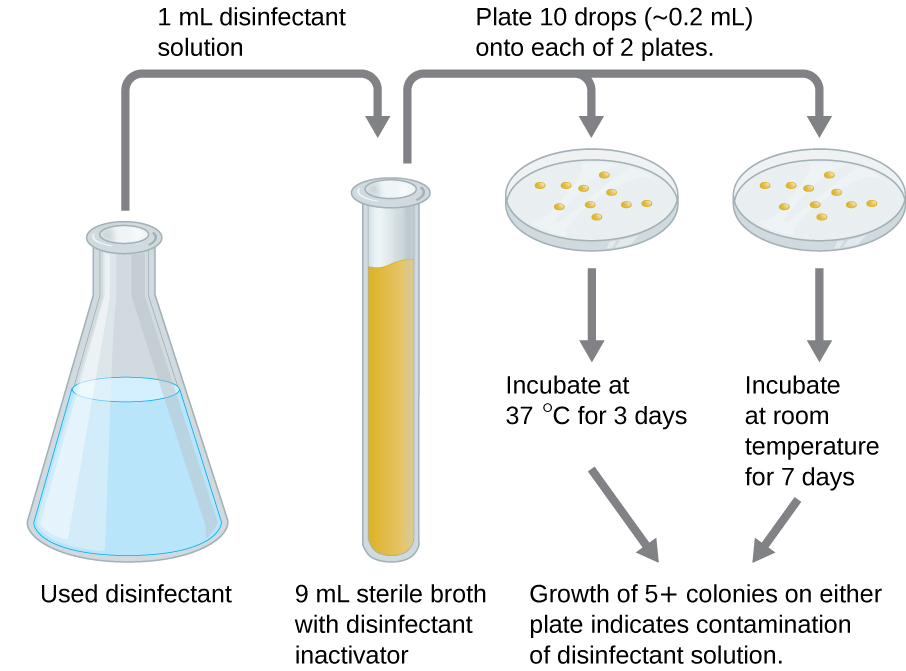
תרגיל \(\PageIndex{4}\)
מה מצביע על בדיקה חיובית בשימוש?
מיקוד קליני: רזולוציה
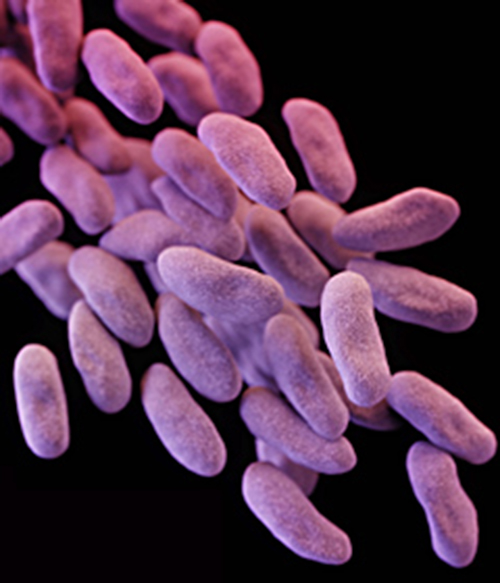
למרות הטיפול האנטיביוטי, הסימפטומים של רוברטה החמירו. היא פיתחה pyelonephritis, דלקת כליות חמורה, ואושפזה מחדש ביחידה לטיפול נמרץ (ICU). מצבה המשיך להידרדר, והיא פיתחה תסמינים של הלם ספיגה. בשלב זה, הרופא שלה הורה על תרבית מהשתן שלה כדי לקבוע את הגורם המדויק לזיהום שלה, כמו גם בדיקת רגישות לתרופות כדי לקבוע איזו אנטיביוטיקה תהיה יעילה נגד החיידק הסיבתי. תוצאות בדיקה זו הצביעו על עמידות למגוון רחב של אנטיביוטיקה, כולל carbapenems, סוג של אנטיביוטיקה המשמשים כמוצא אחרון לסוגים רבים של זיהומים חיידקיים. זו הייתה תוצאה מדאיגה, דבר המצביע על כך שהזיהום של רוברטה נגרם על ידי מה שנקרא superbug: זן חיידקי שפיתח עמידות לרוב האנטיביוטיקה הנפוצה. במקרה זה, הגורם הסיבתי השתייך ל-Enterobacteriaceae העמיד לקרבפנם (CRE), משפחה עמידה לתרופות של חיידקים הנמצאים בדרך כלל במערכת העיכול (איור). \(\PageIndex{3}\) כאשר CRE מוצג למערכות גוף אחרות, כפי שעלול להתרחש באמצעות מכשירים כירורגיים מנוקים בצורה לא נכונה, צנתרים או אנדוסקופים, עלולים להופיע זיהומים אגרסיביים.
ידוע לשמצה שקשה לטפל בזיהומי CRE, עם שיעור תמותה של 40% — 50%. כדי לטפל בזיהום הכליות שלה ובהלם ספיגה, רוברטה טופלה בדיאליזה, נוזלים תוך ורידיים ותרופות לשמירה על לחץ הדם ומניעת קרישת דם. היא החלה גם בטיפול אגרסיבי במתן תוך ורידי של תרופה חדשה בשם טיגציקלין, שהצליחה בטיפול בזיהומים הנגרמים על ידי חיידקים עמידים לתרופות.
לאחר מספר שבועות בטיפול נמרץ, רוברטה התאוששה מזיהום CRE שלה. עם זאת, עד מהרה הבחינו גורמי בריאות הציבור כי המקרה של רוברטה אינו מבודד. מספר חולים שעברו הליכים דומים באותו בית חולים פיתחו גם זיהומי CRE, חלקם מתו כתוצאה מכך. בסופו של דבר, מקור הזיהום נמצא בתריסריון המשמש בהליכים. למרות שצוות בית החולים עקב בקפידה אחר פרוטוקולי היצרן לחיטוי, חיידקים, כולל CRE, נותרו בתוך המכשירים והוכנסו לחולים במהלך ההליכים.
מי אחראי?
זיהומי Enterobacteriaceae עמידים לקרבפנם עקב אנדוסקופים מזוהמים הפכו לבעיה בעלת פרופיל גבוה בשנים האחרונות. מספר התפרצויות CRE נמצאו לאנדוסקופים, כולל מקרה במרכז הרפואי רונלד רייגן UCLA בתחילת 2015 בו 179 חולים נחשפו לאנדוסקופ מזוהם. שבעה מהחולים פיתחו זיהומים, ושניים מתו לאחר מכן. מספר תביעות הוגשו נגד אולימפוס, יצרנית האנדוסקופים. יש הטוענים כי אולימפוס לא קיבלה את אישור ה- FDA לשינויי תכנון שעלולים להוביל לזיהום, ואחרים טוענים כי היצרן מנע ביודעין מידע מבתי חולים בנוגע לפגמים באנדוסקופים.
תביעות כמו אלה מעלות שאלות קשות לענות על אחריות. הליכים פולשניים הם מסוכנים מטבעם, אך ניתן למזער תוצאות שליליות על ידי הקפדה על פרוטוקולים מבוססים. מי אחראי, לעומת זאת, כאשר תוצאות שליליות מתרחשות עקב פרוטוקולים פגומים או ציוד פגום? האם בתי חולים או עובדי בריאות יכולים להיות אחראים אם הם פעלו בקפידה על הליך פגום? האם יש להחזיק את היצרנים בחיים - ואולי לגרש אותם מהעסק - אם ציוד הצלת החיים שלהם נכשל או שנמצא פגום? מה תפקידה של הממשלה להבטיח כי השימוש והתחזוקה של ציוד רפואי ופרוטוקולים אינם בטוחים?
פרוטוקולים לניקוי או עיקור ציוד רפואי מפותחים לרוב על ידי סוכנויות ממשלתיות כמו ה- FDA וקבוצות אחרות, כמו AOAC, ארגון מדעי ללא מטרות רווח הקובע פרוטוקולים רבים לשימוש סטנדרטי ברחבי העולם. נהלים ופרוטוקולים אלה מאומצים לאחר מכן על ידי יצרני מכשור רפואי וציוד. בסופו של דבר, משתמשי הקצה (בתי חולים וצוותם) אחראים לביצוע הליכים אלה ויכולים לשאת באחריות אם מתרחשת הפרה וחולים חולים מציוד מנוקה שלא כהלכה.
למרבה הצער, פרוטוקולים אינם ניתנים לטעות, ולפעמים נדרשות תוצאות שליליות כדי לחשוף את הפגמים שלהם. בשנת 2008 אישר ה- FDA פרוטוקול חיטוי לאנדוסקופים, באמצעות גלוטאראלדהיד (בריכוז נמוך יותר כאשר מעורבב עם פנול), o-phthalaldehyde, מי חמצן, חומצה peracetic, ותערובת של מי חמצן עם חומצה peracetic. עם זאת, התפרצויות CRE שלאחר מכן משימוש באנדוסקופ הראו כי פרוטוקול זה לבדו אינו מספיק.
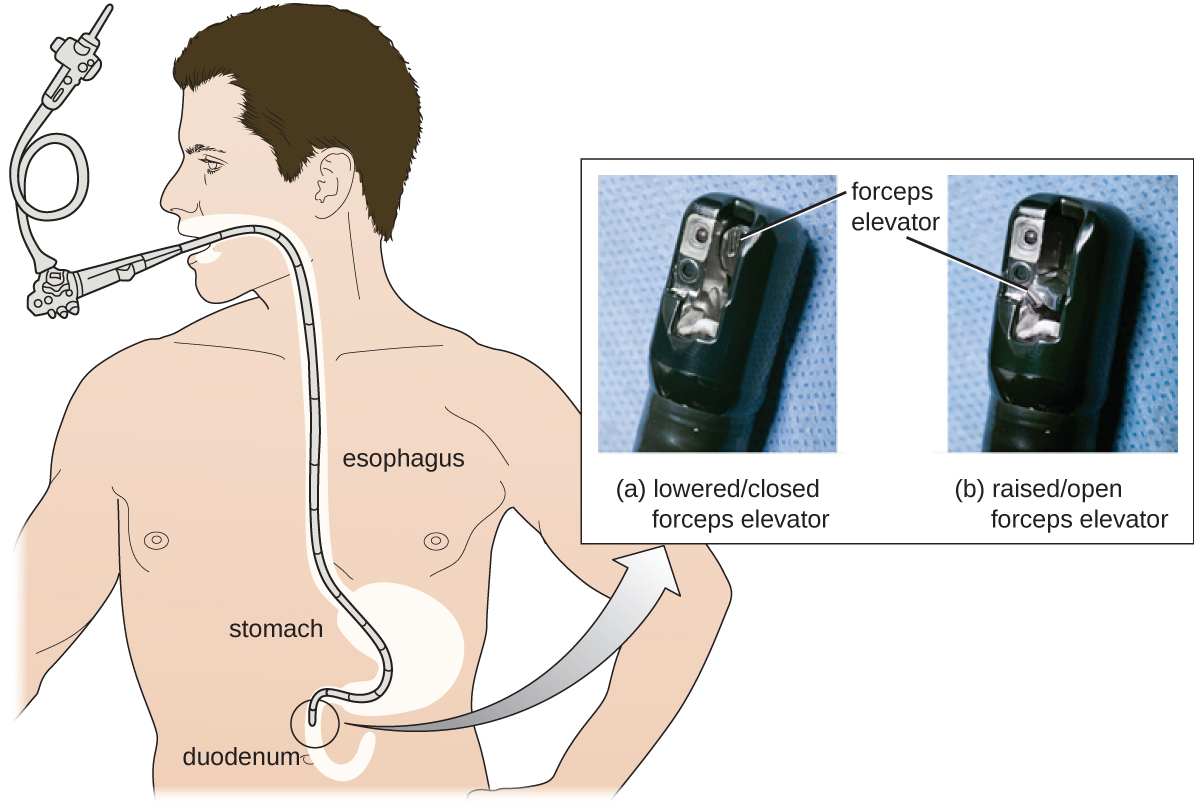
כתוצאה מהתפרצויות CRE, בתי חולים, יצרנים ו- FDA חוקרים פתרונות. בתי חולים רבים נוקטים הליכי ניקיון קפדניים יותר מאלה שנקבעו על ידי ה- FDA. היצרנים מחפשים דרכים לעצב מחדש תריסריון כדי למזער נקיקים שקשה להגיע אליהם בהם חיידקים יכולים להימלט מחומרי חיטוי, וה- FDA מעדכן את הפרוטוקולים שלו. בפברואר 2015 הוסיף ה- FDA המלצות חדשות לניקוי ידיים זהיר של מנגנון מעלית התריסריון (המיקום שבו סביר להניח שחיידקים יברחו מחיטוי), והוציא תיעוד מדוקדק יותר לגבי בקרת איכות של פרוטוקולי חיטוי (איור\(\PageIndex{4}\)).
אין ערובה לכך שפרוצדורות, פרוטוקולים או ציוד חדשים יבטלו לחלוטין את הסיכון לזיהום הקשור לאנדוסקופים. עם זאת, מכשירים אלה משמשים בהצלחה ב 500,000-650,000 נהלים מדי שנה בארצות הברית, רבים מהם מצילי חיים. באיזו נקודה הסיכונים עולים על היתרונות של מכשירים אלה, ומי צריך להיות אחראי כאשר מתרחשות תוצאות שליליות?
מושגי מפתח וסיכום
- חומרי חיטוי כימיים מקובצים לפי סוגי החיידקים וחומרים זיהומיים שהם יעילים נגדם. קוטלי חיידקים ברמה גבוהה הורגים תאים צמחיים, פטריות, וירוסים ואנדוספורים, ובסופו של דבר יכולים להוביל לעיקור. קוטלי חיידקים ברמה בינונית אינם יכולים להרוג את כל הנגיפים והם פחות יעילים נגד אנדוספורים. קוטלי חיידקים ברמה נמוכה הורגים תאים צמחיים וכמה וירוסים עטופים, אך אינם יעילים נגד אנדוספורים.
- יעילותו של חומר חיטוי מושפעת ממספר גורמים, כולל אורך החשיפה, ריכוז חומר החיטוי, הטמפרטורה וה- pH.
- מבחינה היסטורית, היעילות של חומר חיטוי כימי הושוותה לזו של פנול בהריגת סטפילוקוקוס אאורוס ו סלמונלה אנטריקה serovar Typhi, וחושב מקדם פנול.
- שיטת דיפוזיה הדיסק משמשת לבדיקת יעילותו של חומר חיטוי כימי כנגד חיידק מסוים.
- בדיקת דילול השימוש קובעת את יעילותו של חומר חיטוי על משטח. בדיקות בשימוש יכולות לקבוע אם נעשה שימוש נכון בתמיסות חיטוי במסגרות קליניות.


