11.5: מוטציות
- Page ID
- 208876
מטרות למידה
- השווה מוטציות נקודתיות ומוטציות של שינוי מסגרת
- תאר את ההבדלים בין missense, שטויות ומוטציות שקטות
- תאר את ההבדלים בין תיקון אור לחושך
- הסבירו כיצד פועלים מוטגנים שונים
- הסבר מדוע ניתן להשתמש במבחן איימס לאיתור חומרים מסרטנים
- לנתח רצפי DNA ולזהות דוגמאות לסוגי מוטציות
מוטציה היא שינוי תורשתי ברצף ה-DNA של אורגניזם. לאורגניזם המתקבל, הנקרא מוטציה, עשוי להיות שינוי ניכר בפנוטיפ בהשוואה לסוג הבר, שהוא הפנוטיפ הנפוץ ביותר בטבע. שינוי ברצף ה-DNA מוענק ל-mRNA באמצעות שעתוק, ועלול להוביל לשינוי רצף חומצות אמינו בחלבון בתרגום. מכיוון שחלבונים מבצעים את הרוב המכריע של התפקודים התאיים, שינוי ברצף חומצות האמינו בחלבון עשוי להוביל לשינוי פנוטיפ לתא ולאורגניזם.
השפעות המוטציות על רצף ה- DNA
ישנם מספר סוגים של מוטציות המסווגות לפי אופן שינוי מולקולת ה- DNA. סוג אחד, הנקרא מוטציה נקודתית, משפיע על בסיס בודד ומתרחש לרוב כאשר בסיס אחד מוחלף או מוחלף באחר. מוטציות נובעות גם מהוספת בסיס אחד או יותר, המכונה הכנסה, או הסרת בסיס אחד או יותר, המכונה מחיקה.
תרגיל \(\PageIndex{1}\)
איזה סוג של מוטציה מתרחשת כאשר לגן יש שני נוקלאוטידים פחות ברצף שלו?
השפעות המוטציות על מבנה ותפקוד החלבון
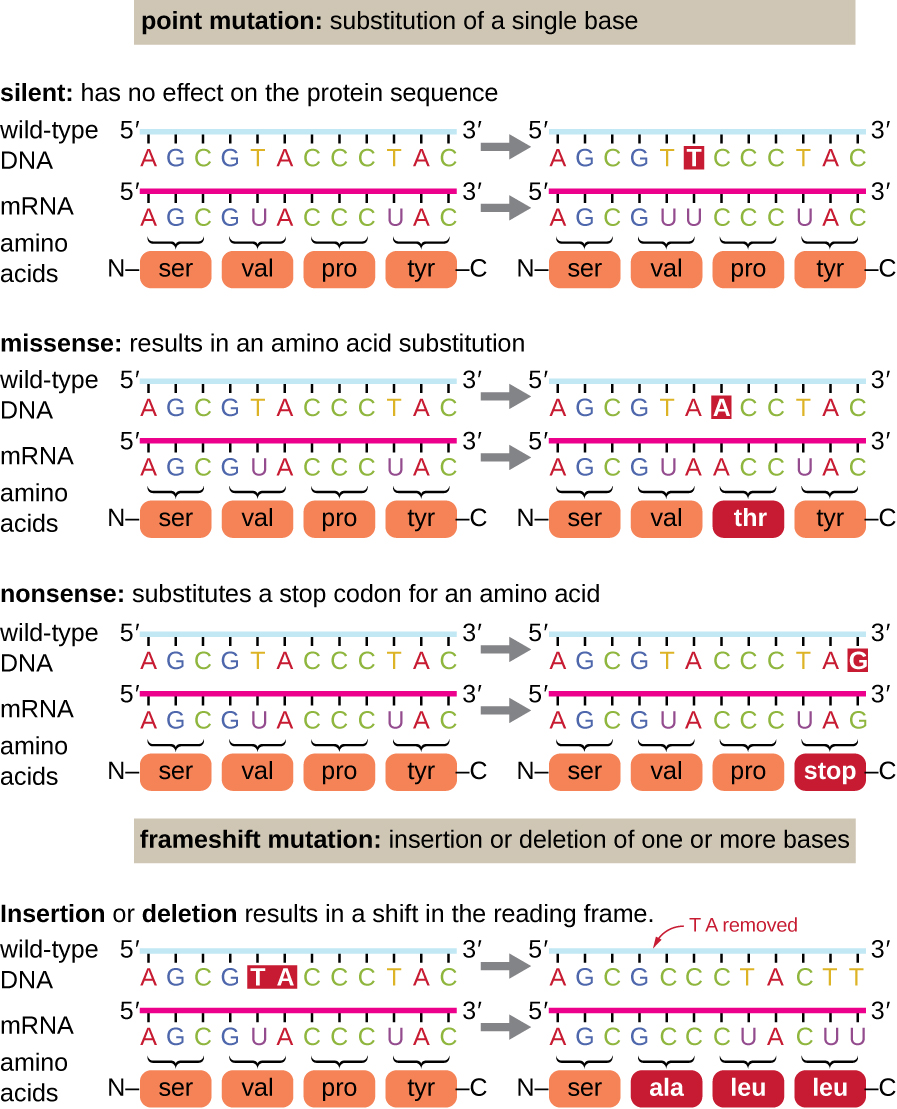
למוטציות נקודתיות עשויות להיות מגוון רחב של השפעות על תפקוד החלבון (איור\(\PageIndex{1}\)). כתוצאה מהניוון של הקוד הגנטי, מוטציה נקודתית תגרום בדרך כלל לשילוב אותה חומצת אמינו בפוליפפטיד שנוצר למרות שינוי הרצף. לשינוי זה לא תהיה השפעה על מבנה החלבון, ולכן הוא נקרא מוטציה שקטה. מוטציה של missense גורמת לשילוב חומצת אמינו אחרת בפוליפפטיד שנוצר. ההשפעה של מוטציית missense תלויה עד כמה חומצת האמינו החדשה שונה מבחינה כימית מחומצת האמינו מסוג הבר. המיקום של חומצת האמינו שהשתנתה בתוך החלבון הוא גם חשוב. לדוגמה, אם חומצת האמינו שהשתנתה היא חלק מהאתר הפעיל של האנזים, אז ההשפעה של מוטציית missense עשויה להיות משמעותית. מוטציות רבות של missense גורמות לחלבונים שעדיין מתפקדים, לפחות במידה מסוימת. לפעמים ההשפעות של מוטציות missense עשויות להיות ניכרות רק בתנאים סביבתיים מסוימים; מוטציות missense כאלה נקראות מוטציות מותנות. לעיתים רחוקות, מוטציה של missense עשויה להועיל. בתנאים הסביבתיים הנכונים, מוטציה מסוג זה עשויה להעניק לאורגניזם המחזיק בו יתרון סלקטיבי. סוג אחר של מוטציה נקודתית, הנקראת מוטציה שטויות, ממיר קודון המקודד לחומצת אמינו (קודון חוש) לקודון עצירה (קודון שטויות). מוטציות שטויות גורמות לסינתזה של חלבונים קצרים יותר מהסוג הבר ובדרך כלל אינם מתפקדים.
מחיקות והוספות גורמות גם להשפעות שונות. מכיוון שקודונים הם שלישיות של נוקלאוטידים, הוספות או מחיקות בקבוצות של שלושה נוקלאוטידים עלולות להוביל להחדרה או למחיקה של חומצת אמינו אחת או יותר ועלולות שלא לגרום להשפעות משמעותיות על תפקוד החלבון המתקבל. עם זאת, מוטציות של שינוי מסגרת, הנגרמות על ידי הוספות או מחיקות של מספר נוקלאוטידים שאינם מכפיל של שלושה, הן בעייתיות ביותר מכיוון ששינוי במסגרת הקריאה נוצר (איור). \(\PageIndex{1}\) מכיוון שריבוזומים קוראים את ה- mRNA בקודונים משולשים, מוטציות של שינוי מסגרת יכולות לשנות כל חומצת אמינו לאחר נקודת המוטציה. מסגרת הקריאה החדשה עשויה לכלול גם קודון עצירה לפני סוף רצף הקידוד. כתוצאה מכך, חלבונים העשויים מגנים המכילים מוטציות של שינוי מסגרת כמעט תמיד אינם מתפקדים.
תרגיל \(\PageIndex{2}\)
- מהן הסיבות לכך שלשינוי נוקלאוטיד בגן לחלבון לא תהיה השפעה כלשהי על הפנוטיפ של הגן הזה?
- האם ניתן להכניס שלושה נוקלאוטידים יחד לאחר הנוקלאוטיד החמישי בגן המקודד חלבון לייצר חלבון קצר מהרגיל? איך או איך לא?
מוטציה מועילה
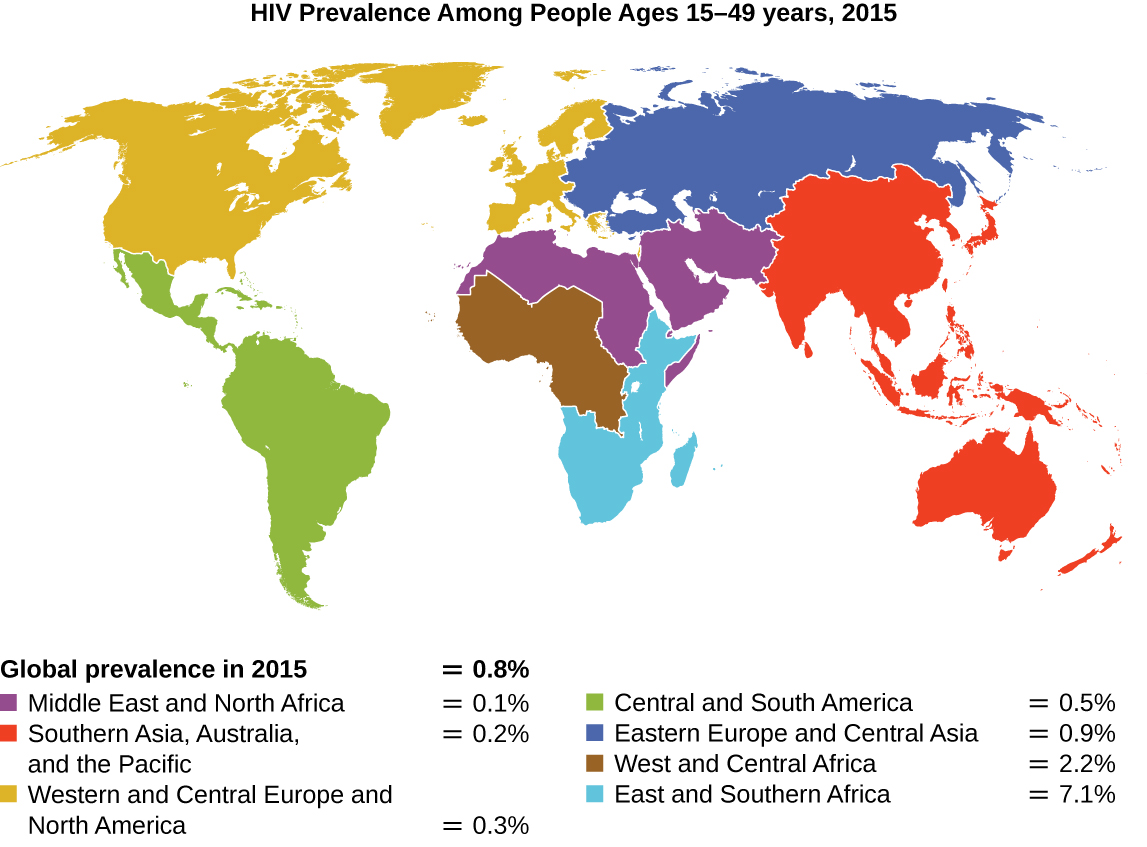
מאז דווח על המקרה הראשון של זיהום בנגיף הכשל החיסוני האנושי (HIV) בשנת 1981, כמעט 40 מיליון בני אדם מתו מהידבקות ב- HIV, 1 הנגיף הגורם לתסמונת הכשל החיסוני הנרכש (איידס). הנגיף מכוון לתאי T עוזרים הממלאים תפקיד מפתח בגישור התגובה החיסונית המולדת והסתגלנית, הדבקה והרג תאים המעורבים בדרך כלל בתגובת הגוף לזיהום. אין תרופה לזיהום ב- HIV, אך תרופות רבות פותחו כדי להאט או לחסום את התקדמות הנגיף. למרות שאנשים ברחבי העולם עלולים להידבק, השכיחות הגבוהה ביותר בקרב אנשים בגילאי 15-49 היא באפריקה שמדרום לסהרה, שם נדבק כמעט אדם אחד מכל 20, המהווה יותר מ -70% מהזיהומים ברחבי העולם 2 (איור). \(\PageIndex{2}\) למרבה הצער, זהו גם חלק מהעולם בו אסטרטגיות מניעה ותרופות לטיפול בזיהום הן החסרות ביותר.
בשנים האחרונות, עניין מדעי כבר עורר על ידי גילוי של כמה אנשים מצפון אירופה אשר עמידים לזיהום HIV. בשנת 1998 פרסמו הגנטיקאי האמריקני סטיבן ג'יי אובראיין במכון הלאומי לבריאות (NIH) ועמיתיו את תוצאות הניתוח הגנטי שלהם של יותר מ -4,000 פרטים. אלה הצביעו על כך שלאנשים רבים ממוצא אירואסיאני (עד 14% בקבוצות אתניות מסוימות) יש מוטציית מחיקה, הנקראת CCR5-delta 32, בגן המקודד ל- CCR5. CCR5 הוא קולטן שנמצא על פני השטח של תאי T הדרוש לזנים רבים של הנגיף להיכנס לתא המארח. המוטציה מובילה לייצור קולטן שאליו HIV אינו יכול להיקשר ביעילות ובכך חוסם כניסה ויראלית. אנשים הומוזיגוטים למוטציה זו הפחיתו מאוד את הרגישות לזיהום ב-HIV, ולאלו שהם הטרוזיגוטים יש הגנה מסוימת גם מפני זיהום.
לא ברור מדוע אנשים ממוצא צפון אירופי, במיוחד, נושאים מוטציה זו, אך נראה כי שכיחותה היא הגבוהה ביותר בצפון אירופה ויורדת בהתמדה באוכלוסיות ככל שעוברים דרומה. מחקרים מצביעים על כך שהמוטציה קיימת עוד לפני הופעת HIV וייתכן שנבחרה באוכלוסיות אירופאיות כתוצאה מחשיפה למגפה או לאבעבועות שחורות. מוטציה זו עשויה להגן על אנשים מפני מגיפה (הנגרמת על ידי החיידק Yersinia pestis) ואבעבועות שחורות (הנגרמות על ידי נגיף הווריולה) מכיוון שקולטן זה עשוי להיות מעורב גם במחלות אלה. גיל המוטציה הזו הוא נושא לוויכוח, אך ההערכות מצביעות על כך שהיא הופיעה בין 1875 שנים ל -225 שנה, וייתכן שהתפשטה מצפון אירופה באמצעות פלישות ויקינגיות.
ממצא מרגש זה הוביל לאפיקים חדשים במחקר HIV, כולל חיפוש תרופות לחסימת קישור CCR5 ל- HIV אצל אנשים חסרי המוטציה. למרות שבדיקת DNA כדי לקבוע אילו אנשים נושאים את המוטציה CCR5-delta 32 אפשרית, ישנם מקרים מתועדים של אנשים הומוזיגוטים למוטציה הנדבקת ב-HIV. מסיבה זו, בדיקות DNA למוטציה אינן מומלצות באופן נרחב על ידי גורמי בריאות הציבור כדי לא לעודד התנהגות מסוכנת אצל אלו הנושאים את המוטציה. עם זאת, עיכוב הקישור של HIV ל- CCR5 ממשיך להיות אסטרטגיה תקפה לפיתוח טיפולים תרופתיים לאנשים הנגועים ב- HIV.
גורם למוטציות
טעויות בתהליך שכפול ה- DNA עלולות לגרום להתרחשות מוטציות ספונטניות. שיעור השגיאות של DNA פולימראז הוא בסיס שגוי אחד למיליארד זוגות בסיסים משוכפלים. חשיפה למוטגנים עלולה לגרום למוטציות המושרות, שהן סוגים שונים של חומרים כימיים או קרינה (טבלה\(\PageIndex{1}\)). חשיפה למוטגן יכולה להגביר את קצב המוטציה יותר מפי 1000. מוטגנים הם לרוב גם מסרטנים, חומרים הגורמים לסרטן. עם זאת, בעוד שכמעט כל החומרים המסרטנים הם מוטגנים, לא כל המוטגנים הם בהכרח מסרטנים.
מוטגנים כימיים
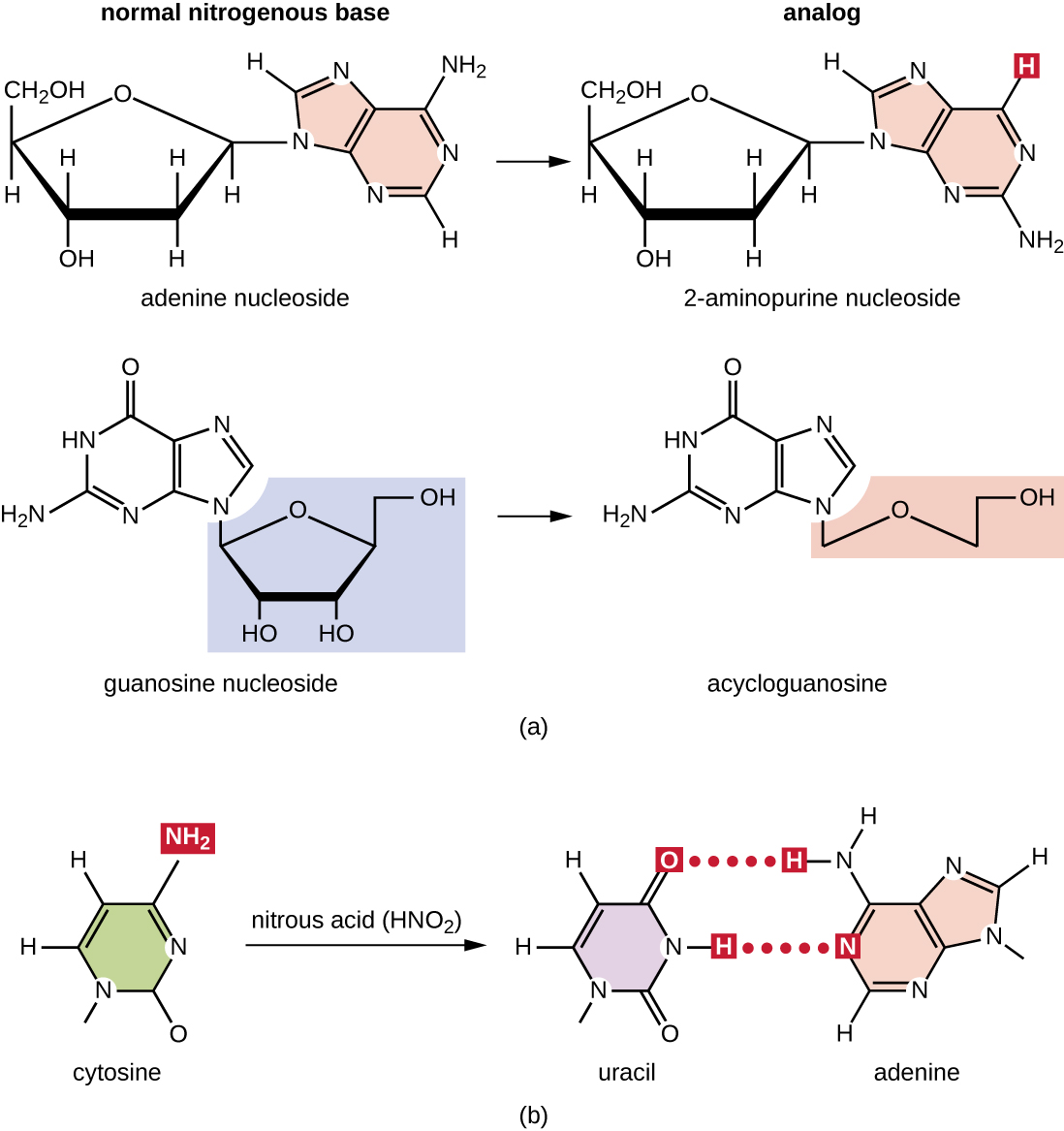
סוגים שונים של מוטגנים כימיים מקיימים אינטראקציה ישירה עם DNA על ידי פעולה כאנלוגים של נוקלאוזידים או על ידי שינוי בסיסי נוקלאוטידים. כימיקלים הנקראים אנלוגים נוקלאוזידים דומים מבחינה מבנית לבסיסי נוקלאוטידים רגילים וניתן לשלב אותם ב-DNA במהלך השכפול (איור\(\PageIndex{3}\)). אנלוגים בסיסיים אלה מעוררים מוטציות מכיוון שלעתים קרובות יש להם כללי זיווג בסיסים שונים מהבסיסים שהם מחליפים. מוטגנים כימיים אחרים יכולים לשנות בסיסי DNA רגילים, וכתוצאה מכך כללי זיווג בסיסים שונים. לדוגמה, חומצה חנקתית מדכאת ציטוסין, וממירה אותו לאורציל. לאחר מכן אורציל מזדווג עם אדנין בסבב שכפול שלאחר מכן, וכתוצאה מכך המרה של זוג בסיסים GC לזוג בסיסים AT. חומצה חנקתית גם משחררת אדנין להיפוקסנטין, שמבסס מזווג עם ציטוסין במקום תימין, וכתוצאה מכך המרה של זוג בסיסים TA לזוג בסיסים CG.
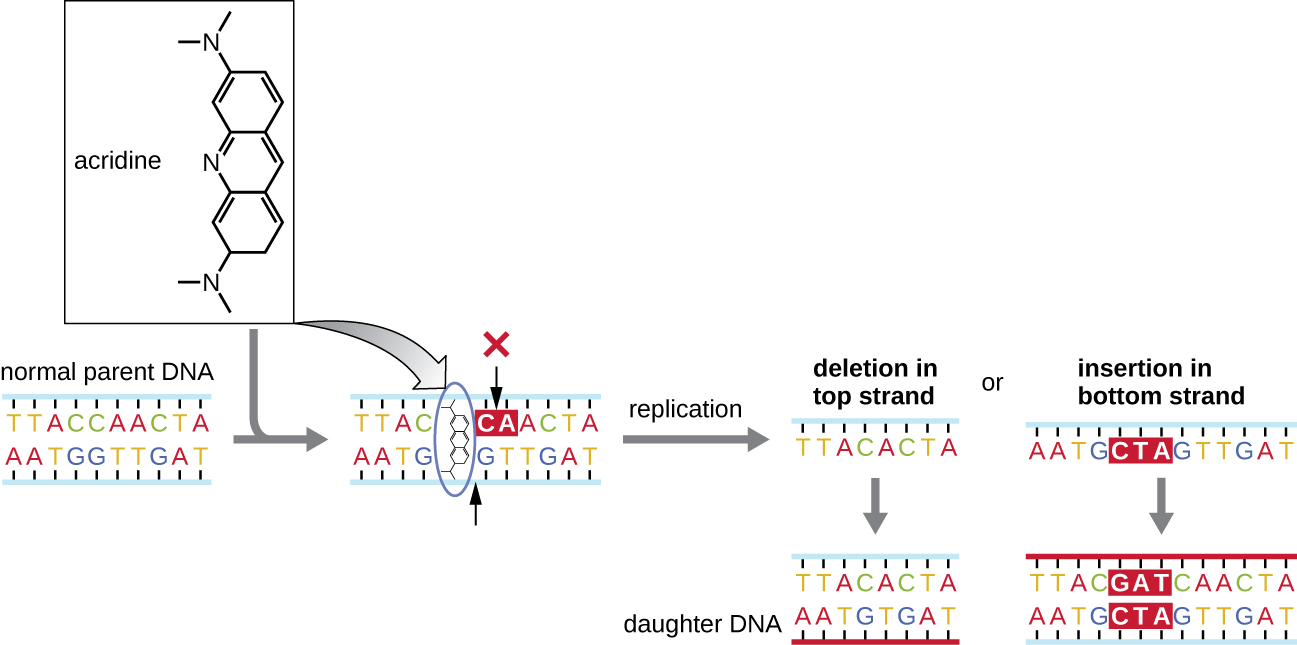
מוטגנים כימיים הידועים כסוכני אינטרקלציה פועלים בצורה שונה. מולקולות אלו מחליקות בין הבסיסים החנקניים המוערמים של הסליל הכפול של ה-DNA, מעוותות את המולקולה ויוצרות מרווח לא טיפוסי בין זוגות בסיסים נוקלאוטידים (איור\(\PageIndex{4}\)). כתוצאה מכך, במהלך שכפול ה-DNA, DNA פולימראז עשוי לדלג על שכפול של מספר נוקלאוטידים (יצירת מחיקה) או להכניס נוקלאוטידים נוספים (יצירת החדרה). כל אחת מהתוצאות עלולה להוביל למוטציה של שינוי מסגרת. מוצרי בעירה כמו פחמימנים ארומטיים פוליציקליים הם חומרים מסוכנים במיוחד שיכולים להוביל לסרטן הנגרם על ידי מוטציה. סוכני הביניים אתידיום ברומיד ותפוז אקרידין משמשים בדרך כלל במעבדה כדי להכתים DNA להדמיה והם מוטגנים פוטנציאליים.
קרינה
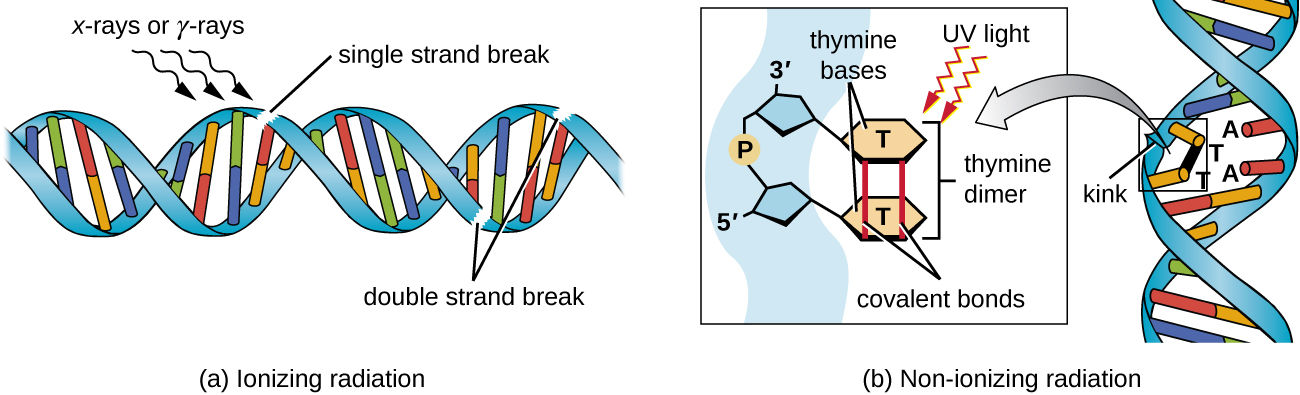
חשיפה לקרינה מייננת או לא יוניונית יכולה לגרום כל אחת למוטציות ב-DNA, אם כי על ידי מנגנונים שונים. קרינה מייננת חזקה כמו קרני רנטגן וקרני גמא עלולה לגרום לשבירות חד-גדיליות ודו-גדיליות בעמוד השדרה של ה-DNA באמצעות היווצרות רדיקלי הידרוקסיל בחשיפה לקרינה (איור). \(\PageIndex{5}\) קרינה מייננת יכולה גם לשנות בסיסים; לדוגמה, דימינציה של ציטוסין לאורציל, מקבילה לפעולה של חומצה חנקנית. 3 חשיפה לקרינה מייננת משמשת להרוג חיידקים לעיקור מכשירים רפואיים ומזונות, בגלל השפעתה הדרמטית הלא ספציפית בפגיעה ב- DNA, חלבונים ורכיבים תאיים אחרים (ראה שימוש בשיטות פיזיות לשליטה במיקרואורגניזמים).
קרינה לא יוניונית, כמו אור אולטרה סגול, אינה אנרגטית מספיק כדי ליזום שינויים כימיים מסוג זה. עם זאת, קרינה לא יוניונית יכולה לגרום להיווצרות דימר בין שני בסיסי פירימידין סמוכים, בדרך כלל שני תימינים, בתוך גדיל נוקלאוטיד. במהלך היווצרות דימר תימין, שני התימינים הסמוכים מקושרים קוולנטית, ואם הם לא מתוקנים, גם שכפול ה-DNA וגם התעתיק נעצרים בשלב זה. פולימראז DNA עשוי להתקדם ולשכפל את הדימר בצורה לא נכונה, מה שעלול להוביל לשינוי מסגרת או מוטציות נקודתיות.
| סוכנים מוטגניים | מצב פעולה | השפעה על ה- DNA | סוג המוטציה המתקבל |
|---|---|---|---|
| אנלוגים של נוקלאוזיד | |||
| 2-אמינופורין | מוכנס במקום A אך זוגות בסיס עם C | ממיר AT לזוג בסיס GC | נקודה |
| 5-ברומורציל | מוכנס במקום T אך זוגות בסיס עם G | ממיר AT לזוג בסיס GC | נקודה |
| סוכן שינוי נוקלאוטיד | |||
| תחמוצת החנקן | מסיר את C עד U | ממיר GC לזוג בסיס AT | נקודה |
| סוכני אינטרקלציה | |||
| תפוז אקרידין, אתידיום ברומיד, פחמימנים ארומטיים פוליציקליים | מעוות סליל כפול, יוצר מרווח יוצא דופן בין נוקלאוטידים | מציג מחיקות והוספות קטנות | שינוי מסגרת |
| קרינה מייננת | |||
| צילומי רנטגן, קרני γ | יוצר רדיקלים הידרוקסיל | גורם לשבירת DNA חד-גדילית וכפולה | מנגנוני תיקון עשויים להכניס מוטציות |
| צילומי רנטגן, קרני γ | משנה בסיסים (למשל, דימינציה של C עד U) | ממיר GC לזוג בסיס AT | נקודה |
| קרינה לא יוניונית | |||
| אולטרה סגול | יוצר דימרים פירמידין (בדרך כלל תימין) | גורם לשגיאות שכפול DNA | שינוי מסגרת או נקודה |
תרגיל \(\PageIndex{3}\)
- כיצד אנלוגי בסיס מציג מוטציה?
- כיצד גורם אינטרקלטיבי מציג מוטציה?
- איזה סוג של מוטגן גורם לדימרים של תימין?
תיקון DNA
תהליך שכפול ה- DNA מדויק ביותר, אך טעויות יכולות להתרחש באופן ספונטני או להיגרם על ידי מוטגנים. טעויות לא מתוקנות עלולות להוביל לתוצאות חמורות על הפנוטיפ. תאים פיתחו מספר מנגנוני תיקון כדי למזער את מספר המוטציות שנמשכות.
הגהה
רוב הטעויות שהוצגו במהלך שכפול ה- DNA מתוקנות באופן מיידי על ידי רוב פולימראזות ה- DNA באמצעות פונקציה הנקראת הגהה. בהגהה, ה-DNA פולימראז קורא את הבסיס החדש שנוסף, ומבטיח שהוא משלים לבסיס המתאים בגדיל התבנית לפני הוספת הבסיס הבא. אם נוסף בסיס שגוי, האנזים מבצע חתך כדי לשחרר את הנוקלאוטיד הלא נכון ומוסיפים בסיס חדש.
תיקון אי התאמה
כמה שגיאות שהוצגו במהלך השכפול מתוקנות זמן קצר לאחר העברת מכונות השכפול. מנגנון זה נקרא תיקון אי התאמה. האנזימים המעורבים במנגנון זה מזהים את הנוקלאוטיד שנוסף בצורה לא נכונה, מוציאים אותו ומחליפים אותו בבסיס הנכון. דוגמה אחת היא תיקון חוסר ההתאמה המכוון מתיל ב אי - קולי. ה- DNA הוא המימתיל. המשמעות היא שהגדיל ההורי מתילט בעוד גדיל הבת החדש שסונתז אינו. זה לוקח כמה דקות עד שהגדיל החדש מתיל. חלבונים MutS, MutL ו- MutH נקשרים לאתר ההמימתיל שבו נמצא הנוקלאוטיד השגוי. MutH חותך את הגדיל הלא מתיל (הגדיל החדש). אקסונוקלאז מסיר חלק מהגדיל (כולל הנוקלאוטיד הלא נכון). הפער שנוצר מתמלא לאחר מכן על ידי DNA pol III וליגאז.
תיקון דימרים של תימין
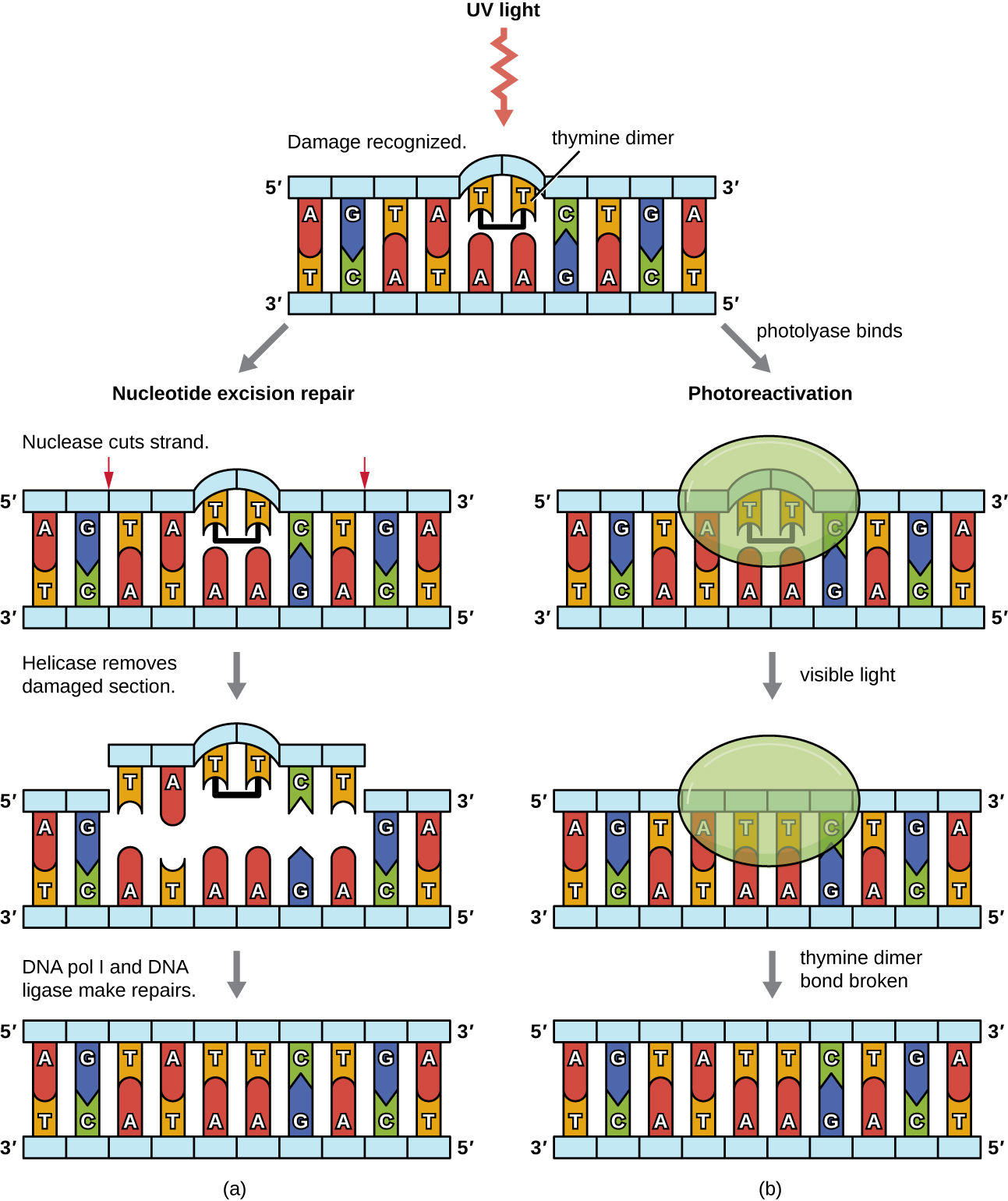
מכיוון שייצור דימרים של תימין נפוץ (אורגניזמים רבים אינם יכולים להימנע מאור אולטרה סגול), התפתחו מנגנונים לתיקון נגעים אלה. בתיקון כריתת נוקלאוטידים (נקרא גם תיקון כהה), אנזימים מסירים את דימר הפירימידין ומחליפים אותו בנוקלאוטידים הנכונים (איור). \(\PageIndex{6}\) ב אי - קולי, ה- DNA נסרק על ידי קומפלקס אנזים. אם נמצא עיוות בסליל הכפול שהוכנס על ידי דימר הפירימידין, קומפלקס האנזים חותך את עמוד השדרה של סוכר-פוספט מספר בסיסים במעלה הזרם ובמורד הזרם של הדימר, וקטע ה-DNA בין שני החתכים הללו מוסר אנזימטית. DNA pol I מחליף את הנוקלאוטידים החסרים בנוקלאוטידים הנכונים וליגאז DNA אוטם את הפער בעמוד השדרה של סוכר-פוספט.
התיקון הישיר (נקרא גם תיקון אור) של דימרים של תימין מתרחש בתהליך של הפעלת פוטו בנוכחות אור גלוי. אנזים הנקרא פוטוליאז מזהה את העיוות בסליל ה- DNA הנגרם על ידי דימר התימין ונקשר לדימר. לאחר מכן, בנוכחות אור גלוי, האנזים הפוטוליאז משנה את הקונפורמציה ומפרק את דימר התימין, ומאפשר לתימינים להתחבר שוב בצורה נכונה עם האדנינים על הגדיל המשלים. נראה כי פוטו-אקטיבציה קיימת בכל האורגניזמים, למעט יונקים שליה, כולל בני אדם. הפעלת פוטו חשובה במיוחד עבור אורגניזמים שנחשפים כרונית לקרינה אולטרה סגולה, כמו צמחים, חיידקים פוטוסינתטיים, אצות ואלמוגים, כדי למנוע הצטברות של מוטציות הנגרמות על ידי היווצרות דימר תימין.
תרגיל \(\PageIndex{4}\)
- במהלך תיקון חוסר התאמה, כיצד מזהה האנזים מהו החדש ומהו הגדיל הישן?
- איזה סוג של מוטציה מתקן פוטוליאז?
זיהוי מוטציות חיידקיות
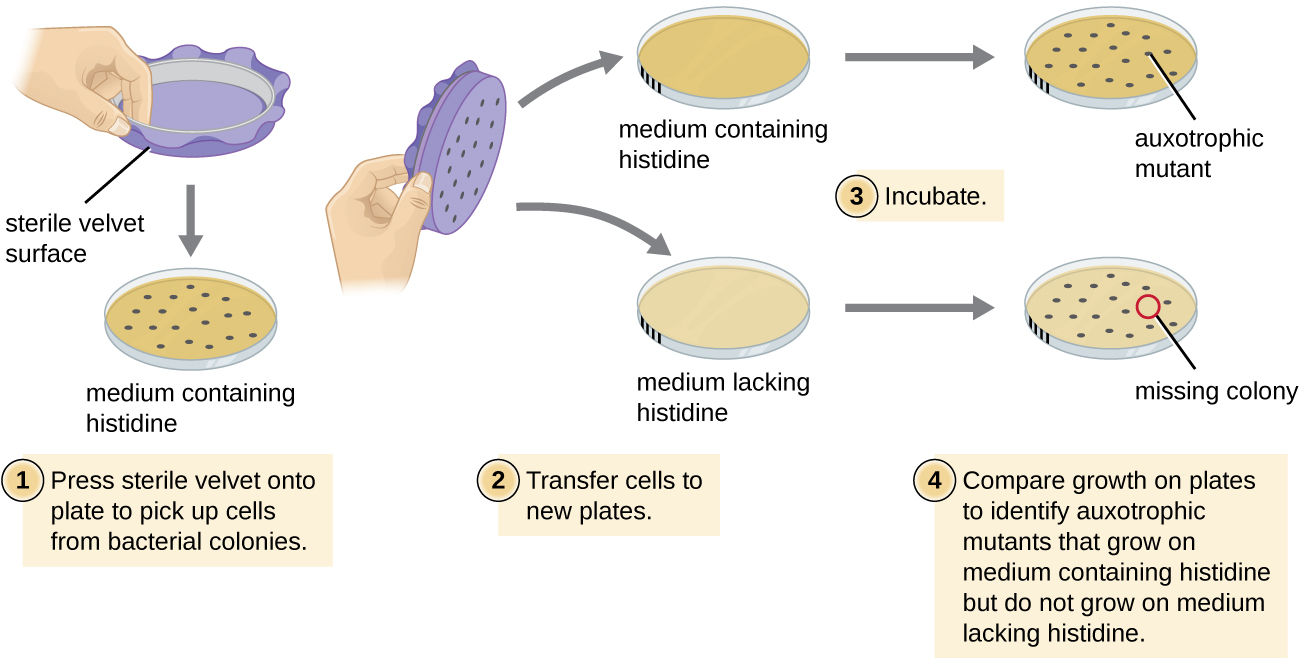
טכניקה נפוצה אחת המשמשת לזיהוי מוטציות חיידקיות נקראת ציפוי העתק. טכניקה זו משמשת לאיתור מוטציות תזונתיות, הנקראות אוקסוטרופים, שיש להן מוטציה בגן המקודד לאנזים במסלול הביוסינתזה של חומר מזין ספציפי, כגון חומצת אמינו. כתוצאה מכך, בעוד שתאים מסוג בר שומרים על היכולת לגדול כרגיל על מדיום חסר את החומר התזונתי הספציפי, האוקסוטרופים אינם מסוגלים לגדול על מדיום כזה. במהלך ציפוי העתק (איור\(\PageIndex{7}\)), אוכלוסיית תאים חיידקיים עוברת מוטציה ולאחר מכן מצופה כתאים בודדים בצלחת מורכבת שלמה מבחינה תזונתית ומאפשרת לגדול למושבות. תאים מהמושבות הללו מוסרים מצלחת מאסטר זו, לעתים קרובות באמצעות קטיפה סטרילית. קטיפה זו, המכילה תאים, נלחצת באותו כיוון על צלחות של מדיות שונות. לפחות צלחת אחת צריכה להיות שלמה מבחינה תזונתית כדי להבטיח שהתאים מועברים כראוי בין הצלחות. הלוחות האחרים חסרים חומרים מזינים ספציפיים, מה שמאפשר לחוקר לגלות מוטציות אוקסוטרופיות שונות שאינן מסוגלות לייצר חומרים מזינים ספציפיים. תאים מהמושבה המתאימה בצלחת השלמה מבחינה תזונתית יכולים לשמש כדי לשחזר את המוטנט למחקר נוסף.
תרגיל \(\PageIndex{5}\)
מדוע תאים מצופים על צלחת שלמה מבחינה תזונתית בנוסף לצלחות חסרות חומרים מזינים כאשר מחפשים מוטציה?
מבחן איימס
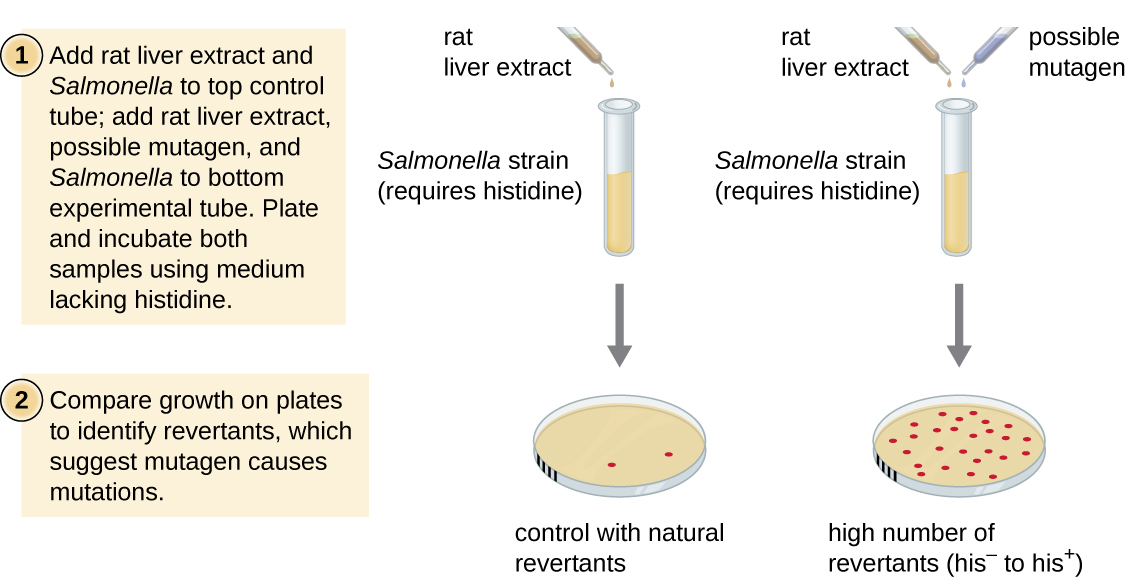
מבחן איימס, שפותח על ידי ברוס איימס (1928—) בשנות השבעים, הוא שיטה המשתמשת בחיידקים לצורך סינון מהיר וזול של הפוטנציאל המסרטן של תרכובות כימיות חדשות. הבדיקה מודדת את שיעור המוטציות הקשור לחשיפה לתרכובת, שאם הוא מוגבר עשוי להצביע על כך שחשיפה לתרכובת זו קשורה לסיכון גבוה יותר לסרטן. בדיקת איימס משתמשת כאורגניזם הבדיקה בזן של סלמונלה טיפימוריום שהוא אוקסוטרוף היסטידין, שאינו מסוגל לסנתז היסטידין משלו בגלל מוטציה בגן חיוני הנדרש לסינתזה שלו. לאחר חשיפה למוטגן פוטנציאלי, חיידקים אלה מצופים על מדיום חסר היסטידין, ומספר המוטציות המחזירות את היכולת לסנתז היסטידין נרשם ומשווה למספר מוטציות כאלה המתעוררות בהיעדר המוטגן הפוטנציאלי (איור). \(\PageIndex{8}\) כימיקלים שהם יותר מוטגניים יביאו ליותר מוטציות עם סינתזת היסטידין משוחזרת במבחן איימס. מכיוון שכימיקלים רבים אינם מוטגניים ישירות אלא עוברים חילוף חומרים לצורות מוטגניות על ידי אנזימי כבד, תמצית כבד חולדה נכללת בדרך כלל בתחילת ניסוי זה כדי לחקות את חילוף החומרים בכבד. לאחר ביצוע בדיקת איימס, תרכובות שזוהו כמוטגניות נבדקות עוד על תכונותיהן המסרטנות הפוטנציאליות באמצעות מודלים אחרים, כולל מודלים של בעלי חיים כמו עכברים וחולדות.
תרגיל \(\PageIndex{6}\)
- איזו מוטציה משמשת כאינדיקטור לשיעור המוטציות במבחן איימס?
- מדוע מבחן איימס יכול לעבוד כמבחן לסרטן?
מושגי מפתח וסיכום
- מוטציה היא שינוי תורשתי ב- DNA. מוטציה עשויה להוביל לשינוי ברצף חומצות האמינו של חלבון, ואולי להשפיע על תפקודו.
- מוטציה נקודתית משפיעה על זוג בסיסים בודד. מוטציה נקודתית עלולה לגרום למוטציה שקטה אם קודון ה-mRNA מקודד לאותה חומצת אמינו, מוטציה של missense אם קודון ה-mRNA מקודד לחומצת אמינו אחרת, או מוטציה שטויות אם קודון ה-mRNA הופך לקודון עצירה.
- מוטציות Missense עשויות לשמור על תפקוד, בהתאם לכימיה של חומצת האמינו החדשה ומיקומה בחלבון. מוטציות שטויות מייצרות חלבונים קטועים ולעתים קרובות לא מתפקדים.
- מוטציה של שינוי מסגרת נובעת מהחדרה או מחיקה של מספר נוקלאוטידים שאינם מכפיל של שלושה. השינוי במסגרת הקריאה משנה כל חומצת אמינו לאחר נקודת המוטציה ומביא לחלבון לא מתפקד.
- מוטציות ספונטניות מתרחשות באמצעות שגיאות שכפול DNA, ואילו מוטציות המושרות מתרחשות באמצעות חשיפה למוטגן.
- חומרים מוטגניים הם לעתים קרובות מסרטנים אך לא תמיד. עם זאת, כמעט כל החומרים המסרטנים הם מוטגניים.
- מוטגנים כימיים כוללים אנלוגים בסיסיים וכימיקלים המשנים בסיסים קיימים. בשני המקרים, מוטציות מוצגות לאחר מספר סבבים של שכפול DNA.
- קרינה מייננת, כגון צילומי רנטגן וקרני γ, מובילה לשבירה של עמוד השדרה הפוספודיסטר של ה-DNA ויכולה גם לשנות כימית בסיסים כדי לשנות את כללי זיווג הבסיסים שלהם.
- קרינה לא יוניונית כמו אור אולטרה סגול עשויה להכניס דימרים של פירמידין (תימין), אשר במהלך שכפול ותעתוק DNA עשויים להכניס שינוי מסגרת או מוטציות נקודתיות.
- לתאים יש מנגנונים לתיקון מוטציות המתרחשות באופן טבעי. לפולימראז DNA יש פעילות הגהה. תיקון אי התאמה הוא תהליך לתיקון בסיסים ששולבו בצורה שגויה לאחר השלמת שכפול ה- DNA.
- ניתן לתקן גם דימרים של פירמידין. בתיקון כריתת נוקלאוטידים (תיקון כהה), אנזימים מזהים את העיוות שהוכנס על ידי דימר הפירימידין ומחליפים את הגדיל הפגוע בבסיסים הנכונים, תוך שימוש בגדיל ה-DNA הלא פגום כתבנית. חיידקים ואורגניזמים אחרים עשויים גם להשתמש בתיקון ישיר, שבו האנזים פוטוליאז, בנוכחות אור נראה, מפרק את הפירימידינים.
- באמצעות השוואה של צמיחה בצלחת המלאה וחוסר צמיחה במדיה חסרת חומרים מזינים ספציפיים, ניתן לזהות מוטציות ספציפיות לאובדן תפקוד הנקראות אוקסוטרופים.
- בדיקת איימס היא שיטה זולה המשתמשת בחיידקים אוקסוטרופיים למדידת מוטגניות של תרכובת כימית. מוטגניות היא אינדיקטור לפוטנציאל מסרטן.
הערות שוליים
- 1 ארגון הבריאות העולמי. נתוני "מצפה הבריאות העולמי (GHO), HIV/איידס." http://www.who.int/gho/hiv/en/. גישה ל -5 באוגוסט 2016.
- 2 ארגון הבריאות העולמי. "נתוני מצפה הבריאות העולמי (GHO), HIV/איידס." http://www.who.int/gho/hiv/en/. גישה ל -5 באוגוסט 2016.
- 3 KR טינדל ואח '. "שינויים ברצף בסיס ה- DNA הנגרמים על ידי מוטגנזה של גמא -ריי של למבדה פאג ונבואה." גנטיקה 118 מס '4 (1988) :551—560.


