6.5: אנזימים
- Page ID
- 205635
מיומנויות לפיתוח
- תאר את תפקידם של אנזימים במסלולים מטבוליים
- הסבר כיצד אנזימים מתפקדים כזרזים מולקולריים
- דון בוויסות האנזים על ידי גורמים שונים
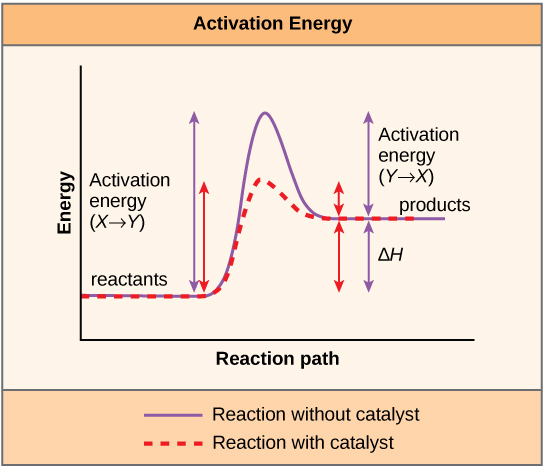
חומר המסייע לתגובה כימית להתרחש הוא זרז, והמולקולות המיוחדות המזרזות תגובות ביוכימיות נקראות אנזימים. כמעט כל האנזימים הם חלבונים, המורכבים משרשראות של חומצות אמינו, והם מבצעים את המשימה הקריטית של הורדת אנרגיות ההפעלה של תגובות כימיות בתוך התא. אנזימים עושים זאת על ידי קשירה למולקולות המגיבות, והחזקתם באופן שיגרום לתהליכי שבירת הקשר הכימי ויצירת הקשר להתרחש ביתר קלות. חשוב לזכור שאנזימים אינם משנים את ∆G של תגובה. במילים אחרות, הם לא משנים אם תגובה היא אקסרגונית (ספונטנית) או אנדרגונית. הסיבה לכך היא שהם אינם משנים את האנרגיה החופשית של המגיבים או המוצרים. הם רק מפחיתים את אנרגיית ההפעלה הנדרשת כדי להגיע למצב המעבר (איור\(\PageIndex{1}\)).
אתר אנזים פעיל וספציפיות מצע
המגיבים הכימיים שאליהם נקשר אנזים הם המצעים של האנזים. יתכנו מצעים אחד או יותר, תלוי בתגובה הכימית המסוימת. בתגובות מסוימות, מצע מגיב יחיד מתפרק למספר מוצרים. באחרים, שני מצעים עשויים להתאחד כדי ליצור מולקולה אחת גדולה יותר. שני מגיבים עשויים גם להיכנס לתגובה, שניהם משתנים ולהשאיר את התגובה כשני מוצרים. המיקום בתוך האנזים שבו המצע נקשר נקרא האתר הפעיל של האנזים. האתר הפעיל הוא המקום בו מתרחשת "הפעולה", כביכול. מכיוון שאנזימים הם חלבונים, קיים שילוב ייחודי של שאריות חומצות אמינו (הנקראות גם שרשראות צד, או קבוצות R) בתוך האתר הפעיל. כל שאריות מאופיינות בתכונות שונות. שאריות יכולות להיות גדולות או קטנות, חומציות חלשות או בסיסיות, הידרופיליות או הידרופוביות, טעונות חיוביות או שליליות, או ניטרליות. השילוב הייחודי של שאריות חומצות אמינו, מיקומם, הרצפים, המבנים והתכונות שלהם, יוצר סביבה כימית מאוד ספציפית בתוך האתר הפעיל. סביבה ספציפית זו מתאימה להיקשר, אם כי בקצרה, למצע כימי ספציפי (או מצעים). בשל התאמה דמוית פאזל זו בין אנזים למצעים שלו (שמתאים את עצמו כדי למצוא את ההתאמה הטובה ביותר בין מצב המעבר לאתר הפעיל), אנזימים ידועים בספציפיות שלהם. "ההתאמה הטובה ביותר" נובעת מהצורה ומהמשיכה של הקבוצה הפונקציונלית של חומצות האמינו למצע. יש אנזים מותאם במיוחד לכל מצע, ולפיכך לכל תגובה כימית; עם זאת, יש גם גמישות.
העובדה שאתרים פעילים מתאימים כל כך לספק תנאים סביבתיים ספציפיים פירושה גם שהם נתונים להשפעות של הסביבה המקומית. נכון שהעלאת הטמפרטורה הסביבתית בדרך כלל מגבירה את קצבי התגובה, מזורזת אנזים או אחרת. עם זאת, עלייה או ירידה של הטמפרטורה מחוץ לטווח אופטימלי יכולה להשפיע על קשרים כימיים בתוך האתר הפעיל באופן שהם פחות מתאימים לקשירת מצעים. טמפרטורות גבוהות יגרמו בסופו של דבר לאנזימים, כמו מולקולות ביולוגיות אחרות, לדנטורציה, תהליך שמשנה את התכונות הטבעיות של חומר. באופן דומה, ה- pH של הסביבה המקומית יכול להשפיע גם על תפקוד האנזים. לשאריות חומצות אמינו באתר פעיל יש תכונות חומציות או בסיסיות משלהן האופטימליות לקטליזה. שאריות אלו רגישות לשינויים ב-pH שעלולים לפגוע באופן שבו מולקולות המצע נקשרות. אנזימים מתאימים לתפקוד הטוב ביותר בטווח pH מסוים, וכמו בטמפרטורה, ערכי pH קיצוניים (חומציים או בסיסיים) של הסביבה יכולים לגרום לאנזימים להתנתק.
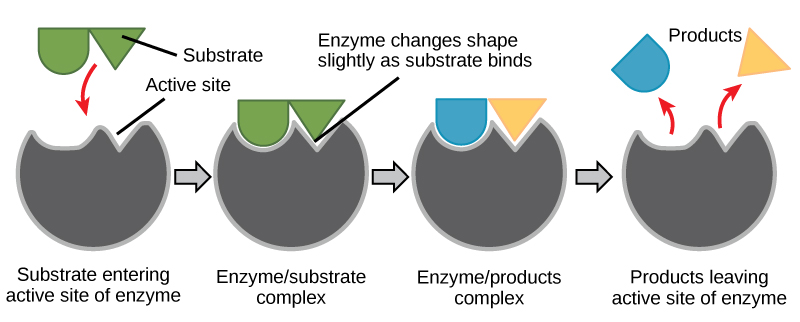
התאמה מושרה ותפקוד אנזים
במשך שנים רבות, מדענים חשבו שקשירת אנזים-מצע מתרחשת בצורה פשוטה של "נעילה ומפתח". מודל זה קבע כי האנזים והמצע משתלבים זה בזה בצורה מושלמת בשלב מיידי אחד. עם זאת, המחקר הנוכחי תומך בהשקפה מעודנת יותר הנקראת התאמה מושרה (איור\(\PageIndex{2}\)). מודל ההתאמה המושרה מרחיב את מודל הנעילה והמפתח על ידי תיאור אינטראקציה דינמית יותר בין אנזים למצע. כאשר האנזים והמצע מתאחדים, האינטראקציה שלהם גורמת לשינוי קל במבנה האנזים המאשר סידור קישור אידיאלי בין האנזים למצב המעבר של המצע. קישור אידיאלי זה ממקסם את יכולתו של האנזים לזרז את תגובתו.
כאשר אנזים קושר את המצע שלו, נוצר קומפלקס אנזים-סובסטרט. קומפלקס זה מוריד את אנרגיית ההפעלה של התגובה ומקדם את התקדמותה המהירה באחת הדרכים הרבות. ברמה הבסיסית, אנזימים מקדמים תגובות כימיות הכוללות יותר ממצע אחד על ידי קירוב המצעים בכיוון אופטימלי. האזור המתאים (אטומים וקשרים) של מולקולה אחת מוצב לאזור המתאים של המולקולה השנייה איתה עליה להגיב. דרך נוספת שבה אנזימים מקדמים את תגובת המצעים שלהם היא על ידי יצירת סביבה אופטימלית בתוך האתר הפעיל להתרחשות התגובה. תגובות כימיות מסוימות עשויות להתקדם בצורה הטובה ביותר בסביבה מעט חומצית או לא קוטבית. התכונות הכימיות העולות מהסידור המסוים של שאריות חומצות אמינו בתוך אתר פעיל יוצרות את הסביבה המושלמת לתגובת המצעים הספציפיים של האנזים.
למדת שאנרגיית ההפעלה הנדרשת לתגובות רבות כוללת את האנרגיה הכרוכה במניפולציה או עיוות מעט של קשרים כימיים, כך שהם יכולים להישבר בקלות ולאפשר לאחרים לבצע רפורמה. פעולה אנזימטית יכולה לסייע לתהליך זה. קומפלקס האנזים-סובסטרט יכול להוריד את אנרגיית ההפעלה על ידי עיוות מולקולות המצע באופן שיקל על שבירת הקשר, ויסייע להגיע למצב המעבר. לבסוף, אנזימים יכולים גם להוריד את אנרגיות ההפעלה על ידי השתתפות בתגובה הכימית עצמה. שאריות חומצות האמינו יכולות לספק יונים או קבוצות כימיות מסוימות היוצרות למעשה קשרים קוולנטיים עם מולקולות מצע כשלב הכרחי בתהליך התגובה. במקרים אלו, חשוב לזכור כי האנזים תמיד יחזור למצבו המקורי עם השלמת התגובה. אחת מתכונות ההיכר של אנזימים היא שהם נשארים בסופו של דבר ללא שינוי על ידי התגובות שהם מזרזים. לאחר סיום אנזים המזרז תגובה, הוא משחרר את המוצר/ים שלו.
שליטה בחילוף החומרים באמצעות ויסות אנזים
נראה אידיאלי לקיים תרחיש שבו כל האנזימים המקודדים בגנום של אורגניזם היו קיימים באספקה בשפע ותפקדו בצורה מיטבית בכל התנאים התאיים, בכל התאים, בכל עת. במציאות, זה רחוק מהמקרה. מגוון מנגנונים מבטיחים שזה לא יקרה. הצרכים והתנאים הסלולריים משתנים מתא לתא, ומשתנים בתוך תאים בודדים לאורך זמן. האנזימים הנדרשים והדרישות האנרגטיות של תאי הקיבה שונים מאלו של תאי אחסון שומן, תאי עור, תאי דם ותאי עצב. יתר על כן, תא עיכול עובד הרבה יותר קשה לעבד ולפרק חומרים מזינים במהלך הזמן העוקב מקרוב אחר ארוחה בהשוואה לשעות רבות לאחר הארוחה. ככל שהדרישות והתנאים הסלולריים הללו משתנים, כך גם הכמויות והפונקציונליות של אנזימים שונים משתנים.
מכיוון ששיעורי התגובות הביוכימיות נשלטים על ידי אנרגיית הפעלה, ואנזימים מורידים וקובעים אנרגיות הפעלה לתגובות כימיות, הכמויות היחסיות והתפקוד של מגוון האנזימים בתוך התא קובעים בסופו של דבר אילו תגובות ימשיכו ובאילו קצב. קביעה זו נשלטת היטב. בסביבות תאיות מסוימות, פעילות האנזים נשלטת בחלקה על ידי גורמים סביבתיים, כמו pH וטמפרטורה. ישנם מנגנונים נוספים שבאמצעותם התאים שולטים בפעילות האנזימים וקובעים את הקצב שבו יתרחשו תגובות ביוכימיות שונות.
ויסות אנזימים על ידי מולקולות
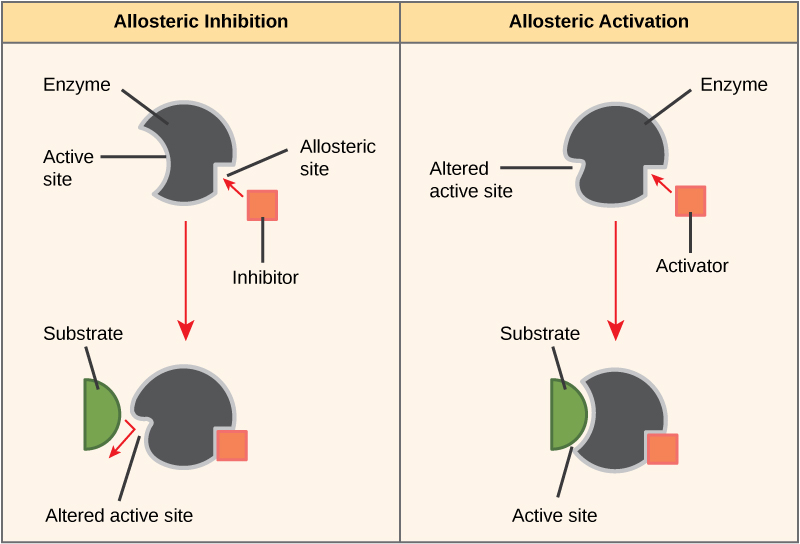
ניתן לווסת אנזימים בדרכים המקדמות או מפחיתות את פעילותם. ישנם סוגים רבים ושונים של מולקולות המעכבות או מקדמות את תפקוד האנזים, וקיימים מנגנונים שונים לשם כך. במקרים מסוימים של עיכוב אנזים, למשל, מולקולת מעכב דומה מספיק למצע שהיא יכולה להיקשר לאתר הפעיל ופשוט לחסום את המצע מלהיקשר. כאשר זה קורה, האנזים מעוכב באמצעות עיכוב תחרותי, מכיוון שמולקולת מעכב מתחרה במצע על קישור אתר פעיל (איור\(\PageIndex{3}\)). מצד שני, בעיכוב לא תחרותי, מולקולת מעכב נקשרת לאנזים במיקום שאינו אתר אלוסטרי ועדיין מצליחה לחסום את קישור המצע לאתר הפעיל.
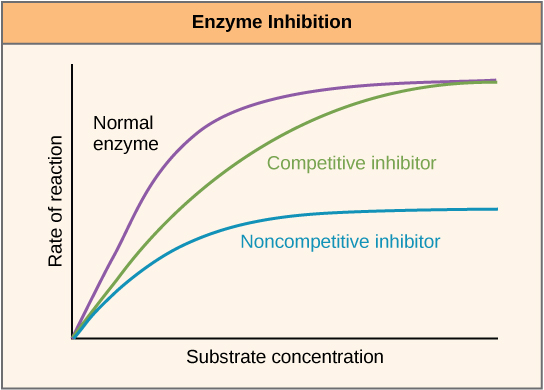
חלק ממולקולות המעכבות נקשרות לאנזימים במיקום שבו הקישור שלהן גורם לשינוי קונפורמטיבי המפחית את הזיקה של האנזים למצע שלו. סוג זה של עיכוב נקרא עיכוב אלוסטרי (איור\(\PageIndex{4}\)). רוב האנזימים המווסתים באופן אלוסטרי מורכבים מיותר מפוליפפטיד אחד, כלומר יש להם יותר מתת-יחידת חלבון אחת. כאשר מעכב אלוסטרי נקשר לאנזים, כל האתרים הפעילים ביחידות המשנה של החלבון משתנים מעט כך שהם קושרים את המצעים שלהם בפחות יעילות. ישנם מפעילים אלוסטריים כמו גם מעכבים. מפעילים אלוסטריים נקשרים למיקומים באנזים הרחק מהאתר הפעיל, וגורמים לשינוי קונפורמטיבי המגביר את הזיקה של האתרים הפעילים של האנזים למצע (ים) שלו.
חיבור יומיומי: גילוי תרופות על ידי חיפוש מעכבי אנזימים מרכזיים במסלולים ספציפיים

אנזימים הם מרכיבים מרכזיים במסלולים מטבוליים. ההבנה כיצד פועלים אנזימים וכיצד ניתן לווסת אותם היא עיקרון מרכזי מאחורי פיתוחן של רבות מהתרופות הפרמצבטיות (איור\(\PageIndex{5}\)) הקיימות כיום בשוק. ביולוגים העובדים בתחום זה משתפים פעולה עם מדענים אחרים, בדרך כלל כימאים, לעיצוב תרופות.
קחו למשל סטטינים - שזה השם שניתן לקבוצת התרופות המפחיתה את רמות הכולסטרול. תרכובות אלה הן למעשה מעכבי האנזים HMG-CoA רדוקטאז. רדוקטאז HMG-CoA הוא האנזים המסנתז כולסטרול משומנים בגוף. על ידי עיכוב אנזים זה ניתן להפחית את רמות הכולסטרול המסונתז בגוף. באופן דומה, אצטמינופן, המשווק באופן פופולרי תחת שם המותג טיילנול, הוא מעכב של האנזים cyclooxygenase. למרות שהוא יעיל במתן הקלה מחום ודלקת (כאב), מנגנון הפעולה שלו עדיין לא מובן לחלוטין.
כיצד מתפתחים תרופות? אחד האתגרים הראשונים בפיתוח תרופות הוא זיהוי המולקולה הספציפית שהתרופה מיועדת למקד אליה. במקרה של סטטינים, רדוקטאז HMG-CoA הוא יעד התרופה. מטרות סמים מזוהות באמצעות מחקר קפדני במעבדה. זיהוי המטרה בלבד אינו מספיק; מדענים צריכים גם לדעת כיצד המטרה פועלת בתוך התא ואילו תגובות משתבשות במקרה של מחלה. לאחר זיהוי המטרה והמסלול, מתחיל התהליך בפועל של עיצוב תרופות. במהלך שלב זה, כימאים וביולוגים עובדים יחד כדי לתכנן ולסנתז מולקולות שיכולות לחסום או להפעיל תגובה מסוימת. עם זאת, זו רק ההתחלה: גם אם וגם כאשר אב טיפוס תרופתי מצליח לבצע את תפקידו, עליו לעבור בדיקות רבות מניסויים חוץ גופיים ועד ניסויים קליניים לפני שהוא יכול לקבל אישור של ה- FDA להיות בשוק.
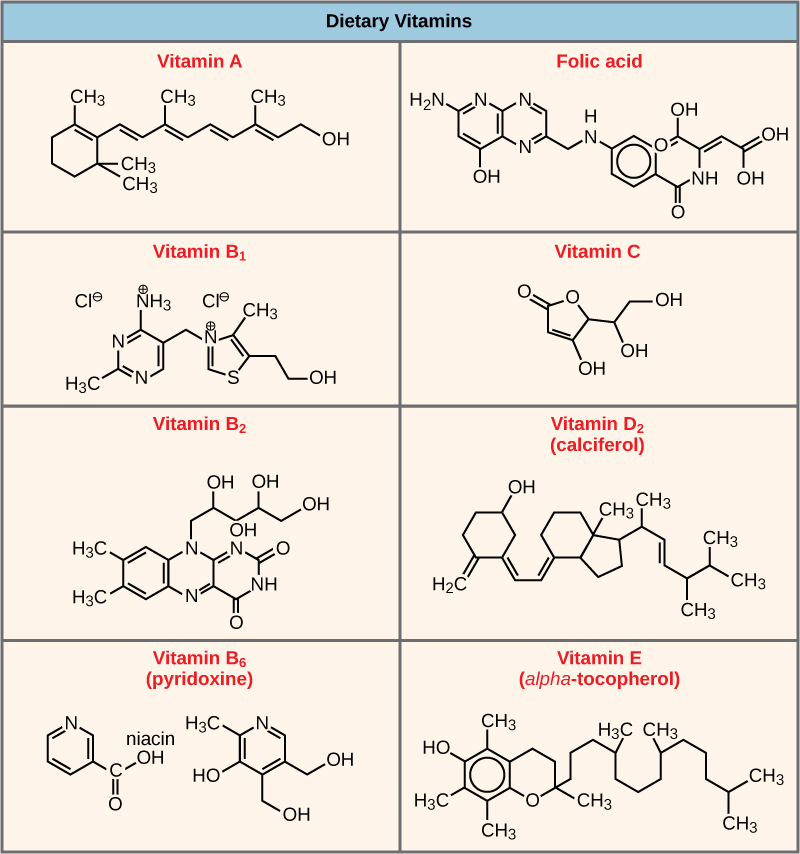
אנזימים רבים אינם פועלים בצורה אופטימלית, או אפילו בכלל, אלא אם כן נקשרים למולקולות עוזרות ספציפיות אחרות שאינן חלבוניות, באופן זמני דרך קשרים יוניים או מימן או לצמיתות באמצעות קשרים קוולנטיים חזקים יותר. שני סוגים של מולקולות עוזרות הן קופקטורים וקו-אנזימים. קשירה למולקולות אלו מקדמת קונפורמציה ותפקוד מיטביים עבור האנזימים שלהם. קופקטורים הם יונים אנאורגניים כגון ברזל (Fe++) ומגנזיום (Mg ++). דוגמה אחת לאנזים הדורש יון מתכת כקופקטור היא האנזים הבונה מולקולות DNA, פולימראז DNA, הדורש יון אבץ קשור (Zn++) לתפקד. קואנזימים הם מולקולות עוזרות אורגניות, בעלות מבנה אטומי בסיסי המורכב מפחמן ומימן, הנדרשות לפעולת האנזים. המקורות הנפוצים ביותר לקו-אנזימים הם ויטמינים תזונתיים (איור\(\PageIndex{6}\)). חלק מהוויטמינים הם מבשרי קואנזימים ואחרים פועלים ישירות כקואנזימים. ויטמין C הוא קואנזים לאנזימים מרובים שלוקחים חלק בבניית מרכיב רקמת החיבור החשוב, קולגן. שלב חשוב בפירוק הגלוקוז להפקת אנרגיה הוא קטליזה על ידי קומפלקס רב-אנזים הנקרא פירובט דהידרוגנאז. פירובט דהידרוגנאז הוא קומפלקס של מספר אנזימים הדורש למעשה קופקטור אחד (יון מגנזיום) וחמישה קואנזימים אורגניים שונים כדי לזרז את התגובה הכימית הספציפית שלו. לכן, תפקוד האנזים מוסדר, בחלקו, על ידי שפע של קופקטורים וקו-אנזימים שונים, המסופקים בעיקר על ידי התזונה של רוב האורגניזמים.
מידור אנזים
בתאים אוקריוטיים, מולקולות כגון אנזימים מחולקות בדרך כלל לאברונים שונים. זה מאפשר רמה נוספת של ויסות של פעילות האנזים. אנזימים הנדרשים רק לתהליכים תאיים מסוימים יכולים להיות מאוחסנים בנפרד יחד עם המצעים שלהם, מה שמאפשר תגובות כימיות יעילות יותר. דוגמאות לוויסות אנזים מסוג זה המבוססות על מיקום וקרבה כוללות את האנזימים המעורבים בשלבים האחרונים של הנשימה התאית, המתרחשים אך ורק במיטוכונדריה, והאנזימים המעורבים בעיכול פסולת תאית וחומרים זרים, הממוקמים בתוך ליזוזומים.
עיכוב משוב במסלולים מטבוליים
מולקולות יכולות לווסת את תפקוד האנזים בדרכים רבות. עם זאת נותרה שאלה מרכזית: מהן המולקולות הללו ומאיפה הן מגיעות? חלקם הם קופקטורים וקו-אנזימים, יונים ומולקולות אורגניות, כפי שלמדת. אילו מולקולות אחרות בתא מספקות ויסות אנזימטי, כגון אפנון אלוסטרי, ועיכוב תחרותי ולא תחרותי? התשובה היא שמגוון רחב של מולקולות יכולות לבצע תפקידים אלה. חלק מהמולקולות הללו כוללות תרופות פרמצבטיות ולא תרופות, רעלים ורעלים מהסביבה. אולי המקורות הרלוונטיים ביותר למולקולות רגולטוריות של האנזים, ביחס למטבוליזם התאי, הם תוצרי התגובות המטבוליות התאיות עצמן. בצורה היעילה והאלגנטית ביותר, תאים התפתחו לשימוש בתוצרי התגובות שלהם לעיכוב משוב של פעילות האנזים. עיכוב משוב כרוך בשימוש במוצר תגובה כדי לווסת את המשך הייצור שלו (איור\(\PageIndex{7}\)). התא מגיב לשפע המוצרים הספציפיים על ידי האטת הייצור במהלך תגובות אנבוליות או קטבוליות. תוצרי תגובה כאלה עשויים לעכב את האנזימים שזרזו את ייצורם באמצעות המנגנונים שתוארו לעיל.
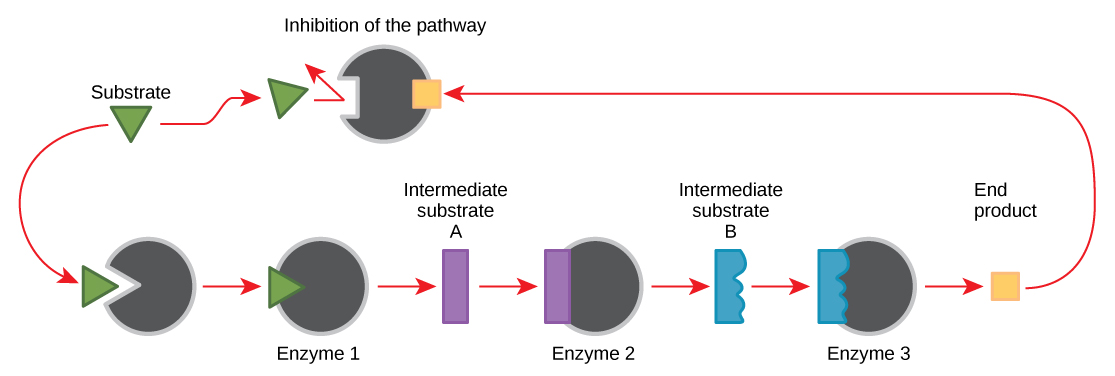
הייצור של חומצות אמינו ונוקלאוטידים נשלט באמצעות עיכוב משוב. בנוסף, ATP הוא מווסת אלוסטרי של חלק מהאנזימים המעורבים בפירוק הקטבולי של הסוכר, התהליך המייצר ATP. באופן זה, כאשר ATP נמצא בשפע, התא יכול למנוע את המשך ייצורו. זכור כי ATP היא מולקולה לא יציבה שיכולה להתנתק באופן ספונטני ל- ADP. אם יותר מדי ATP היה קיים בתא, חלק גדול ממנו היה הולך לפח. מצד שני, ADP משמש כווסת אלוסטרי חיובי (מפעיל אלוסטרי) עבור חלק מאותם אנזימים המעוכבים על ידי ATP. לפיכך, כאשר הרמות היחסיות של ADP גבוהות בהשוואה ל- ATP, התא מופעל לייצר יותר ATP באמצעות קטבוליזם של סוכר.
סיכום
אנזימים הם זרזים כימיים המאיצים תגובות כימיות בטמפרטורות פיזיולוגיות על ידי הורדת אנרגיית ההפעלה שלהם. אנזימים הם בדרך כלל חלבונים המורכבים משרשרת פוליפפטיד אחת או יותר. לאנזימים אתר פעיל המספק סביבה כימית ייחודית, המורכבת מקבוצות R מסוימות של חומצות אמינו (שאריות). סביבה ייחודית זו מתאימה באופן מושלם להמרת מגיבים כימיים מסוימים לאותו אנזים, הנקרא מצעים, לחומרי ביניים לא יציבים הנקראים מצבי מעבר. סבורים כי אנזימים ומצעים נקשרים בהתאמה מושרה, מה שאומר שאנזימים עוברים התאמות קונפורמטיביות קלות במגע המצע, מה שמוביל לקשירה מלאה ואופטימלית. אנזימים נקשרים למצעים ומזרזים תגובות בארבע דרכים שונות: חיבור מצעים בכיוון אופטימלי, פגיעה במבני הקשר של מצעים כך שניתן יהיה לשבור קשרים בקלות רבה יותר, מתן תנאים סביבתיים אופטימליים להתרחשות תגובה, או השתתפות ישירה בתגובה הכימית שלהם על ידי יצירת קשרים קוולנטיים חולפים עם המצעים.
יש לווסת את פעולת האנזים כך שבתא נתון בזמן נתון, התגובות הרצויות מזורזות והתגובות הלא רצויות אינן. אנזימים מוסדרים על ידי תנאים תאיים, כגון טמפרטורה ו- pH. הם מוסדרים גם דרך מיקומם בתוך תא, ולעתים הם מחולקים כך שהם יכולים לזרז תגובות רק בנסיבות מסוימות. עיכוב והפעלה של אנזימים באמצעות מולקולות אחרות הן דרכים חשובות אחרות שבהן אנזימים מוסדרים. מעכבים יכולים לפעול באופן תחרותי, לא תחרותי או אלוסטרי; מעכבים לא תחרותיים הם בדרך כלל אלוסטריים. מפעילים יכולים גם לשפר את תפקודם של אנזימים באופן אלוסטרי. השיטה הנפוצה ביותר שבה תאים מווסתים את האנזימים במסלולים מטבוליים היא באמצעות עיכוב משוב. במהלך עיכוב משוב, תוצרי מסלול מטבולי משמשים כמעכבים (בדרך כלל אלוסטריים) של אחד או יותר מהאנזימים (בדרך כלל האנזים המחויב הראשון של המסלול) המעורבים במסלול המייצר אותם.
רשימת מילים
- אתר פעיל
- אזור ספציפי של האנזים שאליו נקשר המצע
- עיכוב אלוסטרי
- עיכוב על ידי אירוע מחייב באתר שונה מהאתר הפעיל, הגורם לשינוי קונפורמטיבי ומפחית את הזיקה של האנזים למצע שלו
- קואנזים
- מולקולה אורגנית קטנה, כגון ויטמין או נגזרת שלה, אשר נדרש כדי לשפר את הפעילות של אנזים
- קופקטור
- יון אנאורגני, כגון יוני ברזל ומגנזיום, הנדרש לוויסות אופטימלי של פעילות האנזים
- עיכוב תחרותי
- סוג העיכוב שבו המעכב מתחרה במולקולת המצע על ידי קישור לאתר הפעיל של האנזים
- דנטורה
- תהליך שמשנה את התכונות הטבעיות של חומר
- עיכוב משוב
- השפעה של תוצר של רצף תגובה להפחתת ייצורו הנוסף על ידי עיכוב פעילות האנזים הראשון במסלול המייצר אותו
- התאמה מושרה
- התאמה דינמית בין האנזים למצע שלו, שבה שני המרכיבים משנים את המבנים שלהם כדי לאפשר קישור אידיאלי
- מצע
- מולקולה שעליה פועל האנזים


