2.2: Maji
- Page ID
- 175313
Ujuzi wa Kuendeleza
- Eleza mali ya maji ambayo ni muhimu kwa kudumisha maisha
- Eleza kwa nini maji ni kutengenezea bora
- Kutoa mifano ya mali ya maji ya ushirikiano na adhesive
- Jadili jukumu la asidi, besi, na Buffers katika homeostasis
Kwa nini wanasayansi hutumia muda kutafuta maji kwenye sayari nyingine? Kwa nini maji ni muhimu sana? Ni kwa sababu maji ni muhimu kwa maisha kama tunavyojua. Maji ni mojawapo ya molekuli nyingi zaidi na moja muhimu zaidi kwa maisha duniani. Takriban asilimia 60—70 za mwili wa binadamu hujumuishwa na maji. Bila hivyo, maisha kama tunavyojua hayapo.
Polarity ya molekuli ya maji na kusababisha hidrojeni bonding kufanya maji dutu ya kipekee na mali maalum ambayo ni karibu amefungwa na mchakato wa maisha. Maisha awali yalibadilika katika mazingira ya maji, na zaidi ya kemia ya seli za kiumbe na kimetaboliki hutokea ndani ya yaliyomo maji ya saitoplazimu ya seli. Mali maalum ya maji ni uwezo wake wa juu wa joto na joto la mvuke, uwezo wake wa kufuta molekuli za polar, mali yake ya kushikamana na adhesive, na dissociation yake katika ions inayoongoza kwa kizazi cha pH. Kuelewa sifa hizi za maji husaidia kufafanua umuhimu wake katika kudumisha maisha.
Polarity ya maji
Moja ya mali muhimu ya maji ni kwamba inajumuisha molekuli za polar: hidrojeni na oksijeni ndani ya molekuli za maji (H 2 O) huunda vifungo vya covalent vya polar. Wakati hakuna malipo ya wavu kwa molekuli ya maji, polarity ya maji inajenga malipo kidogo juu ya hidrojeni na malipo kidogo hasi juu ya oksijeni, na kuchangia mali ya maji ya kivutio. Mashtaka ya maji yanazalishwa kwa sababu oksijeni ni electronegative zaidi kuliko hidrojeni, na kuifanya uwezekano mkubwa kuwa elektroni iliyoshirikiwa itapatikana karibu na kiini cha oksijeni kuliko kiini cha hidrojeni, hivyo kuzalisha chaji hasi ya sehemu karibu na oksijeni.
Kutokana na polarity ya maji, kila molekuli ya maji huvutia molekuli nyingine za maji kwa sababu ya mashtaka tofauti kati ya molekuli za maji, kutengeneza vifungo vya hidrojeni. Maji pia huvutia au huvutiwa na molekuli nyingine za polar na ions. Dutu ya polar inayoingiliana kwa urahisi na au kufuta ndani ya maji inajulikana kama hydrophilic (hydro-= “maji”; -philic = “upendo”). Kwa upande mwingine, molekuli zisizo za polar kama vile mafuta na mafuta haziingiliani vizuri na maji, kama inavyoonekana kwenye Mchoro\(\PageIndex{1}\) na kutenganisha na hayo badala ya kufuta ndani yake, kama tunavyoona katika mavazi ya saladi yenye mafuta na siki (suluhisho la maji tindikali). Misombo hii isiyo ya kawaida huitwa hydrophobic (hydro- = “maji”; -phobic = “kuogopa”).

Majimbo ya Maji: Gesi, Kioevu, na Mango
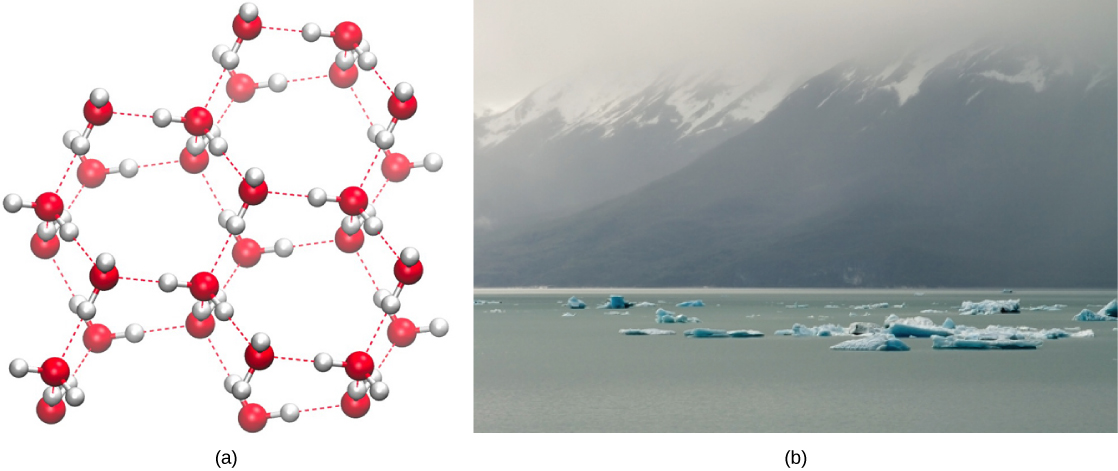
Kuundwa kwa vifungo vya hidrojeni ni ubora muhimu wa maji ya kiowevu ambayo ni muhimu kwa maisha kama tunavyoijua. Kama molekuli za maji zinafanya vifungo vya hidrojeni kwa kila mmoja, maji huchukua sifa za kipekee za kemikali ikilinganishwa na vinywaji vingine na, kwa kuwa vitu vilivyo hai vina maudhui ya juu ya maji, kuelewa vipengele hivi vya kemikali ni muhimu kuelewa maisha. Katika maji ya kioevu, vifungo vya hidrojeni vinaundwa mara kwa mara na kuvunjika kama molekuli za maji zinapita. Kuvunjika kwa vifungo hivi husababishwa na mwendo (nishati ya kinetic) ya molekuli za maji kutokana na joto lililomo katika mfumo. Wakati joto linapofufuliwa kama maji yanavyochemshwa, nishati ya juu ya kinetiki ya molekuli ya maji husababisha vifungo vya hidrojeni kuvunja kabisa na kuruhusu molekuli za maji kutoroka hewani kama gesi (mvuke au mvuke wa maji). Kwa upande mwingine, wakati joto la maji linapopunguzwa na maji kufungia, molekuli za maji huunda muundo wa fuwele uliohifadhiwa na bonding hidrojeni (hakuna nishati ya kutosha kuvunja vifungo vya hidrojeni) ambayo inafanya barafu kuwa chini mnene kuliko maji ya kioevu, jambo ambalo halionekani katika kuimarishwa kwa wengine viowevu.
Uzito wa chini wa maji katika hali yake imara ni kutokana na jinsi vifungo vya hidrojeni vinavyoelekezwa kama inavyofungia: molekuli za maji zinasukumwa mbali zaidi ikilinganishwa na maji kiowevu. Pamoja na vinywaji vingine vingi, uimarishaji wakati matone ya joto yanajumuisha kupungua kwa nishati ya kinetic kati ya molekuli, kuwaruhusu kubeba hata zaidi kwa ukali kuliko fomu ya kioevu na kutoa imara wiani mkubwa kuliko kioevu.
Uzito wa chini wa barafu, unaonyeshwa na umeonyeshwa kwenye Mchoro\(\PageIndex{2}\), shida, husababisha kuelea kwenye uso wa maji ya kioevu, kama vile kwenye barafu au kwenye cubes ya barafu katika glasi ya maji ya barafu. Katika maziwa na mabwawa, barafu itaunda juu ya uso wa maji na kujenga kizuizi cha kuhami ambacho kinalinda wanyama na maisha ya mimea katika bwawa kutoka kufungia. Bila safu hii ya kuhami barafu, mimea na wanyama wanaoishi katika bwawa wangeweza kufungia katika block imara ya barafu na hawakuweza kuishi. Athari mbaya ya kufungia viumbe hai husababishwa na upanuzi wa barafu kuhusiana na maji ya kioevu. Fuwele za barafu ambazo huunda juu ya kufungia kupasuka kwa utando wa maridadi muhimu kwa kazi ya seli zilizo hai, ambazo haziharibu. Viini vinaweza kuishi tu kufungia ikiwa maji ndani yake hubadilishwa kwa muda na kioevu kingine kama glycerol.
Unganisha na Kujifunza

Video: Bofya hapa ili uone uhuishaji wa 3-D wa muundo wa safu ya barafu. (Image mikopo: Jane Whitney. Picha iliyoundwa kwa kutumia Visual Masi Dynamics VMD programu. 2)
Uwezo wa Juu wa Joto la Maji
Uwezo wa juu wa joto la maji ni mali inayosababishwa na kuunganishwa kwa hidrojeni kati ya molekuli za maji. Maji ina uwezo maalum wa joto wa maji yoyote. Joto maalum hufafanuliwa kama kiasi cha joto gramu moja ya dutu inapaswa kunyonya au kupoteza kubadili joto lake kwa shahada moja ya Celsius. Kwa maji, kiasi hiki ni kalori moja. Kwa hiyo inachukua maji muda mrefu kwa joto na muda mrefu ili kupendeza. Kwa kweli, uwezo maalum wa joto wa maji ni karibu mara tano zaidi kuliko ile ya mchanga. Hii inaelezea kwa nini ardhi inakua kwa kasi zaidi kuliko bahari. Kutokana na uwezo wake wa juu wa joto, maji hutumiwa na wanyama wenye joto la damu ili kueneza joto zaidi katika miili yao: hufanya kwa njia sawa na mfumo wa baridi wa gari, kusafirisha joto kutoka maeneo ya joto hadi maeneo ya baridi, na kusababisha mwili kudumisha joto zaidi.
Joto la Maji la Uvukizi
Maji pia yana joto kubwa la uvukizi, kiasi cha nishati kinachohitajika kubadili gramu moja ya dutu kioevu kwa gesi. Kiasi kikubwa cha nishati ya joto (586 cal) inahitajika ili kukamilisha mabadiliko haya katika maji. Utaratibu huu hutokea juu ya uso wa maji. Kama maji ya kioevu yanapokanzwa, bonding ya hidrojeni inafanya kuwa vigumu kutenganisha molekuli ya maji ya kioevu kutoka kwa kila mmoja, ambayo inahitajika ili kuingia awamu yake ya gesi (mvuke). Matokeo yake, maji hufanya kama kuzama kwa joto au hifadhi ya joto na inahitaji joto zaidi kuchemsha kuliko ilivyo kiowevu kama vile ethanol (pombe ya nafaka), ambayo hidrojeni inayounganishwa na molekuli nyingine za ethanol ni dhaifu kuliko kuunganishwa kwa hidrojeni ya maji. Hatimaye, kama maji yanafikia kiwango chake cha kuchemsha cha 100° Celsius (212° Fahrenheit), joto linaweza kuvunja vifungo vya hidrojeni kati ya molekuli za maji, na nishati ya kinetiki (mwendo) kati ya molekuli za maji huwawezesha kutoroka kutoka kiowevu kama gesi. Hata wakati chini ya kiwango chake cha kuchemsha, molekuli za maji binafsi hupata nishati ya kutosha kutoka kwa molekuli nyingine za maji kama kwamba baadhi ya molekuli za maji ya uso zinaweza kutoroka na kuvukiza: mchakato huu unajulikana kama uvukizi.
Ukweli kwamba vifungo vya hidrojeni vinahitaji kuvunjika kwa maji kuenea ina maana kwamba kiasi kikubwa cha nishati hutumiwa katika mchakato. Kama maji yanapoenea, nishati inachukuliwa na mchakato, kuimarisha mazingira ambapo uvukizi unafanyika. Katika viumbe hai vingi, ikiwa ni pamoja na wanadamu, uvukizi wa jasho, ambayo ni asilimia 90 ya maji, inaruhusu viumbe kuwa baridi ili homeostasis ya joto la mwili iweze kudumishwa.
Maji ya kutengenezea Mali
Kwa kuwa maji ni molekuli ya polar yenye mashtaka mazuri na kidogo, ions na molekuli za polar zinaweza kufuta kwa urahisi ndani yake. Kwa hiyo, maji hujulikana kama kutengenezea, dutu inayoweza kufuta molekuli nyingine za polar na misombo ya ionic. Mashtaka yanayohusiana na molekuli hizi zitaunda vifungo vya hidrojeni na maji, vinavyozunguka chembe na molekuli za maji. Hii inajulikana kama nyanja ya taratibu, au shell hydration, kama inavyoonekana katika Kielelezo
Tazama video hii kwa maelezo ya moja kwa moja ya pH na kiwango chake cha logarithmic.
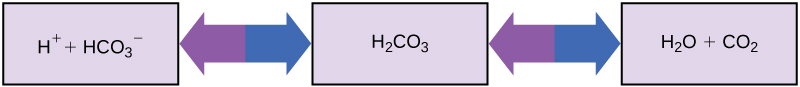
Hivyo jinsi gani viumbe ambao miili yao inahitaji pH karibu-neutral kumeza dutu tindikali na msingi (binadamu kunywa juisi ya machungwa, kwa mfano) na kuishi? Buffers ni muhimu. Buffers urahisi kunyonya ziada H + au OH —, kuweka pH ya mwili makini iimarishwe katika aina nyembamba inahitajika kwa ajili ya kuishi. Kudumisha pH ya damu mara kwa mara ni muhimu kwa ustawi wa mtu. Buffer kudumisha pH ya damu ya binadamu inahusisha asidi kaboni (H 2 CO 3), ion bicarbonate (HCO 3 -), na dioksidi kaboni (CO 2). Wakati ions za bicarbonate zinachanganya na ions za bure za hidrojeni na kuwa asidi ya kaboni, ions hidrojeni huondolewa, kubadilisha mabadiliko ya pH. Vile vile, kama inavyoonekana katika Kielelezo\(\PageIndex{8}\), asidi ya kaboni ya ziada inaweza kubadilishwa kuwa gesi dioksidi kaboni na exhaled kupitia mapafu. Hii inazuia ions nyingi za hidrojeni huru kutoka kujenga katika damu na kupunguza hatari ya pH ya damu. Vivyo hivyo, kama OH sana — ni kuletwa katika mfumo, asidi kaboniki itakuwa kuchanganya na kujenga bicarbonate, kupunguza pH. Bila mfumo huu wa buffer, pH ya mwili ingekuwa fluctuate kutosha kuweka maisha katika hatari.
Mifano mingine ya buffers ni antacids kutumika kupambana na asidi ya tumbo ya ziada. Wengi wa dawa hizi zinazouzwa zinafanya kazi kwa njia sawa na vizuizi vya damu, kwa kawaida na angalau ioni moja inayoweza kunyonya hidrojeni na kupima pH, kuleta misaada kwa wale wanaosumbuliwa na “kupungua kwa moyo” baada ya kula. Mali ya pekee ya maji ambayo huchangia uwezo huu wa kusawazisha pH-pamoja na sifa nyinginezo za maji-ni muhimu kwa kudumisha maisha duniani.
Unganisha na Kujifunza

Ili kujifunza zaidi kuhusu maji. Ziara ya Marekani Kijiolojia Survey Sayansi ya Maji kwa Shule zote Kuhusu Maji! tovuti.
Muhtasari
Maji ina mali nyingi ambazo ni muhimu kwa kudumisha maisha. Ni molekuli ya polar, kuruhusu kuundwa kwa vifungo vya hidrojeni. Vifungo vya hidrojeni huruhusu ions na molekuli nyingine za polar kufuta katika maji. Kwa hiyo, maji ni kutengenezea bora. Vifungo vya hidrojeni kati ya molekuli za maji husababisha maji kuwa na uwezo mkubwa wa joto, maana yake inachukua joto nyingi lililoongezwa ili kuongeza halijoto lake. Wakati joto linapoongezeka, vifungo vya hidrojeni kati ya maji vinaendelea kuvunja na kuunda upya. Hii inaruhusu joto la jumla kubaki imara, ingawa nishati huongezwa kwenye mfumo. Maji pia huonyesha joto kubwa la uvukizi, ambalo ni muhimu kwa jinsi viumbe vinavyojitokeza wenyewe kwa uvukizi wa jasho. Majeshi ya ushirikiano wa maji yanaruhusu mali ya mvutano wa uso, wakati mali zake za wambiso zinaonekana kama maji yanaongezeka ndani ya zilizopo za capillary. Thamani ya pH ni kipimo cha mkusanyiko wa ioni ya hidrojeni katika suluhisho na ni mojawapo ya sifa nyingi za kemikali ambazo zinasimamiwa sana katika viumbe hai kupitia homeostasis. Acids na besi zinaweza kubadilisha maadili ya pH, lakini buffers huwa na wastani wa mabadiliko wanayosababisha. Mali hizi za maji zinaunganishwa sana na michakato ya biochemical na ya kimwili iliyofanywa na viumbe hai, na maisha itakuwa tofauti sana ikiwa mali hizi zilibadilishwa, ikiwa ingeweza kuwepo kabisa.
maelezo ya chini
- 1 W. Humphrey W., A. Dalke, na K. Schulten, “VMD-Visual Masi Dynamics,” Journal of Masi Graphics 14 (1996): 33-38.
- 2 W. Humphrey W., A. Dalke, na K. Schulten, “VMD-Visual Masi Dynamics,” Journal of Masi Graphics 14 (1996): 33-38.
faharasa
- asidi
- molekuli kwamba donates ions hidrojeni na kuongezeka kwa mkusanyiko wa ions hidrojeni katika suluhisho
- ushikamano
- mvuto kati ya molekuli maji na molekuli nyingine
- msingi
- molekuli ambayo hutoa ions hidroksidi au vinginevyo kumfunga ions hidrojeni ziada na kupungua mkusanyiko wa ions hidrojeni katika suluhisho
- bafa
- Dutu kwamba kuzuia mabadiliko katika pH kwa absorbing au kutolewa ions hidrojeni au hidroksidi
- kalori
- kiasi cha joto required na mabadiliko ya joto ya gramu moja ya maji kwa shahada moja Celsius
- hatua ya kapilari
- hutokea kwa sababu molekuli za maji huvutiwa na mashtaka kwenye nyuso za ndani za miundo nyembamba tubular kama vile zilizopo za kioo, kuchora molekuli za maji kwa pande za zilizopo
- mshikamano
- vikosi vya intermolecular kati ya molekuli za maji zinazosababishwa na asili ya maji; kuwajibika kwa mvutano wa uso
- kujitenga
- kutolewa kwa ioni kutoka kwa molekuli kama vile molekuli ya awali sasa ina ion na mabaki ya kushtakiwa ya asili, kama vile wakati maji yanapotengana na H + na OH -
- uvukizaji
- kujitenga kwa molekuli ya mtu binafsi kutoka kwenye uso wa mwili wa maji, majani ya mmea, au ngozi ya kiumbe
- joto la vaporization ya maji
- high kiasi cha nishati required kwa ajili ya maji kioevu kugeuka katika mvuke wa maji
- hydrofiliki
- inaelezea ions au molekuli polar kwamba kuingiliana vizuri na molekuli nyingine polar kama vile maji
- haidrofobu
- inaelezea molekuli zisizo za polar ambazo haziingiliani vizuri na molekuli za polar kama vile maji
- karatasi ya litmus
- (pia, karatasi ya pH) karatasi ya chujio ambayo imetibiwa na rangi ya asili ya mumunyifu ya maji inayobadilisha rangi yake kama pH ya mazingira inabadilika hivyo inaweza kutumika kama kiashiria cha pH
- karatasi ya pH
- tazama karatasi ya litmus
- kiwango cha pH
- wadogo kuanzia sifuri hadi 14 yaani inversely sawia na mkusanyiko wa ions hidrojeni katika suluhisho
- kiyeyusho
- Dutu inayoweza kufuta dutu nyingine
- uwezo maalum wa joto
- kiasi cha joto, gramu moja ya dutu inapaswa kunyonya au kupoteza kubadili joto lake kwa shahada moja ya Celsius;
- nyanja ya hydration
- wakati molekuli ya maji ya polar inazunguka molekuli za kushtakiwa au polar, hivyo kuziweka kufutwa na katika suluhisho
- mvutano wa uso
- mvutano juu ya uso wa mwili wa kioevu ambayo huzuia molekuli kutenganisha; iliyoundwa na vikosi vya kuvutia vya ushirikiano kati ya molekuli ya kioevu


