2.1: Atomi, Isotopes, Ions, na Molekuli - Vitalu vya ujenzi
- Page ID
- 175329
Ujuzi wa Kuendeleza
- Eleza jambo na vipengele
- Eleza uhusiano kati ya protoni, neutroni, na elektroni
- Linganisha njia ambazo elektroni zinaweza kuchangia au kugawanywa kati ya atomi
- Eleza njia ambazo vipengele vya kawaida vinachanganya kuunda molekuli, seli, tishu, mifumo ya chombo, na viumbe
Katika ngazi yake ya msingi zaidi, maisha yanajumuisha suala. Jambo ni dutu yoyote ambayo inachukua nafasi na ina wingi. Elementi ni aina ya pekee ya suala yenye kemikali maalum na mali za kimwili ambazo haziwezi kuvunjwa kuwa dutu ndogo na athari za kawaida za kemikali. Kuna mambo 118, lakini 92 tu hutokea kwa kawaida. Mambo yaliyobaki yanatengenezwa katika maabara na hayatumiki.
Kila kipengele kinateuliwa na ishara yake ya kemikali, ambayo ni barua moja kuu au, wakati barua ya kwanza tayari “imechukuliwa” na kipengele kingine, mchanganyiko wa barua mbili. Vipengele vingine hufuata neno la Kiingereza kwa elementi, kama vile C kwa kaboni na Ca kwa kalsiamu. Ishara za kemikali za vipengele vingine vinatokana na majina yao ya Kilatini; kwa mfano, alama ya sodiamu ni Na, akimaanisha natrium, neno la Kilatini kwa sodiamu.
Elementi nne zinazofanana na viumbe hai vyote ni oksijeni (O), kaboni (C), hidrojeni (H), na nitrojeni (N). Katika ulimwengu usio hai, vipengele vinapatikana kwa idadi tofauti, na baadhi ya vipengele vya kawaida kwa viumbe hai ni nadra sana duniani kwa ujumla, kama inavyoonekana katika Jedwali\(\PageIndex{1}\). Kwa mfano anga ni tajiri wa nitrojeni na oksijeni lakini ina kaboni na hidrojeni kidogo, ilhali ukoko wa dunia, ingawa una oksijeni na kiasi kidogo cha hidrojeni, kina nitrojeni na kaboni kidogo. Licha ya tofauti zao kwa wingi, elementi zote na athari za kemikali kati yao hutii sheria zileile za kemikali na kimwili bila kujali kama ni sehemu ya dunia hai au isiyo hai.
| Element | Maisha (Binadamu) | Anga | Ukonde wa Dunia |
|---|---|---|---|
| Oksijeni (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | fuatilia | fuatilia |
| Hidrojeni (H) | 10% | fuatilia | 0.1% |
| Nitrojeni (N) | 3% | 78% | fuatilia |
Muundo wa Atom
Ili kuelewa jinsi mambo yanavyokusanyika, lazima kwanza kujadili sehemu ndogo au jengo la kipengele, atomi. Atomu ni kitengo kidogo cha suala ambacho kinahifadhi mali zote za kemikali za elementi. Kwa mfano, atomi moja ya dhahabu ina mali yote ya dhahabu kwa kuwa ni chuma kigumu kwenye joto la kawaida. Sarafu ya dhahabu ni tu idadi kubwa sana ya atomi za dhahabu zilizoumbwa katika umbo la sarafu na zenye kiasi kidogo cha elementi nyingine zinazojulikana kama uchafu. Atomi za dhahabu haziwezi kuvunjwa kuwa kitu chochote kidogo huku bado zikihifadhi mali za dhahabu.
Atomu inaundwa na mikoa miwili: kiini, ambayo iko katikati ya atomu na ina protoni na nyutroni, na kanda ya nje ya atomu ambayo ina elektroni zake katika obiti kuzunguka kiini, kama inavyoonekana katika Kielelezo\(\PageIndex{1}\). Atomi zina protoni, elektroni, na nyutroni, kati ya chembe nyingine za subatomiki. Mbali pekee ni hidrojeni (H), ambayo hutengenezwa kwa protoni moja na elektroni moja isiyo na nyutroni.
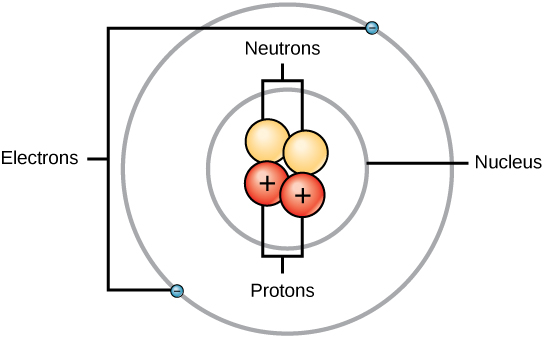
Protoni na nyutroni zina takriban masi sawa, takriban gramu 1.67 × 10 -24. Wanasayansi hufafanua kiholela kiasi hiki cha wingi kama kitengo kimoja cha molekuli ya atomiki (amu) au Dalton moja, kama inavyoonekana katika Jedwali\(\PageIndex{2}\). Ingawa ni sawa katika wingi, protoni na nyutroni hutofautiana katika malipo yao ya umeme. Protoni ina chaji chanya ilhali neutroni haijulikani. Kwa hiyo, idadi ya nyutroni katika atomu inachangia sana kwa wingi wake, lakini si kwa malipo yake. Electroni ni ndogo sana kwa wingi kuliko protoni, yenye uzito wa gramu 9.11 × 10 -28 tu, au kuhusu 1/1800 ya kitengo cha molekuli ya atomia. Kwa hiyo, hazichangia sana kwenye molekuli ya atomiki ya jumla ya elementi. Kwa hiyo, wakati wa kuzingatia molekuli atomia, ni desturi ya kupuuza masi ya elektroni yoyote na kuhesabu masi ya atomu kulingana na idadi ya protoni na nyutroni pekee. Ingawa si wachangiaji muhimu kwa wingi, elektroni huchangia sana chaji ya atomu, kwani kila elektroni ina chaji hasi sawa na chaji chanya ya protoni. Katika atomi zisizochajwa, zisizo na upande wowote, idadi ya elektroni zinazozunguka kiini ni sawa na idadi ya protoni ndani ya kiini. Katika atomi hizi, mashtaka chanya na hasi hughairi kila mmoja nje, na kusababisha atomi isiyo na chaji wavu.
Uhasibu kwa ukubwa wa protoni, nyutroni, na elektroni, kiasi kikubwa cha atomi-kubwa kuliko asilimia 99—ni, kwa kweli, nafasi tupu. Pamoja na nafasi hii yote tupu, mtu anaweza kuuliza kwa nini kinachojulikana vitu imara si tu kupita kwa kila mmoja. Sababu hawafanyi ni kwamba elektroni zinazozunguka atomi zote zinashtakiwa vibaya na mashtaka hasi yanarudiana.
| Charge | Misa (amu) | Eneo | |
|---|---|---|---|
| proton | +1 | 1 | kiini |
| Neutroni | 0 | 1 | kiini |
| Electron | -1 | 0 | orbitals |
Idadi ya Atomiki na Misa
Atomi za kila elementi zina idadi ya tabia ya protoni na elektroni. Idadi ya protoni huamua namba atomia ya elementi na hutumiwa kutofautisha elementi moja na nyingine. Idadi ya nyutroni ni ya kutofautiana, na kusababisha isotopi, ambazo ni aina tofauti za atomi ileile ambazo hutofautiana tu kwa idadi ya nyutroni wanazo nazo. Kwa pamoja, idadi ya protoni na idadi ya nyutroni huamua idadi ya wingi wa kipengele, kama ilivyoonyeshwa kwenye Kielelezo\(\PageIndex{2}\). Kumbuka kwamba mchango mdogo wa wingi kutoka kwa elektroni hupuuzwa kwa kuhesabu idadi ya wingi. Makadirio haya ya molekuli yanaweza kutumika kwa urahisi kuhesabu jinsi nyutroni nyingi elementi ina kwa kutoa tu idadi ya protoni kutoka idadi ya wingi. Kwa kuwa isotopi za elementi zitakuwa na namba tofauti kidogo za molekuli, wanasayansi pia huamua masi atomia, ambayo ni maana ya mahesabu ya namba ya wingi kwa isotopi zake zinazotokea kiasili. Mara nyingi, nambari inayosababisha ina sehemu. Kwa mfano molekuli atomia ya klorini (Cl) ni 35.45 kwa sababu klorini inaundwa na isotopi kadhaa, baadhi (wengi) yenye masi atomia 35 (protoni 17 na nyutroni 18) na baadhi yenye masi atomia 37 (protoni 17 na nyutroni 20).
Sanaa Connection
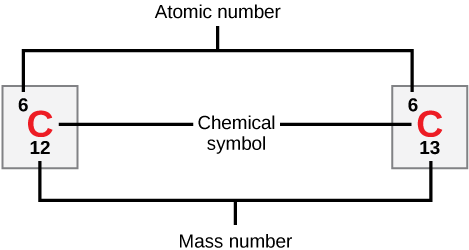
Ni neutroni ngapi ambazo kaboni-12 na kaboni-13 zina, kwa mtiririko huo?
Isotopu
Isotopi ni aina tofauti za elementi ambazo zina idadi sawa ya protoni lakini idadi tofauti ya nyutroni. Baadhi ya vipengele—kama vile kaboni, potasiamu, na uranium-vina isotopi za kawaida zinazotokea. Kaboni-12 ina protoni sita, nyutroni sita, na elektroni sita; kwa hiyo, ina idadi kubwa ya 12 (protoni sita na nyutroni sita). Kaboni-14 ina protoni sita, nyutroni nane, na elektroni sita; masi atomia yake ni 14 (protoni sita na nyutroni nane). Aina hizi mbili mbadala za kaboni ni isotopi. Isotopi zingine zinaweza kutoa nyutroni, protoni, na elektroni, na kufikia usanidi wa atomia thabiti zaidi (kiwango cha chini cha nishati ya uwezo); hizi ni isotopu za mionzi, au radioisotopu. Kuoza kwa mionzi (kaboni-14 kupoteza neutroni hadi hatimaye kuwa kaboni-12) inaelezea upotevu wa nishati unaotokea wakati kiini cha atomi kisicho na msimamo kinatoa mionzi.
Evolution uhusiano: Carbon dating
Kawaida kaboni iko katika angahewa kwa namna ya misombo ya gesi kama dioksidi kaboni na methane. Kaboni-14 (\(\ce C^{14}\)) ni isotopu ya radioisotopu inayotokea kiasili inayoundwa katika angahewa kutoka angahewa\(\ce N^{14}\) (nitrojeni) kwa kuongeza nyutroni na kupoteza protoni kwa sababu ya mionzi ya cosmic. Huu ni mchakato unaoendelea, hivyo zaidi daima\(\ce C^{14}\) huundwa. Kama kiumbe hai kinashirikisha\(\ce C^{14}\) awali kama dioksidi kaboni iliyowekwa katika mchakato wa usanisinuru, kiasi cha jamaa\(\ce C^{14}\) katika mwili wake ni sawa na mkusanyiko wa\(\ce C^{14}\) katika anga. Wakati kiumbe akifa, ni tena kumeza\(\ce C^{14}\), hivyo uwiano kati\(\ce C^{14}\) na kushuka kama\(\ce C^{12}\)\(\ce C^{14}\) kuoza hatua kwa hatua na mchakato kuitwa beta kuoza-chafu ya elektroni au positrons.\(\ce N^{14}\) Kuoza hii hutoa nishati katika mchakato wa polepole.
Baada ya takriban 5,730 miaka, nusu ya mkusanyiko kuanzia wa\(\ce C^{14}\) mapenzi kuwa waongofu nyuma\(\ce N^{14}\). Muda unaotumika kwa nusu ya mkusanyiko asilia wa isotopu kuoza nyuma kwa umbo lake imara zaidi huitwa nusumaisha yake. Kwa sababu nusu ya maisha ya\(\ce C^{14}\) ni ndefu, hutumiwa hadi sasa vitu vilivyo hai kama vile mifupa ya zamani au kuni. Kulinganisha uwiano wa\(\ce C^{14}\) mkusanyiko unaopatikana katika kitu na kiasi cha\(\ce C^{14}\) wanaogunduliwa angahewa, kiasi cha isotopu ambacho bado hakijaharibika kinaweza kuamua. Kwa misingi ya kiasi hiki, umri wa nyenzo, kama vile mammoth ya pygmy iliyoonyeshwa kwenye Kielelezo\(\PageIndex{3}\), inaweza kuhesabiwa kwa usahihi ikiwa sio zaidi kuliko miaka 50,000. Elementi nyingine zina isotopi zenye maisha ya nusu tofauti. Kwa mfano,\(\ce K^{40}\) (potasium-40) ina nusu ya maisha ya miaka bilioni 1.25, na\(\ce U^{235}\) (Uranium 235) ina nusu ya maisha ya takriban miaka milioni 700. Kupitia matumizi ya dating dating, wanasayansi wanaweza kujifunza umri wa fossils au mabaki mengine ya viumbe haiko kuelewa jinsi viumbe vimebadilika kutoka kwa aina za awali.

Unganisha na Kujifunza

Video: Ili kujifunza zaidi kuhusu atomi, isotopu, na jinsi ya kuwaambia isotopu moja kutoka kwa mwingine, tembelea tovuti hii na uendesha simulation.
Jedwali la Mara kwa mara
Mambo tofauti yanapangwa na kuonyeshwa kwenye meza ya mara kwa mara. Iliyoundwa na mwanakemia wa Kirusi Dmitri Mendeleev (1834—1907) mnamo mwaka wa 1869, vikundi vya meza ambavyo, ingawa ni vya kipekee, vinashiriki mali fulani za kemikali na vipengele vingine. Mali ya vipengele ni wajibu wa hali yao ya kimwili kwa joto la kawaida: inaweza kuwa gesi, solids, au vinywaji. Vipengele pia vina reactivity maalum ya kemikali, uwezo wa kuchanganya na kuunganisha kemikali kwa kila mmoja.
Katika meza ya mara kwa mara, inavyoonekana kwenye Kielelezo
Video: Tazama uhuishaji huu wa kuona ili uone mpangilio wa anga wa orbitals p na s.
Athari za kemikali na Molekuli
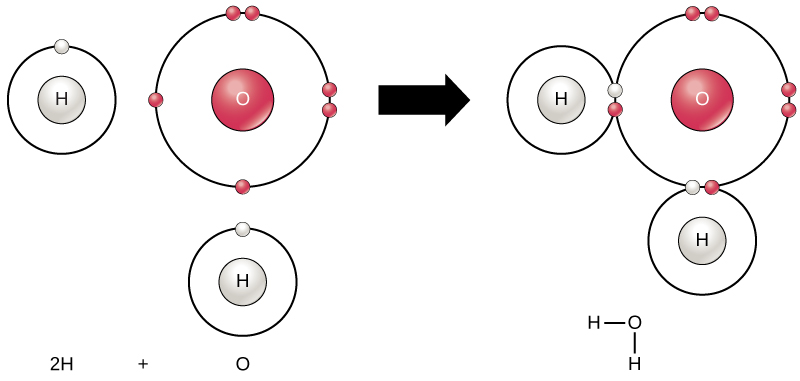
Vipengele vyote ni imara zaidi wakati shell yao ya nje imejaa elektroni kulingana na utawala wa octet. Hii ni kwa sababu ni energetically nzuri kwa atomi kuwa katika Configuration kwamba na inawafanya imara. Hata hivyo, kwa kuwa si elementi zote zina elektroni za kutosha kujaza maganda yao ya nje, atomi huunda vifungo vya kemikali na atomi nyingine na hivyo kupata elektroni wanazohitaji ili kufikia usanidi thabiti wa elektroni. Wakati atomi mbili au zaidi zinahusiana na kemikali, muundo wa kemikali unaosababishwa ni molekuli. familiar maji molekuli, H 2 O, lina atomi mbili hidrojeni na atomi moja oksijeni; hizi dhamana pamoja na kuunda maji, kama inavyoonekana katika Kielelezo\(\PageIndex{8}\). Atomi zinaweza kuunda molekuli kwa kuchangia, kukubali, au kugawana elektroni ili kujaza maganda yao ya nje.
Athari za kemikali hutokea wakati atomi mbili au zaidi zinaunganishwa pamoja ili kuunda molekuli au wakati atomi zilizounganishwa zinavunjika mbali. Dutu zilizotumiwa mwanzoni mwa mmenyuko wa kemikali huitwa reactants (kwa kawaida hupatikana upande wa kushoto wa equation ya kemikali), na vitu vinavyopatikana mwishoni mwa mmenyuko hujulikana kama bidhaa (kwa kawaida hupatikana upande wa kulia wa equation ya kemikali). Mshale ni kawaida inayotolewa kati ya reactants na bidhaa kuonyesha mwelekeo wa mmenyuko wa kemikali; mwelekeo huu si mara zote “njia moja ya barabara.” Kwa kuundwa kwa molekuli ya maji iliyoonyeshwa hapo juu, equation ya kemikali itakuwa:
\[\ce{2H + O \rightarrow H_2O} \nonumber\]
Mfano wa mmenyuko rahisi wa kemikali ni kuvunja molekuli ya peroxide ya hidrojeni, ambayo kila moja ina atomi mbili za hidrojeni zilizounganishwa na atomi mbili za oksijeni (H 2 O 2). Peroxide ya hidrojeni iliyojitokeza imevunjwa ndani ya maji, yenye atomi moja ya oksijeni inayofungwa na atomi mbili za hidrojeni (H 2 O), na oksijeni, ambayo ina atomi mbili za oksijeni zilizounganishwa (O 2). Katika equation chini, majibu ni pamoja na molekuli mbili peroxide ya hidrojeni na molekuli mbili za maji. Huu ni mfano wa usawa kemikali equation, ambayo idadi ya atomi ya kila kipengele ni sawa katika kila upande wa equation. Kwa mujibu wa sheria ya uhifadhi wa suala, idadi ya atomi kabla na baada ya mmenyuko wa kemikali inapaswa kuwa sawa, kama kwamba hakuna atomi, chini ya hali ya kawaida, iliyoundwa au kuharibiwa.
\[\ce{2H_2O_2\: (hydrogen\: peroxide) \rightarrow 2H_2O\: (water) + O_2\: (oxygen)} \nonumber\]
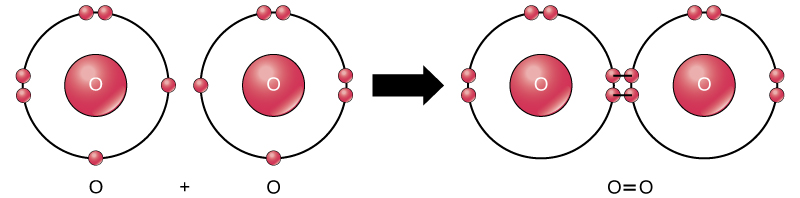
Ingawa wote wa reactants na bidhaa za mmenyuko huu ni molekuli (kila atomi bado bonded kwa angalau atomi nyingine), katika mmenyuko huu tu peroxide hidrojeni na maji ni wawakilishi wa misombo: zina atomi ya aina zaidi ya moja ya kipengele. Masi oksijeni, kwa upande mwingine, kama inavyoonekana katika Kielelezo\(\PageIndex{9}\), lina mbili mbili bonded atomi oksijeni na si classified kama kiwanja lakini kama molekuli mononuclear.
Baadhi ya athari za kemikali, kama vile zilizoonyeshwa hapo juu, zinaweza kuendelea katika mwelekeo mmoja mpaka majibu yote yatumiwe. Ulinganisho unaoelezea athari hizi zina mshale usio na mwelekeo na hauwezi kurekebishwa. Athari zinazobadilishwa ni wale ambao wanaweza kwenda katika mwelekeo wowote. Katika athari zinazobadilishwa, majibu yanageuka kuwa bidhaa, lakini wakati mkusanyiko wa bidhaa huenda zaidi ya kizingiti fulani (tabia ya mmenyuko fulani), baadhi ya bidhaa hizi zitabadilishwa tena kuwa reactants; kwa hatua hii, majina ya bidhaa na reactants yanabadilishwa. Hii nyuma na kurudi inaendelea mpaka uwiano fulani wa jamaa kati ya reactants na bidhaa hutokea-hali inayoitwa usawa. Hali hizi za athari za kurekebishwa mara nyingi zinaashiria na equation ya kemikali na mshale unaoongozwa mara mbili unaoelekeza kuelekea majibu na bidhaa zote mbili.
Kwa mfano, katika damu ya binadamu, ions ya hidrojeni ya ziada (H +) hufunga kwa ions za bicarbonate (HCO 3 -) kutengeneza hali ya usawa na asidi ya kaboni (H 2 CO 3). Ikiwa asidi ya kaboni iliongezwa kwenye mfumo huu, baadhi yake ingebadilishwa kuwa ioni za bicarbonate na hidrojeni.
\[\ce{HCO^{-}_3 + H^+ \leftrightarrow H_2CO_3} \nonumber\]
Katika athari za kibiolojia, hata hivyo, usawa hupatikana mara chache kwa sababu viwango vya reactants au bidhaa au vyote viwili vinabadilika mara kwa mara, mara nyingi na bidhaa ya mmenyuko mmoja kuwa mkazo kwa mwingine. Kurudi kwenye mfano wa ions nyingi za hidrojeni katika damu, malezi ya asidi ya kaboni itakuwa mwelekeo mkubwa wa mmenyuko. Hata hivyo, asidi ya kaboni pia inaweza kuondoka mwili kama gesi ya dioksidi kaboni (kupitia kutolea nje) badala ya kugeuzwa nyuma kwa ioni ya bicarbonate, hivyo kuendesha gari majibu ya haki kwa sheria ya kemikali inayojulikana kama sheria ya hatua ya molekuli. Athari hizi ni muhimu kwa kudumisha homeostasis ya damu yetu.
\[\ce{HCO_3^- + H^+ \leftrightarrow H_2CO_3 \leftrightarrow CO_2 + H_2O} \nonumber\]
Ions na Ionic vifungo
Baadhi ya atomi huwa imara zaidi wanapopata au kupoteza elektroni (au pengine mbili) na kuunda ioni. Hii inajaza shell yao ya nje ya elektroni na inawafanya kuwa imara zaidi. Kwa sababu idadi ya elektroni haifai idadi ya protoni, kila ion ina chaji wavu. Cations ni ions chanya ambazo hutengenezwa kwa kupoteza elektroni. Ions hasi huundwa kwa kupata elektroni na huitwa anions. Anioni huteuliwa kwa jina lao la msingi likibadilishwa ili kuishia katika “-ide”: anioni ya klorini inaitwa kloridi, na anioni ya sulfuri inaitwa sulfidi, kwa mfano.
Mwendo huu wa elektroni kutoka elementi moja hadi nyingine hujulikana kama uhamisho wa elektroni. Kama Kielelezo\(\PageIndex{10}\) unaeleza, sodiamu (Na) ina elektroni moja tu katika ganda lake la nje la elektroni. Inachukua nishati kidogo kwa sodiamu kuchangia hiyo elektroni moja kuliko inavyofanya ili kukubali elektroni saba zaidi kujaza ganda la nje. Ikiwa sodiamu inapoteza elektroni, sasa ina protoni 11, neutroni 11, na elektroni 10 tu, na kuiacha kwa malipo ya jumla ya +1. Sasa inajulikana kama ion ya sodiamu. Klorini (Cl) katika hali yake ya chini kabisa ya nishati (inayoitwa hali ya ardhi) ina elektroni saba katika ganda lake la nje. Tena, ni ufanisi zaidi wa nishati kwa klorini kupata elektroni moja kuliko kupoteza saba. Kwa hiyo inaelekea kupata elektroni kuunda ioni yenye protoni 17, nyutroni 17, na elektroni 18, ikitoa chaji hasi (—1). Sasa inajulikana kama ioni ya kloridi. Katika mfano huu, sodiamu itachangia elektroni yake moja ili kuifuta ganda lake, na klorini itakubali elektroni hiyo kujaza ganda lake. Ions zote mbili sasa zinakidhi utawala wa octet na zina makombora kamili ya nje. Kwa sababu idadi ya elektroni si sawa tena na idadi ya protoni, kila sasa ni ion na ina chaji +1 (sodiamu cation) au -1 (kloridi anioni). Kumbuka kuwa shughuli hizi zinaweza kutokea tu wakati huo huo: ili atomi ya sodiamu ipoteze elektroni, lazima iwe mbele ya mpokeaji anayefaa kama atomi ya klorini.
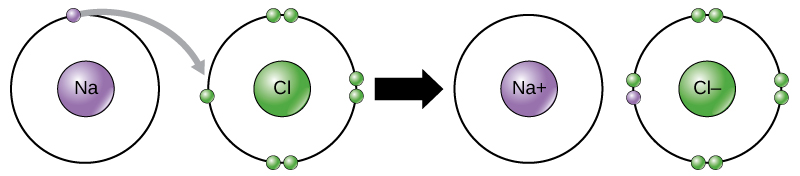
Vifungo vya Ionic vinaundwa kati ya ions na mashtaka kinyume. Kwa mfano, chanya kushtakiwa ions sodiamu na hasi kushtakiwa ions kloridi dhamana pamoja kufanya fuwele ya sodium chloride, au meza chumvi, kujenga molekuli fuwele na zero wavu malipo.
Chumvi fulani hujulikana katika fiziolojia kama electrolytes (ikiwa ni pamoja na sodiamu, potasiamu, na kalsiamu), ions zinazohitajika kwa upitishaji wa msukumo wa neva, vipande vya misuli na usawa Vinywaji vingi vya michezo na virutubisho vya malazi hutoa ions hizi kuchukua nafasi ya wale waliopotea kutoka mwilini kupitia jasho wakati wa zoezi.
Covalent vifungo na vifungo vingine na mwingiliano
Njia nyingine utawala wa octet unaweza kuridhika ni kwa kugawana elektroni kati ya atomi ili kuunda vifungo vya covalent. Vifungo hivi ni nguvu na vya kawaida zaidi kuliko vifungo vya ionic katika molekuli za viumbe hai. Vifungo vyema hupatikana kwa kawaida katika molekuli za kikaboni za kaboni, kama vile DNA na protini zetu. Vifungo vyema vinapatikana pia katika molekuli isokaboni kama H 2 O, CO 2, na O 2. Jozi moja, mbili, au tatu za elektroni zinaweza kugawanywa, na kufanya vifungo moja, mara mbili, na vitatu, kwa mtiririko huo. Vifungo vingi zaidi kati ya atomi mbili, nguvu zaidi ya uhusiano wao. Hivyo, vifungo vitatu ni nguvu zaidi.
Nguvu za viwango tofauti vya bonding covalent ni mojawapo ya sababu kuu viumbe hai wana wakati mgumu katika kupata nitrojeni kwa matumizi katika kujenga molekuli zao, ingawa nitrojeni ya Masi, N 2, ni gesi tele zaidi katika anga. Nitrojeni ya molekuli ina atomi mbili za nitrojeni zilizounganishwa mara tatu na, kama ilivyo kwa molekuli zote, kugawana kwa jozi hizi tatu za elektroni kati ya atomi mbili za nitrojeni inaruhusu kujaza maganda yao ya nje ya elektroni, na kufanya molekuli imara zaidi kuliko atomi za nitrojeni za mtu binafsi. Dhamana hii imara mara tatu inafanya kuwa vigumu kwa mifumo ya maisha kuvunja mbali nitrojeni hii ili kuitumia kama sehemu za protini na DNA.
Uundaji wa molekuli za maji hutoa mfano wa kuunganisha covalent. Atomi za hidrojeni na oksijeni zinazochanganya kuunda molekuli za maji zimefungwa pamoja na vifungo vya covalent, kama inavyoonekana katika Kielelezo\(\PageIndex{8}\). Electroni kutoka hidrojeni hugawanya muda wake kati ya ganda la nje lisilokwisha la atomi za hidrojeni na ganda la nje lisilo kamili la atomi za oksijeni Ili kujaza kabisa ganda la nje la oksijeni, ambalo lina elektroni sita katika ganda lake la nje lakini ambalo litakuwa imara zaidi na nane, elektroni mbili (moja kutoka kila atomi ya hidrojeni) zinahitajika: hivyo formula inayojulikana H 2 O. elektroni zinashirikiwa kati ya elementi mbili kujaza ganda la nje la kila mmoja, na kufanya mambo yote imara zaidi.
Unganisha na Kujifunza
Video: Tazama video hii fupi ili uone uhuishaji wa kuunganisha ionic na covalent.
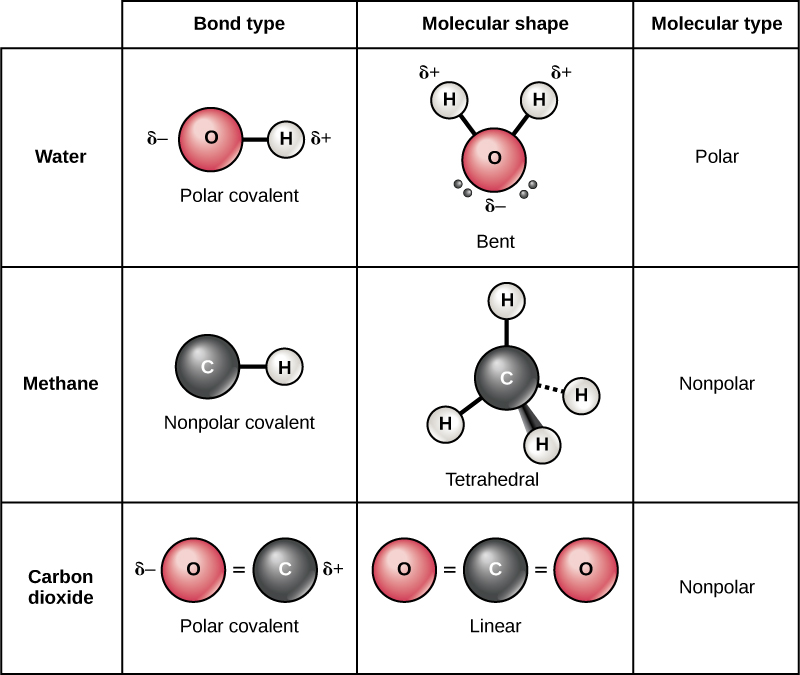
Polar covalent vifungo
Kuna aina mbili za vifungo vya covalent: polar na nonpolar. Katika dhamana covalent polar, inavyoonekana katika Kielelezo\(\PageIndex{11}\), elektroni ni unequality pamoja na atomi na ni kuvutia zaidi ya kiini moja kuliko nyingine. Kwa sababu ya usambazaji usio sawa wa elektroni kati ya atomi za elementi tofauti, chanya kidogo (δ +) au kidogo hasi (δ —) chaji huendelea. Malipo haya ya sehemu ni mali muhimu ya maji na akaunti kwa sifa zake nyingi.
Maji ni molekuli ya polar, na atomi za hidrojeni hupata malipo ya sehemu nzuri na oksijeni ni malipo mabaya ya sehemu. Hii hutokea kwa sababu kiini cha atomi ya oksijeni kinavutia zaidi elektroni za atomi za hidrojeni kuliko kiini cha hidrojeni ni elektroni za oksijeni. Hivyo oksijeni ina electronegativity ya juu kuliko hidrojeni na elektroni zilizoshirikiwa hutumia muda mwingi karibu na kiini cha oksijeni kuliko wanavyofanya karibu na kiini cha atomi za hidrojeni, ikitoa atomi za oksijeni na hidrojeni chaji kidogo hasi na chanya, mtawalia. Njia nyingine ya kusema hii ni kwamba uwezekano wa kupata elektroni iliyoshirikiwa karibu na kiini cha oksijeni ni uwezekano mkubwa kuliko kuipata karibu na kiini cha hidrojeni. Aidha njia, electronegativity jamaa atomi inachangia maendeleo ya mashtaka sehemu wakati wowote kipengele kimoja kikubwa zaidi electronegative kuliko nyingine, na mashtaka yanayotokana na vifungo hizi polar inaweza kisha kutumika kwa ajili ya malezi ya vifungo hidrojeni kulingana na mvuto wa kinyume sehemu ya mashtaka. (Vifungo vya hidrojeni, ambavyo vinajadiliwa kwa undani hapa chini, ni vifungo dhaifu kati ya atomi za hidrojeni zenye kushtakiwa kidogo kwa atomi za chaji vibaya katika molekuli nyingine. Kwa kuwa macromolecules mara nyingi zina atomi ndani yao ambazo hutofautiana katika electronegativity, vifungo vya polar mara nyingi hupo katika molekuli za kikaboni
Nonpolar Covalent vifungo
Nonpolar covalent vifungo fomu kati ya atomi mbili ya elementi moja au kati ya mambo mbalimbali kwamba kushiriki elektroni sawa. Kwa mfano, oksijeni ya molekuli (O 2) ni nonpolar kwa sababu elektroni zitasambazwa sawa kati ya atomi mbili za oksijeni.
Mfano mwingine wa dhamana ya nonpolar covalent ni methane (CH 4), pia inavyoonekana katika Kielelezo\(\PageIndex{11}\). Kaboni ina elektroni nne katika ganda lake la nje kabisa na inahitaji nne zaidi ili kuijaza. Hupata hizi nne kutoka atomi nne za hidrojeni, kila atomu zinazotoa moja, na kufanya ganda la nje imara la elektroni nane. Kaboni na hidrojeni hazina electronegativity sawa lakini ni sawa; hivyo, vifungo vya nonpolar vinaunda. Atomi za hidrojeni kila zinahitaji elektroni moja kwa ganda lao la nje kabisa, ambalo linajazwa linapokuwa na elektroni mbili. Mambo haya hushiriki elektroni sawa kati ya kaboni na atomi za hidrojeni, na kujenga molekuli isiyo ya kawaida ya covalent.
Hidrojeni dhamana na Van Der Waals mwingiliano
Ionic na covalent vifungo kati ya mambo yanahitaji nishati kuvunja. Vifungo vya Ionic sio nguvu kama covalent, ambayo huamua tabia zao katika mifumo ya kibiolojia. Hata hivyo, sio vifungo vyote ni vifungo vya ionic au vyema. Vifungo dhaifu vinaweza pia kuunda kati ya molekuli. Vifungo viwili dhaifu vinavyotokea mara nyingi ni vifungo vya hidrojeni na mwingiliano wa van der Waals Bila aina hizi mbili za vifungo, maisha kama tunavyojua hayapo. Vifungo vya hidrojeni hutoa mali nyingi muhimu, zinazoendelea maisha ya maji na pia huimarisha miundo ya protini na DNA, kizuizi cha seli.
Wakati vifungo vya covalent vya polar vyenye fomu ya hidrojeni, hidrojeni katika dhamana hiyo ina chaji kidogo chanya kwa sababu elektroni ya hidrojeni huvutwa kwa nguvu zaidi kuelekea kipengele kingine na mbali na hidrojeni. Kwa sababu hidrojeni ni chanya kidogo, itavutiwa na mashtaka ya jirani hasi. Hili likitokea, mwingiliano dhaifu hutokea kati ya δ + ya hidrojeni kutoka molekuli moja na δ — malipo kwenye atomi za elektronegative zaidi za molekuli nyingine, kwa kawaida oksijeni au nitrojeni, au ndani ya molekuli hiyo. Mwingiliano huu huitwa dhamana ya hidrojeni. Aina hii ya dhamana ni ya kawaida na hutokea mara kwa mara kati ya molekuli za maji. Vifungo vya hidrojeni binafsi ni dhaifu na vimevunjika kwa urahisi; hata hivyo, hutokea kwa idadi kubwa sana katika maji na katika polima za kikaboni, na kujenga nguvu kubwa kwa macho. Vifungo vya hidrojeni pia huwajibika kwa kuziba pamoja DNA mara mbili helix.
Kama vifungo hidrojeni, van der Waals mwingiliano ni vivutio dhaifu au mwingiliano kati ya molekuli Vivutio vya Van der Waals vinaweza kutokea kati ya molekuli zozote mbili au zaidi na zinategemea kushuka kidogo kwa densiti za elektroni, ambazo si mara zote zilinganifu karibu na atomu. Kwa vivutio hivi kutokea, molekuli zinahitaji kuwa karibu sana. Hizi vifungo - pamoja na ionic, covalent, na dhamana hidrojeni-kuchangia muundo tatu-dimensional ya protini katika seli zetu kwamba ni muhimu kwa ajili ya kazi yao sahihi.
Uhusiano wa Kazi: Kemia ya Madawa
Madaktari wa dawa wanajibika kwa ajili ya maendeleo ya madawa mapya na kujaribu kuamua hali ya utekelezaji wa madawa ya kulevya na ya zamani. Wanahusika katika kila hatua ya mchakato wa maendeleo ya madawa ya kulevya. Madawa ya kulevya yanaweza kupatikana katika mazingira ya asili au yanaweza kuunganishwa katika maabara. Mara nyingi, madawa ya kulevya yanayoweza kupatikana katika asili yanabadilishwa kikemia katika maabara ili kuwafanya kuwa salama na ufanisi zaidi, na wakati mwingine matoleo ya synthetic ya madawa ya kulevya badala ya toleo lililopatikana katika asili.
Baada ya ugunduzi wa awali au awali ya madawa ya kulevya, kemia kisha anaendelea madawa ya kulevya, labda kubadilisha kemikali, kupima ili kuona kama madawa ya kulevya ni sumu, na kisha kubuni mbinu za uzalishaji wa ufanisi kwa kiasi kikubwa. Kisha, mchakato wa kupata madawa ya kulevya kupitishwa kwa matumizi ya binadamu huanza. Nchini Marekani, kibali cha madawa ya kulevya kinashughulikiwa na Utawala wa Chakula na Dawa (FDA) na unahusisha mfululizo wa majaribio makubwa kwa kutumia masomo ya binadamu ili kuhakikisha dawa hiyo haina madhara na kwa ufanisi huchukua hali ambayo inalenga kutibu. Utaratibu huu mara nyingi huchukua miaka kadhaa na inahitaji ushiriki wa madaktari na wanasayansi, pamoja na maduka ya dawa, kukamilisha kupima na kupata idhini.
Mfano wa dawa ambayo awali iligunduliwa katika kiumbe hai ni Paclitaxel (Taxol), dawa ya kupambana na kansa inayotumika kutibu saratani ya matiti. Dawa hii iligunduliwa katika gome la mti wa pacific yew. Mfano mwingine ni aspirini, awali iliyotengwa na gome la mti wa Willow. Kutafuta madawa ya kulevya mara nyingi inamaanisha kupima mamia ya sampuli za mimea, fungi, na aina nyingine za maisha ili kuona kama misombo yoyote ya kibiolojia inapatikana ndani yao. Wakati mwingine, dawa za jadi zinaweza kutoa dalili za kisasa za dawa ambapo kiwanja cha kazi kinaweza kupatikana. Kwa mfano, matumizi ya gome la Willow kufanya dawa imekuwa inajulikana kwa maelfu ya miaka, dating nyuma Misri ya kale. Haikuwa mpaka miaka ya 1800 marehemu, hata hivyo, kwamba molekuli ya aspirini, inayojulikana kama asidi acetylsalicylic, ilitakaswa na kuuzwa kwa matumizi ya binadamu.
Mara kwa mara, madawa ya kulevya yaliyotengenezwa kwa matumizi moja yanapatikana kuwa na madhara yasiyotarajiwa yanayoruhusu dawa hizi kutumiwa kwa njia zingine, zisizohusiana. Kwa mfano, minoxidil ya madawa ya kulevya (Rogaine) ilianzishwa awali ili kutibu shinikizo la damu. Wakati wa kupimwa kwa wanadamu, ilibainishwa kuwa watu wanaotumia madawa ya kulevya watakua nywele mpya. Hatimaye dawa hiyo iliuzwa kwa wanaume na wanawake wenye upara ili kurejesha nywele zilizopotea.
Kazi ya kemia ya dawa inaweza kuhusisha kazi ya upelelezi, majaribio, na maendeleo ya madawa ya kulevya, wote kwa lengo la kufanya binadamu kuwa na afya njema.
Muhtasari
Jambo ni kitu chochote kinachukua nafasi na kina wingi. Imeundwa na vipengele. Vipengele vyote 92 vinavyotokea kiasili vina sifa za kipekee ambazo zinawawezesha kuchanganya kwa njia mbalimbali za kuunda molekuli, ambazo kwa upande huchanganya kuunda seli, tishu, mifumo ya chombo, na viumbe. Atomi, ambazo zinajumuisha protoni, nyutroni, na elektroni, ni vitengo vidogo vya elementi vinavyohifadhi mali zote za elementi hiyo. Electroni zinaweza kuhamishwa, pamoja, au kusababisha tofauti za malipo kati ya atomi ili kuunda vifungo, ikiwa ni pamoja na vifungo vya ioniki, covalent, na hidrojeni, pamoja na mwingiliano wa van der Waals.
Sanaa Connections
Kielelezo\(\PageIndex{2}\): Ni nyutroni ngapi ambazo kaboni-12 na kaboni-13 zina, kwa mtiririko huo?
- Jibu
-
Kaboni-12 ina nyutroni sita. Kaboni-13 ina nyutroni saba.
Kielelezo\(\PageIndex{6}\): atomi inaweza kutoa, kuchukua, au kushiriki elektroni na atomi nyingine ili kufikia shell kamili ya valence, usanidi wa elektroni imara zaidi. Kuangalia takwimu hii, ni elektroni ngapi ambazo vipengele katika kikundi 1 vinahitaji kupoteza ili kufikia usanidi wa elektroni imara? Ni elektroni ngapi ambazo vipengele katika vikundi 14 na 17 vinahitaji kupata ili kufikia usanidi thabiti?
- Jibu
-
Vipengele katika kikundi 1 vinahitaji kupoteza elektroni moja ili kufikia usanidi wa elektroni imara. Vipengele katika vikundi 14 na 17 vinahitaji kupata elektroni nne na moja, kwa mtiririko huo, ili kufikia usanidi thabiti.
faharasa
- anion
- ioni hasi ambayo hutengenezwa na atomi kupata elektroni moja au zaidi
- atomi
- kitengo ndogo ya jambo kwamba anakuwa wote wa mali ya kemikali ya kipengele
- molekuli atomiki
- mahesabu ya maana ya idadi ya wingi kwa isotopu ya elementi
- idadi ya atomiki
- jumla ya idadi ya protoni katika atomu
- usawa wa kemikali
- taarifa ya mmenyuko wa kemikali na idadi ya kila aina ya atomi iliyosawazishwa kwa bidhaa zote mbili na reactants
- cation
- chanya ion kwamba ni sumu kwa atomi kupoteza elektroni moja au zaidi
- kemikali dhamana
- mwingiliano kati ya mbili au zaidi ya atomi sawa au tofauti ambayo husababisha kuundwa kwa molekuli
- mmenyuko wa kemikali
- mchakato wa kuongoza kwa rearrangement ya atomi katika molekuli
- kemikali reactivity
- uwezo wa kuchanganya na kemikali dhamana na kila mmoja
- kiwanja
- Dutu linajumuisha molekuli yenye atomi ya mambo mawili tofauti
- dhamana ya covalent
- aina ya dhamana imara iliyoundwa kati ya mbili za elementi sawa au tofauti; hutengeneza wakati elektroni zinashirikiwa kati ya atomi
- electroliti
- ion muhimu kwa ajili ya uendeshaji wa msukumo wa neva, vipande vya misuli na usawa wa maji
- elektroni
- chembe ya subatomiki iliyosababishwa vibaya ambayo inakaa nje ya kiini katika orbital ya elektroni; inakosa molekuli ya kazi na ina chaji hasi ya kitengo -1
- usanidi wa elektroni
- mpangilio wa elektroni katika shell ya elektroni ya atomi (kwa mfano, 1s 2 2s 2 2p 6)
- elektroni orbital
- jinsi elektroni zinavyosambazwa kwa anga karibu na kiini; eneo ambako elektroni inawezekana kupatikana
- uhamisho wa elektroni
- harakati ya elektroni kutoka kipengele kimoja hadi nyingine; muhimu katika kuundwa kwa vifungo vya ionic
- electronegativity
- uwezo wa vipengele vingine kuvutia elektroni (mara nyingi ya atomi za hidrojeni), kupata mashtaka ya sehemu hasi katika molekuli na kujenga mashtaka ya sehemu chanya kwenye atomi za hidrojeni
- kipengee
- moja ya vitu 118 vya kipekee ambavyo haviwezi kuvunjwa kuwa vitu vidogo; kila kipengele kina mali ya pekee na idadi maalum ya protoni
- usawa
- hali ya kutosha ya ukolezi wa jamaa na bidhaa katika athari za kemikali zinazorekebishwa katika mfumo uliofungwa
- hidrojeni dhamana
- dhamana dhaifu kati ya atomi kidogo chanya chaji hidrojeni kwa atomi kidogo chaji vibaya katika molekuli
- gesi ya ajizi
- (pia, gesi vyeo) elementi na kujazwa nje elektroni shell kwamba ni unreactive na atomi nyingine
- ioni
- atomi au kemikali kundi ambayo haina idadi sawa ya protoni na elektroni
- ionic dhamana
- kemikali dhamana kwamba aina kati ya ions na mashtaka kinyume (cations na anions)
- majibu ya kemikali yasiyotumiwa
- kemikali mmenyuko ambapo reactants kuendelea uni-directionally kuunda bidhaa
- isotope
- aina moja au zaidi ya elementi ambayo ina idadi tofauti ya nyutroni
- sheria ya hatua ya molekuli
- sheria ya kemikali na kusema kuwa kiwango cha mmenyuko ni sawia na mkusanyiko wa vitu vinavyoitikia
- idadi ya molekuli
- jumla ya idadi ya protoni na nyutroni katika atomu
- jambo
- chochote ambacho kina molekuli na kinachukua nafasi
- molekuli
- atomi mbili au zaidi kemikali bonded pamoja
- neutroni
- chembe isiyochajiwa ambayo inakaa katika kiini cha atomu; ina masi ya amu moja
- gesi yenye heshima
- tazama gesi ya ajizi
- nonpolar covalent dhamana
- aina ya dhamana ya covalent ambayo huunda kati ya atomi wakati elektroni zinashirikiwa sawa kati yao
- kiini
- msingi wa atomu; ina protoni na nyutroni
- utawala wa nane
- utawala kwamba atomi ni imara zaidi wakati wao kushikilia elektroni nane katika shells yao ya nje
- ya mzunguko
- kanda inayozunguka kiini; ina elektroni
- meza ya mara kwa mara
- chati ya shirika ya vipengele vinavyoonyesha namba ya atomiki na molekuli ya atomiki ya kila kipengele; hutoa taarifa muhimu kuhusu mali ya vipengele
- polar covalent dhamana
- aina ya dhamana ya covalent ambayo hufanya kama matokeo ya ugawaji usio sawa wa elektroni, na kusababisha kuundwa kwa mikoa kidogo ya chanya na kidogo ya kushtakiwa ya molekuli
- bidhaa
- molekuli kupatikana upande wa kulia wa equation kemikali
- protoni
- chembe yenye chaji chanya inayokaa katika kiini cha atomu; ina masi ya amu moja na chaji ya +1
- isotopu redio
- isotopu inayotoa mionzi linajumuisha chembe za subatomiki ili kuunda vipengele vilivyo imara zaidi
- mwenye kujibu
- molekuli kupatikana upande wa kushoto wa equation kemikali
- mmenyuko wa kemikali ya kubadilishwa
- mmenyuko wa kemikali ambayo hufanya kazi mbili kwa moja, ambapo bidhaa zinaweza kugeuka kuwa reactants ikiwa ukolezi wao ni wa kutosha
- shell ya valence
- shell ya nje ya atomu
- mwingiliano wa van der Waals
- mwingiliano dhaifu sana kati ya molekuli kutokana na mashtaka ya muda kuvutia atomi ambazo ni karibu sana pamoja


