30.3: Nadharia ya Bohr ya Atom ya Hidrojeni
- Page ID
- 182910
Malengo ya kujifunza
Mwishoni mwa sehemu hii, utaweza:
- Eleza siri za spectra ya atomiki.
- Eleza nadharia ya Bohr ya atomi ya hidrojeni.
- Eleza mfano wa sayari wa Bohr wa atomi.
- Onyesha hali ya nishati kwa kutumia mchoro wa ngazi ya nishati.
- Eleza ushindi na mipaka ya nadharia ya Bohr.
Mwanafizikia mkuu wa Denmark Niels Bohr (1885—1962) alitumia mara moja mfano wa sayari wa Rutherford wa atomi. (Kielelezo\(\PageIndex{1}\)). Bohr aliamini uhalali wake na alitumia sehemu ya 1912 katika maabara ya Rutherford. Mwaka wa 1913, baada ya kurudi Copenhagen, alianza kuchapisha nadharia yake ya atomi rahisi, hidrojeni, kulingana na mfano wa sayari wa atomi. Kwa miongo kadhaa, maswali mengi yaliulizwa kuhusu sifa za atomiki. Kutoka ukubwa wao hadi spectra yao, mengi yalijulikana kuhusu atomi, lakini kidogo ilikuwa imeelezewa katika suala la sheria za fizikia. Nadharia ya Bohr ilieleza wigo atomiki wa hidrojeni na kuanzisha kanuni mpya na pana husika katika mechanics quantum.

Siri za Spectra ya Atomiki
Kama ilivyoelezwa katika “Quantization ya Nishati,” nguvu za mifumo ndogo ndogo ni quantized. Atomiki na Masi chafu na ngozi spectra wamekuwa inajulikana kwa zaidi ya karne ya kuwa discrete (au quantized) (Kielelezo\(\PageIndex{2}\)). Maxwell na wengine walikuwa wamegundua kwamba lazima kuwe na uhusiano kati ya wigo wa atomi na muundo wake, kitu kama masafa ya resonant ya vyombo vya muziki. Lakini, licha ya miaka ya jitihada za akili nyingi, hakuna mtu aliyekuwa na nadharia yenye nguvu. (Ilikuwa ni utani unaoendesha kwamba nadharia yoyote ya spectra ya atomiki na Masi inaweza kuharibiwa kwa kutupa kitabu cha data ndani yake, hivyo tata ilikuwa spectra.) Kufuatia pendekezo la Einstein la photoni na nguvu za kupimwa moja kwa moja sawia na wavelengths zao, ikawa dhahiri zaidi kwamba elektroni katika atomi zinaweza kuwepo tu katika njia za kipekee.
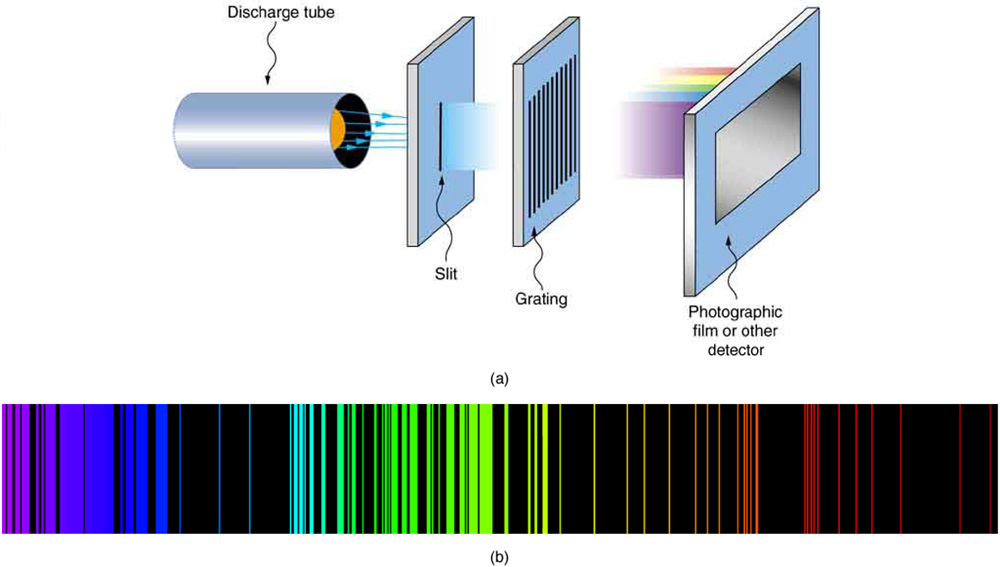
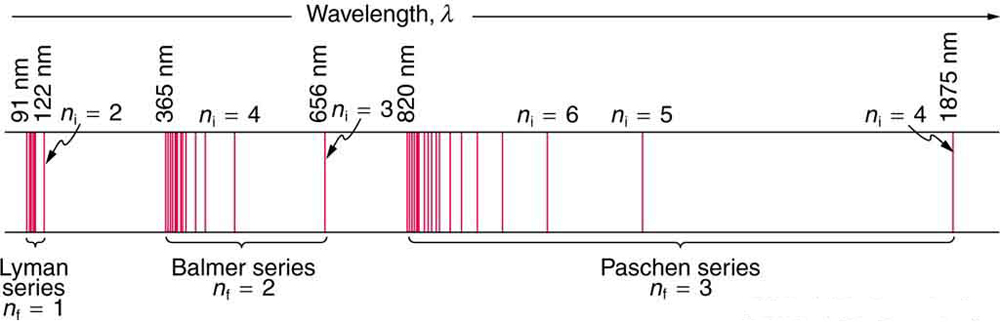
Katika baadhi ya matukio, ilikuwa inawezekana kuunda formula ambazo zilielezea spectra ya chafu. Kama unaweza kutarajia, atomi rahisi — hidrojeni, pamoja na elektroni yake moja — ina wigo rahisi. Wigo wa hidrojeni ulionekana katika infrared (IR), inayoonekana, na ultraviolet (UV), na mfululizo kadhaa wa mistari ya spectral ulikuwa umeonekana. (Angalia Kielelezo\(\PageIndex{3}\).) Mfululizo huu huitwa jina la watafiti wa mapema ambao walijifunza kwa kina fulani.
Wavelengths ya wigo wa hidrojeni inayoonekana inaweza kuhesabiwa kwa kutumia formula ifuatayo:
\[\frac{1}{\lambda} = R \left( \frac{1}{n_{f}^{2}} - \frac{1}{n_{i}^{2}} \right), \label{30.4.1}\]
wapi\(\lambda\) wavelength ya mionzi ya EM iliyotolewa na\(R\) ni mara kwa mara ya Rydberg, imedhamiriwa na jaribio kuwa
\[R = 1.097 \times 10^{7}/m \left( or m^{-1} \right).\label{30.4.2}\]
Mara kwa mara\(n_{f}\) ni integer chanya inayohusishwa na mfululizo maalum. Kwa mfululizo Lyman,\(n_{f} = 1\); kwa mfululizo Balmer,\(n_{f} = 2\); kwa mfululizo Paschen,\(n_{f} = 3\); na kadhalika. Mfululizo wa Lyman ni kabisa katika UV, wakati sehemu ya mfululizo wa Balmer inaonekana na UV iliyobaki. Mfululizo wa Paschen na wengine wote ni IR kabisa. Kuna inaonekana idadi isiyo na ukomo wa mfululizo, ingawa hulala kwa kasi zaidi ndani ya infrared na kuwa vigumu kuchunguza kama\(n_{f}\) ongezeko. Mara kwa mara\(n_{i}\) ni integer chanya, lakini lazima iwe kubwa kuliko\(n_{f}\). Hivyo, kwa mfululizo wa Balmer,\( n_{f} = 2\) na\(n_{i} = 3, 4, 5, 6, \cdot \cdot \cdot\). Kumbuka kwamba\(n_{i}\) inaweza kufikia infinity. Wakati formula katika wavelengths equation ilikuwa kichocheo tu iliyoundwa na fit data na haikuwa msingi wa kanuni za kimwili, haikuwa na maana zaidi. Balmer kwanza walipanga formula kwa mfululizo wake peke yake, na baadaye kupatikana kuelezea mfululizo wengine wote kwa kutumia maadili tofauti ya\(n_{f}\). Bohr alikuwa wa kwanza kuelewa maana ya kina zaidi. Tena, tunaona mwingiliano kati ya majaribio na nadharia katika fizikia. Kwa majaribio, spectra ilianzishwa vizuri, equation ilipatikana ili kufanana na data ya majaribio, lakini msingi wa kinadharia ulikuwa haupo.
Mfano\(\PageIndex{1}\): Calculating Wave Interference of a Hydrogen Line
Je, ni umbali kati ya slits ya grating ambayo inazalisha kwanza ili upeo kwa pili Balmer line kwa pembeni ya\(15^{\circ}\)?
Mkakati na Dhana:
Kwa tatizo Integrated Concept, ni lazima kwanza kutambua kanuni za kimwili kushiriki. Katika mfano huu, tunahitaji kujua (a) wavelength ya mwanga pamoja na (b) hali ya kuingiliwa upeo kwa mfano kutoka kwa watakata mara mbili. Sehemu (a) inahusika na mada ya sura ya sasa, wakati sehemu (b) inazingatia nyenzo za kuingiliwa kwa wimbi la “Wave Optics.”
Suluhisho kwa (a):
Hidrojeni wigo waveleng Mfululizo wa Balmer unahitaji hiyo\(n_{f} = 2\). Mstari wa kwanza katika mfululizo unachukuliwa kuwa\(n_{i} = 3\), na hivyo pili ingekuwa nayo\(n_{i} = 4\).
Mahesabu ni matumizi ya moja kwa moja ya equation ya wavelength. Kuingia maadili yaliyopangwa\(n_{f}\) na\(n_{i}\) mavuno
\[ \begin{align*} \frac{1}{\lambda} = R \left( \frac{1}{n_{f}^{2}} - \frac{1}{n_{i}^{2}} \right) \label{30.4.3} \\[5pt] &= \left(1.097 \times 10^{7} m^{-1}\right) \left( \frac{1}{2^{2}} - \frac{1}{4^{2}} \right) \\[5pt] &= 2.057 \times 10^{6} m^{-1}. \end{align*}\]
Majadiliano kwa (a):
Hii ni kweli wavelength iliyoonekana kwa majaribio, sawa na mstari wa pili (bluu-kijani) katika mfululizo wa Balmer. Kuvutia zaidi ni ukweli kwamba mapishi sawa sawa yanatabiri mistari yote ya wigo wa hidrojeni, ikiwa ni pamoja na mpya zilizoonekana katika majaribio yafuatayo. Nini asili inatuambia?
Suluhisho kwa (b):
Double watakata kuingiliwa (“Wave Optics”). Ili kupata kuingiliwa kwa kujenga kwa ajili ya kupasuka mara mbili, tofauti ya urefu wa njia kutoka slits mbili lazima iwe nyingi muhimu ya wavelength. Hali hii ilielezwa na equation
\[d \sin{\theta} = m \lambda, \nonumber \]
\(d\)wapi umbali kati ya slits na\(\theta\) ni angle kutoka mwelekeo wa awali wa boriti. Nambari\(m\) ni utaratibu wa kuingiliwa;\(m=1\) katika mfano huu. Kutatua\(d\) na kuingia mazao ya maadili inayojulikana
\[d = \frac{\left(1\right) \left(486 nm\right)}{\sin{15^{\circ}}} = 1.88 \times 10^{-6} m. \nonumber\]
Majadiliano kwa (b):
Nambari hii ni sawa na yale yaliyotumika katika mifano ya kuingiliwa ya “Utangulizi wa Fizikia ya Quantum” (na iko karibu na nafasi kati ya slits katika glasi za kawaida za diffraction).
Suluhisho la Bohr kwa Hidrojeni
Bohr aliweza kupata formula kwa wigo wa hidrojeni kwa kutumia fizikia ya msingi, mfano wa sayari wa atomi, na baadhi ya mapendekezo mapya muhimu sana. Pendekezo lake la kwanza ni kwamba njia fulani pekee zinaruhusiwa: tunasema ya kwamba njia za elektroni katika atomi zinahesabiwa. Kila obiti ina nishati tofauti, na elektroni zinaweza kuhamia kwenye obiti ya juu kwa kunyonya nishati na kushuka hadi obiti ya chini kwa kutoa nishati. Ikiwa orbits ni quantized, kiasi cha nishati kufyonzwa au kutolewa pia ni quantized, kuzalisha spectra discrete. Ufyonzaji wa photon na chafu ni miongoni mwa mbinu za msingi za kuhamisha nishati ndani na nje ya atomi. Nguvu za fotoni zinahesabiwa, na nishati zao zinaelezewa kuwa sawa na mabadiliko katika nishati ya elektroni inapohamia kutoka obiti moja hadi nyingine. Katika fomu equation, hii ni
\[\Delta E = hf = E_{i} - E_{f}. \label{30.4.5}\]
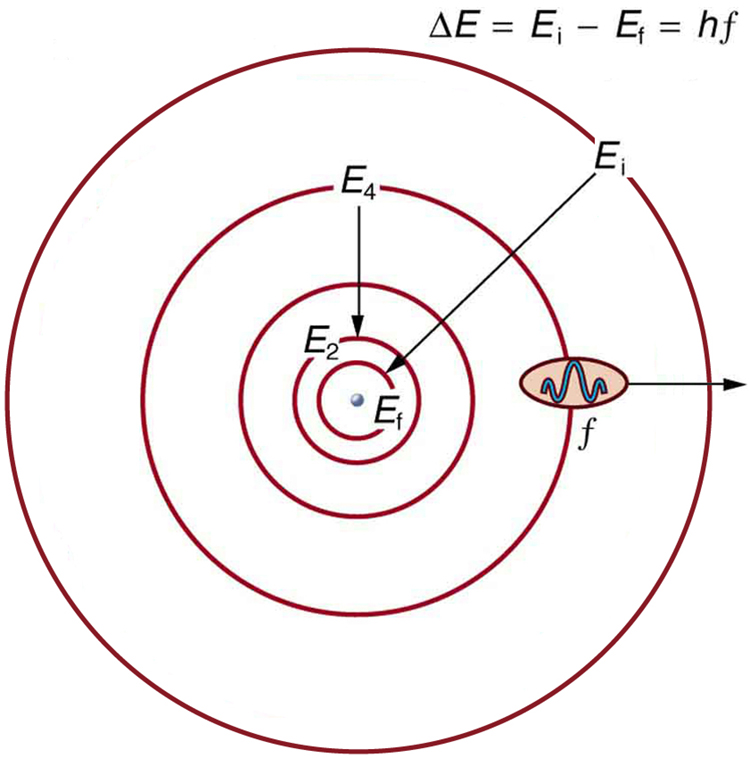
Hapa,\(\Delta E\) ni mabadiliko katika nishati kati ya njia za awali na za mwisho, na\(hf\) ni nishati ya photon iliyoingizwa au iliyotolewa. Ni mantiki kabisa (yaani, inatarajiwa kutokana na uzoefu wetu wa kila siku) kwamba nishati inashiriki katika kubadilisha njia. Mlipuko wa nishati unahitajika kwa kuhamisha nafasi, kwa mfano, kupanda kwenye obiti ya juu. Kitu kisichotarajiwa ni kwamba njia za atomiki zinapaswa kupimwa. Hii haionyeshi kwa satelaiti au sayari, ambazo zinaweza kuwa na obiti yoyote iliyotolewa nishati sahihi. (Angalia Kielelezo\(\PageIndex{4}\).)
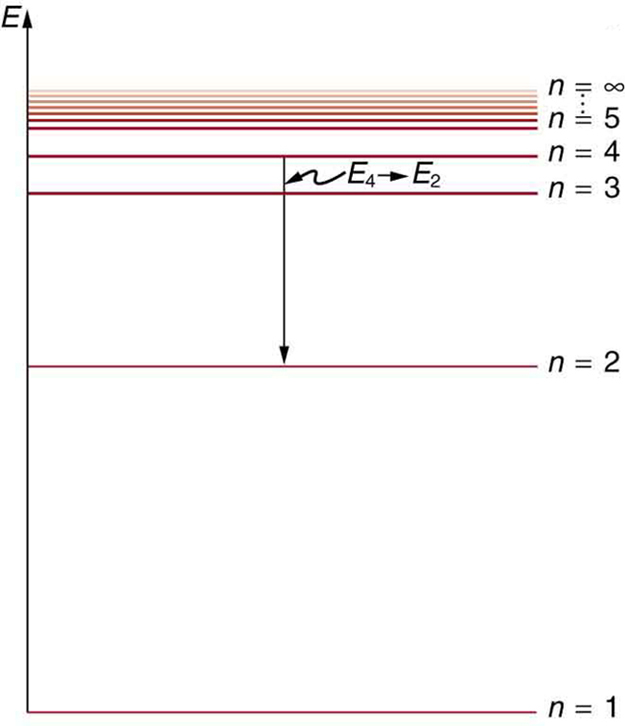
Kielelezo\(\PageIndex{5}\). inaonyesha mchoro wa ngazi ya nishati, njia rahisi ya kuonyesha majimbo ya nishati. Katika majadiliano ya sasa, tunachukua haya kuwa viwango vya nishati vinavyoruhusiwa vya elektroni. Nishati imepangwa kwa wima na hali ya chini au ya ardhi chini na kwa majimbo ya msisimko hapo juu. Kutokana na nguvu za mistari katika wigo wa atomiki, inawezekana (ingawa wakati mwingine vigumu sana) kuamua viwango vya nishati vya atomi. Michoro ya kiwango cha nishati hutumiwa kwa mifumo mingi, ikiwa ni pamoja na molekuli na nuclei. Nadharia ya atomu au mfumo mwingine wowote lazima itabiri nguvu zake kulingana na fizikia ya mfumo.
Bohr alikuwa wajanja wa kutosha kutafuta njia ya kuhesabu nguvu za orbital za elektroni katika hidrojeni. Hii ilikuwa hatua muhimu ya kwanza ambayo imeboreshwa juu, lakini ni vizuri kurudia hapa, kwa sababu inaelezea kwa usahihi sifa nyingi za hidrojeni. Kutokana na njia za mviringo, Bohr alipendekeza kuwa kasi\(L\) ya angular ya elektroni katika obiti yake ni quantized, yaani, ina tu maalum, maadili ya kipekee. Thamani ya\(L\) hutolewa kwa formula\[L = m_{e}vr_{n} = n\frac{h}{2\pi} \left(n = 1,2,3, \cdot \cdot \cdot \right), \label{30.4.6}\] ambapo\(L\) ni kasi ya angular,\(m_{e}\) ni molekuli ya elektroni,\(r_{n}\) ni radius\(n\) ya obiti, na\(h\) ni mara kwa mara ya Planck. Kumbuka kuwa kasi angular ni\[L = I \omega. \label{30.4.7}\] Kwa kitu kidogo katika eneo\(r\),\[I = mr^{2}\label{30.4.8}\] na\[\omega = \frac{v}{r}\label{30.4.9}\], ili\[L = \left(mr^{2}\right)\left(\frac{v}{r}\right) = mvr. \label{30.4.10}\] Quantization anasema kuwa thamani hii ya\(mvr\) inaweza tu kuwa sawa na\(h/2, 2h/2, 3h/2\), nk Wakati huo, Bohr mwenyewe hakujua kwa nini kasi angular lazima quantized, lakini kwa kutumia dhana hii aliweza kuhesabu nguvu katika wigo wa hidrojeni, kitu ambacho hakuna mtu mwingine aliyefanya wakati huo.
Kutokana na mawazo ya Bohr, sasa tutapata idadi ya mali muhimu ya atomi ya hidrojeni kutoka fizikia ya classical tumeifunika katika maandiko. Tunaanza kwa kutambua nguvu ya centripetal inayosababisha elektroni kufuata njia ya mviringo hutolewa na nguvu ya Coulomb. Ili kuwa zaidi ya jumla, tunaona kwamba uchambuzi huu halali kwa atomi yoyote ya elektroni moja. Hivyo, kama kiini kina\(Z\) protoni (\(Z = 1\)kwa hidrojeni, 2 kwa heliamu n.k.) na elektroni moja tu, atomi hiyo inaitwa atomi kama hidrojeni. Spectra ya ions kama hidrojeni ni sawa na hidrojeni, lakini kubadilishwa kwa nishati ya juu kwa nguvu kubwa ya kuvutia kati ya elektroni na kiini. Ukubwa wa nguvu ya centripetal ni\(m_e v^2/r_n\), wakati nguvu ya Coulomb ni\(k(Zq_e)(q_e)/r_n^2\). Dhana tacit hapa ni kwamba kiini ni kubwa zaidi kuliko elektroni stationary, na elektroni huzunguka kuhusu hilo. Hii ni sawa na mfano wa sayari wa atomu. Equating hizi,
\[k\dfrac{Zq_e^2}{r_n^2} = \dfrac{m_e v^2}{r_n} (Coulomb = centripetal).\]
Angular kasi quantization ni alisema katika equation mapema. Sisi kutatua kwamba equation kwa\(v\), badala yake katika hapo juu, na upya kujieleza ili kupata Radius ya obiti. Hii inazalisha:\[r_n = \dfrac{n^2}{Z} a_B, \, for \, allowed \, orbits \, (n = 1, \, 2, \, 3, . . . ),\]
ambapo\(a_B\) hufafanuliwa kuwa Radius Bohr, tangu kwa obiti ya chini kabisa (\( n = 1 \)) na kwa hidrojeni\((Z = 1)\),\(r_1 = a_B\). Imeachwa kwa Matatizo na Mazoezi ya sura hii ili kuonyesha kwamba Radius Bohr ni
\[a_B = \dfrac{h^2}{4 \pi^2 m_e kq_e^2} = 0.529 \times 10^{-10} \, m.\]
Equations hizi mbili za mwisho zinaweza kutumiwa kuhesabu radii ya mizunguko ya elektroni iliyoruhusiwa (quantized) katika atomu yoyote inayofanana na hidrojeni. Inashangaza kwamba formula inatoa ukubwa sahihi wa hidrojeni, ambayo hupimwa kwa majaribio kuwa karibu sana na radius ya Bohr. equation mapema pia inatuambia kwamba radius orbital ni sawia na\(n^2\), kama inavyoonekana katika Kielelezo\(\PageIndex{6}\).
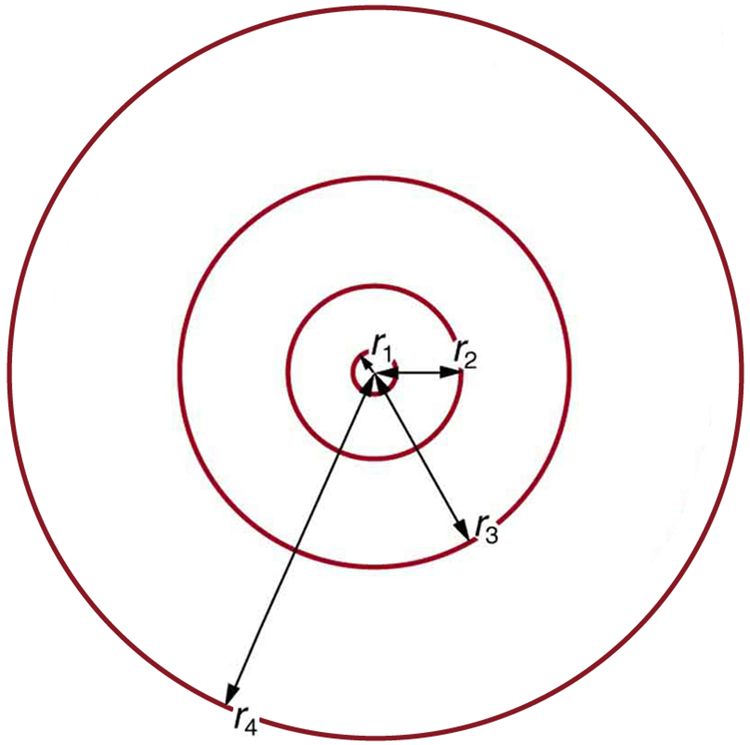
Ili kupata nguvu za elektroni orbital, tunaanza kwa kutambua kwamba nishati ya elektroni ni jumla ya nishati yake ya kinetic na uwezo: Nishati ya\[ E_n = KE + PE.\] Kinetic ni ya kawaida\(KE = (1/2)m_e v^2\), kwa kuzingatia elektroni haihamia kwa kasi ya relativistic. Nishati ya uwezo kwa elektroni ni umeme\(PE = q_e V\), au, wapi\(V\) uwezekano kutokana na kiini, ambacho kinaonekana kama malipo ya uhakika. Kiini kina malipo mazuri\(Zq_e\); hivyo\(V = kZq_e/r_n\), kukumbuka equation mapema kwa uwezo kutokana na malipo ya uhakika. Kwa kuwa malipo ya elektroni ni hasi, tunaona hiyo\(PE = -kZq_e/r_n\). Kuingia maneno kwa\(KE\) na\(PE\), tunapata\[E_n = \dfrac{1}{2} m_ev^2 - k\dfrac{Zq_e^2}{r_n}.\]
Sasa sisi badala\(r_n\) na\(v\) kutoka equations mapema katika kujieleza hapo juu kwa nishati. Algebraic kudanganywa mavuno\[E_n = \dfrac{Z^2}{n^2} E_0(n = 1, \, 2, \, 3, ...)\]
kwa nguvu orbital ya atomi hidrojeni kama. Hapa,\(E_0\) ni nishati ya hali ya ardhi (\(n = 1)\)kwa hidrojeni\((Z = 1)\) na hutolewa na
\[E_0 = \dfrac{2 \pi^2 Q_e^4 m_e k^2}{h^2} = 13.6 \, eV.\]
Hivyo, kwa ajili ya hidrojeni,
\[E_n = - \dfrac{13.6 \, eV}{n^2} (n = 1, \, 2, \, 3, ...).\]
Kielelezo\(\PageIndex{7}\) inaonyesha mchoro wa kiwango cha nishati kwa hidrojeni ambayo pia inaonyesha jinsi mfululizo mbalimbali wa spectral kwa hidrojeni ni kuhusiana na mabadiliko kati ya viwango vya nishati.
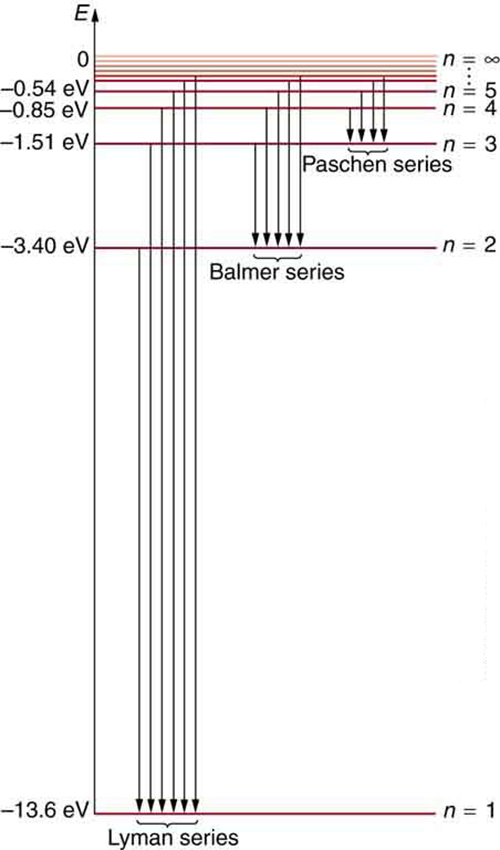
Nguvu za jumla za elektroni ni hasi, kwani elektroni imefungwa kwa kiini, sawa na kuwa katika shimo bila nishati ya kutosha ya kinetic kutoroka. Kama\(n\) inakaribia infinity, nishati ya jumla inakuwa sifuri. Hii inalingana na elektroni ya bure isiyo na nishati ya kinetic, tangu\(r_N\) inapata kubwa sana kwa kubwa\(n\), na nishati ya uwezo wa umeme inakuwa sifuri. Hivyo, 13.6 eV inahitajika ili ionize hidrojeni (kwenda kutoka -13.6 eV hadi 0, au unbound), nambari iliyohakikishiwa majaribio. Kutokana na nishati zaidi, elektroni inakuwa isiyofunguliwa na nishati fulani ya kinetic. Kwa mfano, kutoa 15.0 eV kwa elektroni katika hali ya ardhi ya hidrojeni huipiga kutoka kwa atomi na kuiacha na 1.4 eV ya nishati ya kinetic.
Hatimaye, hebu fikiria nishati ya photon lilio katika mpito kushuka, iliyotolewa na equation kuwa\[\Delta E = hf = E_i - E_f.\] Substituting\(E_n = (-13.6 \, eV/n^2)\), tunaona kwamba\[hf = (13.6 \, eV)\left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right).\]
Kugawanya pande zote mbili za equation hii na\(hc\) anatoa kujieleza kwa\(1/\lambda\):
\[\dfrac{hf}{hc} = \dfrac{f}{c} = \dfrac{1}{\lambda} = \dfrac{(13.6 \, eV)}{hc} \left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right).\]Inaweza kuonyeshwa kuwa\[\left(\dfrac{13.6 \, eV}{hc} \right) = \dfrac{(13.6 \, eV)(1.602 \times 10^{-19} \, J/eV)}{(6.626 \, 10^{-34} \, J \cdot s)(2.998 \times 10^8 \, m/s)} = 1.097 \times 10^7 \, m^{-1} = R\] ni mara kwa mara Rydberg. Kwa hiyo, tumetumia mawazo ya Bohr kupata formula ya kwanza iliyopendekezwa na miaka ya Balmer mapema kama kichocheo cha kufaa data ya majaribio. \[\dfrac{1}{\lambda} = R \left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2} \right)\]
Tunaona kwamba nadharia ya Bohr ya atomi ya hidrojeni hujibu swali kuhusu kwa nini fomula hii inayojulikana hapo awali inaelezea wigo wa hidrojeni. Ni kwa sababu viwango vya nishati ni sawia na\(1/n^2\), wapi\(n\) integer yasiyo ya hasi. Mpito wa kushuka hutoa nishati, na hivyo\(n_i\) lazima iwe kubwa zaidi kuliko\(n_f\). Mfululizo mbalimbali ni wale ambapo mabadiliko yanaisha kwa kiwango fulani. Kwa mfululizo wa Lyman,\(n_f = 1\) yaani, mabadiliko yote yanaisha katika hali ya ardhi (angalia pia Kielelezo). Kwa mfululizo wa Balmer,\(n_f = 2\), au mabadiliko yote yanaisha katika hali ya kwanza ya msisimko; na kadhalika. Nini mara moja mapishi ni sasa msingi katika fizikia, na kitu kipya ni kujitokea-angular kasi ni quantized.
Ushindi na Mipaka ya Nadharia ya Bohr
Bohr alifanya kile ambacho hakuna mtu aliyeweza kufanya kabla. Sio tu alielezea wigo wa hidrojeni, alihesabu kwa usahihi ukubwa wa atomi kutoka fizikia ya msingi. Baadhi ya mawazo yake yanatumika kwa upana. Nguvu za orbital za elektroni zinahesabiwa katika atomi zote na molekuli. Kasi ya angular ni quantized. elektroni si ond katika kiini, kama ilivyotarajiwa classically (kasi mashtaka kung'ara, ili elektroni orbits classically bila kuoza haraka, na elektroni bila kukaa juu ya nucleus-jambo bila kuanguka). Hizi ni ushindi mkubwa.
Lakini kuna mipaka kwa nadharia ya Bohr. Haiwezi kutumika kwa atomi nyingi za elektroni, hata moja rahisi kama atomi ya heliamu ya elektroni mbili. Mfano wa Bohr ni kile tunachokiita semiclassical. Njia ni quantized (nonclassical) lakini ni kudhani kuwa njia rahisi mviringo (classical). Kama mechanics ya quantum ilianzishwa, ikawa wazi kuwa hakuna njia zilizoelezwa vizuri; badala yake, kuna mawingu ya uwezekano. Nadharia ya Bohr pia haikueleza kwamba baadhi ya mistari ya spectral ni mara mbili (imegawanywa katika mbili) inapochunguzwa kwa karibu. Sisi kuchunguza mambo mengi ya mechanics quantum kwa undani zaidi, lakini ni lazima ikumbukwe kwamba Bohr hakuwa na kushindwa. Badala yake, alifanya hatua muhimu sana njiani kwenda maarifa zaidi na kuweka msingi kwa fizikia atomiki yote ambayo tangu sasa imebadilika.
PHET EXPLORATIONS: MIFANO YA ATOMU HIDROJENI
Wanasayansi waligundua jinsi gani muundo wa atomi bila kuziangalia? Jaribu mifano tofauti na risasi mwanga katika chembe. Angalia jinsi utabiri wa mfano unavyolingana na matokeo ya majaribio.
Kielelezo\(\PageIndex{8}\): Mifano ya Atom ya Hid
Muhtasari
- Mfano wa sayari wa atomu huchora elektroni zinazozunguka kiini kwa njia ambayo sayari huzunguka jua. Bohr alitumia mfano wa sayari kuendeleza nadharia ya kwanza ya kuridhisha ya hidrojeni, atomi rahisi zaidi. Spectra ya atomiki na Masi ni quantized, na wavelengths wigo wa hidrojeni iliyotolewa na formula\[\dfrac{1}{\lambda} = R\left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right), \nonumber\] ambapo\(\lambda\) ni wavelength ya mionzi EM lilio na\(R\) ni mara kwa mara Rydberg, ambayo ina thamani\[R = 1.097 \times 10^7 \, m^{-1}. \nonumber\]
- constants\(n_i\) na\(n_f\) ni integers chanya, na\(n_i\) lazima kuwa kubwa kuliko\(n_f\).
- Bohr alipendekeza kwa usahihi kwamba nishati na radii ya orbits ya elektroni katika atomi ni quantized, na nishati kwa ajili ya mabadiliko kati ya orbits zinazotolewa na\[\Delta E = hf = E_i - E_f,\] wapi\(\Delta E\) mabadiliko ya nishati kati ya obiti ya awali na ya mwisho na\(hf\) ni nishati ya fotoni iliyofyonzwa au iliyotolewa. Ni muhimu kupanga njama za orbital kwenye grafu ya wima inayoitwa mchoro wa ngazi ya nishati.
- Bohr mapendekezo kwamba orbits kuruhusiwa ni mviringo na lazima quantized orbital angular kasi iliyotolewa na\[L = m_evr_n = n\dfrac{h}{2\pi} (n = 1, \, 2, \, 3, . . .), \nonumber\] ambapo\(L\) ni kasi angular,\(r_n\) ni Radius ya obiti\(n\) th, na\(h\) ni Planck ya mara kwa mara. Kwa atomi zote za elektroni moja (hidrojeni kama), radius ya obiti hutolewa na\[r_n = \dfrac{n^2}{Z}a_B(allowed \, orbits \, n = 1, \, 2, \, 3, ...), \nonumber\]\(Z\) ni namba atomia ya elementi (idadi ya elektroni ina wakati wa neutral) na\(a_B\) inafafanuliwa kuwa radius ya Bohr, ambayo ni\[a_B = \dfrac{h^2}{4 \pi^2m_ekq_e^2} = 0.529 \times 10^{-10} \, m. \nonumber\]
- Zaidi ya hayo, nguvu za atomi hidrojeni kama ni kutolewa na\[E_n = - \dfrac{Z^2}{n^2}E_0 (n = 1, \, 2, \, 3 ... ), \nonumber\] ambapo\(E_0\) ni ardhi hali ya nishati na ni kutolewa na\[E_0 = \dfrac{2 \pi^2 q_e^4m_ek^2}{h^2} = 13.6 \, eV. \nonumber\] Hivyo, kwa hidrojeni,\[E_n = - \dfrac{13.6 \, eV}{n^2} (n = 1, \, 2, \, 3, . . .). \nonumber\]
- Nadharia ya Bohr inatoa maadili sahihi kwa viwango vya nishati katika atomi kama hidrojeni, lakini imekuwa kuboreshwa juu katika mambo kadhaa.
faharasa
- wigo wa wigo wa hidrojeni
- wavelengths ya mwanga inayoonekana kutoka hidrojeni; inaweza kuhesabiwa na\(\frac{1}{\lambda} = R \left(\frac{1}{n_f^2} - \frac{1}{n_i^2} \right)\)
- Rydberg mara kwa mara
- mara kwa mara kimwili kuhusiana na spectra atomiki na thamani imara ya\(1.097 \times 10^7 \, m^{-1}\)
- kuingiliwa mara mbili
- jaribio ambalo mawimbi au chembe kutoka chanzo kimoja huathiri slits mbili ili muundo wa kuingilia kati unaweza kuzingatiwa
- mchoro wa kiwango cha nishati
- mchoro uliotumiwa kuchambua kiwango cha nishati ya elektroni katika njia za atomu
- Radius Bohr
- radius maana ya obiti ya elektroni karibu na kiini cha atomi ya hidrojeni katika hali yake ya ardhi
- hidrojeni kama atomi
- atomi yoyote yenye elektroni moja tu
- nguvu za atomi za hidrojeni
- Bohr formula kwa nguvu za majimbo ya elektroni katika atomi kama hidrojeni:\(E_n = - \frac{Z^2}{n^2} E_0 (n = 1, \, 2, \, 3, . . . )\)


