30.2: Ugunduzi wa Sehemu za Atom - Electroni na Nuclei
- Page ID
- 182953
Malengo ya kujifunza
Mwishoni mwa sehemu hii, utaweza:
- Eleza jinsi elektroni zilivyogunduliwa.
- Eleza jaribio la kushuka kwa mafuta ya Millikan.
- Eleza majaribio ya dhahabu ya Rutherford.
- Eleza mfano wa sayari wa Rutherford wa atomi.
Kama vile atomi ni substructure ya suala, elektroni na viini ni substructures ya atomi. Majaribio yaliyotumika kugundua elektroni na viini hufunua baadhi ya mali za msingi za atomi na zinaweza kueleweka kwa urahisi kwa kutumia mawazo kama vile nguvu ya umeme na magnetic, tayari imefunikwa katika sura zilizopita.
MASHTAKA NA NGUVU ZA UMEME
Katika majadiliano ya awali, tumebainisha kuwa malipo mazuri yanahusishwa na nuclei na malipo hasi na elektroni. Sisi pia kufunikwa masuala mengi ya vikosi vya umeme na magnetic yanayoathiri mashtaka. Sasa tutachunguza ugunduzi wa elektroni na kiini kama substructures ya atomi na kuchunguza michango yao kwa mali ya atomi.
elektroni
Mizigo ya kutokwa kwa gesi, kama vile ilivyoonyeshwa kwenye Kielelezo\(\PageIndex{1}\), inajumuisha tube ya kioo iliyohamishwa iliyo na electrodes mbili za chuma na gesi isiyo na kawaida. Wakati voltage ya juu inatumiwa kwa electrodes, gesi huangaza. Vipande hivi vilikuwa watangulizi wa taa za neon za leo. Walikuwa kwanza alisoma kwa uzito na Heinrich Geissler, mvumbuzi wa Ujerumani na glassblower, kuanzia miaka ya 1860. Mwanasayansi wa Kiingereza William Crookes, miongoni mwa wengine, aliendelea kujifunza nini kwa muda fulani waliitwa mirija ya Crookes, ambako elektroni huachiliwa kutoka atomi na molekuli katika gesi rarefied ndani ya bomba na huharakishwa kutoka cathode (hasi) hadi anode (chanya) na uwezo mkubwa. Hizi “mionzi ya cathode” hugongana na atomi za gesi na molekuli na kuzisisimua, na kusababisha chafu ya mionzi ya sumakuumeme (EM) inayofanya njia ya elektroni ionekane kama ray inayoenea na kufifia inapoondoka mbali na cathode.
Mizigo ya kutokwa kwa gesi leo ni kawaida inayoitwa zilizopo za cathode-ray, kwa sababu mionzi hutoka kwenye cathode. Crookes ilionyesha kuwa elektroni hubeba kasi (wanaweza kufanya gurudumu ndogo la paddle kugeuka). Pia aligundua kwamba njia yao ya kawaida ya moja kwa moja imebuniwa na sumaku katika mwelekeo unaotarajiwa kwa chaji hasi inayohamia mbali na cathode. Hizi zilikuwa dalili za kwanza za moja kwa moja za elektroni na malipo yao.
Mwanafizikia wa Kiingereza J. J. Thomson (1856—1940) aliboresha na kupanua upeo wa majaribio na zilizopo za kutokwa gesi. (Takwimu\(\PageIndex{2}\) na\(\PageIndex{3}\)) Alithibitisha malipo mabaya ya mionzi ya cathode na mashamba ya magnetic na umeme. Zaidi ya hayo, alikusanya mionzi katika kikombe cha chuma na akapata ziada ya malipo hasi. Thomson pia aliweza kupima uwiano wa malipo ya elektroni kwa wingi wake,\(q_{e}/m_{e}\) - hatua muhimu ya kutafuta maadili halisi ya wote\(q_{e}\) na\(m_{e}\).

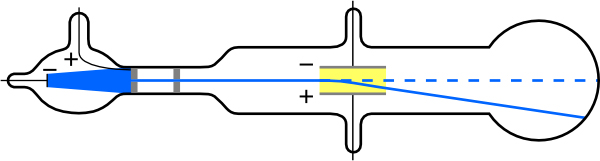
Kielelezo\(\PageIndex{4}\) kinaonyesha tube ya cathode-ray, ambayo hutoa boriti nyembamba ya elektroni ambayo hupita kupitia sahani za malipo zilizounganishwa na nguvu za juu-voltage. Shamba la umeme\(E\) linazalishwa kati ya sahani za malipo, na tube ya cathode-ray imewekwa kati ya miti ya sumaku ili shamba la umeme liwe na shamba\(E\) la magnetic\(B\) la sumaku. Mashamba haya, kuwa perpendicular kwa kila mmoja, kuzalisha vikosi vya kupinga juu ya elektroni. Kama ilivyojadiliwa kwa spectrometers ya molekuli katika "Matumizi zaidi ya Magnetism,” ikiwa nguvu ya wavu kutokana na mashamba hupotea, basi kasi ya chembe ya kushtakiwa ni\(v = E/B\). Kwa namna hii, Thomson aliamua kasi ya elektroni halafu akahamisha boriti juu na chini kwa kurekebisha uwanja wa umeme.
Kuona jinsi kiasi cha kufuta kinatumiwa kuhesabu\(q_{e}/m_{e}\), kumbuka kuwa kufuta ni sawia na nguvu za umeme kwenye elektroni:\[F = q_{e}E.\label{30.3.1}\] Lakini kufuta wima pia kunahusiana na wingi wa elektroni, kwa kuwa kasi ya elektroni ni
\[a = \frac{F}{m_{e}}.\label{30.3.2}\]
Thamani ya\(F\) haijulikani, tangu\(q_{e}\) haikujulikana bado. Kubadilisha maneno ya nguvu ya umeme katika kujieleza kwa mavuno ya kuongeza kasi
\[a = \frac{F}{m_{e}} = \frac{q_{e}E}{m_{e}}.\label{30.3.3}\]
Kukusanya maneno, tuna
\[\frac{q_{e}}{m_{e}} = \frac{a}{E}.\label{30.3.5}\]
Deflection ni kuchambuliwa kupata\(a\), na\(E\) imedhamiriwa kutoka voltage kutumika na umbali kati ya sahani; hivyo,\(\frac{q_{e}}{m_{e}}\) inaweza kuamua. Kwa kasi inayojulikana, kipimo kingine cha\(\frac{q_{e}}{m_{e}}\) kinaweza kupatikana kwa kupiga boriti ya elektroni na shamba la magnetic. Tangu
\[F_{mag} = q_{e}vB = m_{e}a,\label{30.3.6}\]
tuna
\[\frac{q_{e}}{m_{e}} = \frac{a}{vB}.\label{30.3.7}\]
Matokeo thabiti yanapatikana kwa kutumia kufuta magnetic.
Nini muhimu sana kuhusu\(q_{e}/m_{e}\), uwiano wa malipo ya elektroni kwa wingi wake? Thamani iliyopatikana ni
\[\frac{q_{e}}{m_{e}} = -1.76 \times 10^{11} C/kg \left(electron\right).\]
Hii ni idadi kubwa, kama Thomson alitambua, na ina maana kwamba elektroni ina molekuli ndogo sana. Ilijulikana kutoka kwa electroplating kwamba kuhusu\(10^{8} C/kg\) inahitajika sahani nyenzo, sababu ya karibu 1000 chini ya malipo kwa kila kilo ya elektroni. Thomson aliendelea kufanya jaribio lileile kwa ioni za hidrojeni zenye chaji chanya (ambazo sasa zinajulikana kuwa protoni zilizo wazi) akapata chaji kwa kilo takriban mara 1000 ndogo kuliko ile kwa elektroni, ikimaanisha kuwa protoni ni kubwa zaidi ya mara 1000 kuliko elektroni. Leo, tunajua zaidi kwamba
\[\frac{q_{p}}{m_{p}} = 9.58 \times 10^{7} C/kg \left(proton\right), \label{30.3.8}\]
\(q_{p}\)wapi malipo ya proton na\(m_{p}\) ni wingi wake. Uwiano huu (kwa takwimu nne muhimu) ni mara 1836 chini ya malipo kwa kilo kuliko kwa elektroni. Kwa kuwa mashtaka ya elektroni na protoni ni sawa kwa ukubwa, hii ina maana\(m_{p} = 1836 m_{e}\).
Thomson alifanya majaribio mbalimbali kwa kutumia gesi tofauti katika zilizopo za kutokwa na kutumia mbinu nyingine, kama vile athari ya photoelectric, kwa kumkomboa elektroni kutoka atomi. Daima alipata mali sawa kwa elektroni, akionyesha kuwa chembe huru. Kwa kazi yake, vipande muhimu ambavyo alianza kuchapisha mwaka wa 1897, Thomson alipewa Tuzo ya Nobel ya 1906 katika Fizikia. Katika retrospect, ni vigumu kufahamu jinsi ya kushangaza ilikuwa kupata kwamba atomu ina substructure. Thomson mwenyewe alisema, “Ilikuwa tu wakati nilipoamini kwamba majaribio hayakuacha kutoroka humo ndipo nilichapisha imani yangu katika kuwepo kwa miili ndogo kuliko atomi.”
Thomson alijaribu kupima malipo ya elektroni binafsi, lakini njia yake inaweza kuamua malipo yake tu kwa utaratibu wa ukubwa uliotarajiwa.
Tangu majaribio ya Faraday na electroplating katika miaka ya 1830, ilikuwa inajulikana kuwa karibu 100,000 C kwa mole ilihitajika kwa sahani ions moja ionized. Kugawanya hii kwa idadi ya ions kwa mole (yaani, kwa idadi ya Avogadro), ambayo ilikuwa takriban inayojulikana, malipo kwa ion yalihesabiwa kuwa karibu\(1.6 \times 10^{-19} C\), karibu na thamani halisi.
Mwanafizikia wa Marekani, Robert Millikan (1868—1953) (Kielelezo\(\PageIndex{5}\)), aliamua kuboresha juu ya majaribio ya Thomson kwa kupima\(q_{e}\) na hatimaye alilazimishwa kujaribu mbinu nyingine, ambayo sasa ni jaribio la kawaida lililofanywa na wanafunzi. Jaribio la kushuka kwa mafuta ya Millikan linaonyeshwa kwenye Kielelezo\(\PageIndex{6}\).

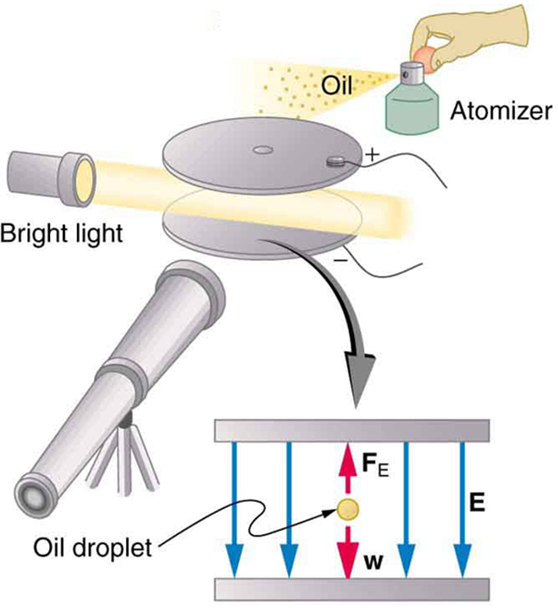
Katika jaribio la kushuka kwa mafuta ya Millikan, matone mazuri ya mafuta hupunjwa kutoka kwa atomizer. Baadhi ya hizi zinashtakiwa na mchakato na zinaweza kusimamishwa kati ya sahani za chuma na voltage kati ya sahani. Katika hali hii, uzito wa tone ni sawa na nguvu ya umeme:\[m_{drop}g = q_{e}E.\label{30.3.9}\]
Shamba la umeme linazalishwa na voltage iliyotumiwa, kwa hiyo,
\[E = \frac{V}{d},\label{30.3.10}\]
na\(V\) ni kubadilishwa kwa uwiano tu uzito tone. Matone yanaweza kuonekana kama pointi za mwanga uliojitokeza kwa kutumia darubini, lakini ni ndogo mno kupima moja kwa moja ukubwa na wingi wao. Masi ya tone imedhamiriwa kwa kuchunguza jinsi inavyoanguka haraka wakati voltage imezimwa. Kwa kuwa upinzani wa hewa ni muhimu sana kwa matone haya ya submicroscopic, matone makubwa zaidi huanguka kwa kasi zaidi kuliko mahesabu ya chini, na mahesabu ya kisasa ya mchanga yanaweza kufunua wingi wao. Mafuta hutumiwa badala ya maji, kwa sababu haina urahisi kuenea, na hivyo molekuli ni karibu mara kwa mara. Mara baada ya wingi wa tone kujulikana, malipo ya elektroni hutolewa kwa upya upya equation uliopita:
\[q = \frac{m_{drop}g}{E} = \frac{m_{drop}gd}{V}, \label{30.3.11}\]
wapi\(d\) mgawanyo wa sahani na\(V\) ni voltage ambayo inashikilia tone lisilo na mwendo. (Tone moja linaweza kuzingatiwa kwa saa kadhaa ili kuona kwamba ni kweli bila mwendo.) Kufikia mwaka 1913 Millikan alikuwa amepima chaji ya elektroni\(q_{e}\) kwa usahihi wa 1%, na aliboresha hili kwa sababu ya 10 ndani ya miaka michache hadi thamani ya\(-1.60 \times 10^{-19} C\). Pia aliona ya kwamba mashtaka yote yalikuwa mafungu ya chaji ya elektroni ya msingi na kwamba mabadiliko ya ghafla yanaweza kutokea ambapo elektroni ziliongezwa au kuondolewa kutoka matone. Kwa kipimo hiki cha msingi cha moja kwa moja\(q_{e}\) na kwa ajili ya masomo yake ya athari za photoelectric, Millikan alipewa Tuzo ya Nobel ya 1923 katika Fizikia.
Kwa malipo ya elektroni inayojulikana na uwiano wa malipo hadi molekuli unaojulikana, masi ya elektroni inaweza kuhesabiwa. Ni
\[m = \frac{q_{e}}{\left(\frac{q_{e}}{m_{e}}\right)}.\label{30.3.12}\]
Kubadilisha maadili inayojulikana mavuno\[m_e = \dfrac{-1.60 \times 10^{-19} \, C}{-1.76 \times 10^{11} \, C/kg}\] au\[m_e = 9.11 \times 10^{-31} \, kg \, (electron's \, mass),\] ambapo makosa ya pande zote yamesahihishwa. Masi ya elektroni imethibitishwa katika majaribio mengi yafuatayo na sasa inajulikana kwa usahihi wa bora kuliko sehemu moja katika milioni moja. Ni molekuli ndogo sana na inabakia molekuli ndogo zaidi inayojulikana ya chembe yoyote ambayo ina molekuli. (Baadhi ya chembe, kama vile photoni, hazina massa na haziwezi kuletwa kupumzika, lakini husafiri kwa kasi ya nuru.) Hesabu sawa hutoa raia wa chembe nyingine, ikiwa ni pamoja na proton. Kwa tarakimu tatu, wingi wa proton sasa unajulikana kuwa
\[m_p = 1.67 \times 10^{-27} \, kg \, (proton's \, mass),\]
ambayo ni karibu sawa na wingi wa atomi hidrojeni. Kile ambacho Thomson na Millikan walikuwa wamefanya ni kuthibitisha kuwepo kwa substructure moja ya atomi, elektroni, na zaidi kuonyesha kwamba ilikuwa na sehemu ndogo tu ya masi ya atomu. Kiini cha atomi kina wingi wake, na asili ya kiini haikutarajiwa kabisa.
Tabia nyingine muhimu ya mechanics quantum pia ilianza kuibuka. Elektroni zote zinafanana na zingine. Malipo na masi ya elektroni si maadili ya wastani; badala yake, ni maadili ya pekee ambayo elektroni zote zina. Hii ni kweli kwa vyombo vingine vya msingi katika ngazi ndogo ndogo. Protoni zote zinafanana na kila mmoja, na kadhalika.
Nucleus
Hapa, tunachunguza ushahidi wa kwanza wa moja kwa moja wa ukubwa na wingi wa kiini. Katika sura za baadaye, tutachunguza mambo mengine mengi ya fizikia ya nyuklia, lakini maelezo ya msingi juu ya ukubwa wa nyuklia na masi ni muhimu sana kuelewa atomu tunayoiangalia hapa.
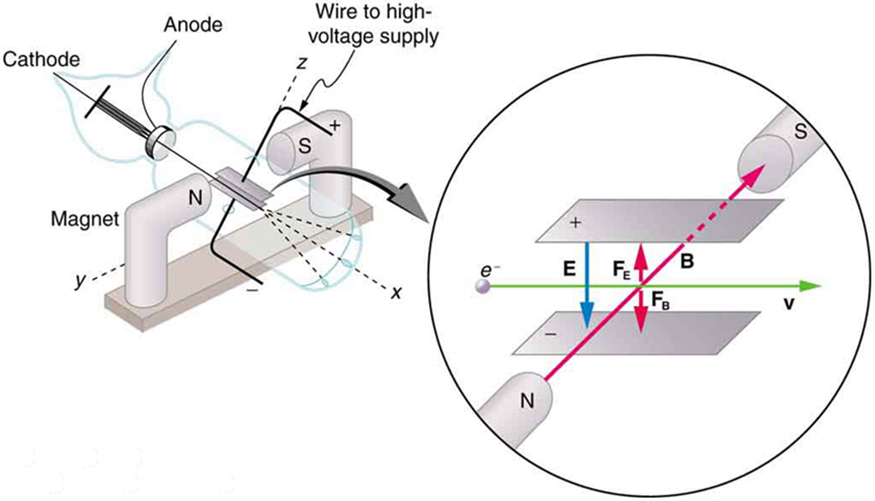
Mionzi ya nyuklia iligunduliwa mwaka wa 1896, na hivi karibuni ilikuwa chini ya utafiti mkali na idadi ya wanasayansi bora duniani. Miongoni mwao alikuwa New Zealander Bwana Ernest Rutherford, ambaye alifanya uvumbuzi mbalimbali za msingi na kupata jina la “baba wa fizikia ya nyuklia.” Alizaliwa Nelson, Rutherford alifanya masomo yake ya uzamili katika Maabara ya Cavendish nchini Uingereza kabla ya kuchukua nafasi katika Chuo Kikuu cha McGill nchini Kanada ambapo alifanya kazi ambayo ilimpata Tuzo ya Nobel ya Kemia mwaka 1908. Katika eneo la fizikia atomiki na nyuklia, kuna mwingiliano mwingi kati ya kemia na fizikia, huku fizikia ikitoa nadharia za msingi zinazowezesha. Alirudi Uingereza katika miaka ya baadaye na alikuwa na washindi sita wa Tuzo ya Nobel ya baadaye kama wanafunzi. Rutherford alitumia mionzi ya nyuklia kuchunguza moja kwa moja ukubwa na masi ya kiini atomia. Jaribio alilopanga linaonyeshwa kwenye Kielelezo\(\PageIndex{7}\). Chanzo cha mionzi kinachotoa mionzi ya alpha kiliwekwa kwenye chombo cha risasi chenye shimo upande mmoja ili kuzalisha boriti ya chembe za alpha, ambazo ni aina ya mionzi ya ionizing inayotolewa na kiini cha chanzo cha mionzi. Foil nyembamba ya dhahabu iliwekwa kwenye boriti, na kueneza kwa chembe za alpha kulizingatiwa na mwanga uliosababishwa wakati walipiga skrini ya fosforasi.
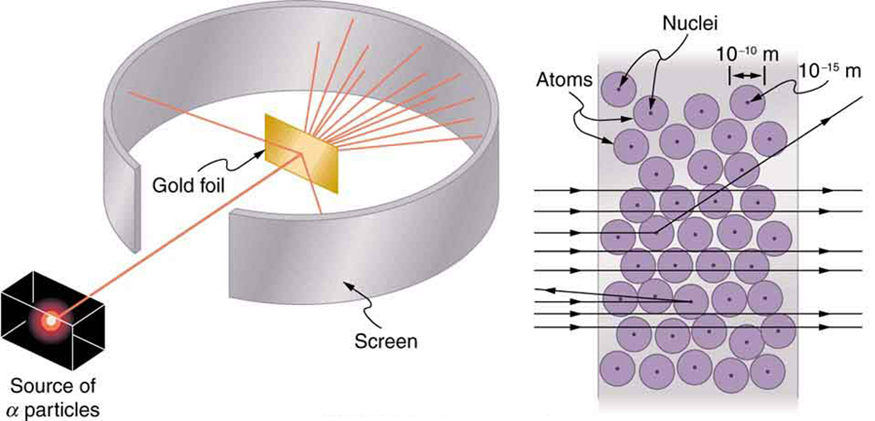
Chembe za alpha zilijulikana kuwa kiini chanya cha kushtakiwa mara mbili cha atomi za heliamu ambazo zilikuwa na nguvu za kinetic kwa utaratibu wa\(5 \, MeV\) wakati uliotolewa katika kuoza nyuklia, ambayo ni ugawanyiko wa kiini cha nuclide isiyo imara na chafu ya hiari ya chembe za kushtakiwa. Chembe hizi huingiliana na jambo hasa kupitia nguvu ya Coulomb, na namna ambayo hutawanya kutoka nuclei inaweza kudhihirisha ukubwa wa nyuklia na wingi. Hii ni sawa na kuchunguza jinsi mpira wa bowling umetawanyika na kitu ambacho huwezi kuona moja kwa moja. Kwa sababu nishati alpha chembe ni kubwa ikilinganishwa na nguvu ya kawaida ya kuhusishwa na atomi\((MeV\) dhidi\(eV)\), ungependa kutarajia chembe alpha tu ajali kupitia foil nyembamba sana kama mpira supersonic Bowling bila ajali kwa njia ya safu kadhaa kadhaa ya pini Bowling. Thomson alikuwa ametazamia atomu kuwa nyanja ndogo ambamo kiasi sawa cha chaji chanya na hasi zilisambazwa sawasawa. Tukio hilo chembe kubwa za alpha zingeweza kuteseka deflections ndogo tu katika mfano huo. Badala yake, Rutherford na washirika wake waligundua kwamba chembe za alpha mara kwa mara zilitawanyika kwa pembe kubwa, baadhi hata nyuma katika mwelekeo ambao walikuja! Uchambuzi wa kina kwa kutumia uhifadhi wa kasi na nishati-hasa wa idadi ndogo iliyokuja nyuma moja kwa moja—ulidai kuwa viini vya dhahabu ni vidogo sana ikilinganishwa na ukubwa wa atomi ya dhahabu, vyenye karibu wote wa masi ya atomu, na ni tightly amefungwa. Kwa kuwa kiini cha dhahabu ni mara kadhaa zaidi kuliko chembe ya alpha, mgongano wa kichwa-juu ungewatawanya chembe ya alpha moja kwa moja kuelekea chanzo. Aidha, ndogo kiini, chembe chache alpha ambayo hit kichwa moja juu ya.
Ingawa matokeo ya jaribio yalichapishwa na wenzake mwaka 1909, ilichukua Rutherford miaka miwili kujishawishi maana yake. Kama Thomson mbele yake, Rutherford alikuwa akisita kukubali matokeo hayo makubwa. Hali kwa kiwango kidogo ni tofauti na ulimwengu wetu wa classical kwamba hata wale walio mbele ya ugunduzi wakati mwingine wanashangaa. Rutherford baadaye aliandika: “Ilikuwa karibu kama ajabu kama wewe fired shell 15-inch katika kipande cha karatasi tishu na akarudi na kugonga wewe. Kwa kuzingatia, nilitambua kwamba hii kueneza nyuma... [maana]... sehemu kubwa ya wingi wa atomu ilikuwa imejilimbikizia katika kiini kidogo.” Mwaka 1911, Rutherford alichapisha uchambuzi wake pamoja na mfano uliopendekezwa wa atomu. Ukubwa wa kiini uliamua kuwa karibu\(10^{-15} \, m\) au mara 100,000 ndogo kuliko atomi. Hii ina maana wiani mkubwa, kwa utaratibu wa kutofautiana na jambo\(10^{15} \, g/cm^3\) lolote la macroscopic. Pia inamaanisha kuwepo kwa vikosi vya nyuklia ambavyo havijulikani hapo awali ili kukabiliana na vikosi vya Coulomb vikubwa vya kukataa kati ya mashtaka mazuri katika kiini. Vikosi vikubwa pia vingekuwa sawa na nguvu kubwa zilizotolewa katika mionzi ya nyuklia.
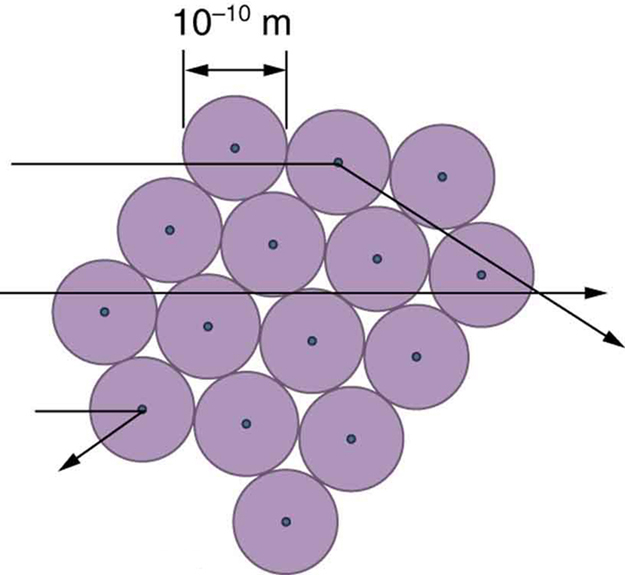
Ukubwa mdogo wa kiini pia unamaanisha kwamba atomu ni tupu zaidi ndani. Kwa kweli, katika majaribio ya Rutherford, alpha nyingi zilikwenda moja kwa moja kwa njia ya foil ya dhahabu na kutawanyika kidogo sana, kwani elektroni zina raia ndogo sana na tangu atomi ilikuwa tupu na kitu cha alpha kugonga. Tayari kulikuwa na vidokezo vya hili wakati Rutherford alifanya majaribio yake, kwa kuwa elektroni za juhudi zilionekana kupenya foils nyembamba kwa urahisi zaidi kuliko ilivyotarajiwa. Kielelezo\(\PageIndex{7}\) kinaonyesha schematic ya atomi katika foil nyembamba na miduara inayowakilisha ukubwa wa atomi (kuhusu\(10^{-10} \, m\)) na dots zinazowakilisha nuclei. (Dots si kwa wadogo - kama walikuwa, ungehitaji darubini kuwaona.) Wengi alpha chembe kukosa nuclei ndogo na ni kidogo tu waliotawanyika na elektroni. Mara kwa mara, (mara moja katika nyakati 8000 katika jaribio la Rutherford), alpha hupiga kiini kichwa-juu na hutawanyika moja kwa moja nyuma.
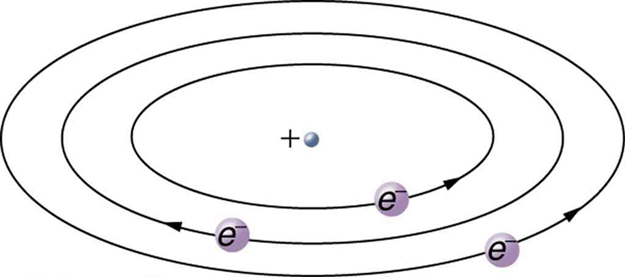
Kulingana na ukubwa na wingi wa kiini kilichofunuliwa na majaribio yake, pamoja na wingi wa elektroni, Rutherford alipendekeza mfano wa sayari wa atomi. Mfano wa sayari wa atomu huchora elektroni za chini za molekuli zinazozunguka kiini kikubwa. Ukubwa wa mizunguko ya elektroni ni kubwa ikilinganishwa na ukubwa wa kiini, huku hasa utupu ndani ya atomu. Picha hii ni sawa na jinsi sayari za molekuli za chini katika mfumo wetu wa jua zinavyozunguka Jua kubwa kwa umbali mkubwa ikilinganishwa na ukubwa wa jua. Katika atomi, nguvu ya kuvutia ya Coulomb inafanana na uvunjaji katika mfumo wa sayari (Kielelezo\(\PageIndex{9}\)). Kumbuka kuwa mfano au picha ya akili inahitajika kueleza matokeo ya majaribio, kwani atomu ni ndogo mno ili kuzingatiwa moja kwa moja na mwanga unaoonekana.
Mfano wa sayari wa Rutherford wa atomi ulikuwa muhimu kuelewa sifa za atomi, na mwingiliano na nguvu zao, kama tutakavyoona katika sehemu chache zijazo. Pia, ilikuwa ni dalili ya jinsi asili tofauti ni kutoka kwa ulimwengu wa kawaida wa kawaida juu ya wadogo wadogo, quantum mitambo wadogo. Ugunduzi wa substructure kwa mambo yote katika mfumo wa atomi na molekuli sasa ulikuwa unachukuliwa hatua zaidi ili kudhihirisha substructure ya atomi iliyokuwa rahisi kuliko elementi 92 zilizojulikana wakati huo. Tumeendelea kutafuta substructures zaidi, kama vile wale ndani ya kiini, na baadhi ya mafanikio. Katika sura za baadaye, tutafuata jitihada hii katika majadiliano ya quarks na chembe nyingine za msingi, na tutaangalia mwelekeo utafutaji unaonekana sasa unaelekea.
PHET UCHUNGUZI: RUTHERFORD KUTAWANYA
Jinsi gani Rutherford alitambua muundo wa atomu bila kuweza kuiona? Kuiga jaribio maarufu ambalo alikanusha mfano wa Pudding wa Plum wa atomi kwa kuchunguza chembe za alpha zinazopiga atomi na kuamua kwamba lazima iwe na msingi mdogo.
Muhtasari
- Atomi zinajumuisha elektroni za kushtakiwa vibaya, kwanza zimeonekana kuwepo katika majaribio ya cathode-ray-tube, na kiini chenye kushtakiwa vyema.
- Electroni zote zinafanana na zina uwiano wa malipo hadi kwa wingi wa\[\dfrac{q_e}{m_e} = -1.76 \times 10^{11} \, C/kg. \nonumber\]
- Malipo mazuri katika nuclei hufanywa na chembe zinazoitwa protoni, ambazo zina uwiano wa malipo hadi molekuli\[\dfrac{q_p}{m_p} = 9.57 \times 10^7 \, C/kg.\nonumber\]
- Misa ya elektroni,\[m_e = 9.11 \times 10^{-31} \, kg.\nonumber\]
- Misa ya proton,\[m_p = 1.67 \times 10^{-27} \, kg.\nonumber\]
- Mfano wa sayari wa atomu huchora elektroni zinazozunguka kiini kwa njia sawa na sayari zinazobili jua.
faharasa
- tube ya cathode-ray
- tube utupu zenye chanzo cha elektroni na screen kuona picha
- mfano wa sayari wa atomi
- mfano unaojulikana zaidi au mfano wa muundo wa atomi


