15.1: Sheria ya Kwanza ya Thermodynamics
- Page ID
- 183860
Malengo ya kujifunza
Mwishoni mwa sehemu hii, utaweza:
- Eleza sheria ya kwanza ya thermodynamics.
- Eleza jinsi uhifadhi wa nishati unahusiana na sheria ya kwanza ya thermodynamics.
- Kutambua matukio ya sheria ya kwanza ya thermodynamics kufanya kazi katika hali ya kila siku, ikiwa ni pamoja na kimetaboliki ya kibiolojia
- Tumia mabadiliko katika nishati ya ndani ya mfumo, baada ya uhasibu kwa uhamisho wa joto na kazi iliyofanywa.
Ikiwa tuna nia ya jinsi uhamisho wa joto unabadilishwa kufanya kazi, basi uhifadhi wa kanuni ya nishati ni muhimu. Sheria ya kwanza ya thermodynamics inatumika uhifadhi wa kanuni za nishati kwa mifumo ambapo uhamisho wa joto na kufanya kazi ni njia za kuhamisha nishati ndani na nje ya mfumo.

Sheria ya kwanza ya thermodynamics inasema kuwa mabadiliko katika nishati ya ndani ya mfumo ni sawa na uhamisho wa joto halisi ndani ya mfumo hupunguza kazi ya wavu iliyofanywa na mfumo. Katika fomu ya equation, sheria ya kwanza ya thermodynamics ni
\[\Delta U = Q - W. \label{first}\]
Hapa\(\Delta U\) kuna mabadiliko katika nishati \(U\)ya ndani ya mfumo. \(Q\)ni joto wavu kuhamishiwa katika mfumo - yaani,\(Q\) ni jumla ya uhamisho wote joto ndani na nje ya mfumo. \(W\)ni kazi ya wavu iliyofanywa na mfumo - yaani,\(W\) ni jumla ya kazi yote iliyofanywa au kwa mfumo. Tunatumia makusanyiko yafuatayo ya ishara: ikiwa\(Q\) ni chanya, basi kuna uhamisho wa joto wavu ndani ya mfumo; ikiwa\(W\) ni chanya, basi kuna kazi halisi iliyofanywa na mfumo. Hivyo chanya\(Q\) huongeza nishati kwa mfumo na chanya\(W\) inachukua nishati kutoka kwa mfumo. Hivyo\(\Delta U = Q - W\). Kumbuka pia kwamba ikiwa uhamisho zaidi wa joto ndani ya mfumo hutokea kuliko kazi iliyofanyika, tofauti huhifadhiwa kama nishati ya ndani. Injani joto ni mfano mzuri wa hii - joto uhamisho ndani yao unafanyika ili waweze kufanya kazi (Kielelezo\(\PageIndex{2}\)). Sasa tutachunguza\(Q, \, W\) na\(\Delta U\) kuendelea.

SHERIA YA THERMODYNAMICS NA SHERIA YA UHIFADHI WA
Sheria ya kwanza ya thermodynamics ni kweli sheria ya uhifadhi wa nishati iliyoelezwa kwa fomu muhimu sana katika thermodynamics. Sheria ya kwanza inatoa uhusiano kati ya uhamisho wa joto, kazi iliyofanywa, na mabadiliko katika nishati ya ndani ya mfumo.
Joto Q na Kazi W
Uhamisho wa joto\(Q\) na kufanya kazi\(W\) ni njia mbili za kila siku za kuleta nishati ndani au kuchukua nishati nje ya mfumo. Michakato ni tofauti kabisa. Uhamisho wa joto, mchakato mdogo uliopangwa, unaendeshwa na tofauti za joto. Kazi, mchakato ulioandaliwa kabisa, unahusisha nguvu ya macroscopic inayotumiwa kwa mbali. Hata hivyo, joto na kazi zinaweza kuzalisha matokeo yanayofanana.Kwa mfano, wote wawili wanaweza kusababisha ongezeko la joto. Uhamisho wa joto ndani ya mfumo, kama vile wakati Jua linapunguza hewa katika tairi la baiskeli, linaweza kuongeza joto lake, na hivyo linaweza kufanya kazi kwenye mfumo, kama wakati bicyclist inapopiga hewa ndani ya tairi. Mara baada ya ongezeko la joto limetokea, haiwezekani kujua kama lilisababishwa na uhamisho wa joto au kwa kufanya kazi. Ukosefu huu ni jambo muhimu. Uhamisho wa joto na kazi zote mbili ni nishati katika usafiri-wala hazihifadhiwa kama vile katika mfumo. Hata hivyo, wote wanaweza kubadilisha nishati\(U\) ya ndani ya mfumo. Nishati ya ndani ni aina ya nishati tofauti kabisa na joto au kazi.
Nishati ya Ndani U
Tunaweza kufikiri juu ya nishati ya ndani ya mfumo kwa njia mbili tofauti lakini thabiti. Ya kwanza ni mtazamo wa atomiki na Masi, ambao huchunguza mfumo kwenye kiwango cha atomiki na Masi. Nishati\(U\) ya ndani ya mfumo ni jumla ya nguvu za kinetic na uwezo wa atomi na molekuli zake. Kumbuka kwamba kinetic pamoja na nishati inayoitwa nishati ya mitambo. Hivyo nishati ya ndani ni jumla ya nishati ya atomiki na Masi mitambo. Kwa sababu haiwezekani kuweka wimbo wa atomi zote binafsi na molekuli, ni lazima kukabiliana na wastani na mgawanyo. Njia ya pili ya kuona nishati ya ndani ya mfumo ni kwa mujibu wa sifa zake za macroscopic, ambazo ni sawa na maadili ya wastani ya atomiki na Masi.
Macroscopically, sisi kufafanua mabadiliko katika nishati\(\Delta U\) ya ndani kuwa ile iliyotolewa na sheria ya kwanza ya thermodynamics (Equation\ ref {kwanza}):\[\Delta U = Q - W \nonumber\]
Majaribio mengi ya kina\(\Delta U = Q - W\) yamehakikishia kwamba, wapi\(\Delta U\) mabadiliko katika nishati ya jumla ya kinetic na uwezo wa atomi zote na molekuli katika mfumo. Pia imedhamiriwa kwa majaribio kwamba nishati ya ndani\(U\) ya mfumo inategemea tu hali ya mfumo na sio jinsi ilivyofikia hali hiyo. Zaidi hasa,\(U\) hupatikana kuwa kazi ya kiasi chache cha macroscopic (shinikizo, kiasi, na joto, kwa mfano), bila kujali historia ya zamani kama vile kumekuwa na uhamisho wa joto au kazi iliyofanyika. Uhuru huu unamaanisha kwamba ikiwa tunajua hali ya mfumo, tunaweza kuhesabu mabadiliko katika nishati yake ya ndani\(U\) kutoka kwa vigezo vichache vya macroscopic.
MACROSCOPIC VS
Katika thermodynamics, mara nyingi tunatumia picha ya macroscopic wakati wa kufanya mahesabu ya jinsi mfumo unavyofanya, wakati picha ya atomiki na Masi inatoa maelezo ya msingi kwa suala la wastani na mgawanyo. Tutaona hili tena katika sehemu za baadaye za sura hii. Kwa mfano, katika mada ya entropy, mahesabu yatafanywa kwa kutumia mtazamo wa atomiki na Masi.
Ili kupata wazo bora la jinsi ya kufikiri juu ya nishati ya ndani ya mfumo, hebu tuchunguze mfumo unaoenda kutoka Jimbo la 1 hadi Jimbo la 2. Mfumo una nishati ya ndani\(U_1\) katika Jimbo la 1, na ina nishati ya ndani\(U_2\) katika Jimbo la 2, bila kujali jinsi ilivyofikia hali yoyote. Hivyo mabadiliko katika nishati ya ndani
\[\Delta U = U_2 - U_1\]
ni huru ya nini kilichosababisha mabadiliko. Kwa maneno mengine,\(\delta U\) ni huru ya njia. Kwa njia, tunamaanisha njia ya kupata kutoka mwanzo hadi hatua ya mwisho. Kwa nini uhuru huu ni muhimu? Wote\(Q\) na \(W\)hutegemea njia, lakini\(\Delta U\) haina (Equation\ ref {kwanza}). Njia hii uhuru ina maana kwamba nishati\(U\) ya ndani ni rahisi kuzingatia kuliko uhamisho wa joto au kazi iliyofanywa.
Mfano\(\PageIndex{1}\): Calculating Change in Internal Energy - The Same Change in \(U\) is Produced by Two Different Processes
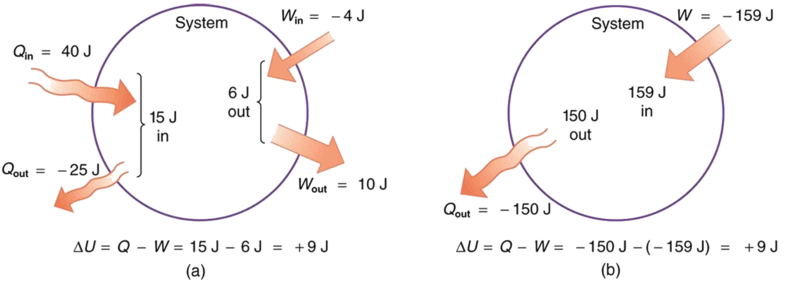
- Tuseme kuna uhamisho wa joto wa 40.00 J kwa mfumo, wakati mfumo unafanya 10.00 J ya kazi. Baadaye, kuna uhamisho wa joto wa 25.00 J nje ya mfumo wakati 4.00 J ya kazi imefanywa kwenye mfumo. Mabadiliko ya wavu katika nishati ya ndani ya mfumo ni nini?
- Je! Ni mabadiliko gani katika nishati ya ndani ya mfumo wakati jumla ya 150.00 J ya uhamisho wa joto hutokea nje ya (kutoka) mfumo na 159.00 J ya kazi hufanyika kwenye mfumo (Kielelezo\(\PageIndex{3}\))?
Mkakati
Katika sehemu (a), lazima kwanza kupata uhamisho wa joto wavu na kazi ya wavu iliyofanywa kutoka kwa habari iliyotolewa. Kisha sheria ya kwanza ya thermodynamics (Equation\ ref {kwanza}).
inaweza kutumika kupata mabadiliko katika nishati ya ndani. Katika sehemu (b), uhamisho wa joto na kazi iliyofanywa hutolewa, hivyo equation inaweza kutumika moja kwa moja.
Suluhisho kwa (a)
Uhamisho wa joto halisi ni uhamisho wa joto ndani ya mfumo usiondoe uhamisho wa joto nje ya mfumo, au
\[ \begin{align*} Q &= 40.00 \, J - 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
Vile vile, kazi ya jumla ni kazi iliyofanywa na mfumo hupunguza kazi iliyofanywa kwenye mfumo, au
\[ \begin{align*} W &= 10.00 \, J - 4.00 \, J \\[5pt] &= 6.00 \, J. \end{align*}\]
Majadiliano juu ya (a)
Haijalishi kama unatazama mchakato wa jumla au kuivunja katika hatua, mabadiliko katika nishati ya ndani ni sawa.
Suluhisho kwa (b)
Hapa uhamisho wa joto na kazi ya jumla hutolewa moja kwa moja kuwa\(Q = -150.00 \, J\) na\(W = -159.00 \, J\), ili
\[ \begin{align*} \Delta U &= Q - W = -150.00 - (-159.00) \\[5pt] &= 9.00 \, J. \end{align*}\]
Majadiliano juu ya (b)
Mchakato tofauti sana katika sehemu (b) hutoa mabadiliko sawa ya 9.00-J katika nishati ya ndani kama sehemu (a). Kumbuka kuwa mabadiliko katika mfumo katika sehemu zote mbili ni kuhusiana\(\Delta U\) na na si kwa\(Q\) s mtu binafsi au\(W\) s kushiriki. Mfumo unaishia katika hali sawa katika wote (a) na (b). Sehemu (a) na (b) zinawasilisha njia mbili tofauti kwa mfumo wa kufuata kati ya pointi sawa za kuanzia na za mwisho, na mabadiliko katika nishati ya ndani kwa kila mmoja ni sawa—ni huru ya njia.
Metabolism ya Binadamu na Sheria ya Kwanza ya Thermodynamics
Kimetaboliki ya binadamu ni uongofu wa chakula katika uhamisho wa joto, kazi, na mafuta yaliyohifadhiwa. Metabolism ni mfano wa kuvutia wa sheria ya kwanza ya thermodynamics katika hatua. Sasa tunaangalia mada haya kupitia sheria ya kwanza ya thermodynamics. Kuzingatia mwili kama mfumo wa maslahi, tunaweza kutumia sheria ya kwanza kuchunguza uhamisho wa joto, kufanya kazi, na nishati ya ndani katika shughuli kuanzia usingizi hadi zoezi nzito. Je! Ni baadhi ya sifa kuu za uhamisho wa joto, kufanya kazi, na nishati katika mwili? Kwa moja, joto la mwili huhifadhiwa mara kwa mara na uhamisho wa joto kwa mazingira. Hii ina maana\(Q\) ni hasi. Ukweli mwingine ni kwamba mwili hufanya kazi kwa ulimwengu wa nje. Hii ina maana\(W\) ni chanya. Katika hali kama hiyo, basi, mwili hupoteza nishati ya ndani, kwani\(\Delta U = Q - W\) ni hasi.
Sasa fikiria madhara ya kula. Kula huongeza nishati ya ndani ya mwili kwa kuongeza nishati ya uwezo wa kemikali (hii ni mtazamo usio na kimapenzi wa steak nzuri). Mwili hutengeneza chakula chochote tunachotumia. Kimsingi, kimetaboliki ni mchakato wa oxidation ambapo nishati ya uwezo wa kemikali ya chakula hutolewa. Hii ina maana kwamba pembejeo ya chakula iko katika fomu ya kazi. Nishati ya chakula inaripotiwa katika kitengo maalum, kinachojulikana kama Calorie. Nishati hii inapimwa kwa kuchoma chakula katika calorimeter, ambayo ni jinsi vitengo vinavyoamua.
Katika kemia na biochemistry, kalori moja (iliyoandikwa kwa chini c) hufafanuliwa kama nishati (au uhamisho wa joto) inahitajika kuongeza joto la gramu moja ya maji safi kwa shahada moja ya Celsius. Nutritionists na walinzi wa uzito huwa na kutumia kalori ya chakula, ambayo mara nyingi huitwa Calorie (iliyoandikwa na mji mkuu C). Chakula kimoja Kalori ni nishati inahitajika kuongeza joto la kilo moja ya maji kwa shahada moja ya Celsius. Hii ina maana kwamba kalori moja ya chakula ni sawa na kilocalorie moja kwa kemia, na mtu lazima awe makini ili kuepuka kuchanganyikiwa kati ya hizo mbili.
Tena, fikiria nishati ya ndani mwili umepoteza. Kuna maeneo matatu nishati hii ya ndani inaweza kwenda-kuhamisha joto, kufanya kazi, na kuhifadhiwa mafuta (sehemu ndogo pia inakwenda kukarabati kiini na ukuaji). Uhamisho wa joto na kufanya kazi huchukua nishati ya ndani nje ya mwili, na chakula huiweka nyuma. Ikiwa unakula kiasi cha haki cha chakula, basi nishati yako ya ndani ya wastani inabakia mara kwa mara. Chochote unachopoteza kwa uhamisho wa joto na kufanya kazi ni kubadilishwa na chakula, ili, kwa muda mrefu,\(\Delta U = 0\). Ikiwa unakula mara kwa mara, basi daima\(\Delta U\) ni chanya, na mwili wako huhifadhi nishati hii ya ziada ya ndani kama mafuta. Reverse ni kweli ikiwa unakula kidogo sana. Ikiwa\(\Delta U\) ni hasi kwa siku chache, basi mwili hutengeneza mafuta yake ili kudumisha joto la mwili na kufanya kazi ambayo inachukua nishati kutoka kwa mwili. Utaratibu huu ni jinsi mlo unavyozalisha kupoteza uzito.
Maisha sio rahisi sana, kama vile mtu yeyote anayejua. Mwili huhifadhi mafuta au metabolizes tu ikiwa ulaji wa nishati hubadilika kwa kipindi cha siku kadhaa. Mara baada ya kuwa juu ya chakula kubwa, moja ijayo ni chini ya mafanikio kwa sababu mwili wako hubadilisha njia inavyojibu kwa ulaji wa chini wa nishati. Kiwango chako cha kimetaboliki cha kimetaboliki (BMR) ni kiwango ambacho chakula kinabadilishwa kuwa uhamisho wa joto na kazi iliyofanyika wakati mwili unapumzika kabisa. Mwili hubadilisha kiwango chake cha kimetaboliki cha kimetaboliki ili kulipa fidia kwa kula zaidi au kula chini. Mwili utapungua kiwango cha metabolic badala ya kuondoa mafuta yake mwenyewe kuchukua nafasi ya ulaji wa chakula kilichopotea. Utakuwa na urahisi zaidi na kujisikia nguvu kidogo kama matokeo ya kiwango cha chini cha metabolic, na huwezi kupoteza uzito haraka kama hapo awali. Zoezi husaidia kupoteza uzito, kwa sababu hutoa uhamisho wa joto kutoka kwa mwili wako na kazi, na huwafufua kiwango chako cha metabolic hata wakati unapumzika. Kupoteza uzito pia kunasaidiwa na ufanisi mdogo kabisa wa mwili katika kubadili nishati ya ndani kufanya kazi, ili kupoteza nishati ya ndani kutokana na kufanya kazi ni kubwa zaidi kuliko kazi iliyofanyika. Ikumbukwe, hata hivyo, kwamba mifumo ya maisha haipo katika usawa wa mafuta.
Mwili hutupa dalili bora kwamba michakato mingi ya thermodynamic haiwezi kurekebishwa. Mchakato usioweza kurekebishwa unaweza kwenda katika mwelekeo mmoja lakini sio kinyume, chini ya seti ya masharti. Kwa mfano, ingawa mafuta ya mwili yanaweza kubadilishwa kufanya kazi na kuzalisha uhamisho wa joto, kazi iliyofanywa kwenye mwili na uhamisho wa joto ndani yake haiwezi kubadilishwa kuwa mafuta ya mwili. Vinginevyo, tunaweza kuruka chakula cha mchana kwa jua wenyewe au kwa kutembea chini ya ngazi. Mfano mwingine wa mchakato wa thermodynamic usioweza kurekebishwa ni photosynth Utaratibu huu ni ulaji wa aina moja ya nishati-mwanga-na mimea na uongofu wake kwa nishati ya uwezo wa kemikali. Matumizi yote ya sheria ya kwanza ya thermodynamics yanaonyeshwa kwenye Kielelezo\(\PageIndex{4}\). Faida moja kubwa ya sheria za uhifadhi kama sheria ya kwanza ya thermodynamics ni kwamba zinaelezea kwa usahihi pointi za mwanzo na za mwisho za michakato tata, kama vile kimetaboliki na usanisinuru, bila kujali matatizo yaliyopo kati.

Muhtasari
Jedwali linatoa muhtasari wa masharti muhimu kwa sheria ya kwanza ya thermodynamics.
| Muda | Ufafanuzi |
|---|---|
| \(U\) | Nishati ya ndani-jumla ya nguvu za kinetic na uwezo wa atomi za mfumo na molekuli. Inaweza kugawanywa katika makundi mengi, kama vile nishati ya joto na kemikali. Inategemea tu hali ya mfumo (kama vile\(P\),\(V\) na\(T\), si jinsi nishati ilivyoingia kwenye mfumo. Mabadiliko katika nishati ya ndani ni njia huru. |
| \(Q\) | Joto-nishati kuhamishwa kwa sababu ya tofauti ya joto. Sifa ya random Masi mwendo. Inategemea sana njia. \(Q\)kuingia mfumo ni chanya. |
| \(W\) | Kazi-Nishati iliyohamishwa na nguvu inayohamia kwa umbali. Mchakato ulioandaliwa, utaratibu. Njia tegemezi. \(W\)iliyofanywa na mfumo (ama dhidi ya nguvu ya nje au kuongeza kiasi cha mfumo) ni chanya. |
- Sheria ya kwanza ya thermodynamics hutolewa kama\(\Delta U = Q - W\), wapi\(\Delta U\) mabadiliko katika nishati ya ndani ya mfumo,\(Q\) ni uhamisho wa joto (jumla ya uhamisho wote wa joto ndani na nje ya mfumo), na\(W\) ni kazi ya wavu iliyofanywa (jumla ya kazi yote iliyofanywa au kwa mfumo).
- Wote\(Q\) na\(W\) ni nishati katika usafiri;\(\Delta U\) inawakilisha tu kiasi cha kujitegemea kinachoweza kuhifadhiwa.
- Nishati\(U\) ya ndani ya mfumo inategemea tu hali ya mfumo na sio jinsi ilivyofikia hali hiyo.
- Kimetaboliki ya viumbe hai, na usanisinuru wa mimea, ni aina maalumu za uhamisho wa joto, kufanya kazi, na nishati ya ndani ya mifumo.
faharasa
- sheria ya kwanza ya thermodynamics
- inasema kuwa mabadiliko katika nishati ya ndani ya mfumo ni sawa na uhamisho wa joto halisi ndani ya mfumo hupunguza kazi ya wavu iliyofanywa na mfumo
- nishati ya ndani
- Jumla ya nguvu kinetic na uwezo wa atomi mfumo na molekuli
- kimetaboliki ya binadamu
- uongofu wa chakula katika joto uhamisho, kazi, na mafuta kuhifadhiwa


