15.2: Lewis Acids na Msingi
- Page ID
- 182457
- Eleza mfano wa Lewis wa kemia ya asidi-msingi
- Andika equations kwa ajili ya malezi ya adducts na ions tata
- Kufanya mahesabu ya usawa kuwashirikisha malezi mara kwa mara
Mwaka 1923, G. Lewis alipendekeza ufafanuzi wa jumla wa tabia ya asidi-msingi ambayo asidi na besi zinatambuliwa na uwezo wao wa kukubali au kuchangia jozi ya elektroni na kuunda dhamana ya covalent ya kuratibu.
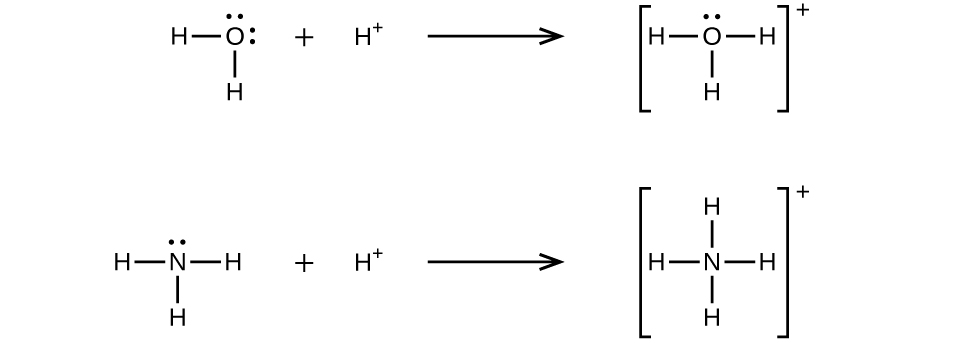
Kuratibu dhamana covalent (au dhamana dative) hutokea wakati moja ya atomi katika dhamana hutoa elektroni zote mbili bonding. Kwa mfano, dhamana ya covalent ya kuratibu hutokea wakati molekuli ya maji inachanganya na ioni ya hidrojeni ili kuunda ioni ya hidroniamu. Dhamana ya covalent ya kuratibu pia husababisha wakati molekuli ya amonia inachanganya na ioni ya hidrojeni ili kuunda ioni ya amonia. Wote wa equations hizi ni umeonyesha hapa.
Ufafanuzi: Lewis Acids na Msingi
- Asidi ya Lewis ni spishi yoyote (molekuli au ion) inayoweza kukubali jozi ya elektroni, na msingi wa Lewis ni spishi yoyote (molekuli au ion) inayoweza kuchangia jozi ya elektroni.
Mmenyuko wa asidi-msingi wa Lewis hutokea wakati msingi unatoa jozi ya elektroni kwa asidi. Mchanganyiko wa asidi-msingi wa Lewis, kiwanja kilicho na dhamana ya kuratibu kati ya asidi ya Lewis na msingi wa Lewis, huundwa. Equations zifuatazo zinaonyesha matumizi ya jumla ya dhana ya Lewis.
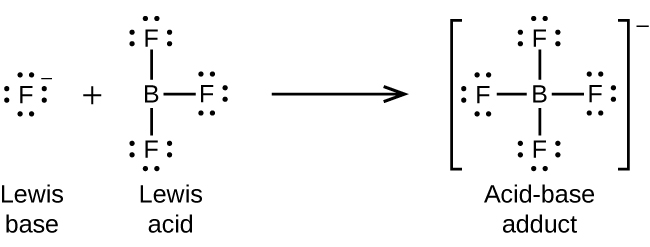
Atomu ya boroni katika trifluoride ya boroni, BF 3, ina elektroni sita tu katika shell yake ya valence. Kwa kuwa mfupi wa octet iliyopendekezwa, BF 3 ni asidi nzuri sana ya Lewis na humenyuka na besi nyingi za Lewis; ioni ya fluoridi ni msingi wa Lewis katika mmenyuko huu, akichangia mojawapo ya jozi zake pekee:
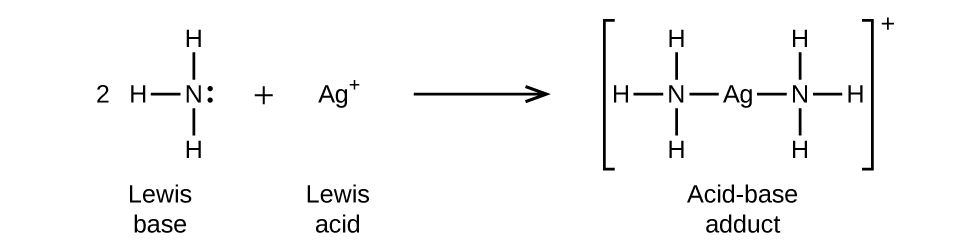
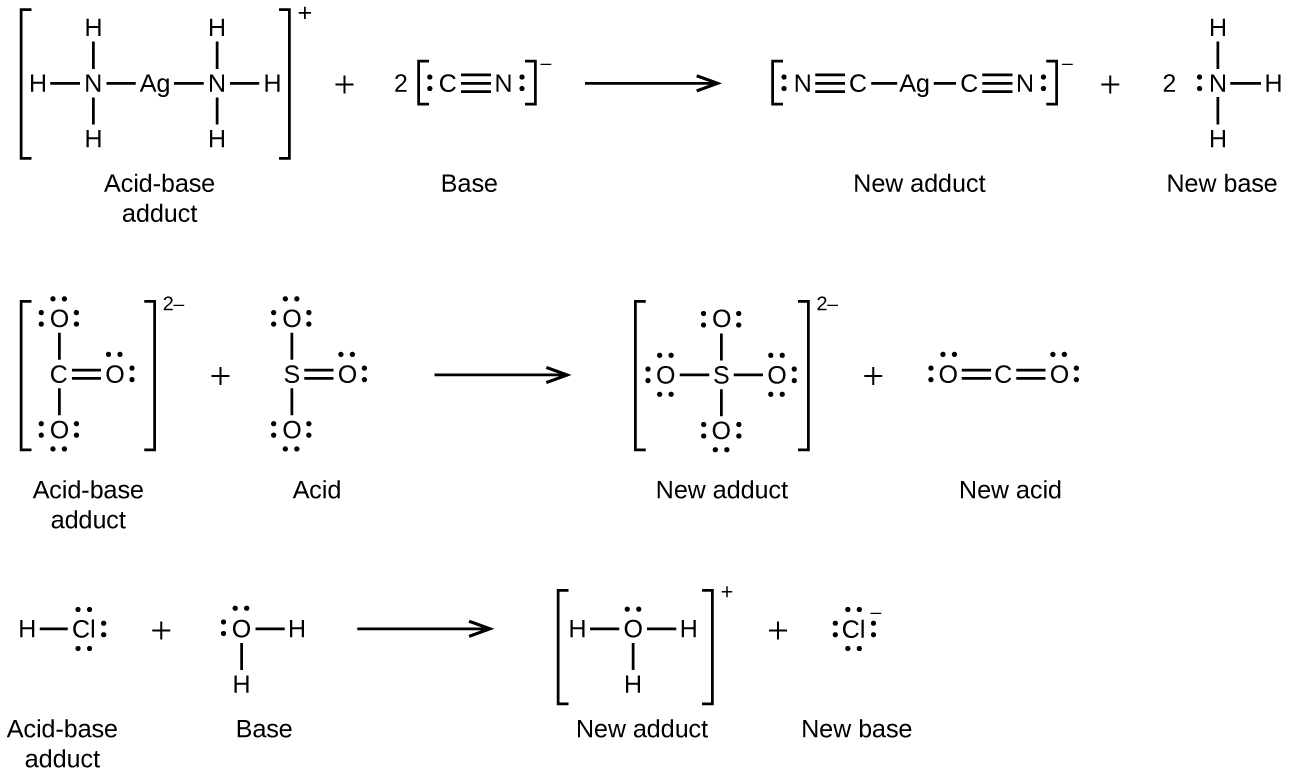
Katika majibu yafuatayo, kila moja ya molekuli mbili za amonia, besi za Lewis, hutoa jozi ya elektroni kwa ion ya fedha, asidi ya Lewis:
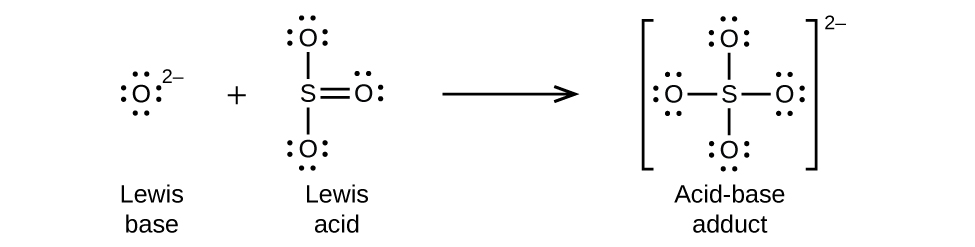
Oksidi zisizo za metali hufanya kama asidi ya Lewis na huitikia na ioni za oksidi, besi za Lewis, ili kuunda oxyanions
Athari nyingi za asidi-msingi za Lewis ni athari za uhamisho ambapo msingi mmoja wa Lewis huondoa msingi mwingine wa Lewis kutoka kwenye adduct ya asidi-msingi, au ambayo asidi moja ya Lewis huhamisha asidi nyingine ya Lewis:
Majibu ya mwisho ya makazi yanaonyesha jinsi majibu ya asidi ya Brønsted-Lowry yenye msingi yanafaa katika dhana ya Lewis. Asidi ya Brønsted-Lowry kama vile HCl ni adduct ya asidi-msingi kulingana na dhana ya Lewis, na uhamisho wa proton hutokea kwa sababu adduct imara zaidi ya asidi-msingi huundwa. Hivyo, ingawa ufafanuzi wa asidi na besi katika nadharia mbili ni tofauti kabisa, nadharia huingiliana sana.
Wengi kidogo mumunyifu ionic yabisi kufutwa wakati mkusanyiko wa ioni chuma katika ufumbuzi ni kupungua kwa malezi ya tata (polyatomic) ions katika Lewis acid-msingi mmenyuko. Kwa mfano, kloridi ya fedha hupasuka katika suluhisho la amonia kwa sababu ioni ya fedha humenyuka na amonia ili kuunda io n tata\(\ce{Ag(NH3)2+}\). Muundo wa Lewis wa\(\ce{Ag(NH3)2+}\) ion ni:
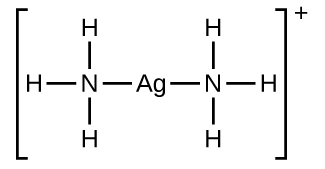
Ulinganisho wa kufutwa kwa AgCl katika suluhisho la NH 3 ni:
\[\ce{AgCl}(s)⟶\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq) \nonumber \]
\[\textrm{Net: }\ce{AgCl}(s)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq)+\ce{Cl-}(aq) \nonumber \]
Hidroksidi ya alumini hupasuka katika suluhisho la hidroksidi ya sodiamu au msingi mwingine wenye nguvu kwa sababu ya kuundwa kwa ion tata\(\ce{Al(OH)4-}\). Muundo wa Lewis wa\(\ce{Al(OH)4-}\) ion ni:
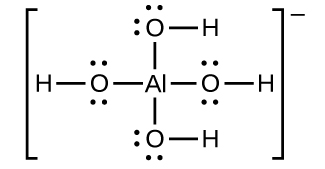
Equations kwa ajili ya kuvunjwa ni:
\[\ce{Al(OH)3}(s)⟶\ce{Al^3+}(aq)+\ce{3OH-}(aq) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{4OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
\[\textrm{Net: }\ce{Al(OH)3}(s)+\ce{OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
Mercury (II) sulfidi hupasuka katika suluhisho la sulfidi ya sodiamu kwa sababu HGs humenyuka na S 2— ion:
\[\ce{HgS}(s)⟶\ce{Hg^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
\[\ce{Hg^2+}(aq)+\ce{2S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
\[\textrm{Net: }\ce{HgS}(s)+\ce{S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
Ioni tata ina atomu ya kati, kwa kawaida cation ya chuma ya mpito, iliyozungukwa na ioni, au molekuli inayoitwa ligandi. Ligandi hizi zinaweza kuwa molekuli zisizo na upande wowote kama H 2 O au NH 3, au ioni kama vile CN - au OH -. Mara nyingi, ligandi hufanya kama besi za Lewis, kutoa jozi ya elektroni kwa atomi kuu. Ligands hujiunganisha karibu na atomi kuu, na kuunda ion mpya na malipo sawa na jumla ya mashtaka na, mara nyingi, ion ya mpito ya chuma. Mpangilio huu mgumu zaidi ni kwa nini ion inayoitwa ioni tata. Ioni tata inayotengenezwa katika athari hizi haiwezi kutabiriwa; ni lazima iamuliwe kwa majaribio. Aina za vifungo vilivyotengenezwa katika ions tata huitwa kuratibu vifungo vya covalent, kama elektroni kutoka kwa ligands zinashirikiwa na atomi kuu. Kwa sababu hii, ions tata wakati mwingine hujulikana kama complexes uratibu. Hii itasoma zaidi katika sura zijazo.
Mara kwa mara ya usawa kwa mmenyuko wa vipengele vya ion tata kuunda ion tata katika suluhisho inaitwa mara kwa mara ya malezi (K f) (wakati mwingine huitwa mara kwa mara utulivu). Kwa mfano, ion tata\(\ce{Cu(CN)2-}\) inavyoonyeshwa hapa:
![]()
Inaunda kwa majibu:
\[\ce{Cu+}(aq)+\ce{2CN-}(aq)⇌\ce{Cu(CN)2-}(aq) \nonumber \]
Katika usawa:
\[K_\ce{f}=Q=\ce{\dfrac{[Cu(CN)2- ]}{[Cu+][CN- ]^2}} \nonumber \]
Inverse ya mara kwa mara ya malezi ni mara kwa mara ya kujitenga (K d), mara kwa mara ya usawa kwa kuharibika kwa ion tata katika vipengele vyake katika suluhisho. Tutafanya kazi na vipindi vya kujitenga zaidi katika mazoezi ya sehemu hii. Jedwali E4 na Jedwali\(\PageIndex{1}\) ni meza za vipindi vya malezi. Kwa ujumla, kubwa ya malezi ya mara kwa mara, imara zaidi; hata hivyo, kama ilivyo katika maadili ya K sp, stoichiometry ya kiwanja lazima izingatiwe.
| Dutu | KL f saa 25 °C |
|---|---|
| \(\ce{[Cd(CN)4]^2-}\) | 3 × 10 18 |
| \(\ce{Ag(NH3)2+}\) | 1.7 × 10 7 |
| \(\ce{[AlF6]^3-}\) | 7 × 10 19 |
Kama mfano wa kuvunjwa kwa malezi ya ion tata, hebu tuchunguze kinachotokea wakati tunaongeza amonia yenye maji kwa mchanganyiko wa kloridi ya fedha na maji. Kloridi ya fedha hupasuka kidogo katika maji, ikitoa mkusanyiko mdogo wa Ag + ([Ag +] = 1.3 × 10 —5 M):
\[\ce{AgCl}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Hata hivyo, ikiwa NH 3 iko ndani ya maji, ion tata\(\ce{Ag(NH3)2+}\), inaweza kuunda kulingana na equation:
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
na
\[K_\ce{f}=\ce{\dfrac{[Ag(NH3)2+]}{[Ag+][NH3]^2}}=1.7×10^7 \nonumber \]
Ukubwa mkubwa wa mara kwa mara hii ya malezi inaonyesha kwamba wengi wa ions za fedha za bure zinazozalishwa na kufutwa kwa AgCl huchanganya na NH 3 kuunda\(\ce{Ag(NH3)2+}\). Matokeo yake, mkusanyiko wa ioni za fedha, [Ag +], umepunguzwa, na quotient ya mmenyuko kwa ajili ya kuvunjwa kwa kloridi ya fedha, [Ag +] [Cl —], iko chini ya bidhaa umumunyifu wa AgCl:
\[Q=\ce{[Ag+][Cl- ]}<K_\ce{sp} \nonumber \]
Zaidi ya kloridi ya fedha kisha hupasuka. Ikiwa mkusanyiko wa amonia ni wa kutosha, kloridi yote ya fedha hupasuka.
Tumia mkusanyiko wa ion ya fedha katika suluhisho ambalo awali ni 0.10 M kwa heshima na\(\ce{Ag(NH3)2+}\).
Suluhisho la Marekani
Tunatumia njia inayojulikana ya kutatua tatizo hili:
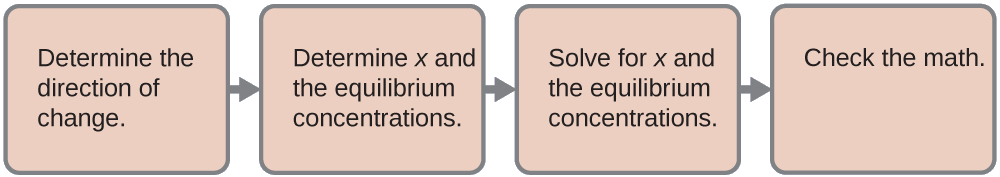
- Kuamua mwelekeo wa mabadiliko. Ioni tata\(\ce{Ag(NH3)2+}\) iko katika usawa na vipengele vyake, kama inavyowakilishwa na equation:\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
Tunaandika usawa kama mmenyuko wa malezi kwa sababu Jedwali E4 linaorodhesha vipindi vya malezi kwa ions tata. Kabla ya usawa, quotient ya majibu ni kubwa kuliko mara kwa mara ya usawa (K_F = 1.7\ mara 10 ^ 7\), na\(Q=\dfrac{0.10}{0 \times 0} = \infty\) (ni kubwa sana), hivyo majibu hubadilika upande wa kushoto kufikia usawa.


