15.1: Upepo na Uharibifu
- Page ID
- 182458
- Andika milinganyo ya kemikali na maneno ya usawa inayowakilisha usawa wa umumunyifu
- Kufanya hesabu za usawa zinazohusisha umumunyifu, maneno ya usawa, na viwango vya solute
Uhifadhi wa sampuli za damu za maabara ya matibabu, madini ya maji ya bahari kwa magnesiamu, uundaji wa madawa yanayouzwa kama vile Maziwa ya Magnesia na antacids, na kutibu uwepo wa maji ngumu katika maji ya nyumba yako ni chache tu ya kazi nyingi zinazohusisha kudhibiti usawa kati ya mumunyifu kidogo ionic imara na ufumbuzi wa maji ya ions yake.
Katika hali nyingine, tunataka kuzuia kuvunjwa kutokea. Kuoza kwa jino, kwa mfano, hutokea wakati hidroxylapatite ya kalsiamu, ambayo ina formula Ca 5 (PO 4) 3 (OH), katika meno yetu hupasuka. Mchakato wa kuvunjwa unasaidiwa wakati bakteria katika midomo yetu sikukuu ya sukari katika mlo wetu ili kuzalisha asidi lactic, ambayo humenyuka na ions hidroksidi katika hidroxylapatite calcium. Kuzuia uharibifu huzuia kuoza. Kwa upande mwingine, wakati mwingine tunataka dutu kufuta. Tunataka calcium carbonate katika antacid chewable kufuta kwa sababu\(\ce{CO3^2-}\) ions zinazozalishwa katika mchakato huu kusaidia Visa tumbo upset.
Katika sehemu hii, tutajua jinsi tunaweza kudhibiti uharibifu wa imara ya ionic imara kwa matumizi ya kanuni ya Le Chatelier. Tutajifunza pia jinsi ya kutumia mara kwa mara ya usawa wa mmenyuko ili kuamua mkusanyiko wa ions zilizopo katika suluhisho.
Mara kwa mara ya bidhaa umumunyifu
Silver chloride ni nini inajulikana kama kidogo mumunyifu ionic imara (Kielelezo\(\PageIndex{1}\)). Kumbuka kutoka kwa sheria za umumunyifu katika sura ya awali kwamba halides ya Ag + sio kawaida ya mumunyifu. Hata hivyo, tunapoongeza ziada ya agCl imara kwa maji, hupasuka kwa kiasi kidogo na hutoa mchanganyiko unao na suluhisho la kuondokana sana la Ag + na Cl — ions katika usawa na kloridi ya fedha isiyosafishwa:
\[\ce{AgCl}(s)\mathrm{\xrightleftharpoons[\:precipitation\:]{\:dissolution\:}}\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Msawazo huu, kama usawa mwingine, ni nguvu; baadhi ya agCl imara inaendelea kufuta, lakini wakati huo huo, Ag + na Cl — ions katika suluhisho huchanganya ili kuzalisha kiasi sawa cha imara. Katika usawa, michakato ya kupinga ina viwango sawa.
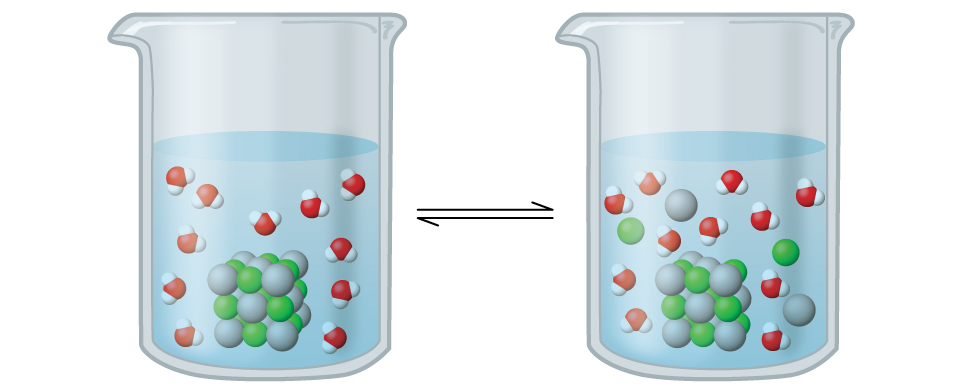
Msawazo mara kwa mara kwa usawa kati ya imara kidogo mumunyifu ionic na ufumbuzi wa ions yake inaitwa umumunyifu bidhaa (K sp) ya imara. Kumbuka kutoka sura juu ya ufumbuzi na colloids kwamba tunatumia mkusanyiko wa ion kama makadirio ya shughuli zake katika suluhisho la kuondokana. Kwa kloridi ya fedha, kwa usawa:
\[\ce{AgCl}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
na
\[K_\ce{sp}=[\ce{Ag+}(aq)][\ce{Cl-}(aq)] \nonumber \]
Wakati wa kuangalia athari za kuvunjwa kama hii, imara imeorodheshwa kama reactant, wakati ions zimeorodheshwa kama bidhaa. Umumunyifu wa bidhaa mara kwa mara, kama ilivyo kwa kila usawa kujieleza mara kwa mara, imeandikwa kama bidhaa ya viwango vya kila ions, iliyoinuliwa kwa nguvu ya coefficients yao ya stoichiometric. Hapa, mara kwa mara ya bidhaa za umumunyifu ni sawa na Ag + na Cl — wakati suluhisho la kloridi ya fedha liko katika usawa na agCl isiyofutwa. Hakuna denominator inayowakilisha reactants katika usemi huu wa usawa kwani mmenyuko ni imara safi; kwa hiyo [AgCl] haionekani katika usemi kwa K sp.
| Dutu | K sp saa 25 °C |
|---|---|
| CuCl | 1.2 × 10 —6 |
| CubR | 6.27 × 10 —9 |
| AGI | 1.5 × 10 —16 |
| PBs | 7 × 10 —29 |
| Al (OH) 3 | 2 × 10 —32 |
| Fe (OH) 3 | 4 × 10 —38 |
Bidhaa zingine za umumunyifu wa kawaida zimeorodheshwa kwenye Jedwali\(\PageIndex{1}\) kulingana na maadili yao ya K sp, wakati mkusanyiko mkubwa wa bidhaa unaonekana katika Jedwali E3. Kila moja ya vipindi hivi vya usawa ni ndogo sana kuliko 1 kwa sababu misombo iliyoorodheshwa ni mumunyifu kidogo tu. K sp ndogo inawakilisha mfumo ambao usawa uongo upande wa kushoto, ili ions chache hidrati itakuwa sasa katika suluhisho ulijaa.
Andika equation ionic kwa ajili ya kuvunjwa na kujieleza bidhaa umumunyifu kwa kila moja ya yafuatayo misombo kidogo mumunyifu ionic:
- AGI, iodidi ya fedha, imara na mali ya antiseptic
- CaCO 3, calcium carbonate, ingredient kazi katika antacids wengi yanayouzwa chewable
- Mg (OH) 2, hidroksidi magnesiamu, viungo hai katika Maziwa ya Magnesia
- Mg (NH 4) PO 4, phosphate ya amonia ya magnesiamu, dutu isiyo ya kawaida inayotumiwa katika vipimo vya magnesiamu
- Ca 5 (PO 4) 3 OH, apatite ya madini, chanzo cha phosphate kwa mbolea
(Kidokezo: Wakati wa kuamua jinsi ya kuvunja (d) na (e) hadi ions, rejea orodha ya ions polyatomic katika sehemu ya majina ya kemikali.)
Suluhisho
- \(\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+][I- ]}\)
- \(\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+][CO3^2- ]}\)
- \(\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][OH- ]^2}\)
- \(\ce{Mg(NH4)PO4}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{NH4+}(aq)+\ce{PO4^3-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][NH4+][PO4^3- ]}\)
- \(\ce{Ca5(PO4)3OH}(s) \rightleftharpoons \ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+]^5[PO4^3- ]^3[OH- ]}\)
Andika equation ionic kwa ajili ya kuvunjwa na bidhaa umumunyifu kwa kila moja ya misombo yafuatayo kidogo mumunyifu:
- BaSo 4
- Agor 2 - PSO 4
- Al (OH) 3
- Pb (OH) Cl
- Jibu
-
\(\ce{BaSO4}(s) \rightleftharpoons \ce{Ba^2+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ba^2+][SO4^2- ]}\)
- Jibu b
-
\(\ce{Ag2SO4}(s) \rightleftharpoons \ce{2Ag+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+]^2[SO4^2- ]}\)
- Jibu c
-
\(\ce{Al(OH)3}(s) \rightleftharpoons \ce{Al^2+}(aq)+\ce{3OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Al^3+][OH- ]^3}\)
- Jibu d
-
\(\ce{Pb(OH)Cl}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{OH-}(aq)+\ce{Cl-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Pb^2+][OH- ][Cl- ]}\)
Sasa tutaongeza majadiliano ya K sp na kuonyesha jinsi mara kwa mara ya bidhaa umumunyifu imedhamiriwa kutoka kwa umumunyifu wa ions zake, pamoja na jinsi K sp inaweza kutumika kuamua umumunyifu wa molar wa dutu.
K sp na umumunyifu
Kumbuka kwamba ufafanuzi wa umumunyifu ni mkusanyiko wa kiwango cha juu cha solute katika suluhisho kwa joto na shinikizo. Tunaweza kuamua umumunyifu wa bidhaa kidogo mumunyifu imara kutokana na kipimo cha umumunyifu wake katika joto fulani na shinikizo, mradi tu majibu muhimu ambayo hutokea wakati dissolves imara ni dissociation yake katika ions solvated, yaani, msawazo tu kushiriki ni:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Katika kesi hii, tunahesabu bidhaa za umumunyifu kwa kuchukua umumunyifu wa imara ulioonyeshwa katika vitengo vya moles kwa lita (mol/L), inayojulikana kama umumunyifu wake wa molar.
Tulianza sura na majadiliano yasiyo rasmi ya jinsi fluorite ya madini inavyoundwa. Fluorite, CaF 2, ni imara kidogo ya mumunyifu ambayo hupasuka kulingana na equation:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Mkusanyiko wa Ca 2 + katika suluhisho iliyojaa ya CaF 2 ni 2.1 × 10 —4 M; Kwa hiyo, ile ya F — ni 4.2 × 10 —4 M, yaani, mara mbili mkusanyiko wa Ca 2 +. Je! Ni bidhaa gani ya umumunyifu wa fluorite?
Suluhisho
Kwanza, andika maneno ya K sp, kisha ubadilishe katika viwango na kutatua kwa K sp:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Suluhisho lililojaa ni suluhisho la usawa na imara. Hivyo:
\[\begin{align*} K_\ce{sp} &=\ce{[Ca^2+][F^{-}]^2} \\[4pt] &=(2.1×10^{−4})(4.2×10^{−4})^2 \\[4pt] &=3.7×10^{−11} \end{align*} \nonumber \]
Kama ilivyo kwa vipindi vingine vya usawa, hatujumuishi vitengo na K sp.
Katika suluhisho iliyojaa ambayo inawasiliana na Mg imara (OH) 2, mkusanyiko wa Mg 2 + ni 3.7 × 10 —5 M. Je! Ni bidhaa gani ya umumunyifu kwa Mg (OH) 2?
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
- Jibu
-
2.0 × 10 —13
K sp ya shaba (I) bromidi, CubR, ni 6.3 × 10 —9. Tumia umumunyifu wa molar wa bromidi ya shaba.
Suluhisho
Bidhaa ya umumunyifu mara kwa mara ya shaba (I) bromidi ni\(6.3 \times 10^{–9}\).
Majibu ni:
\[\ce{CuBr}(s) \rightleftharpoons \ce{Cu+}(aq)+\ce{Br-}(aq) \nonumber \]
Kwanza, kuandika bidhaa umumunyifu usawa kujieleza mara kwa mara:
\[K_\ce{sp}=\ce{[Cu+][Br- ]} \nonumber \]
Unda meza ya ICE (kama ilivyoletwa katika sura ya dhana ya msingi ya usawa), na kuacha safu ya Cubr tupu kama ilivyo imara na haina kuchangia K sp:
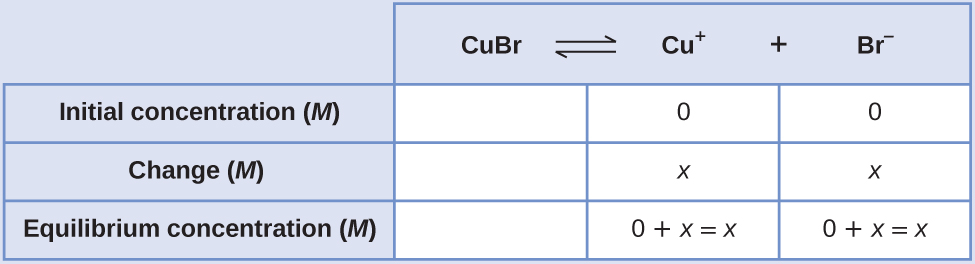
Katika usawa:
\[\begin{align*} K_{sp} &=\ce{[Cu+][Br- ]} \\[4pt] 6.3×10^{−9} &=(x)(x)=x^2 \\[4pt] x &=\sqrt{(6.3×10^{−9})}=7.9×10^{−5} \end{align*} \nonumber \]Kwa hiyo, umumunyifu wa molar wa CubR ni 7.9 × 10 —5 M.
K sp ya AGI ni 1.5 × 10 —16. Tumia umumunyifu wa molar wa iodidi ya fedha.
- Jibu
-
1.2 × 10 —8 M
Uamuzi wa umumunyifu wa Molar kutoka K sp, Sehemu ya II K sp ya hidroksidi ya kalsiamu, Ca (OH) 2, ni 8.0 × 10 —6. Tumia umumunyifu wa molar wa hidroksidi kalsiamu.
Suluhisho
Bidhaa ya umumunyifu mara kwa mara ya hidroksidi ya kalsiamu ni 1.3 × 10 —6.
Majibu ni:
\[\ce{Ca(OH)2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
Kwanza, kuandika bidhaa umumunyifu usawa kujieleza mara kwa mara:
\[K_\ce{sp}=\ce{[Ca^2+][OH- ]^2} \nonumber \]
Kujenga meza ICE, na kuacha Ca (OH) 2 safu tupu kama ni imara na haina kuchangia K sp:
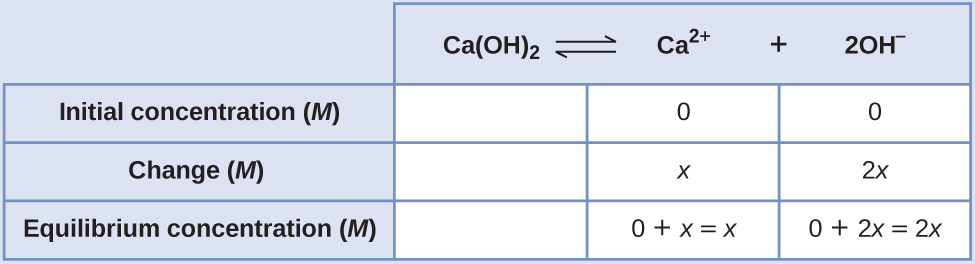
Katika usawa:
\[ \begin{align*} K_\ce{sp} &=\ce{[Ca^2+][OH- ]^2} \\[4pt] 1.3×10^{−6} &=(x)(2x)^2=(x)(4x^2)=4x^3 \\[4pt] x &=\sqrt[3]{\dfrac{1.3×10^{-6}}{4}}=6.9×10^{-3} \end{align*} \nonumber \]
Kwa hiyo, umumunyifu wa molar wa Ca (OH) 2 ni 6.9 × 10 —3 M.
K sp ya PBi 2 ni 1.4 × 10 —8. Tumia umumunyifu wa molar wa iodidi ya risasi (II).
- Jibu
-
1.5 × 10 —3 M
Kumbuka kuwa umumunyifu sio daima hutolewa kama thamani ya molar. Wakati umumunyifu wa kiwanja hutolewa katika kitengo fulani isipokuwa moles kwa lita, tunapaswa kubadili umumunyifu ndani ya moles kwa lita (yaani, molarity) ili kuitumia katika bidhaa ya umumunyifu kujieleza mara kwa mara. Mfano\(\PageIndex{5}\) unaonyesha jinsi ya kufanya mabadiliko hayo ya kitengo kabla ya kuamua usawa wa bidhaa umumunyifu.
Wengi wa rangi zinazotumiwa na wasanii katika rangi za mafuta (Kielelezo\(\PageIndex{2}\)) ni kidogo mumunyifu katika maji. Kwa mfano, umumunyifu wa rangi ya msanii wa chrome njano, PBCRO 4, ni 4.6 × 10 —6 g/L.

Suluhisho
Tunapewa umumunyifu wa PBCRo 4 kwa gramu kwa lita. Ikiwa tunabadilisha umumunyifu huu ndani ya moles kwa lita, tunaweza kupata viwango vya usawa wa Pb 2 + na\(\ce{CrO4^2-}\), kisha K sp:
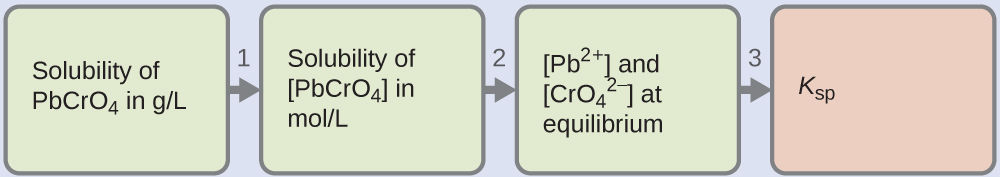
- Tumia molekuli ya molar ya PBCrO 4\(\mathrm{\left(\dfrac{323.2\:g}{1\:mol}\right)}\) ili kubadilisha umumunyifu wa PBCro 4 kwa gramu kwa lita moja ndani ya moles kwa lita:
\(\mathrm{[PbCrO_4]=\dfrac{4.6×10^{−6}\:g\: PbCrO_4}{1\:L}×\dfrac{1\:mol\: PbCrO_4}{323.2\:g\: PbCrO_4}}\)
\(\mathrm{=\dfrac{1.4×10^{−8}\:mol\: PbCrO_4}{1\:L}}\)
\(=1.4×10^{−8}\:M\)
- Equation ya kemikali kwa ajili ya kufutwa inaonyesha kwamba 1 mol ya PBCrO 4 inatoa 1 mol ya Pb 2 + (aq) na 1 mol ya\(\ce{CrO_4^{2-}}(aq)\):
\(\ce{PbCrO4}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{CrO4^2-}(aq)\)
Hivyo, wote [Pb 2 +] na\(\ce{[CrO4^2- ]}\) ni sawa na umumunyifu wa molar wa PBCro 4:
\(\ce{[Pb^2+]}=\ce{[CrO4^2- ]}=1.4×10^{−8}\:M\) - Kutatua. K sp = [Pb 2 +]\(\ce{[CrO4^2- ]}\) = (1.4 × 10 —8) (1.4 × 10 —8) = 2.0 × 10 —16
Umumunyifu wa tlCl [thallium (I) kloridi], kati inayoundwa wakati thalliamu inapotengwa na ores, ni gramu 3.46 kwa lita moja saa 20 °C Ni bidhaa gani ya umumunyifu?
- Jibu
-
2.08 × 10 —4
Calomel, Hg 2 Cl 2, ni kiwanja linajumuisha ioni diatomic ya zebaki (I),\(\ce{Hg2^2+}\), na ions kloridi, Cl -. Ingawa misombo mingi ya zebaki sasa inajulikana kuwa yenye sumu, madaktari wa karne ya kumi na nane walitumia kalomeli kama dawa. Wagonjwa wao mara chache walipata sumu yoyote ya zebaki kutokana na matibabu kwa sababu calomel haipatikani kabisa:
\[\ce{Hg2Cl2}(s) \rightleftharpoons \ce{Hg2^2+}(aq)+\ce{2Cl-}(aq) \hspace{20px} K_\ce{sp}=1.1×10^{−18} \nonumber \]
Tumia umumunyifu wa molar wa Hg 2 Cl 2.
Suluhisho
Umumunyifu wa molar wa Hg 2 Cl 2 ni sawa na mkusanyiko wa\(\ce{Hg2^2+}\) ions kwa sababu kwa kila 1 mol ya Hg 2 Cl 2 ambayo hupasuka, 1 mol ya\(\ce{Hg2^2+}\) fomu:
- Kuamua mwelekeo wa mabadiliko. Kabla ya Hg 2 Cl 2 kufuta, Q ni sifuri, na majibu yatahamia haki ya kufikia usawa.
- Kuamua viwango vya x na usawa. Mazingira na mabadiliko hutolewa katika meza ya ICE ifuatayo:
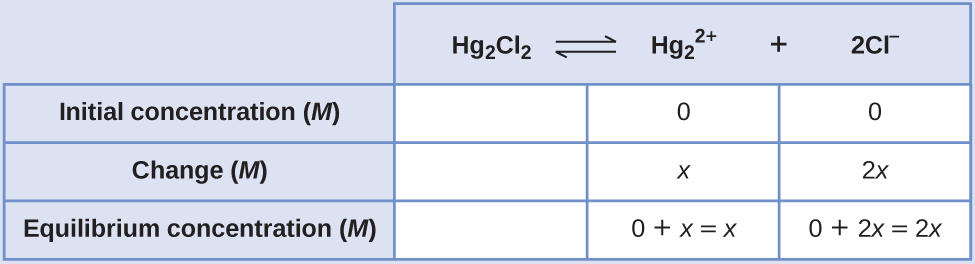
Kumbuka kuwa mabadiliko katika mkusanyiko wa Cl — (2 x) ni mara mbili kubwa kama mabadiliko katika mkusanyiko wa\(\ce{Hg2^2+}\) (x) kwa sababu 2 mol ya Cl — fomu kwa kila 1 mol ya aina\(\ce{Hg2^2+}\) hiyo. Hg 2 Cl 2 ni imara safi, hivyo haionekani katika hesabu.
- Kutatua kwa x na viwango vya usawa. Sisi badala ya viwango vya usawa katika kujieleza kwa K sp na kuhesabu thamani ya x:
\[\begin{align*} K_\ce{sp} &=\ce{[Hg2^2+][Cl- ]^2} \\[4pt] 1.1×10^{−18} &=(x)(2x)^2 \\[4pt] 4x^3 &=1.1×10^{−18} \\[4pt] x &=\sqrt[3]{\left(\dfrac{1.1×10^{-18}}{4}\right)}=6.5×10^{-7}\:M \end{align*} \nonumber \]
Hivyo viwango ni
\[\begin{align*} \ce{[Hg2^2+]} &=6.5×10^{−7}\:M=6.5×10^{−7}\:M \\[4pt] \ce{[Cl- ]} &=2x=2(6.5×10^{−7})=1.3×10^{−6}\:M \end{align*} \nonumber \]
Umumunyifu wa molar wa Hg 2 Cl 2 ni sawa na\(\ce{[Hg2^2+]}\), au 6.5 × 10 —7 M.
Angalia kazi.
Katika usawa, Q = K sp:
\[Q=\ce{[Hg2^2+][Cl- ]^2}=(6.5×10^{−7})(1.3×10^{−6})^2=1.1×10^{−18} \nonumber \]
Hundi ya mahesabu.
Kuamua umumunyifu wa molar wa MgF 2 kutoka kwa bidhaa yake ya umumunyifu: K sp = 6.4 × 10 —9.
- Jibu
-
1.2 × 10 —3 M
Maadili ya K sp yaliyoorodheshwa yanaweza pia kulinganishwa na quotients za majibu zilizohesabiwa kutoka data ya majaribio ili kujua kama imara itapungua katika mmenyuko chini ya hali maalum: Swali ni sawa na K sp katika usawa; ikiwa Q ni chini ya K sp, imara itafuta mpaka Q sawa na K sp; ikiwa Q ni kubwa kuliko K sp, mvua itatokea kwenye joto lililopewa mpaka Q inalingana na K sp.
Aina mbalimbali za mbinu za upigaji picha za kimatibabu zinatumika kusaidia uchunguzi wa magonjwa kwa namna isiyo ya kawaida. Mbinu moja hutumia kumeza kiwanja cha bariamu kabla ya kuchukua picha ya X-ray. Kusimamishwa kwa sulfate ya bariamu, poda ya chalky, huingizwa na mgonjwa. Kwa kuwa K sp ya sulfate ya bariamu ni 1.1 × 10 —10, kidogo sana hupasuka kama inavyovaa kitambaa cha njia ya tumbo ya mgonjwa. Barium-coated maeneo ya njia ya utumbo kisha kuonekana kwenye X-ray kama nyeupe, kuruhusu kwa maelezo zaidi Visual kuliko jadi X-ray (Kielelezo\(\PageIndex{3}\)).
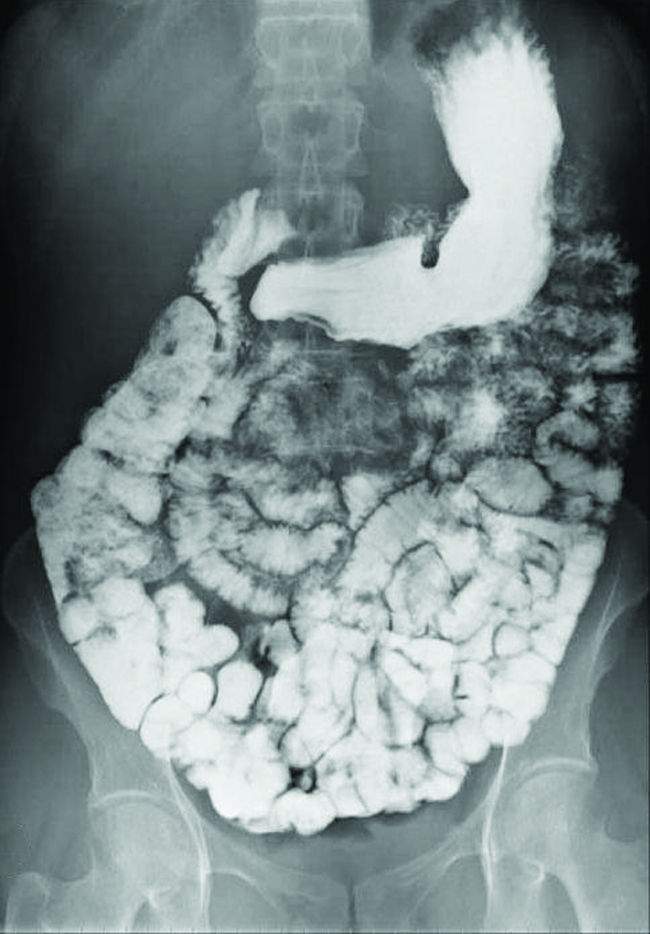
Upimaji zaidi wa uchunguzi unaweza kufanyika kwa kutumia sulfate ya bariamu na fluoroscopy. Katika fluoroscopy, X-ray inayoendelea inapita kupitia mwili ili daktari anaweza kufuatilia, kwenye skrini ya TV au kompyuta, harakati ya sulfate ya bariamu inapita kupitia njia ya utumbo. Upigaji picha wa kimatibabu kwa kutumia sulfate ya bariamu inaweza kutumika kutambua ugonjwa wa reflux asidi, ugonjwa wa Crohn, na vidonda pamoja na hali nyingine.
Utabiri wa mvua
Equation inayoelezea usawa kati ya carbonate ya kalsiamu imara na ions zake zilizosumbuliwa ni:
\[\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Tunaweza kuanzisha usawa huu ama kwa kuongeza carbonate ya kalsiamu imara kwa maji au kwa kuchanganya suluhisho ambalo lina ioni za kalsiamu na suluhisho ambalo lina ioni za carbonate. Kama sisi kuongeza calcium carbonate kwa maji, imara kufuta mpaka viwango ni kama kwamba thamani ya quotient majibu\(\ce{(Q=[Ca^2+][CO3^2- ])}\) ni sawa na bidhaa umumunyifu (K sp = 4.8 × 10 —9). Kama sisi kuchanganya ufumbuzi wa nitrati calcium, ambayo ina Ca 2 + ions, na ufumbuzi wa carbonate sodium, ambayo ina\(\ce{CO3^2-}\) ions, kidogo mumunyifu ionic imara CaCO 3 itakuwa precipitate, mradi viwango vya Ca 2 + na \(\ce{CO3^2-}\)ions ni kama kwamba Q ni kubwa kuliko K sp kwa mchanganyiko. Mabadiliko ya mmenyuko upande wa kushoto na viwango vya ions hupunguzwa kwa kuundwa kwa imara mpaka thamani ya Q ni sawa na K sp. Suluhisho lililojaa katika usawa na imara isiyofutwa itasababisha. Ikiwa viwango ni kama vile Q ni chini ya K sp, basi suluhisho haijajaa na hakuna usahihi utaunda.
Tunaweza kulinganisha maadili ya namba ya Q na K sp kutabiri kama precipitation kutokea, kama\(\PageIndex{7}\) inaonyesha Mfano. (Kumbuka: Kwa kuwa kila aina ya constants usawa ni tegemezi joto, sisi kudhani chumba joto mazingira kwenda mbele katika sura hii isipokuwa tofauti joto thamani ni wazi maalum.)
Hatua ya kwanza katika maandalizi ya chuma magnesiamu ni mvua ya Mg (OH) 2 kutoka maji ya bahari kwa kuongeza ya chokaa, Ca (OH) 2, chanzo cha gharama nafuu cha OH — ion:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=8.9×10^{−12} \nonumber \]
Mkusanyiko wa Mg 2 + (aq) katika maji ya bahari ni 0.0537 M. Je Mg (OH) 2 precipitate wakati kutosha Ca (OH) 2 ni aliongeza kutoa [OH —] ya 0.0010 M?
Suluhisho
Tatizo hili linauliza kama majibu:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
mabadiliko ya kushoto na aina imara Mg (OH) 2 wakati [Mg 2 +] = 0.0537 M na [OH -] = 0.0010 M. Mabadiliko ya majibu upande wa kushoto ikiwa Q ni kubwa kuliko K sp. Uhesabuji wa quotient ya majibu chini ya hali hizi huonyeshwa hapa:
\[\mathrm{Q=[Mg^{2+}][OH^-]^2=(0.0537)(0.0010)^2=5.4×10^{−8}} \nonumber \]
Kwa sababu Q ni kubwa kuliko K sp (Q = 5.4 × 10 —8 ni kubwa kuliko K sp = 8.9 × 10 —12), tunaweza kutarajia majibu ya kuhama upande wa kushoto na kuunda hidroksidi imara ya magnesiamu. Mg (OH) 2 (s) huunda mpaka viwango vya ioni ya magnesiamu na ioni ya hidroksidi hupunguzwa kwa kutosha ili thamani ya Q ni sawa na K sp.
Tumia bidhaa za umumunyifu katika Jedwali E3 ili kuamua kama CahPo 4 itapungua kutoka suluhisho na [Ca 2 +] = 0.0001 M na\(\ce{[HPO4^2- ]}\) = 0.001 M.
- Jibu
-
Hakuna mvua ya CaHPo 4; Q = 1 × 10 —7, ambayo ni chini ya K sp
Je, kloridi ya fedha hupunguza wakati kiasi sawa cha ufumbuzi wa 2.0 × 10 —4 - M wa AgNo 3 na ufumbuzi wa 2.0 × 10 —4 - M wa NaCl huchanganywa?
(Kumbuka: Suluhisho pia lina Na + na\(\ce{NO3-}\) ions, lakini wakati akimaanisha sheria za umumunyifu, mtu anaweza kuona kwamba nitrati ya sodiamu ni mumunyifu sana na haiwezi kuunda usahihi.)
Suluhisho
Ulinganisho wa usawa kati ya kloridi ya fedha imara, ion ya fedha, na ioni ya kloridi ni:
Bidhaa ya umumunyifu ni 1.8 × 10 —10 (Jedwali E3).
AgCl itakuwa precipitate kama majibu quotient mahesabu kutoka viwango katika mchanganyiko wa AgNo 3 na NaCl ni kubwa kuliko K sp. Kiwango cha mara mbili wakati tunachanganya kiasi sawa cha AgNo 3 na ufumbuzi wa NaCl, hivyo kila mkusanyiko umepungua hadi nusu thamani yake ya awali. Kwa hiyo, mara moja baada ya kuchanganya, [Ag +] na [Cl -] zote mbili ni sawa na:
Quotient ya majibu, Q, ni kwa muda mfupi zaidi kuliko K sp kwa AgCl, hivyo suluhisho la supersaturated linaundwa:
Kwa kuwa ufumbuzi supersaturated ni imara, AgCl itakuwa precipitate kutoka mchanganyiko mpaka ufumbuzi anarudi kwa usawa, na Q sawa na K sp.
Je, kClo 4 itapungua wakati 20 ml ya ufumbuzi wa 0.050- M wa K + huongezwa kwa 80 ml ya ufumbuzi wa 0.50- M ya\(\ce{ClO4-}\)? (Kumbuka kuhesabu mkusanyiko mpya wa kila ion baada ya kuchanganya ufumbuzi kabla ya kuziba katika kujieleza majibu quotient.)
- Jibu
-
Hapana, Q = 4.0 × 10 —3, ambayo ni chini ya K sp = 1.07 × 10 —2
Katika mifano miwili iliyopita, tumeona kwamba Mg (OH) 2 au AgCl precipitate wakati Q ni kubwa kuliko K sp. Kwa ujumla, wakati ufumbuzi wa chumvi mumunyifu ya M m+ion imechanganywa na suluhisho la chumvi mumunyifu wa X n— ion, imara, M p X q inakabiliwa ikiwa thamani ya Q kwa mchanganyiko wa M m+ na X n— ni kubwa kuliko K sp kwa M p X q. Hivyo, kama tunajua mkusanyiko wa moja ya ions ya imara kidogo mumunyifu ionic na thamani ya bidhaa umumunyifu wa imara, basi tunaweza kuhesabu mkusanyiko kwamba ion nyingine lazima kisichozidi kwa precipitation kuanza. Ili kurahisisha hesabu, tutafikiri kwamba mvua huanza wakati quotient ya majibu inakuwa sawa na bidhaa ya umumunyifu mara kwa mara.
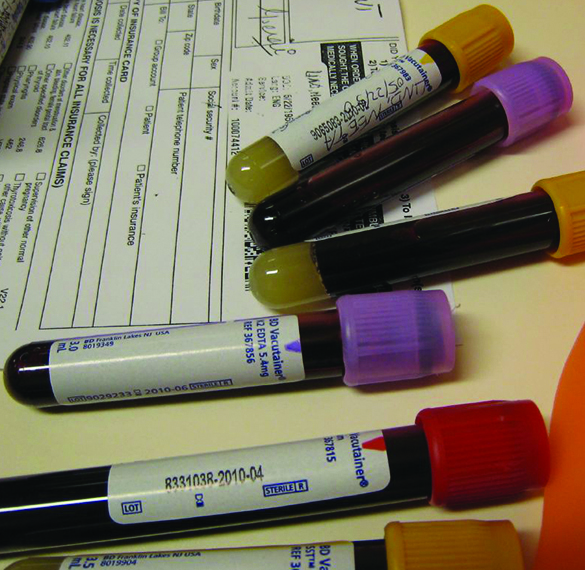
Damu haiwezi kuziba ikiwa ioni za kalsiamu zinaondolewa kwenye plasma yake. Baadhi ya zilizopo za kukusanya damu zina chumvi za ion oxalate\(\ce{C2O4^2-}\), kwa kusudi hili (Kielelezo\(\PageIndex{4}\)). Katika viwango vya kutosha vya juu, ioni za kalsiamu na oxalate huunda imara, CaC 2 O 4 • H 2 O (ambayo pia ina maji yaliyofungwa kwenye imara). Mkusanyiko wa Ca 2 + katika sampuli ya seramu ya damu ni 2.2 × 10 —3 M. Ni mkusanyiko gani wa\(\ce{C2O4^2-}\) ioni lazima uanzishwe kabla ya CaC 2 O 4 •H 2 O huanza kuharakisha?
Suluhisho
Maneno ya usawa ni:
\[\ce{CaC2O4}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{C2O4^2-}(aq) \nonumber \]
Kwa majibu haya (Jedwali E3):
\[K_\ce{sp}=\ce{[Ca^2+][C2O4^2- ]}=1.96×10^{−8} \nonumber \]
CaC 2 the 4 haionekani katika usemi huu kwa sababu ni imara. Maji haionekani kwa sababu ni kutengenezea.
Mango CaC 2 the 4 haina kuanza kuunda mpaka Q sawa K sp. Kwa sababu tunajua K sp na [Ca 2 +], tunaweza kutatua kwa mkusanyiko wa\(\ce{C2O4^2-}\) kwamba ni muhimu kuzalisha maelezo ya kwanza ya imara:
Mkusanyiko wa\(\ce{[C2O4^2- ]}\) = 8.9 × 10 —6 M ni muhimu kuanzisha mvua ya CaC 2 O 4 chini ya masharti haya.
Ikiwa suluhisho lina 0.0020 ml ya\(\ce{CrO4^2-}\) lita moja, ni mkusanyiko gani wa Ag + ion lazima ufikiwe kwa kuongeza AgNo 3 imara kabla ya Ag 2 CRO 4 huanza kuharakisha? Puuza ongezeko lolote la kiasi juu ya kuongeza nitrati ya fedha imara.
- Jibu
-
4.5 × 10 —9 M
Wakati mwingine ni muhimu kujua mkusanyiko wa ion iliyobaki katika suluhisho baada ya mvua. Tunaweza kutumia bidhaa ya umumunyifu kwa hesabu hii pia: Ikiwa tunajua thamani ya K sp na mkusanyiko wa ion moja katika suluhisho, tunaweza kuhesabu mkusanyiko wa ion ya pili iliyobaki katika suluhisho. Hesabu ni ya aina moja kama ile katika Mfano\(\PageIndex{8}\) —hesabu ya mkusanyiko wa spishi katika mchanganyiko wa msawazo kutoka kwa viwango vya spishi nyingine na mara kwa mara ya usawa. Hata hivyo, viwango ni tofauti; tunahesabu viwango baada ya mvua kukamilika, badala ya mwanzo wa mvua.
Mavazi yaliyoosha katika maji ambayo ina manganese [Mn 2 + (aq)] mkusanyiko unaozidi 0.1 mg/L (1.8 × 10 —6 M) inaweza kubadilika na manganese juu ya oksidi, lakini kiasi cha Mn 2 + ndani ya maji kinaweza kupunguzwa kwa kuongeza msingi. Ikiwa mtu anayefanya kufulia anataka kuongeza buffer ili kuweka pH juu ya kutosha kuharakisha manganese kama hidroksidi, Mn (OH) 2, ni pH gani inahitajika kushika [Mn 2 +] sawa na 1.8 × 10 —6 M?
Suluhisho
Uharibifu wa Mn (OH) 2 unaelezewa na equation:
\[\ce{Mn(OH)2}(s) \rightleftharpoons \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=2×10^{−13} \nonumber \]
Tunahitaji kuhesabu mkusanyiko wa OH — wakati mkusanyiko wa Mn 2 + ni 1.8 × 10 —6 M. Kutoka hapo, tunahesabu pH. Katika usawa:
au
\[ (1.8×10^{−6})\ce{[OH- ]^2}=2×10^{−13} \nonumber \]
kwa hivyo
Sasa tunahesabu pH kutoka kwa poH:
Ikiwa mtu anayefanya kufulia anaongeza msingi, kama vile silicate ya sodiamu (Na 4 SiO 4) katika sabuni fulani, kwa maji ya safisha mpaka pH itafufuliwa hadi 10.52, ioni ya manganese itapungua hadi mkusanyiko wa 1.8 × 10 —6 M; katika mkusanyiko huo au chini, ion haitavaa nguo.
Hatua ya kwanza katika maandalizi ya chuma cha magnesiamu ni mvua ya Mg (OH) 2 kutoka maji ya bahari kwa kuongeza Ca (OH) 2. Mkusanyiko wa Mg 2 + (aq) katika maji ya bahari ni 5.37 × 10 —2 M. Tumia pH ambayo [Mg 2 +] imepungua hadi 1.0 × 10 —5 M kwa kuongeza Ca (OH) 2.
- Jibu
-
10.97
Kutokana na unyeti wao wa mwanga, mchanganyiko wa halidi za fedha hutumiwa katika fiber optics kwa lasers za matibabu, katika lenses za macho ya photochromic (lenses za kioo ambazo huwa giza moja kwa moja wakati wa jua), na-kabla ya ujio wa picha ya digital - katika filamu ya picha. Japokuwa AgCl (K sp = 1.6 × 10 —10), AgBr (K sp = 5.0 × 10 —13), na AGI (K sp = 1.5 × 10 —16) kila mmoja hauna kabisa, hatuwezi kuandaa mchanganyiko wa homogeneous imara kwa kuongeza Ag + kwa suluhisho la Cl -, Br -, na mimi -; kimsingi yote ya AGI itakuwa precipitate kabla yoyote ya aina nyingine imara halidi kwa sababu ya thamani yake ndogo kwa K sp. Hata hivyo, tunaweza kuandaa mchanganyiko sawa wa yabisi kwa kuongeza polepole suluhisho la Cl —, Br -, na mimi — kwa suluhisho la Ag +.
Wakati anions mbili huunda misombo kidogo ya mumunyifu na cation sawa, au wakati cations mbili huunda misombo kidogo mumunyifu na anion sawa, kiwanja kidogo cha mumunyifu (kwa kawaida, kiwanja na ndogo K sp) kwa ujumla hupungua kwanza wakati sisi kuongeza wakala precipitating kwa suluhisho iliyo na anions zote mbili (au cations zote mbili). Wakati maadili ya K sp ya misombo miwili yanatofautiana na amri mbili za ukubwa au zaidi (kwa mfano, 10 —2 dhidi ya 10 —4), karibu wote wa kiwanja cha chini cha mumunyifu hupungua kabla ya yoyote ya mumunyifu zaidi. Huu ni mfano wa mvua ya kuchagua, ambapo reagent huongezwa kwenye suluhisho la ions zilizovunjika, na kusababisha moja ya ions kuenea kabla ya wengine.
Jukumu la mvua katika Matibabu ya maji machafu
Umumunyifu usawa ni zana muhimu katika matibabu ya maji machafu kufanyika katika vituo ambayo inaweza kutibu maji ya manispaa katika mji wako au mji (Kielelezo\(\PageIndex{5}\)). Hasa, mvua ya kuchagua hutumiwa kuondoa uchafu kutoka kwa maji machafu kabla ya kutolewa tena kwenye miili ya asili ya maji. Kwa mfano, ions phosphate mara nyingi\(\ce{(PO4^2- )}\) hupo katika maji yaliyotolewa kutoka kwenye vifaa vya viwanda. Wengi wa phosphate husababisha mwani wa ziada kukua, ambayo huathiri kiasi cha oksijeni inapatikana kwa maisha ya baharini pamoja na kufanya maji yasiyofaa kwa matumizi ya binadamu.

Njia moja ya kawaida ya kuondoa phosphates kutoka kwa maji ni kwa kuongeza hidroksidi ya kalsiamu, inayojulikana kama chokaa, Ca (OH) 2. Chokaa kinabadilishwa kuwa carbonate ya kalsiamu, msingi wa nguvu, ndani ya maji. Kama maji yanafanywa zaidi ya msingi, ions za kalsiamu huguswa na ioni za phosphate ili kuzalisha hydroxylapatite, Ca 5 (PO4) 3 (OH), ambayo hutoka nje ya suluhisho:
\[\ce{5Ca^2+ + 3PO4^3- + OH- \rightleftharpoons Ca10(PO4)6⋅(OH)2}(s) \nonumber \]
Upepo huo huondolewa na filtration na maji hurudishwa kwa pH ya neutral kwa kuongeza CO 2 katika mchakato wa recarbonation. Kemikali nyingine zinaweza pia kutumika kwa ajili ya kuondolewa kwa phosphates kwa mvua, ikiwa ni pamoja na chuma (III) kloridi na sulfate ya alumini.
Uchaguzi wa mvua unaweza pia kutumika katika uchambuzi wa ubora. Kwa njia hii, reagents huongezwa kwa mchanganyiko wa kemikali isiyojulikana ili kushawishi mvua. Vitendanishi fulani husababisha ions maalum kuziba nje; kwa hiyo, kuongeza kwa reagent inaweza kutumika kuamua kama ion iko katika suluhisho.
Suluhisho lina 0.0010 mol ya KI na 0.10 mol ya kCl kwa lita. AgNo 3 ni hatua kwa hatua aliongeza kwa suluhisho hili. Ni aina ya kwanza, AGI imara au agCl imara?
Suluhisho
Mizani miwili inayohusika ni:
Ikiwa suluhisho lilikuwa na viwango sawa vya Cl — na mimi —, basi chumvi ya fedha na ndogo K sp (AGI) ingekuwa precipitate kwanza. Viwango si sawa, hata hivyo, hivyo tunapaswa kupata [Ag +] ambapo AgCl huanza kuharakisha na [Ag +] ambapo AGI huanza kuharakisha. Chumvi inayounda chini [Ag +] hupungua kwanza.
Kwa AGI: AGI hupungua wakati Q ni sawa na K sp kwa AGI (1.5 × 10 —16). Wakati [I —] = 0.0010 M:
AGI huanza kuharakisha wakati [Ag +] ni 1.5 × 10 —13 M.
Kwa AgCl: AgCl inapita wakati Q ni sawa na K sp kwa AgCl (1.6 × 10 —10). Wakati [Cl -] = 0.10 M:
AgCl huanza kuharakisha wakati [Ag +] ni 1.6 × 10 —9 M.
AGI huanza kuharakisha kwa [Ag +] ya chini kuliko AgCl, hivyo AGI huanza kuharakisha kwanza.
Kama nitrati fedha ufumbuzi ni aliongeza kwa ufumbuzi ambayo ni 0.050 M katika wote Cl — na Br — ions, kwa nini [Ag +] bila precipitation kuanza, na nini itakuwa formula ya precipitate?
- Jibu
-
[Ag +] = 1.0 × 10 —11 M; AGBr hupungua kwanza
Athari ya kawaida ya Ion
Kama tulivyoona tulipojadili ufumbuzi wa buffer, hidronium ion mkusanyiko wa mmumunyo wa maji ya asidi asetiki hupungua wakati nguvu electrolyte sodiamu acetate, NaCH 3 CO 2, imeongezwa. Tunaweza kuelezea athari hii kwa kutumia kanuni ya Le Chatelier. Kuongezewa kwa ioni za acetate husababisha usawa kuhama upande wa kushoto, kupungua kwa mkusanyiko wa\(\ce{H3O+}\) kulipa fidia kwa ukolezi wa acetate ion. Hii huongeza mkusanyiko wa CH 3 CO 2 H:
\ [\ ce {CH3CO2H + H2O\ Vijiko vya kushoto vya kulia H3O+ + CH3 CO2-}\)]
Kwa sababu acetate ya sodiamu na asidi ya asidi ina ion ya acetate kwa kawaida, ushawishi juu ya usawa huitwa athari ya kawaida ya ion. Athari ya kawaida ya ion pia inaweza kuwa na athari ya moja kwa moja juu ya usawa wa umumunyifu. Tuseme tunatazama majibu ambapo iodidi ya fedha hupasuka:
\[\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \nonumber \]
Ikiwa tungeongeza iodidi ya potasiamu (KI) kwa suluhisho hili, tungeongeza dutu inayoshiriki ioni ya kawaida na iodidi ya fedha. Kanuni ya Le Chatelier inatuambia kwamba wakati mabadiliko yanafanywa kwa mfumo katika usawa, majibu yatabadilika kukabiliana na mabadiliko hayo. Katika mfano huu, kutakuwa na ziada ya ioni iodidi, hivyo majibu yangeweza kuelekea upande wa kushoto, na kusababisha iodidi zaidi ya fedha kuondokana na suluhisho.
Tumia umumunyifu wa molar wa sulfidi ya cadmium (CDs) katika suluhisho la 0.010- M la bromidi ya cadmium (CDBr 2). K sp ya CD ni 1.0 × 10 —28.
Suluhisho
Jambo la kwanza unapaswa kutambua ni kwamba sulfidi ya cadmium inafutwa katika suluhisho ambalo lina ions za cadmium. Tunahitaji kutumia meza ya ICE ili kuanzisha tatizo hili na ni pamoja na mkusanyiko wa CDBr 2 kama mchangiaji wa ions za cadmium:
\[\ce{CdS}(s) \rightleftharpoons \ce{Cd^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
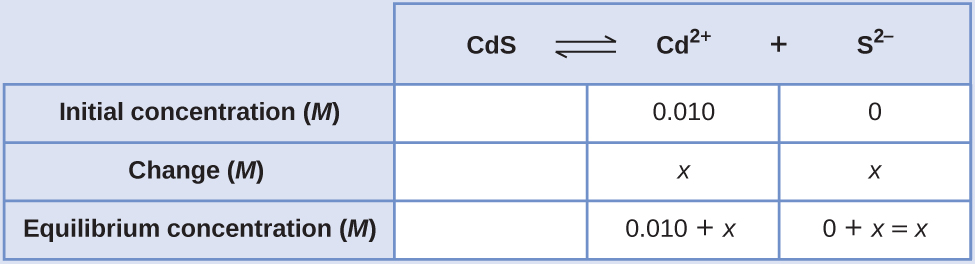
\( (0.010+x)(x)=1.0×10^{−28}\)\(x^2+0.010x−1.0×10^{−28}=0\)
Tunaweza kutatua equation hii kwa kutumia formula quadratic, lakini tunaweza pia kufanya dhana kufanya hesabu hii rahisi zaidi. Kwa kuwa thamani ya K sp ni ndogo sana ikilinganishwa na mkusanyiko wa cadmium, tunaweza kudhani kuwa mabadiliko kati ya mkusanyiko wa awali na mkusanyiko wa usawa ni duni, ili 0.010 + x ~ 0.010. Kurudi kwenye K sp yetu kujieleza, tunataka sasa kupata:
Kwa hiyo, umumunyifu wa molar wa CD katika suluhisho hili ni 1.0 × 10 —26 M.
Tumia umumunyifu wa molar wa hidroksidi ya alumini, Al (OH) 3, katika ufumbuzi wa 0.015- M ya nitrati ya alumini, Al (NO 3) 3. K sp ya Al (OH) 3 ni 2 × 10 —32.
- Jibu
-
4 × 10 —11
Muhtasari
Mara kwa mara ya usawa kwa usawa unaohusisha mvua au kuvunjwa kwa imara kidogo ya ionic imara inaitwa bidhaa ya umumunyifu, K sp, ya imara. Wakati tuna tofauti nyingi msawazo kuwashirikisha kidogo mumunyifu imara M p X q na ions yake M m + na X n—:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Tunaandika maelezo ya bidhaa ya umumunyifu kama:
\[K_\ce{sp}=\mathrm{[M^{m+}]}^p\mathrm{[X^{n−}]}^q \nonumber \]
Bidhaa ya umumunyifu wa electrolyte kidogo ya mumunyifu inaweza kuhesabiwa kutoka kwa umumunyifu wake; kinyume chake, umumunyifu wake unaweza kuhesabiwa kutoka kwa K sp yake, ikiwa ni pamoja na majibu muhimu tu yanayotokea wakati imara hupasuka ni malezi ya ions zake. Electrolyte kidogo ya mumunyifu huanza kuimarisha wakati ukubwa wa quotient ya mmenyuko kwa mmenyuko wa kufutwa huzidi ukubwa wa bidhaa za umumunyifu. Upepo unaendelea mpaka quotient ya mmenyuko inalingana na bidhaa za umumunyifu. Reagent inaweza kuongezwa kwa suluhisho la ions kuruhusu ion moja kuchagua nje ya suluhisho. Athari ya kawaida ya ion pia inaweza kuwa na jukumu katika athari za mvua. Katika uwepo wa ioni sawa na moja ya ions katika suluhisho, kanuni ya Le Chatelier inatumika na usahihi zaidi hutoka katika suluhisho ili umumunyifu wa molar upunguzwe.
faharasa
- athari ya kawaida ya ion
- athari juu ya usawa wakati dutu na ion sawa na aina kufutwa ni aliongeza kwa suluhisho; husababisha kupungua kwa umumunyifu wa aina ionic, au kupungua kwa ionization ya asidi dhaifu au msingi
- umumunyifu wa molar
- umumunyifu wa kiwanja kilichoonyeshwa katika vitengo vya moles kwa lita (mol/L)
- mvua ya kuchagua
- mchakato ambao ions hutenganishwa kwa kutumia tofauti katika umumunyifu wao na reagent iliyotolewa
- bidhaa umumunyifu (K sp)
- mara kwa mara ya usawa kwa ajili ya kufutwa kwa electrolyte kidogo


