7.2: Kuainisha athari za Kemikali
- Page ID
- 182494
- Eleza aina tatu za kawaida za athari za kemikali (mvua, asidi-msingi, na kupunguza oxidation)
- Kuainisha athari za kemikali kama moja ya aina hizi tatu, kupewa maelezo sahihi au milinganyo ya kemikali.
- Kutambua asidi ya kawaida na besi
- Kutabiri umumunyifu wa misombo ya kawaida isokaboni kwa kutumia sheria umumunyifu
- Futa majimbo ya oxidation kwa vipengele katika misombo
Binadamu huingiliana kwa namna mbalimbali na ngumu, na tunaweka maingiliano haya kulingana na mifumo ya kawaida ya tabia. Wakati wanadamu wawili wanabadilishana habari, tunasema wanawasiliana. Wanapobadilishana makofi kwa ngumi au miguu yao, tunasema wanapigana. Wanakabiliwa na mwingiliano mbalimbali kati ya vitu vya kemikali, wanasayansi vivyo hivyo wamegundua kuwa rahisi (au hata muhimu) kuainisha mwingiliano wa kemikali kwa kutambua mifumo ya kawaida ya reactivity. Moduli hii itatoa utangulizi wa aina tatu za athari za kemikali: mvua, asidi-msingi, na kupunguza oxidation.
Maelekezo ya mvua na Kanuni za Umumunyifu
Mmenyuko wa mvua ni moja ambayo vitu vilivyoharibika huguswa ili kuunda bidhaa moja (au zaidi) imara. Athari nyingi za aina hii zinahusisha kubadilishana kwa ions kati ya misombo ya ioniki katika suluhisho la maji na wakati mwingine hujulikana kama makazi ya mara mbili, uingizwaji mara mbili, au athari za metathesis. Athari hizi ni za kawaida katika asili na zinawajibika kwa kuundwa kwa miamba ya matumbawe katika maji ya bahari na mawe ya figo katika wanyama. Wao hutumiwa sana katika sekta kwa ajili ya uzalishaji wa idadi ya bidhaa na kemikali maalum. Athari za mvua pia zina jukumu kuu katika mbinu nyingi za uchambuzi wa kemikali, ikiwa ni pamoja na vipimo vya doa vinavyotumiwa kutambua ions za chuma na mbinu za gravimetric za kuamua muundo wa suala (tazama moduli ya mwisho ya sura hii).
Kiwango ambacho dutu inaweza kufutwa katika maji, au kutengenezea yoyote, inaelezwa kwa kiasi kikubwa kama umumunyifu wake, hufafanuliwa kama mkusanyiko wa juu wa dutu ambayo inaweza kupatikana chini ya hali maalum. Vipengele vilivyo na umumunyifu mkubwa vinasemekana kuwa mumunyifu. Dutu hii itapungua wakati hali ya ufumbuzi ni kama kwamba ukolezi wake unazidi umumunyifu wake. Vipengele vilivyo na umwagilivu wa chini vinasemekana kuwa havikuwepo, na haya ni vitu vinavyoweza kuondokana na suluhisho. Maelezo zaidi juu ya dhana hizi muhimu hutolewa katika sura ya maandishi juu ya ufumbuzi. Kwa madhumuni ya kutabiri utambulisho wa yabisi yaliyoundwa na athari za mvua, mtu anaweza tu kutaja ruwaza za umumunyifu ambazo zimeonekana kwa misombo mingi ya ionic (Jedwali\(\PageIndex{1}\)).
| Misombo ya mumunyifu yana | Tofauti na sheria hizi umumunyifu ni pamoja na |
|
|
| Misombo isiyo na misombo yana | Isipokuwa na sheria hizi insolubility ni pamoja na |
|
|
Mfano wazi wa mvua huzingatiwa wakati ufumbuzi wa iodidi ya potasiamu na nitrati ya risasi huchanganywa, na kusababisha kuundwa kwa iodidi imara ya risasi:
\[\ce{2KI}(aq)+\ce{Pb(NO3)2}(aq)\rightarrow \ce{PbI2}(s)+\ce{2KNO3}(aq) \nonumber \]
Uchunguzi huu ni sambamba na miongozo umumunyifu: tu hakuna kiwanja kati ya wote wanaohusika ni risasi iodidi, moja ya isipokuwa kwa umumunyifu wa jumla wa chumvi iodidi.
Equation ya ioniki ya wavu inayowakilisha mmenyuko huu ni:
\[\ce{Pb^2+}(aq)+\ce{2I-}(aq)\rightarrow \ce{PbI2}(s) \nonumber \]
Kiongozi iodidi ni mkali njano imara ambayo zamani ilitumika kama rangi ya msanii inayojulikana kama iodini njano (Kielelezo\(\PageIndex{1}\)). Mali ya fuwele safi ya PBi 2 huwafanya kuwa muhimu kwa ajili ya utengenezaji wa detectors ya X-ray na gamma ray.

Miongozo ya umumunyifu katika Jedwali\(\PageIndex{1}\) inaweza kutumika kutabiri kama mmenyuko wa mvua utatokea wakati ufumbuzi wa misombo ya ioniki ya mumunyifu huchanganywa pamoja. Moja tu mahitaji ya kutambua ions wote sasa katika ufumbuzi na kisha kufikiria kama inawezekana cation/anion pairing inaweza kusababisha kiwanja hakuna. Kwa mfano, kuchanganya ufumbuzi wa nitrati ya fedha na fluoride ya sodiamu itazalisha suluhisho iliyo na Ag +\(\ce{NO3-}\),, Na +, na F - ions. Mbali na misombo miwili ya ionic iliyopo awali katika ufumbuzi, AgNo 3 na NaF, misombo miwili ya ziada ya ionic inaweza kupatikana kutoka kwa mkusanyiko huu wa ions: NaNo 3 na aGF. Miongozo ya umumunyifu huonyesha chumvi zote za nitrati ni mumunyifu lakini hiyo aGF ni moja ya tofauti na umumunyifu wa jumla wa chumvi za fluoride. Kwa hiyo, mmenyuko wa mvua unatabiriwa kutokea, kama ilivyoelezwa na equations zifuatazo:
\[\ce{NaF}(aq)+\ce{AgNO3}(aq)\rightarrow \ce{AgF}(s)+\ce{NaNO3}(aq)\hspace{20px}\ce{(molecular)} \nonumber \]
\[\ce{Ag+}(aq)+\ce{F-}(aq)\rightarrow \ce{AgF}(s)\hspace{20px}\ce{(net\: ionic)} \nonumber \]
Kutabiri matokeo ya kuchanganya ufumbuzi wa kujilimbikizia kwa misombo yafuatayo ya ionic. Kama mvua inatarajiwa, kuandika uwiano wavu ionic equation kwa majibu.
- sulfate ya potassium na nitrati
- lithiamu kloridi na acetate fedha
- risasi nitrate na carbonate amonia
Suluhisho
(a) Bidhaa mbili zinazowezekana kwa mchanganyiko huu ni KNO 3 na BaSO 4. Miongozo ya umumunyifu inaonyesha BaSO 4 haipatikani, na hivyo mmenyuko wa mvua unatarajiwa. wavu ionic equation kwa mmenyuko huu, inayotokana kwa namna ya kina katika moduli ya awali, ni
\[\ce{Ba^2+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{BaSO4}(s) \nonumber \]
(b) Bidhaa mbili zinazowezekana kwa mchanganyiko huu ni LiC 2 H 3 O 2 na AgCl. Miongozo ya umumunyifu huonyesha AgCl haipatikani, na hivyo mmenyuko wa mvua unatarajiwa. wavu ionic equation kwa mmenyuko huu, inayotokana kwa namna ya kina katika moduli ya awali, ni
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
(c) Bidhaa mbili zinazowezekana kwa mchanganyiko huu ni PBCo 3 na NH 4 NO 3. Miongozo ya umumunyifu inaonyesha PBCo 3 haipatikani, na hivyo mmenyuko wa mvua unatarajiwa. wavu ionic equation kwa mmenyuko huu, inayotokana kwa namna ya kina katika moduli ya awali, ni
\[\ce{Pb^2+}(aq)+\ce{CO3^2-}(aq)\rightarrow \ce{PbCO3}(s) \nonumber \]
Ni suluhisho gani linaweza kutumika kuimarisha ion ya bariamu, Ba 2 +, katika sampuli ya maji: kloridi ya sodiamu, hidroksidi ya sodiamu, au sulfate ya sodiamu? Je, ni formula gani ya kutarajia kutarajiwa?
- Jibu
-
sulfate ya sodiamu, BaSO 4
Athari ya Asidi-Msingi
Mmenyuko wa asidi-msingi ni moja ambayo ion hidrojeni, H +, huhamishwa kutoka kwa aina moja ya kemikali hadi nyingine. Athari hizo ni za umuhimu wa kati kwa michakato mbalimbali ya asili na teknolojia, kuanzia mabadiliko ya kemikali yanayotokea ndani ya seli na maziwa na bahari, hadi uzalishaji wa viwanda wa mbolea, madawa, na vitu vingine muhimu kwa jamii. Somo la kemia ya asidi-msingi, kwa hiyo, inastahili majadiliano ya kina, na sura kamili ni kujitolea kwa mada hii baadaye katika maandiko.
Kwa madhumuni ya utangulizi huu mfupi, tutazingatia tu aina za kawaida za athari za asidi-msingi zinazofanyika katika ufumbuzi wa maji. Katika muktadha huu, asidi ni dutu ambayo itapasuka katika maji ili kuzalisha ions hydronium, H 3 O +. Kwa mfano, fikiria equation iliyoonyeshwa hapa:
\[\ce{HCl}(aq)+\ce{H2O}(aq)\rightarrow \ce{Cl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Mchakato unaowakilishwa na equation hii unathibitisha kwamba kloridi hidrojeni ni asidi. Wakati kufutwa katika maji, H 3 O + ions huzalishwa na mmenyuko wa kemikali ambayo H + ions huhamishwa kutoka molekuli ya HCl hadi H 2 O molekuli (Kielelezo\(\PageIndex{2}\)).
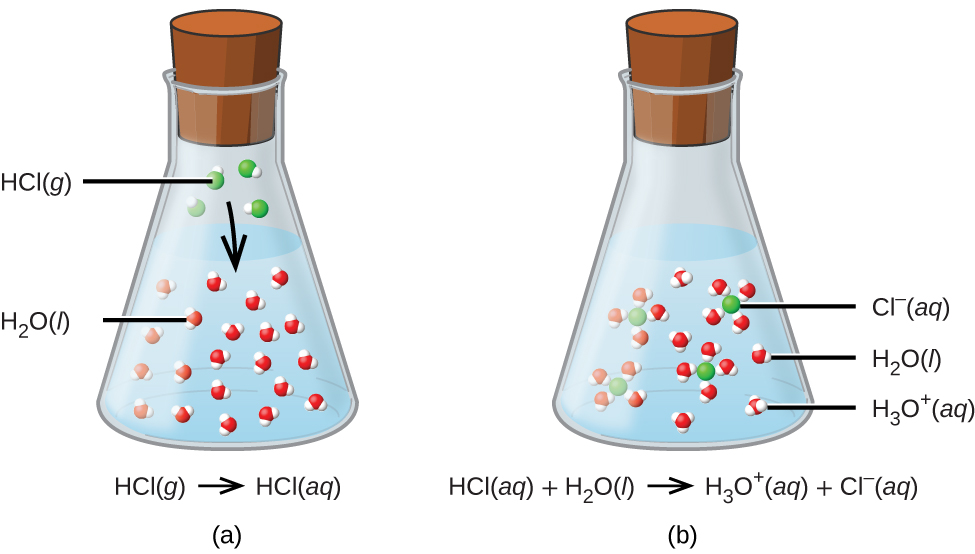
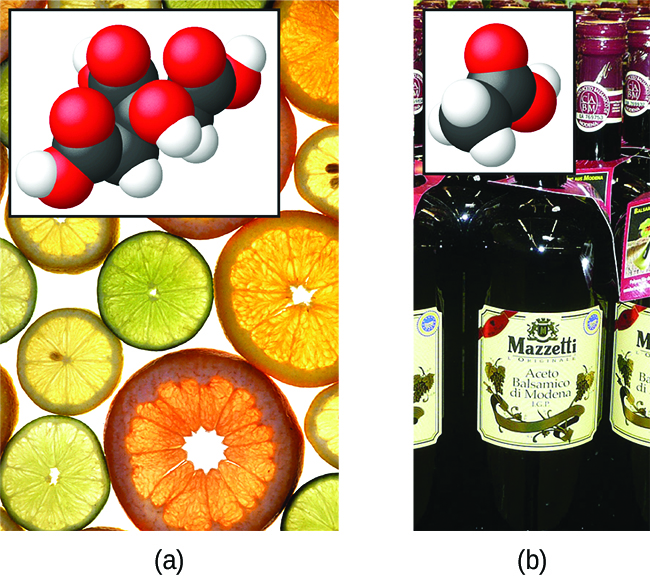
Hali ya HCl ni kwamba majibu yake na maji kama ilivyoelezwa tu ni ya ufanisi wa 100%: Karibu kila molekuli ya HCl ambayo hupasuka katika maji itafanyika majibu haya. Acids ambayo huguswa kabisa kwa mtindo huu huitwa asidi kali, na HCl ni moja kati ya wachache tu wa misombo ya kawaida ya asidi ambayo huwekwa kama nguvu (Jedwali\(\PageIndex{1}\)). Idadi kubwa zaidi ya misombo hufanya kama asidi dhaifu na sehemu tu huguswa na maji, na kuacha idadi kubwa ya molekuli zilizovunjwa katika fomu yao ya awali na kuzalisha kiasi kidogo cha ioni za hidronium. Asidi dhaifu hukutana kwa kawaida katika asili, kuwa vitu vinavyohusika na ladha ya tangy ya matunda ya machungwa, hisia ya kuumwa kwa wadudu, na harufu mbaya zinazohusiana na harufu ya mwili. Mfano unaojulikana wa asidi dhaifu ni asidi ya asidi, kiungo kikuu katika vinegars ya chakula:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{CH3CO2-}(aq)+\ce{H3O+}(aq) \nonumber \]
Wakati kufutwa katika maji chini ya hali ya kawaida, tu juu ya 1% ya molekuli asidi asidi ni sasa katika fomu ionized,\(\ce{CH3CO2-}\) (Kielelezo\(\PageIndex{3}\)). (Matumizi ya mshale mara mbili katika equation hapo juu inaashiria sehemu ya mmenyuko wa mchakato huu, dhana kushughulikiwa kikamilifu katika sura juu ya usawa wa kemikali.)
| kiwanja formula | Jina katika Solution yenye maji |
|---|---|
| HbR | asidi hydrobromic |
| HCl | asidi hidrokloriki |
| HI | asidi hydroiodic |
| NO 3 | asidi ya nitriki |
| chlo 4 | asidi perchloric |
| H 2 HIVYO 4 | asidi sulfuriki |
Msingi ni dutu ambayo itapasuka ndani ya maji ili kuzalisha ions hidroksidi, OH -. Msingi wa kawaida ni misombo ya ioniki inayojumuisha cations ya alkali au alkali ya metali ya ardhi (vikundi 1 na 2) pamoja na ioni ya hidroksidi—kwa mfano NaOH na Ca (OH) 2. Wakati misombo hii hupasuka katika maji, ions ya hidroksidi hutolewa moja kwa moja kwenye suluhisho. Kwa mfano, KOH na Ba (OH) 2 kufutwa katika maji na dissociate kabisa kuzalisha cations (K + na Ba 2 +, kwa mtiririko huo) na ions hidroksidi, OH -. Msingi huu, pamoja na hidroksidi nyingine ambazo hutengana kabisa katika maji, huchukuliwa kuwa misingi yenye nguvu.
Fikiria kama mfano uharibifu wa lye (hidroksidi ya sodiamu) katika maji:
\[\ce{NaOH}(s)\rightarrow \ce{Na+}(aq)+\ce{OH-}(aq) \nonumber \]
Equation hii inathibitisha kwamba hidroksidi ya sodiamu ni msingi. Wakati kufutwa katika maji, NaOH dissociates kutoa Na + na OH - ions. Hii pia ni kweli kwa kiwanja kingine chochote cha ioniki kilicho na ioni za hidroksidi. Kwa kuwa mchakato wa dissociation kimsingi ni kamili wakati misombo ionic kufutwa katika maji chini ya hali ya kawaida, NaOH na hidroksidi nyingine ionic wote ni classified kama besi kali.
Tofauti na hidroksidi ioniki, baadhi ya misombo huzalisha ions hidroksidi wakati kufutwa na kemikali kukabiliana na molekuli ya maji. Katika hali zote, misombo hii huguswa kwa sehemu tu na hivyo huwekwa kama besi dhaifu. Aina hizi za misombo pia ni nyingi katika asili na bidhaa muhimu katika teknolojia mbalimbali. Kwa mfano, uzalishaji wa kimataifa wa amonia dhaifu msingi ni kawaida vizuri zaidi ya tani 100 kila mwaka, kuwa sana kutumika kama mbolea ya kilimo, malighafi kwa ajili ya awali ya kemikali ya misombo mingine, na ingredient kazi katika cleaners kaya (Kielelezo\(\PageIndex{4}\)). Wakati kufutwa katika maji, amonia humenyuka sehemu ya kutoa ions hidroksidi, kama inavyoonekana hapa:
\[\ce{NH3}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \nonumber \]
Hii ni, kwa ufafanuzi, mmenyuko wa asidi-msingi, katika kesi hii inayohusisha uhamisho wa H + ions kutoka kwa molekuli za maji hadi molekuli za amonia. Chini ya hali ya kawaida, asilimia 1 tu ya amonia iliyovunjwa iko kama\(\ce{NH4+}\) ions.

Athari za kemikali zilizoelezwa ambapo asidi na besi zilizovunjwa katika maji huzalisha hidroniamu na ioni za hidroksidi, kwa mtiririko huo, ni, kwa ufafanuzi, athari za asidi-msingi. Katika athari hizi, maji hutumikia kama kutengenezea na reactant. Mmenyuko wa neutralization ni aina maalum ya majibu ya asidi-msingi ambayo reactants ni asidi na msingi, bidhaa mara nyingi ni chumvi na maji, na wala majibu ni maji yenyewe:
\[\mathrm{acid+base\rightarrow salt+water} \nonumber \]
Ili kuonyesha mmenyuko wa neutralization, fikiria kinachotokea wakati antacid ya kawaida kama maziwa ya magnesia (kusimamishwa kwa maji ya Mg imara (OH) 2) inaingizwa ili kupunguza dalili zinazohusiana na asidi ya tumbo ya ziada (HCl):
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{2H2O}(l). \nonumber \]
Kumbuka kuwa pamoja na maji, mmenyuko huu hutoa chumvi, kloridi ya magnesiamu.
Andika usawa wa kemikali kwa athari za asidi-msingi zilizoelezwa hapa:
- asidi dhaifu hidrojeni hypochlorite humenyuka na maji
- suluhisho la hidroksidi ya bariamu hupunguzwa na suluhisho la asidi ya nitriki
Suluhisho
(a) reactants mbili hutolewa, HoCl na H 2 O. Kwa kuwa dutu hii inaripotiwa kuwa asidi, majibu yake na maji yatahusisha uhamisho wa H + kutoka HoCl hadi H 2 O ili kuzalisha ioni za hidronium, H 3 O + na ioni za hypochlorite, OCL - .
\[\ce{HOCl}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{OCl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Mshale mara mbili unafaa katika equation hii kwa sababu inaonyesha HoCl ni asidi dhaifu ambayo haijaitikia kabisa.
(b) reactants mbili hutolewa, Ba (OH) 2 na HNO 3. Kwa kuwa hii ni mmenyuko wa neutralization, bidhaa hizo mbili zitakuwa maji na chumvi linajumuisha cation ya hidroksidi ioniki (Ba 2 +) na anion inayozalishwa wakati asidi inapohamisha ion yake ya hidrojeni\(\ce{(NO3- )}\).
\[\ce{Ba(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Ba(NO3)2}(aq)+\ce{2H2O}(l) \nonumber \]
Andika equation ya ionic ya wavu inayowakilisha neutralization ya asidi yoyote yenye nguvu na hidroksidi ionic. (Kidokezo: Fikiria ions zinazozalishwa wakati asidi kali ni kufutwa katika maji.)
- Jibu
-
\[\ce{H3O+}(aq)+\ce{OH-}(aq)\rightarrow \ce{2H2O}(l) \nonumber \]
Kuchunguza mtazamo microscopic ya asidi kali na dhaifu na besi.
Athari za Kupunguza oxidation
Anga ya dunia ina takriban asilimia 20 ya oksijeni ya Masi, O 2, gesi yenye athari ya kemikali ambayo ina jukumu muhimu katika kimetaboliki ya viumbe vya aerobic na katika michakato mingi ya mazingira inayounda dunia. Neno oxidation awali lilitumika kuelezea athari za kemikali zinazohusisha O 2, lakini maana yake imebadilika ili kutaja darasa pana na muhimu la mmenyuko linalojulikana kama athari za kupunguza oxidation (redox). Mifano machache ya athari hizo zitatumika kuendeleza picha wazi ya uainishaji huu.
Baadhi ya athari za redoksi huhusisha uhamisho wa elektroni kati ya spishi za reactant ili kuzalisha bidhaa ioniki, kama vile mmenyuko kati ya sodiamu na klorini ili kuzalisha kloridi ya sodiamu:
\[\ce{2Na}(s)+\ce{Cl2}(g)\rightarrow \ce{2NaCl}(s) \nonumber \]
Ni muhimu kuona mchakato kuhusiana na kila mtu anayejibu, yaani, kuwakilisha hatima ya kila reactant kwa namna ya equation inayoitwa nusu-mmenyuko:
\[ \begin{align*} \ce{2Na}(s) &\rightarrow \ce{2Na+}(s)+\ce{2e-} \\[4pt] \ce{Cl2}(g)+\ce{2e-} &\rightarrow \ce{2Cl-}(s) \end{align*} \nonumber \]
Milinganyo hii inaonyesha kwamba atomi za Na zinapoteza elektroni ilhali atomi za Cl (katika molekuli ya Cl 2) zinapata elektroni, “s” scripts kwa ions zinazosababisha kuashiria zipo katika mfumo wa kiwanja imara ioniki. Kwa athari za redox za aina hii, kupoteza na faida ya elektroni hufafanua michakato ya ziada ambayo hutokea:
\ (\ kuanza {align}
\ textbf {oxidation} &=\ textrm {kupoteza elektroni}\
\ textbf {kupunguza} &=\ textrm {faida ya elektroni}
\ mwisho {align}\)
Katika mmenyuko huu, basi, sodiamu ni oxidized na klorini hupunguzwa. Kutazamwa kwa mtazamo wa kazi zaidi, kazi za sodiamu kama wakala wa kupunguza (reductant), kwani hutoa elektroni kwa (au inapunguza) klorini. Vivyo hivyo, klorini hufanya kazi kama wakala wa oksidi (kioksidishaji), kwani huondoa elektroni kutoka kwa sodiamu (oxidizes).
\ (\ kuanza {align}
\ textbf {kupunguza wakala} &=\ textrm {spishi ambayo ni iliyooksidishwa}\
\ textbf {wakala oxidizing} &=\ textrm {spishi ambayo imepunguzwa}
\ mwisho {align}\)
Baadhi ya taratibu za redox, hata hivyo, hazihusishi uhamisho wa elektroni. Fikiria, kwa mfano, mmenyuko sawa na ule unaojitokeza\(\ce{NaCl}\):
\[\ce{H2}(g)+\ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
Bidhaa ya mmenyuko huu ni kiwanja cha covalent, hivyo uhamisho wa elektroni kwa maana ya wazi hauhusiki. Ili kufafanua kufanana kwa mmenyuko huu kwa uliopita na kuruhusu ufafanuzi usiojulikana wa athari za redox, mali inayoitwa namba ya oxidation imefafanuliwa. Nambari ya oksidi (au hali ya oksidi) ya elementi katika kiwanja ni chaji atomi zake ingekuwa zimiliki kama kiwanja kilikuwa ioniki. Miongozo ifuatayo hutumiwa kugawa namba za oksidi kwa kila elementi katika molekuli au ioni.
- Idadi ya oxidation ya atomi katika dutu ya msingi ni sifuri.
- Nambari ya oxidation ya ion monatomic ni sawa na malipo ya ion.
- Nambari za oxidation kwa nonmetali za kawaida hutolewa kama ifuatavyo:
- Hidrojeni: +1 ikiwa ni pamoja na nonmetali, -1 ikiwa ni pamoja na metali
- Oksijeni: -2 katika misombo zaidi, wakati mwingine -1 (kinachojulikana peroxides,\(\ce{O2^2-}\)), mara chache sana\(-\dfrac{1}{2}\) (kinachojulikana superoxides,\(\ce{O2-}\)), maadili mazuri wakati wa pamoja na F (maadili hutofautiana)
- Halojeni: -1 kwa F daima, -1 kwa halojeni nyingine isipokuwa ikiwa ni pamoja na oksijeni au halojeni nyingine (idadi nzuri ya oxidation katika kesi hizi, maadili tofauti)
- Jumla ya namba za oksidi kwa atomi zote katika molekuli au ioni ya polyatomiki inalingana na chaji kwenye molekuli au ion.
Kumbuka: Mkataba sahihi wa kuripoti malipo ni kuandika namba kwanza, ikifuatiwa na ishara (kwa mfano, 2+), wakati nambari ya oxidation imeandikwa na mlolongo uliobadilishwa, ishara ikifuatiwa na namba (kwa mfano, +2). Mkataba huu unalenga kusisitiza tofauti kati ya mali hizi mbili zinazohusiana.
Fuata miongozo katika sehemu hii ya maandishi kuwapa idadi oxidation kwa mambo yote katika aina zifuatazo:
- H 2 S
- \(\ce{SO3^2-}\)
- Na 2 SO 4
Suluhisho
(a) Kwa mujibu wa mwongozo wa 1, nambari ya oxidation ya H ni +1.
Kutumia nambari hii ya oxidation na formula ya kiwanja, mwongozo wa 4 unaweza kutumiwa kuhesabu namba ya oxidation ya sulfuri:
\(\ce{charge\: on\: H2S}=0=(2\times +1)+(1\times x)\)
\(x=0-(2\times +1)=-2\)
(b) Mwongozo wa 3 unaonyesha idadi ya oksijeni ya oksijeni ni -1.
Kutumia nambari hii ya oxidation na formula ya ion, mwongozo wa 4 unaweza kutumiwa kuhesabu nambari ya oxidation ya sulfuri:
\(\ce{charge\: on\: SO3^2-}=-2=(3\times -2)+(1\times x)\)
\(x=-2-(3\times -2)=+4\)
(c) Kwa misombo ya ionic, ni rahisi kugawa namba za oxidation kwa cation na anion tofauti.
Kwa mujibu wa mwongozo wa 2, nambari ya oxidation ya sodiamu ni +1.
Kutokana na idadi ya kawaida ya oksijeni ya oksijeni (-1 kwa mwongozo 3), idadi ya oxidation ya sulfuri imehesabiwa kama ilivyoagizwa na mwongozo 4:
\(x=-2-(4\times -2)=+6\)
Weka majimbo ya oxidation kwa vipengele ambavyo atomi zinasisitizwa katika kila moja ya misombo au ions zifuatazo:
- KM N 3
- Al Ah 3
- \(\mathrm{\underline{N}H_4^+}\)
- \(\mathrm{\sideset{ }{_{\large{4}}^{-}}{H_2\underline{P}O}}\)
- Jibu
-
N, +5
- Jibu b
-
Al, +3
- Jibu c
-
N, 1-3
- Jibu d
-
P, +5
Kutumia dhana ya namba ya oxidation, ufafanuzi wote wa umoja wa mmenyuko wa redox umeanzishwa. Athari za kupunguza oxidation (redox) ni zile ambazo vipengele moja au zaidi vinavyohusika vinapata mabadiliko katika idadi ya oxidation. Wakati idadi kubwa ya athari redox kuhusisha mabadiliko katika idadi oxidation kwa mambo mawili au zaidi, isipokuwa chache kuvutia na sheria hii kufanya zipo kama inavyoonekana hapa chini\). Ufafanuzi wa michakato ya ziada ya darasa hili la majibu yanarekebishwa kama inavyoonekana hapa:
\ [kuanza {align}
\ textbf {oxidation} &=\ textrm {ongezeko la idadi oxidation}\
\ textbf {kupunguza} &=\ textrm {kupungua kwa idadi oxidation}
\ mwisho {align}\ nonumber\]
Kurudi kwenye athari zilizotumiwa kuanzisha mada hii, wanaweza sasa wote kutambuliwa kama michakato ya redox. Katika mmenyuko kati ya sodiamu na klorini ili kuzalisha kloridi ya sodiamu, sodiamu inaksidishwa (idadi yake ya oxidation huongezeka kutoka 0 katika Na hadi +1 katika NaCl) na klorini imepunguzwa (idadi yake ya oxidation inapungua kutoka 0 katika Cl 2 hadi -1 katika NaCl). Katika mmenyuko kati ya hidrojeni ya molekuli na klorini, hidrojeni ni oxidized (idadi yake ya oxidation huongezeka kutoka 0 katika H 2 hadi +1 katika HCl) na klorini imepunguzwa (idadi yake ya oxidation inapungua kutoka 0 katika Cl 2 hadi -1 katika HCl).
Aina kadhaa za athari za redox zinatambuliwa, ikiwa ni pamoja na athari za mwako ambazo hupunguza (pia huitwa mafuta) na kioksidishaji (mara nyingi, lakini si lazima, oksijeni ya molekuli) huguswa kwa nguvu na kuzalisha kiasi kikubwa cha joto, na mara nyingi mwanga, kwa namna ya moto. Athari kali za mafuta ya roketi kama vile ile iliyoonyeshwa hapa chini ni michakato ya mwako. Mmenyuko wa kawaida wa propellant ambayo alumini imara ni oxidized na perchlorate ya amonia inawakilishwa na equation hii:
\[\ce{10Al}(s)+\ce{6NH4ClO4}(s)\rightarrow \ce{4Al2O3}(s)+\ce{2AlCl3}(s)+\ce{12H2O}(g)+\ce{3N2}(g) \nonumber \]
Tazama video fupi inayoonyesha kurusha mtihani wa inji ndogo, mfano, mseto wa roketi iliyopangwa kutumika katika mfumo mpya wa Uzinduzi wa Nafasi unaotengenezwa na NASA. Injini za kwanza zinazorusha saa 3 s (moto wa kijani) hutumia mchanganyiko wa mafuta/kioksidishaji kiowevu, na ya pili, inji zenye nguvu zaidi zinazorusha saa 4 s (moto wa njano) hutumia mchanganyiko imara.
Athari moja ya uhamisho (uingizwaji) ni athari za redox ambazo ion katika suluhisho huhamishwa (au kubadilishwa) kupitia oxidation ya kipengele cha metali. Mfano mmoja wa kawaida wa aina hii ya mmenyuko ni oxidation ya asidi ya metali fulani:
\[\ce{Zn}(s)+\ce{2HCl}(aq)\rightarrow \ce{ZnCl2}(aq)+\ce{H2}(g) \nonumber \]
Vipengele vya metali vinaweza pia kuwa vioksidishaji na ufumbuzi wa chumvi nyingine za chuma; kwa mfano:
\[\ce{Cu}(s)+\ce{2AgNO3}(aq)\rightarrow \ce{Cu(NO3)2}(aq)+\ce{2Ag}(s) \nonumber \]
Tabia hii inaweza kuzingatiwa kwa kuweka waya wa shaba katika suluhisho iliyo na chumvi ya fedha iliyoharibika. Ions za fedha katika suluhisho zinapunguzwa kwa fedha ya msingi kwenye uso wa waya wa shaba, na kusababisha Cu 2 + ions kufutwa katika suluhisho la kutoa rangi ya bluu ya tabia (Kielelezo\(\PageIndex{4}\)).

Tambua milinganyo ambayo inawakilisha athari za redox, kutoa jina kwa majibu ikiwa inafaa. Kwa athari hizo kutambuliwa kama redox, jina kioksidishaji na reductant.
- \(\ce{ZnCO3}(s)\rightarrow \ce{ZnO}(s)+\ce{CO2}(g)\)
- \(\ce{2Ga}(l)+\ce{3Br2}(l)\rightarrow \ce{2GaBr3}(s)\)
- \(\ce{2H2O2}(aq)\rightarrow \ce{2H2O}(l)+\ce{O2}(g)\)
- \(\ce{BaCl2}(aq)+\ce{K2SO4}(aq)\rightarrow \ce{BaSO4}(s)+\ce{2KCl}(aq)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(l)\)
Suluhisho la Marekani
Redox athari ni kutambuliwa kwa ufafanuzi kama mambo moja au zaidi kupitia mabadiliko katika idadi oxidation.
- Hii sio mmenyuko wa redox, kwani namba za oksidi hazibadilika kwa vipengele vyote.
- Hii ni mmenyuko wa redox. Gallium ni oxidized, idadi yake ya oxidation kuongezeka kutoka 0 katika Ga (l) hadi +3 katika GaBr 3 (s). Wakala wa kupunguza ni Ga (l). Bromini imepunguzwa, idadi yake ya oxidation inapungua kutoka 0 katika Br 2 (l) hadi -1 katika GaBr 3 (s). Wakala wa oxidizing ni Br 2 (l).
- Hii ni mmenyuko wa redox. Ni mchakato wa kuvutia sana, kwa sababu inahusisha kipengele hicho, oksijeni, inakabiliwa na oxidation na kupunguza (kinachojulikana kama mmenyuko wa kutofautiana). Oksijeni ni oxidized, idadi yake ya oxidation inaongezeka kutoka -1 katika H 2 O 2 (aq) hadi 0 katika O 2 (g). Oksijeni pia imepunguzwa, idadi yake ya oksidi inapungua kutoka -1 katika H 2 O 2 (aq) hadi -1 katika H 2 O (l). Kwa athari za kutofautiana, dutu sawa hufanya kazi kama kioksidishaji na kupunguza.
- Hii sio mmenyuko wa redox, kwani namba za oksidi hazibadilika kwa vipengele vyote.
- Hii ni mmenyuko wa redox (mwako). Carbon ni oxidized, idadi yake ya oxidation kuongezeka kutoka -1 katika C 2 H 4 (g) hadi +4 katika CO 2 (g). Wakala wa kupunguza (mafuta) ni C 2 H 4 (g). Oksijeni imepunguzwa, idadi yake ya oxidation inapungua kutoka 0 katika O 2 (g) hadi -1 katika H 2 O (l). Wakala wa oxidizing ni O 2 (g).
Equation hii inaelezea uzalishaji wa kloridi ya bati (II):
\[\ce{Sn}(s)+\ce{2HCl}(g)\rightarrow \ce{SnCl2}(s)+\ce{H2}(g) \nonumber \]
Je, hii ni mmenyuko wa redox? Kama ni hivyo, kutoa jina maalum zaidi kwa ajili ya majibu kama inafaa, na kutambua kioksidishaji na reductant.
- Jibu
-
Ndiyo, mmenyuko moja-badala. Sn (s) ni reductant, HCl (g) ni kioksidishaji.
Kusawazisha Reactions Redox kupitia Njia ya Nusu-Reaction
Athari za Redox zinazotokea katika vyombo vya habari vyenye maji mara nyingi huhusisha maji, ioni za hidroniamu, na ioni za hidroksidi kama majibu au bidhaa. Ingawa spishi hizi hazipatikani au zimepunguzwa, zinashiriki katika mabadiliko ya kemikali kwa njia nyingine (k.m., kwa kutoa elementi zinazohitajika kuunda oksianioni). Ulinganifu unaowakilisha athari hizi wakati mwingine ni vigumu sana kusawazisha na ukaguzi, hivyo mbinu za utaratibu zimeandaliwa ili kusaidia katika mchakato. Njia moja muhimu sana ni kutumia njia ya athari za nusu, ambayo inahusisha hatua zifuatazo:
- Andika majibu mawili ya nusu inayowakilisha mchakato wa redox.
- Mizani vipengele vyote isipokuwa oksijeni na hidrojeni.
- Mizani atomi oksijeni kwa kuongeza H 2 O molekuli.
- Mizani atomi za hidrojeni kwa kuongeza H + ions.
- Malipo ya usawa 1 kwa kuongeza elektroni.
- Ikiwa ni lazima, kuzidisha kila coefficients ya nusu ya majibu kwa integers ndogo iwezekanavyo ili kutoa idadi sawa ya elektroni katika kila mmoja.
- Ongeza uwiano nusu-athari pamoja na kurahisisha kwa kuondoa spishi zinazoonekana pande zote mbili za equation.
- Kwa athari zinazotokea katika vyombo vya habari vya msingi (ions nyingi za hidroksidi), fanya hatua hizi za ziada:
- Ongeza OH -ions kwa pande zote mbili za equation kwa idadi sawa na idadi ya H + ions.
- Upande wa equation iliyo na H + na OH - ions, kuchanganya ions hizi ili kuzalisha molekuli za maji.
- Kurahisisha equation kwa kuondoa molekuli yoyote redundant maji.
- Hatimaye, kuangalia kuona kwamba wote idadi ya atomi na jumla ya mashtaka 2 ni uwiano.
Andika usawa wa usawa kwa mmenyuko kati ya ion dichromate na chuma (II) ili kuzalisha chuma (III) na chromium (III) katika suluhisho la tindikali.
\[\ce{Cr2O7^2- + Fe^2+ \rightarrow Cr^3+ + Fe^3+} \nonumber \]
Suluhisho la Marekani
Andika majibu mawili ya nusu.
Kila majibu ya nusu yatakuwa na reactant moja na bidhaa moja yenye kipengele kimoja sawa.
\(\ce{Cr2O7^2- \rightarrow Cr^3+}\)
Mizani vipengele vyote isipokuwa oksijeni na hidrojeni. Nusu ya mmenyuko wa chuma tayari ni sawa, lakini mmenyuko wa nusu ya chromium unaonyesha atomi mbili za Cr upande wa kushoto na atomi moja ya Cr upande wa kulia. Kubadilisha mgawo upande wa kulia wa equation hadi 2 hufikia usawa kuhusiana na atomi za Cr.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+}\)
Mizani atomi za oksijeni kwa kuongeza H 2 O molekuli. Nusu-mmenyuko wa chuma hauna atomi O. Nusu-mmenyuko wa chromium inaonyesha atomi saba za O upande wa kushoto na hakuna upande wa kulia, hivyo molekuli saba za maji zinaongezwa upande wa kulia.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+ + 7H2O}\)
Mizani atomi za hidrojeni kwa kuongeza H + ions. Nusu-mmenyuko wa chuma hauna atomi za H. Nusu-mmenyuko wa chromium inaonyesha atomi 14 H upande wa kulia na hakuna upande wa kushoto, hivyo ioni 14 za hidrojeni zinaongezwa upande wa kushoto.
\(\ce{Cr2O7^2- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Mizani malipo kwa kuongeza elektroni. Nusu ya mmenyuko wa chuma inaonyesha malipo ya jumla ya 2+ upande wa kushoto (1 Fe 2 + ion) na 3+ upande wa kulia (1 Fe 3 + ion). Kuongeza elektroni moja upande wa kulia huleta jumla ya malipo ya upande huo hadi (3+) + (1-) = 2+, na usawa wa malipo unapatikana.
Nusu-mmenyuko wa chromium inaonyesha malipo ya jumla ya (1 × 2 ÷) + (14 × 1+) = 12+ upande wa kushoto (\(\ce{1 Cr2O7^2-}\)ion na 14 H + ions). Malipo ya jumla upande wa kulia ni (2 × 3+) = 6 + (2 Cr 3 + ions). Kuongeza elektroni sita upande wa kushoto kutaleta jumla ya malipo ya upande huo hadi (12+ + 6—) = 6+, na usawa wa malipo unapatikana.
\(\ce{Fe^2+ \rightarrow Fe^3+ + e-}\)
\(\ce{Cr2O7^2- + 14H+ + 6e- \rightarrow 2Cr^3+ + 7H2O}\)
Panua nusu-athari mbili hivyo idadi ya elektroni katika mmenyuko mmoja inalingana na idadi ya elektroni katika mmenyuko mwingine. Ili kuwa sawa na uhifadhi wa wingi, na wazo kwamba athari za redox zinahusisha uhamisho (sio uumbaji au uharibifu) wa elektroni, mgawo wa nusu ya mmenyuko wa chuma lazima uongezwe na 6.
\(\ce{6Fe^2+ \rightarrow 6Fe^3+ + 6e-}\)
\(\ce{Cr2O7^2- + 6e- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Kuongeza uwiano nusu athari na kufuta aina kwamba kuonekana pande zote mbili za equation.
\[\ce{6Fe^2+ + Cr2O7^2- + 6e- + 14H+ \rightarrow 6Fe^3+ + 6e- + 2Cr^3+ + 7H2O} \nonumber \]
Elektroni sita tu ni spishi redundant. Kuwaondoa kutoka kila upande wa equation hutoa equation kilichorahisishwa, uwiano hapa:
\[\ce{6Fe^2+ + Cr2O7^2- + 14H+ \rightarrow 6Fe^3+ + 2Cr^3+ + 7H2O} \nonumber \]
hundi ya mwisho ya atomi na malipo usawa unathibitisha equation ni uwiano.
| Wanyanyabiashara | Bidhaa | |
|---|---|---|
| Fe | 6 | 6 |
| Cr | 2 | 2 |
| O | 7 | 7 |
| H | 14 | 14 |
| malipo | 24+ | 24+ |
Katika suluhisho la tindikali, peroxide ya hidrojeni humenyuka na Fe 2 + ili kuzalisha Fe 3 + na H 2 O. kuandika usawa wa usawa kwa mmenyuko huu.
- Jibu
-
\[\ce{H2O2}(aq)+\ce{2H+}(aq)+\ce{2Fe^2+} \rightarrow \ce{2H2O}(l)+\ce{2Fe^3+} \nonumber \]
Muhtasari
Athari za kemikali zinawekwa kulingana na mifumo sawa ya tabia. Idadi kubwa ya athari muhimu zinajumuishwa katika makundi matatu: mvua, asidi-msingi, na kupunguza oxidation (redox). Athari za mvua zinahusisha malezi ya bidhaa moja au zaidi. Athari za msingi za asidi zinahusisha uhamisho wa ions hidrojeni kati ya reactants. Redox athari kuhusisha mabadiliko katika idadi oxidation kwa moja au zaidi reactant vipengele. Kuandika milinganyo ya uwiano kwa baadhi ya athari za redox zinazotokea katika ufumbuzi wa maji ni rahisi kwa kutumia mbinu ya utaratibu inayoitwa njia ya nusu-mmenyuko.
maelezo ya chini
- 1 Mahitaji ya “usawa wa malipo” ni aina maalum ya “usawa wa wingi” ambapo spishi zinazohusika ni elektroni. Equation lazima kuwakilisha idadi sawa ya elektroni kwenye pande reactant na bidhaa, na hivyo atomi zote mbili na mashtaka lazima uwiano.
- 2 Mahitaji ya “usawa wa malipo” ni aina maalum ya “usawa wa wingi” ambapo spishi zinazohusika ni elektroni. Equation lazima kuwakilisha idadi sawa ya elektroni kwenye pande reactant na bidhaa, na hivyo atomi zote mbili na mashtaka lazima uwiano.
faharasa
- asidi
- Dutu inayozalisha H 3 O + wakati kufutwa katika maji
- mmenyuko wa asidi-msingi
- mmenyuko kuwashirikisha uhamisho wa ion hidrojeni kati ya aina reactant
- msingi
- Dutu inayozalisha OH - wakati kufutwa katika maji
- mmenyuko wa mwako
- kraftfulla redox mmenyuko kuzalisha kiasi kikubwa cha nishati katika mfumo wa joto na, wakati mwingine, mwanga
- nusu-mmenyuko
- equation ambayo inaonyesha kama kila reactant kupoteza au faida elektroni katika mmenyuko.
- isiyoweza kutatuliwa
- ya umumunyifu wa chini; kufuta tu kwa kiasi kidogo
- neutralization majibu
- mmenyuko kati ya asidi na msingi wa kuzalisha chumvi na maji
- oxidation
- mchakato ambao idadi oxidation kipengele ni kuongezeka kwa hasara ya elektroni
- mmenyuko wa kupunguza oxidation
- (pia, mmenyuko wa redox) mmenyuko unaohusisha mabadiliko katika idadi ya oxidation kwa vipengele moja au zaidi ya reactant
- idadi ya oxidation
- (pia, hali oxidation) malipo kila atomi ya kipengele ingekuwa katika kiwanja kama kiwanja walikuwa ionic
- wakala oxidizing
- (pia, kioksidishaji) Dutu ambayo huleta juu ya oxidation ya dutu nyingine, na katika mchakato inakuwa kupunguzwa
- harakisha
- hakuna bidhaa ambayo hutokana na mmenyuko wa reactants mumunyifu
- mmenyuko wa mvua
- mmenyuko unaozalisha bidhaa moja au zaidi; wakati reactants ni misombo ya ionic, wakati mwingine huitwa mbili-displacement au metathesis
- kupunguza
- mchakato ambao idadi oxidation kipengele ni ilipungua kwa faida ya elektroni
- wakala wa kupunguza
- (pia, kupunguza) Dutu ambayo huleta juu ya kupunguza dutu nyingine, na katika mchakato inakuwa oxidized
- chumvi
- kiwanja cha ioniki ambacho kinaweza kuundwa na mmenyuko wa asidi yenye msingi ambayo ina cation na anion isipokuwa hidroksidi au oksidi
- mmenyuko mmoja wa makazi
- (pia, badala) mmenyuko wa redox unaohusisha oxidation ya dutu ya msingi na aina ya ionic
- mumunyifu
- ya umumunyifu wa juu; kufuta kwa kiasi kikubwa
- umumunyifu
- kiwango ambacho Dutu inaweza kuwa kufutwa katika maji, au kutengenezea yoyote
- asidi kali
- asidi kwamba humenyuka kabisa wakati kufutwa katika maji ili kuzalisha ions hydronium
- msingi wa nguvu
- msingi kwamba humenyuka kabisa wakati kufutwa katika maji ya mavuno ions hidroksidi
- asidi dhaifu
- asidi ambayo humenyuka kwa kiwango kidogo tu wakati kufutwa katika maji ili kuzalisha ions hydronium
- msingi dhaifu
- msingi kwamba humenyuka kwa kiasi kidogo tu wakati kufutwa katika maji na mavuno ions hidroksidi


