7.1: Kuandika na kusawazisha Ulinganisho wa Kemikali
- Page ID
- 182501
- Pata usawa wa kemikali kutoka kwa maelezo ya maelezo ya athari za kemikali.
- Andika na usawazisha milinganyo ya kemikali katika muundo wa Masi, jumla ya ionic, na wavu ionic.
Sura iliyotangulia ilianzisha matumizi ya alama za elementi kuwakilisha atomi za mtu binafsi. Wakati atomi zinapopata au kupoteza elektroni ili kuzalisha ioni, au kuchanganya na atomi nyingine kuunda molekuli, alama zao zinabadilishwa au kuunganishwa ili kuzalisha fomula za kemikali ambazo zinawakilisha spishi hizi ipasavyo. Kupanua ishara hii kuwakilisha utambulisho wote na kiasi cha jamaa cha vitu vinavyotokana na mabadiliko ya kemikali (au kimwili) kunahusisha kuandika na kusawazisha equation ya kemikali. Fikiria kama mfano mmenyuko kati ya molekuli moja ya methane (CH 4) na molekuli mbili za oksijeni diatomiki (O 2) kuzalisha molekuli moja ya dioksidi kaboni (CO 2) na molekuli mbili za maji (H 2 O). equation kemikali anayewakilisha mchakato huu hutolewa katika nusu ya juu ya Kielelezo\(\PageIndex{1}\), na mifano ya nafasi ya kujaza Masi inavyoonekana katika nusu ya chini ya takwimu.
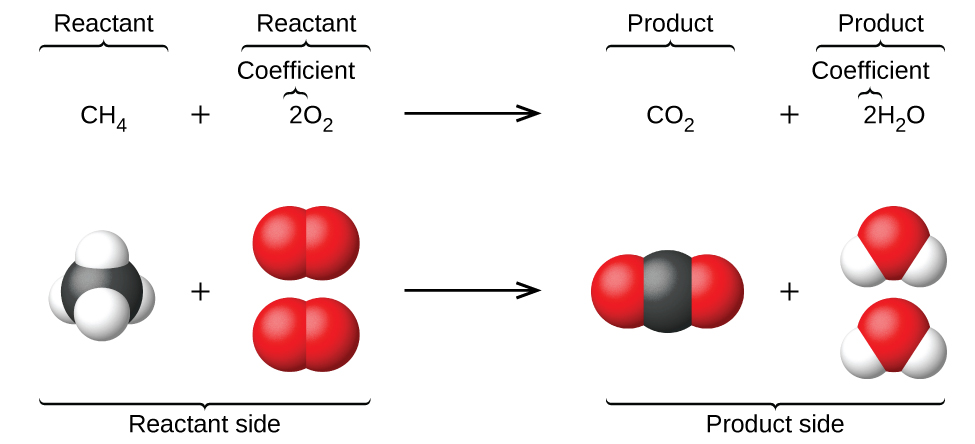
Mfano huu unaeleza mambo ya msingi ya equation yoyote kemikali:
- Dutu zinazofanyika majibu huitwa reactants, na kanuni zao zinawekwa upande wa kushoto wa equation.
- Dutu zinazozalishwa na mmenyuko huitwa bidhaa, na kanuni zao zinawekwa kwenye macho ya kulia ya equation.
- Zaidi ishara (+) tofauti ya mtu binafsi reactant na bidhaa formula, na mshale () hutenganisha reactant na bidhaa (kushoto na kulia) pande ya equation.
- Idadi ya jamaa ya aina ya reactant na bidhaa zinawakilishwa na coefficients (namba zilizowekwa mara moja upande wa kushoto wa kila formula). Mgawo wa 1 kawaida hutolewa.
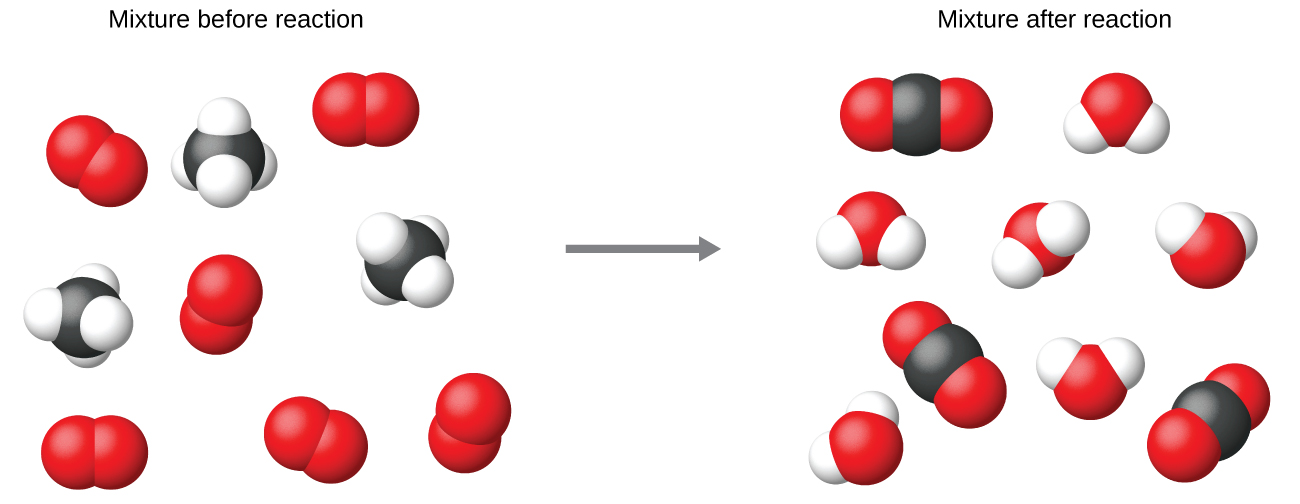
Ni kawaida kutumia coefficients ndogo iwezekanavyo nzima-namba katika equation kemikali, kama ni kufanyika katika mfano huu. Tambua, hata hivyo, kwamba coefficients hizi zinawakilisha idadi ya jamaa ya reactants na bidhaa, na kwa hiyo, wanaweza kutafsiriwa kwa usahihi kama uwiano. Methane na oksijeni huguswa ili kuzalisha dioksidi kaboni na maji katika uwiano wa 1:2:1:2. Uwiano huu umeridhika ikiwa idadi ya molekuli hizi ni, kwa mtiririko huo, 1-2-1-2, au 2-4-2-4, au 3-6-3-6, na kadhalika (Kielelezo\(\PageIndex{2}\)). Vivyo hivyo, coefficients hizi zinaweza kutafsiriwa kuhusiana na kitengo chochote cha kiasi (namba), na hivyo equation hii inaweza kusomwa kwa usahihi kwa njia nyingi, ikiwa ni pamoja na:
- Molekuli moja ya methane na molekuli mbili za oksijeni huguswa ili kutoa molekuli moja ya dioksidi kaboni
- Molekuli kumi na mbili za methane na molekuli kumi na mbili za oksijeni huguswa ili kutoa molekuli dazeni moja ya dioksidi kaboni
- Mole moja ya molekuli ya methane na moles 2 ya molekuli ya oksijeni huguswa ili kutoa mole 1 ya molekuli ya dioksidi kaboni na mol
Kusawazisha equations
Wakati equation kemikali ni uwiano inamaanisha kwamba idadi sawa ya atomi kwa kila elementi kushiriki katika mmenyuko ni kuwakilishwa kwenye pande reactant na bidhaa. Hii ni sharti equation lazima kukidhi kuwa sambamba na sheria ya uhifadhi wa suala. Inaweza kuthibitishwa kwa kuhesabu tu idadi ya atomi upande wowote wa mshale na kulinganisha kiasi hiki ili kuhakikisha kuwa ni sawa. Kumbuka kwamba idadi ya atomi kwa elementi iliyotolewa huhesabiwa kwa kuzidisha mgawo wa fomula yoyote iliyo na kipengele hicho kwa usajili wa elementi katika formula. Kama kipengele inaonekana katika formula zaidi ya moja upande fulani wa equation, idadi ya atomi kuwakilishwa katika kila lazima computed na kisha aliongeza pamoja. Kwa mfano, aina zote mbili za bidhaa katika mmenyuko wa mfano,\(\ce{CO2}\) na\(\ce{H2O}\), zina kipengele cha oksijeni, na hivyo idadi ya atomi za oksijeni upande wa bidhaa ya equation ni
\[\left(1\: \cancel{\ce{CO_2} \: \text{molecule}} \times \dfrac{2\: \ce{O} \: \text{atoms}}{ \cancel{\ce{CO_2} \: \text{molecule}}}\right) + \left( \cancel{ \ce{2H_2O} \: \text{molecule} }\times \dfrac{1\: \ce{O}\: \text{atom}}{\cancel{ \ce{H_2O} \: \text{molecule}}}\right)=4\: \ce{O} \: \text{atoms} \nonumber \]
Ulinganisho wa mmenyuko kati ya methane na oksijeni ili kuzalisha dioksidi kaboni na maji imethibitishwa kuwa na usawa kwa njia hii, kama inavyoonyeshwa hapa:
\[\ce{CH4 +2O2\rightarrow CO2 +2H2O} \nonumber \]
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| C | 1 × 1 = 1 | 1 × 1 = 1 | 1 = 1, ndiyo |
| H | 4 × 1 = 4 | 2 × 2 = 4 | 4 = 4, ndiyo |
| O | 2 × 2 = 4 | (1 × 2) + (2 × 1) = 4 | 4 = 4, ndiyo |
uwiano kemikali equation mara nyingi inaweza kuwa inayotokana na maelezo ya ubora wa baadhi mmenyuko kemikali na mbinu haki rahisi inayojulikana kama kusawazisha na ukaguzi. Fikiria kama mfano utengano wa maji ili kuzalisha hidrojeni ya molekuli na oksijeni. Utaratibu huu unawakilishwa kwa usawa na usawa wa kemikali usio na usawa:
\[\ce{H2O \rightarrow H2 + O2} \tag{unbalanced} \]
Kulinganisha idadi ya atomi H na O upande wowote wa equation hii inathibitisha usawa wake:
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| H | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, ndiyo |
| O | 1 × 1 = 1 | 1 × 2 = 2 | 1 - 2, hapana |
Idadi ya atomi H kwenye pande za reactant na bidhaa za equation ni sawa, lakini idadi ya atomi O si. Ili kufikia usawa, coefficients ya equation inaweza kubadilishwa kama inahitajika. Kumbuka, bila shaka, kwamba formula subscripts kufafanua, kwa sehemu, utambulisho wa dutu, na hivyo hizi haziwezi kubadilishwa bila kubadilisha maana ya ubora wa equation. Kwa mfano, kubadilisha formula ya reactant kutoka H 2 O hadi H 2 O 2 ingeweza kutoa usawa katika idadi ya atomi, lakini kufanya hivyo pia hubadilisha utambulisho wa reactant (sasa ni peroxide ya hidrojeni na sio maji). Uwiano wa atomi O unaweza kupatikana kwa kubadilisha mgawo wa H 2 O hadi 2.
\[\ce{2H2O \rightarrow H2 + O2} \tag{unbalanced} \]
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| H | 2 × 2 = 4 | 1 × 2 = 2 | 4 - 2, hapana |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, ndiyo |
Uwiano wa atomi wa H ulikasirika na mabadiliko haya, lakini hurejeshwa kwa urahisi kwa kubadilisha mgawo wa bidhaa H 2 hadi 2.
\[\ce{2H_2O \rightarrow 2H2 + O2} \tag{balanced} \]
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| H | 2 × 2 = 4 | 2 × 2 = 2 | 4 = 4, ndiyo |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, ndiyo |
Coefficients hizi mavuno idadi sawa ya wote H na O atomi katika pande reactant na bidhaa, na equation uwiano ni, kwa hiyo:
\[\ce{2H_2O \rightarrow 2H_2 + O_2} \nonumber \]
Andika equation uwiano kwa mmenyuko wa nitrojeni Masi (N 2) na oksijeni (O 2) ili kuunda pentoxide ya dinitrojeni.
Suluhisho
Kwanza, andika equation isiyo na usawa.
\[\ce{N_2 + O_2 \rightarrow N_2O_5} \tag{unbalanced} \]
Next, kuhesabu idadi ya kila aina ya atomi sasa katika usawa unbalanced.
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| N | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, ndiyo |
| O | 1 × 2 = 2 | 1 × 5 = 5 | 2 - 5, hapana |
Ingawa nitrojeni ni ya usawa, mabadiliko katika coefficients yanahitajika kusawazisha idadi ya atomi za oksijeni. Ili kusawazisha idadi ya atomi za oksijeni, jaribio la kwanza la busara litakuwa kubadili coefficients kwa O 2 na N 2 O 5 kwa integers ambazo zitazaa atomi za 10 O (nyingi zaidi ya kawaida kwa michango ya atomi O katika kanuni hizi mbili).
\[\ce{N_2 + 5 O2 \rightarrow 2 N2O5} \tag{unbalanced} \]
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| N | 1 × 2 = 2 | 2 × 2 = 4 | 2 - 4, hapana |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, ndiyo |
Uwiano wa atomu ya N umefadhaika na mabadiliko haya; ni kurejeshwa kwa kubadilisha mgawo kwa reactant N 2 hadi 2.
\[\ce{2N_2 + 5O_2\rightarrow 2N_2O_5} \nonumber \]
| Element | Wanyanyabiashara | Bidhaa | Uwiano? |
|---|---|---|---|
| N | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, ndiyo |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, ndiyo |
Idadi ya atomi za N na O upande wowote wa equation sasa ni sawa, na hivyo equation ni sawa.
Andika equation uwiano kwa utengano wa nitrati amonia kuunda nitrojeni Masi, molekuli oksijeni, na maji. (Kidokezo: Mizani oksijeni mwisho, kwani ni sasa katika molekuli zaidi ya moja upande wa kulia wa equation.)
- Jibu
-
\[\ce{2NH4NO3 \rightarrow 2N2 + O2 + 4H2O} \nonumber \]
Mitikio ya kusawazisha Ambayo yana Polyatomics: Mitikio ya kusawazisha Ambayo yana Polyatomics (inafungua katika dirisha jipya) [youtu.be]
Wakati mwingine ni rahisi kutumia sehemu ndogo badala ya integers kama coefficients kati katika mchakato wa kusawazisha equation kemikali. Wakati usawa unapopatikana, coefficients zote za equation zinaweza kuzidishwa na namba nzima ili kubadilisha coefficients za sehemu kwa integers bila kuharibu usawa wa atomi. Kwa mfano, fikiria mmenyuko wa ethane (C 2 H 6) na oksijeni ili kuzalisha H 2 O na CO 2, iliyowakilishwa na equation isiyo na usawa:
\[\ce{C_2H_6 + O_2 \rightarrow H_2O + CO_2} \tag{unbalanced} \]
Kufuatia mbinu ya kawaida ya ukaguzi, mtu anaweza kwanza kusawazisha C na H atomi kwa kubadilisha coefficients kwa aina mbili za bidhaa, kama inavyoonekana:
\[\ce{C_2H_6 + O_2 \rightarrow 3H_2O + 2CO_2} \tag{unbalanced} \]
Hii matokeo katika saba O atomi upande wa bidhaa ya equation, isiyo ya kawaida idadi-hakuna mgawo integer inaweza kutumika kwa O 2 reactant mavuno idadi isiyo ya kawaida, hivyo sehemu mgawo\(\ce{7/2}\), ni kutumika badala ya mavuno muda uwiano equation:
\[\ce{C2H6 + 7/2 O2\rightarrow 3H2O + 2CO2} \nonumber \]
Equation ya kawaida ya uwiano na coefficients integer-tu inatokana na kuzidisha kila mgawo kwa 2:
\[\ce{2C2H6 +7O2\rightarrow 6H2O + 4CO2} \nonumber \]
Hatimaye kuhusiana na equations uwiano, kukumbuka kwamba mkataba dictates matumizi ya coefficients ndogo nzima-idadi. Ingawa equation kwa mmenyuko kati ya nitrojeni Masi na hidrojeni Masi ya kuzalisha amonia ni, kwa kweli, uwiano,
\[\ce{3N2 +9H2\rightarrow 6NH3} \nonumber \]
coefficients sio integers ndogo iwezekanavyo inayowakilisha idadi ya jamaa ya molekuli ya reactant na bidhaa. Kugawanya kila mgawo kwa sababu kubwa ya kawaida, 3, hutoa equation iliyopendekezwa:
\[\ce{N2 + 3H2\rightarrow 2NH3} \nonumber \]
Tumia mafunzo haya ya maingiliano kwa usawa wa ziada wa mazoezi ya kusawazisha.
Maelezo ya ziada katika Ulinganisho wa Kemikali
Majimbo ya kimwili ya reactants na bidhaa katika milinganyo ya kemikali mara nyingi huonyeshwa kwa kifupi cha parenthetical kufuatia formula. Vifupisho vya kawaida ni pamoja na s kwa yabisi, l kwa vinywaji, g kwa gesi, na aq kwa vitu vilivyovunjwa katika maji (ufumbuzi wa maji, kama ilivyoletwa katika sura iliyotangulia). Nukuu hizi zinaonyeshwa katika mfano equation hapa:
\[\ce{2Na (s) + 2H2O (l) \rightarrow 2NaOH (aq) + H2(g)} \nonumber \]
Equation hii inawakilisha mmenyuko unaofanyika wakati chuma cha sodiamu kinawekwa ndani ya maji. Sodiamu imara humenyuka na maji ya kioevu ili kuzalisha gesi ya hidrojeni ya molekuli na hidroksidi ya ioniki ya kiwanja cha sodiamu (imara katika fomu safi, lakini kwa urahisi kufutwa katika
Hali maalum zinazohitajika kwa mmenyuko wakati mwingine huteuliwa kwa kuandika neno au alama juu au chini ya mshale wa equation. Kwa mfano, majibu yaliyofanywa na inapokanzwa yanaweza kuonyeshwa na delta ya Kigiriki ya Kigiriki kubwa (Δ) juu ya mshale.
\[\ce{CaCO3}(s)\xrightarrow{\:\Delta\:} \ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Mifano mingine ya hali hizi maalum zitakutana kwa kina zaidi katika sura za baadaye.
Ulinganisho wa athari za Ionic
Kutokana na wingi wa maji duniani, inasimama kwa sababu kwamba athari nyingi za kemikali hufanyika katika vyombo vya habari vya maji. Wakati ions zinahusika katika athari hizi, equations ya kemikali inaweza kuandikwa kwa ngazi mbalimbali za undani zinazofaa kwa matumizi yao yaliyokusudiwa. Ili kuonyesha hili, fikiria mmenyuko kati ya misombo ya ionic inayofanyika katika suluhisho la maji. Wakati ufumbuzi wa maji\(\ce{CaCl2}\) na\(\ce{AgNO3}\) unachanganywa, mmenyuko unafanyika huzalisha maji\(\ce{Ca(NO3)2}\) na imara\(\ce{AgCl}\):
\[\ce{CaCl2}(aq)+\ce{2AgNO3}(aq)\rightarrow \ce{Ca(NO3)2}(aq)+\ce{2AgCl}(s) \nonumber \]
Hii equation uwiano, inayotokana na mtindo wa kawaida, inaitwa equation Masi kwa sababu haina wazi kuwakilisha aina ionic kwamba ni sasa katika ufumbuzi. Wakati misombo ionic kufutwa katika maji, wanaweza dissociate katika ions yao Constituent, ambayo hatimaye kutawanyika homogenously katika ufumbuzi kusababisha (majadiliano ya kina ya mchakato huu muhimu hutolewa katika sura ya ufumbuzi). Misombo ya ionic kufutwa katika maji, kwa hiyo, zaidi ya kweli inawakilishwa kama ions dissociated, katika kesi hii:
\[\ce{CaCl2}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2Cl-}(aq) \nonumber \]
\[\ce{2AgNO3}(aq)\rightarrow \ce{2Ag+}(aq)+\ce{2NO3-}(aq) \nonumber \]
\[\ce{Ca(NO3)2}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2NO3-}(aq) \nonumber \]
Tofauti na misombo hii ya ionic tatu, AgCl haina kufuta katika maji kwa kiasi kikubwa, kama inavyoashiria hali yake ya kimwili, (s).
Ni wazi anayewakilisha matokeo yote ions kufutwa katika kamili ionic equation. Katika kesi hii, fomu za misombo ya ionic iliyoharibiwa hubadilishwa na fomu kwa ions zao zilizojitenga:
\[\ce{Ca^2+}(aq)+\ce{2Cl-}(aq)+\ce{2Ag+}(aq)+\ce{2NO3-}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2NO3-}(aq)+\ce{2AgCl}(s) \nonumber \]
Kuchunguza equation hii inaonyesha kwamba aina mbili kemikali ni sasa katika fomu kufanana pande zote mbili za mshale,\(\ce{Ca^{2+}(aq)}\) na\(\ce{NO3-}(aq)\). Ioni hizi za watazamaji -ions ambazo uwepo wake unahitajika kudumisha malipo ya neutrality-sio kemikali wala kimwili kubadilishwa na mchakato, na hivyo wanaweza kuondolewa kutoka equation kutoa uwakilishi succinct zaidi iitwayo wavu ionic equation:
\[\cancel{\ce{Ca^2+}(aq)}+\ce{2Cl-}(aq)+\ce{2Ag+}(aq)+\cancel{\ce{2NO3-}(aq)}\rightarrow \cancel{\ce{Ca^2+}(aq)}+\cancel{\ce{2NO3-}(aq)}+\ce{2AgCl}(s) \nonumber \]
\[\ce{2Cl-}(aq)+\ce{2Ag+}(aq)\rightarrow \ce{2AgCl}(s) \nonumber \]
Kufuatia mkataba wa kutumia integers ndogo iwezekanavyo kama coefficients, equation hii ni kisha imeandikwa:
\[\ce{Cl-}(aq)+\ce{Ag+}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
Equation hii ya ionic ya wavu inaonyesha kwamba kloridi ya fedha imara inaweza kuzalishwa kutoka kwa kloridi iliyoharibiwa na fedha (I) ions, bila kujali chanzo cha ions hizi. Equations hizi za molekuli na kamili za ionic hutoa maelezo ya ziada, yaani, misombo ya ionic inayotumiwa kama vyanzo vya\(\ce{Cl^{−}}\) na\(\ce{Ag+}\).
Wakati kaboni dioksidi kufutwa katika suluhisho la maji ya hidroksidi ya sodiamu, mchanganyiko humenyuka ili kuzalisha carbonate ya sodiamu yenye maji Andika uwiano Masi, ionic kamili, na equations wavu ionic kwa mchakato huu.
Suluhisho
Anza kwa kutambua formula kwa reactants na bidhaa na kuzipanga vizuri katika fomu ya equation ya kemikali:
\[\ce{CO2(aq) + NaOH(aq) \rightarrow Na2CO3(aq) + H2O(l)} \tag{unbalanced} \]
Mizani inapatikana kwa urahisi katika kesi hii kwa kubadilisha mgawo wa NaOH hadi 2, na kusababisha equation ya Masi kwa mmenyuko huu:
\[\ce{CO2(aq)+2NaOH(aq)\rightarrow Na2CO3(aq) + H2O}(l) \nonumber \]
mbili kufutwa misombo ionic, NaOH na Na 2 CO 3, inaweza kuwakilishwa kama ions dissociated kutoa kamili ionic equation:
\[\ce{CO2 (aq) + 2Na+ (aq) + 2OH- (aq) \rightarrow 2Na+ (aq) + CO3^{2-} (aq) + H2O (l)} \nonumber \]
Hatimaye, kutambua ion mtazamaji (s), katika kesi hii Na + (aq), na kuondoa hiyo kutoka kila upande wa equation kuzalisha wavu ionic equation:
\ [kuanza {align*}
\ ce {CO2} (aq) +\ kufuta {\ ce {2Na+} (aq)} +\ ce {2OH-} (aq) &\ mstari wa kulia\ kufuta {\ ce {2Na+} (aq)} +\ ce {CO3 ^ 2-} (aq) +\ ce {H2O} (l)\\\ ce {CO2} (aq) +\ ce {H2O} (l)\\ ce {CO2} (aq) +
\ ce {H2O} (l)\\ ce {CO2} (aq) +\ ce {2OH-} (aq) &\ rightarrow\ ce {CO3 ^ 2-} (aq) +\ ce {H2O} (l)
\ mwisho {align*}\ nonumber\]
Klorini ya diatomiki na hidroksidi ya sodiamu (lye) ni kemikali za bidhaa zinazozalishwa kwa kiasi kikubwa, pamoja na hidrojeni diatomiki, kupitia electrolysis ya brine, kulingana na equation yafuatayo isiyo na usawa:
\[\ce{NaCl(aq) + H2O(l) ->[ electricity] NaOH(aq) + H2(g) + Cl2(g)} \nonumber \]
Andika uwiano Masi, ionic kamili, na equations wavu ionic kwa mchakato huu.
- Jibu
-
Uwiano wa Masi ya usawa:\[\ce{2NaCl(aq) + 2H2O(l) -> 2NaOH(aq) + H2(g) + Cl2(g)} \nonumber \]
Uwiano wa ionic usawa:\[\ce{2Na^{+}(aq) + 2Cl^{-}(aq) + 2H2O (l) -> 2Na^{+}(aq) + 2OH^{-}(aq) + H2(g) + Cl2(g)} \nonumber \]
Uwiano wavu wa ionic equation:\[\ce{2Cl^{-}(aq) + 2H2O(l) -> 2OH^{-}(aq) + H2(g) + Cl2(g) } \nonumber \]
Dhana muhimu na Muhtasari
Ulinganisho wa kemikali ni uwakilishi wa mfano wa mabadiliko ya kemikali na kimwili. Fomu za vitu vinavyobadilika (reactants) na vitu vinavyotokana na mabadiliko (bidhaa) vinatenganishwa na mshale na kutanguliwa na coefficients integer inayoonyesha idadi yao ya jamaa. Ulinganifu wa usawa ni wale ambao coefficients husababisha idadi sawa ya atomi kwa kila elementi katika reactants na bidhaa. Athari za kemikali katika suluhisho la maji ambalo linahusisha majibu ya ionic au bidhaa zinaweza kuwakilishwa zaidi kwa kweli na milinganyo kamili ya ionic na, kwa ufupi zaidi, na usawa wa ionic wavu.
faharasa
- equation uwiano
- kemikali equation na idadi sawa ya atomi kwa kila kipengele katika reactant na bidhaa
- kemikali equation
- uwakilishi wa mfano wa mmenyuko wa kemikali
- mgawo
- idadi kuwekwa mbele ya alama au formula katika equation kemikali kuonyesha kiasi yao jamaa
- equation kamili ya ionic
- equation kemikali ambayo kila reactants kufutwa ionic na bidhaa, ikiwa ni pamoja na ions mtazamaji, ni wazi kuwakilishwa na formula kwa ions zao dissociated
- molekuli equation
- equation kemikali ambayo reactants wote na bidhaa ni kuwakilishwa kama dutu neutral
- equation ya ionic
- equation kemikali ambayo tu wale reactants kufutwa ionic na bidhaa kwamba kupitia kemikali au mabadiliko ya kimwili ni kuwakilishwa (isipokuwa ions mtazamaji)
- bidhaa
- Dutu iliyoundwa na mabadiliko ya kemikali au kimwili; umeonyeshwa upande wa kulia wa mshale katika equation ya kemikali
- mwenye kujibu
- Dutu inayofanyika mabadiliko ya kemikali au kimwili; umeonyeshwa upande wa kushoto wa mshale katika usawa wa kemikali
- ion mtazamaji
- ion ambayo haina mabadiliko ya kemikali au kimwili wakati wa mmenyuko, lakini uwepo wake unahitajika kudumisha kutokuwa na nia ya malipo


