4.6: Muundo wa Masi na Polarity
- Page ID
- 182593
- Kutabiri miundo ya molekuli ndogo kwa kutumia valence shell elektroni jozi repulsion (VSEPR) nadharia
- Eleza dhana za vifungo vya polar covalent na polarity ya Masi
- Tathmini polarity ya molekuli kulingana na bonding yake na muundo
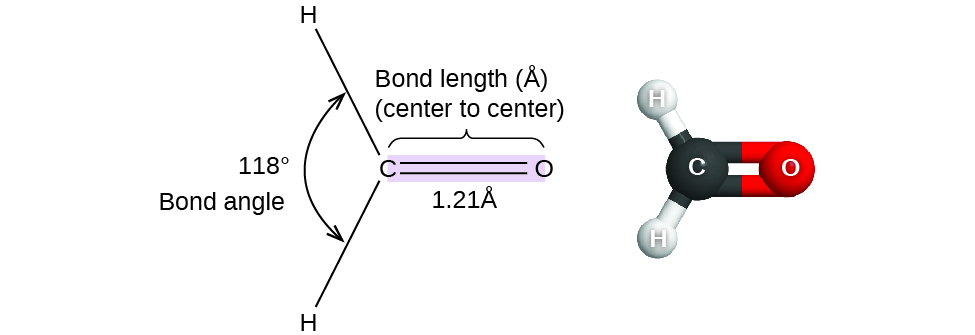
Hadi sasa, tumetumia miundo miwili ya Lewis kuwakilisha molekuli. Hata hivyo, muundo Masi ni kweli tatu-dimensional, na ni muhimu kuwa na uwezo wa kuelezea vifungo Masi katika suala la umbali wao, pembe, na mipango jamaa katika nafasi (Kielelezo\(\PageIndex{1}\)). Pembe ya dhamana ni pembe kati ya vifungo vyovyote viwili vinavyojumuisha atomu ya kawaida, kwa kawaida hupimwa kwa digrii. Umbali wa dhamana (au urefu wa dhamana) ni umbali kati ya viini vya atomi mbili zilizounganishwa kando ya mstari wa moja kwa moja kujiunga na nuclei. Umbali wa dhamana hupimwa katika Ångstroms (1 Å = 10 —10 m) au picometers (1 pm = 10 —12 m, 100pm = 1 Å).
Nadharia ya VSEPR
Valence shell elektroni-jozi repulsion nadharia (VSEPR nadharia) inatuwezesha kutabiri muundo Masi, ikiwa ni pamoja na pembe takriban dhamana kuzunguka atomu ya kati, ya molekuli kutoka uchunguzi wa idadi ya vifungo na jozi elektroni lone katika muundo wake Lewis. Mfano wa VSEPR unafikiri kwamba jozi za elektroni katika shell ya valence ya atomi ya kati itachukua mpangilio ambao hupunguza repulsions kati ya jozi hizi za elektroni kwa kuongeza umbali kati yao. Electroni katika shell ya valence ya atomi ya kati huunda jozi za elektroni, ziko hasa kati ya atomi zilizounganishwa, au jozi pekee. Kupinduliwa kwa umeme kwa elektroni hizi kunapungua wakati mikoa mbalimbali ya wiani wa juu wa elektroni huchukua nafasi mbali na kila mmoja iwezekanavyo.
Nadharia ya VSEPR inatabiri mpangilio wa jozi za elektroni karibu na kila atomu ya kati na, kwa kawaida, mpangilio sahihi wa atomi katika molekuli. Tunapaswa kuelewa, hata hivyo, kwamba nadharia inazingatia tu repulsions elektroni-jozi. Mwingiliano mwingine, kama vile repulsions nyuklia nyuklia na vivutio nyuklia elektroni, pia ni kushiriki katika mpangilio wa mwisho kwamba atomi kupitisha katika muundo fulani Masi.
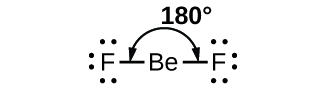
Kama mfano rahisi wa nadharia ya VSEPR, hebu kutabiri muundo wa molekuli ya gesi BeF 2. Muundo wa Lewis wa BeF 2 (Kielelezo\(\PageIndex{2}\)) unaonyesha jozi mbili tu za elektroni karibu na atomi kuu ya beryllium. Kwa vifungo viwili na hakuna jozi pekee za elektroni kwenye atomi ya kati, vifungo viko mbali mbali iwezekanavyo, na kupinduliwa kwa umeme kati ya mikoa hii ya wiani wa juu wa elektroni hupunguzwa hadi kiwango cha chini wakati wako pande tofauti za atomi kuu. Pembe ya dhamana ni 180° (Kielelezo\(\PageIndex{2}\)).
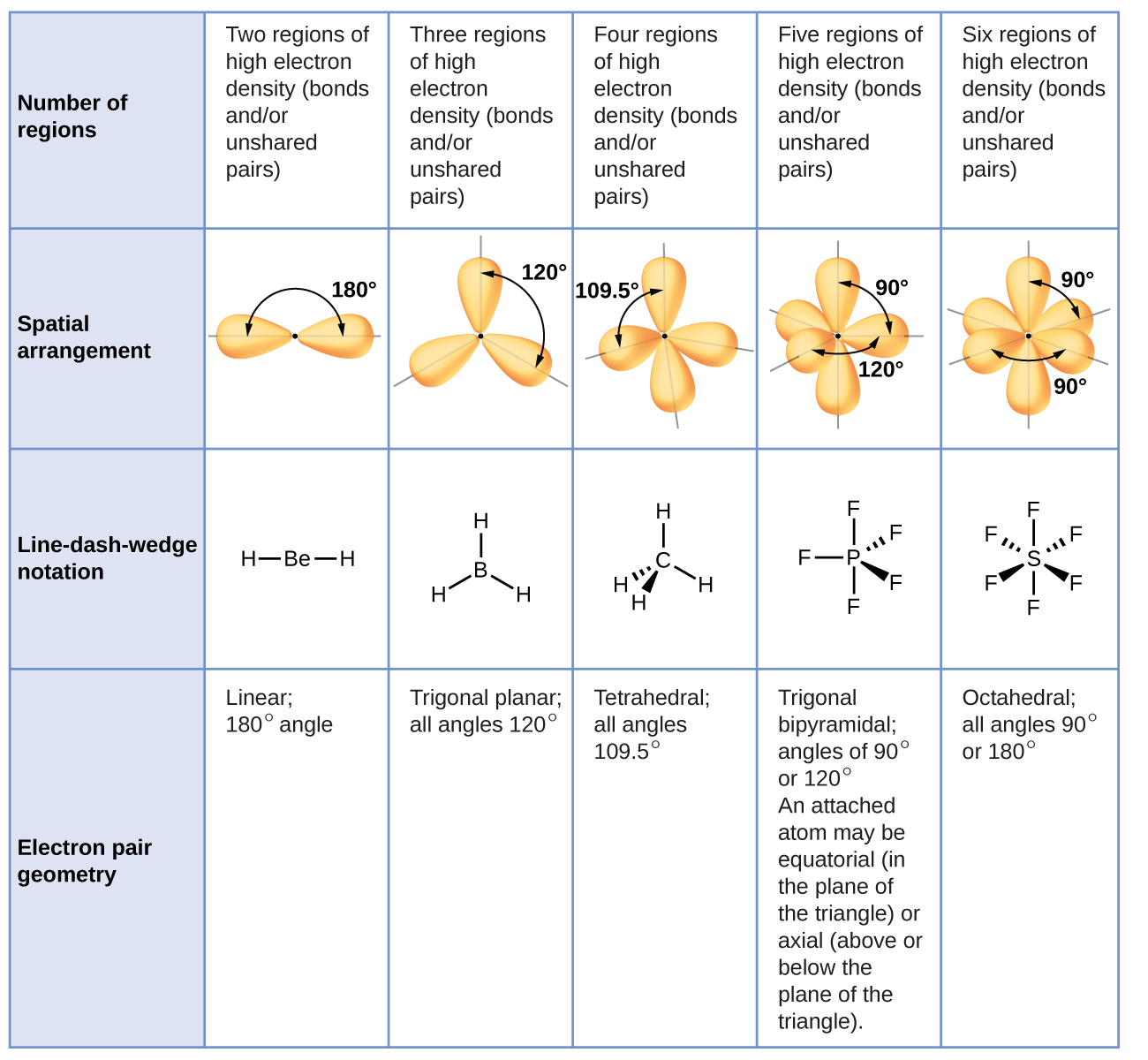
Kielelezo\(\PageIndex{3}\) unaeleza hii na nyingine elektroni-jozi geometries kwamba kupunguza repulsions kati ya mikoa ya wiani high elektroni (vifungo na/au jozi lone). Mikoa miwili ya wiani wa elektroni karibu na atomi kuu katika molekuli huunda jiometri ya mstari; mikoa mitatu huunda jiometri ya trigonal; mikoa minne huunda jiometri ya tetrahedral; mikoa mitano huunda jiometri ya bipyramidal ya trigonal; na mikoa sita huunda jiometri ya octahedral.
Electron-jozi jiometri dhidi ya Masi Muundo
Ni muhimu kutambua kwamba jiometri ya jozi ya elektroni karibu na atomi ya kati si kitu kimoja na muundo wake wa Masi. elektroni-jozi jiometri inavyoonekana katika Kielelezo\(\PageIndex{3}\) kuelezea mikoa yote ambapo elektroni ziko, vifungo pamoja na jozi lone. Muundo wa molekuli huelezea eneo la atomi, si elektroni.
Tunatofautisha kati ya hali hizi mbili kwa kutaja jiometri inayojumuisha jozi zote za elektroni jiometri ya jozi ya elektroni. Muundo unaojumuisha tu uwekaji wa atomi katika molekuli huitwa muundo wa Masi. Jiometri za jozi za elektroni zitakuwa sawa na miundo ya molekuli wakati hakuna jozi za elektroni pekee kuzunguka atomu ya kati, lakini zitakuwa tofauti wakati kuna jozi za pekee zilizopo kwenye atomu ya kati.
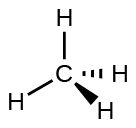
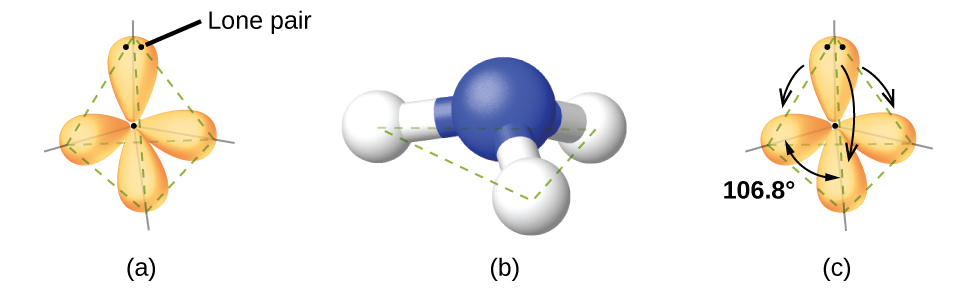
Kwa mfano, molekuli ya methane, CH 4, ambayo ni sehemu kubwa ya gesi asilia, ina jozi nne za elektroni karibu na atomi kuu ya kaboni; jiometri ya jozi ya elektroni ni tetrahedral, kama ilivyo muundo wa Masi (Kielelezo\(\PageIndex{4}\)). Kwa upande mwingine, molekuli ya amonia, NH 3, pia ina jozi nne za elektroni zinazohusishwa na atomi ya nitrojeni, na hivyo ina jiometri ya jozi ya elektroni ya tetrahedral. Moja ya mikoa hii, hata hivyo, ni jozi pekee, ambayo haijumuishwa katika muundo wa Masi, na jozi hii pekee huathiri sura ya molekuli (Kielelezo\(\PageIndex{5}\)).
Small kuvuruga kutoka pembe bora katika Kielelezo\(\PageIndex{5}\) inaweza kusababisha kutoka tofauti katika repulsion kati ya mikoa mbalimbali ya wiani elektroni. Nadharia ya VSEPR inatabiri upotovu huu kwa kuanzisha utaratibu wa repulsions na utaratibu wa kiasi cha nafasi inayotumiwa na aina mbalimbali za jozi za elektroni. Utaratibu wa repulsions ya jozi ya elektroni kutoka kwa repulsion kubwa hadi angalau ni:
jozi lone jozi-lone jozi> jozi moja ya kuunganisha jozi> jozi ya kuunganisha jozi-bonding
Utaratibu huu wa kupinduliwa huamua kiasi cha nafasi inayotumiwa na mikoa tofauti ya elektroni. Jozi moja ya elektroni inachukua eneo kubwa la nafasi kuliko elektroni katika dhamana tatu; kwa upande mwingine, elektroni katika dhamana tatu huchukua nafasi zaidi kuliko wale walio katika dhamana mbili, na kadhalika. Utaratibu wa ukubwa kutoka kwa ukubwa hadi mdogo ni:
jozi lone > dhamana mara tatu > mara mbili dhamana > dhamana moja
Fikiria formaldehyde, H 2 CO, ambayo hutumiwa kama kihifadhi kwa vielelezo vya kibiolojia na anatomical. Molekuli hii ina mikoa ya wiani wa juu wa elektroni ambayo inajumuisha vifungo viwili vya moja na dhamana moja mara mbili. Jiometri ya msingi ni planar ya trigonal yenye pembe za dhamana 120°, lakini tunaona kwamba dhamana mara mbili husababisha pembe kubwa kidogo (121°), na angle kati ya vifungo moja ni ndogo kidogo (118°).
Katika molekuli ya amonia, atomi tatu za hidrojeni zilizounganishwa na nitrojeni ya kati hazipatikani katika muundo wa gorofa, trigonal planar Masi, bali katika piramidi ya tatu ya trigonal (Kielelezo\(\PageIndex{6}\)) na atomi ya nitrojeni kwenye kilele na atomi tatu za hidrojeni zinazounda msingi. Pembe bora za dhamana katika piramidi ya trigonal zinategemea jiometri ya jozi ya elektroni ya tetrahedral. Tena, kuna upungufu kidogo kutoka kwa bora kwa sababu jozi pekee huchukua mikoa mikubwa ya nafasi kuliko elektroni za kuunganisha. H-N—H dhamana pembe katika NH 3 ni kidogo kidogo kuliko angle 109.5° katika tetrahedron mara kwa mara (Kielelezo\(\PageIndex{6}\)) kwa sababu lone jozi bonding jozi repulsion ni kubwa kuliko bonding jozi bonding jozi repulsion. Miundo bora ya Masi inatabiriwa kulingana na jiometri za jozi za elektroni kwa mchanganyiko mbalimbali wa jozi pekee na jozi za kuunganisha.
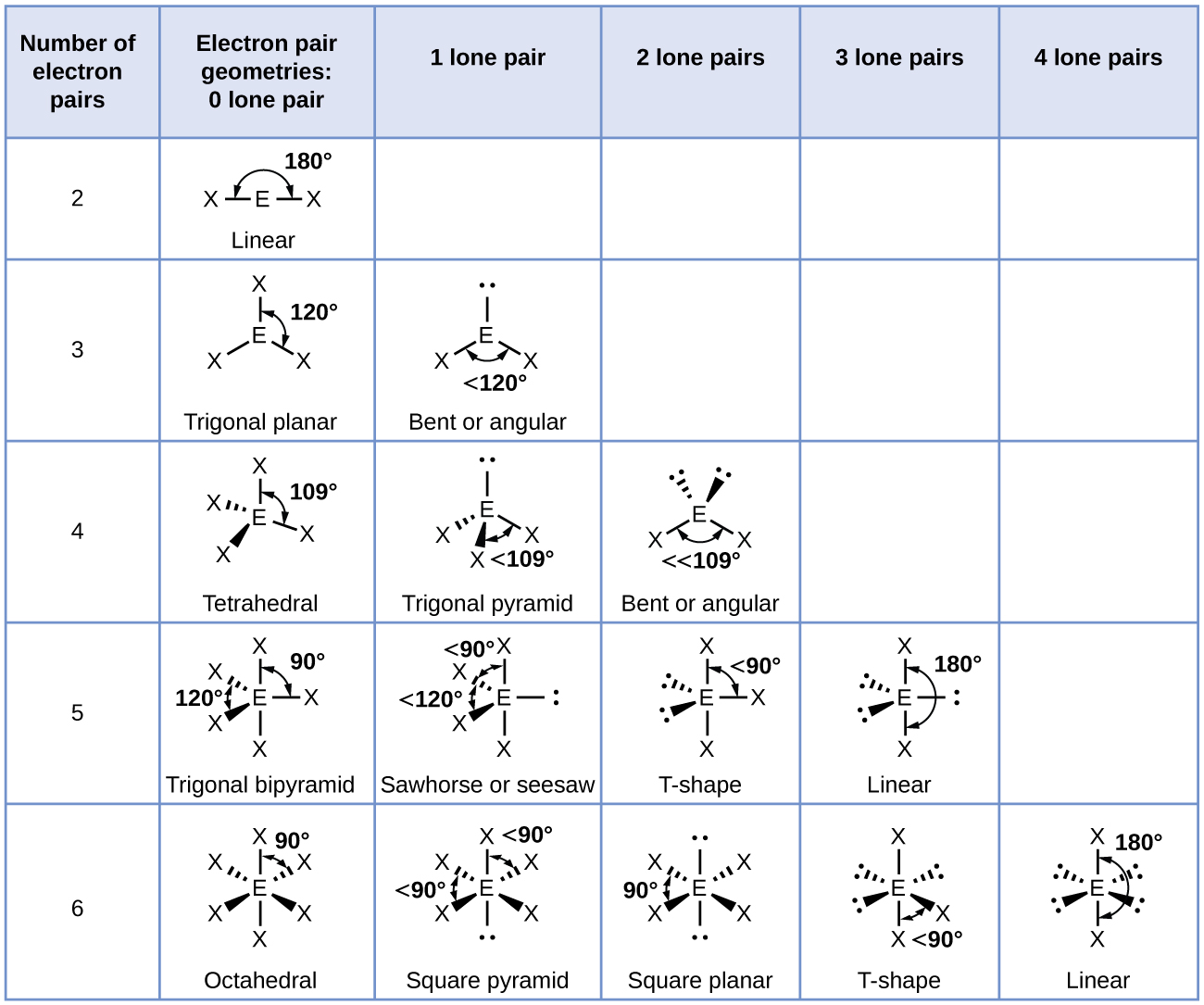
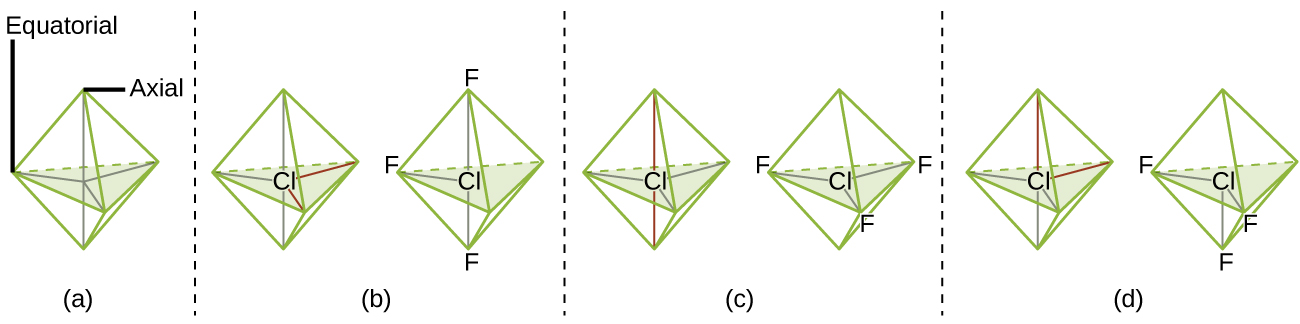
Kwa mujibu wa nadharia ya VSEPR, maeneo ya atomu ya terminal (Xs katika Kielelezo\(\PageIndex{7}\)) ni sawa ndani ya mstari, trigonal planar, na tetrahedral elektroni-jozi geometries (safu tatu za kwanza za meza). Haijalishi ambayo X inabadilishwa na jozi pekee kwa sababu molekuli zinaweza kuzungushwa ili kubadilisha nafasi. Kwa trigonal bipyramidal elektroni-jozi jiometri, hata hivyo, kuna mbili tofauti X nafasi (Kielelezo\(\PageIndex{7}\) a): nafasi axial (kama sisi kushikilia mfano wa trigonal bipyramid na nafasi mbili axial, tuna mhimili karibu ambayo tunaweza mzunguko mfano) na nafasi ya ikweta (nafasi tatu huunda ikweta karibu katikati ya molekuli). Msimamo wa axial umezungukwa na pembe za dhamana za 90°, wakati nafasi ya ikweta ina nafasi zaidi inapatikana kwa sababu ya pembe za dhamana 120°. Katika jiometri ya trigonal bipyramidal elektroni-jozi, jozi moja daima huchukua nafasi za equator kwa sababu nafasi hizi za wasaa zinaweza kubeba kwa urahisi jozi kubwa za pekee.
Kinadharia, tunaweza kuja na mipango mitatu iwezekanavyo kwa vifungo vitatu na jozi mbili za pekee kwa molekuli ya ClF 3 (Kielelezo\(\PageIndex{7}\)). Muundo thabiti ni ule unaoweka jozi pekee katika maeneo ya ikweta, kutoa muundo wa Masi ya T.
Wakati atomi ya kati ina jozi mbili za elektroni na mikoa minne ya kuunganisha, tuna jiometri ya jozi ya elektroni ya octahedral. Jozi mbili za pekee ziko kwenye pande tofauti za octahedron (180° mbali), zinatoa muundo wa Masi ya mpango wa mraba ambao hupunguza repulsions jozi moja moja.
Utaratibu unaofuata unatumia nadharia ya VSEPR kuamua jozi za elektroni jiometri na miundo ya masi:
- Andika muundo wa Lewis wa molekuli au ioni ya polyatomiki.
- Hesabu idadi ya mikoa ya wiani wa elektroni (jozi pekee na vifungo) karibu na atomi kuu. Dhamana moja, mara mbili, au tatu huhesabu kama kanda moja ya wiani wa elektroni.
- Tambua jiometri ya jozi ya elektroni kulingana na idadi ya mikoa ya wiani wa elektroni: linear, trigonal planar, tetrahedral, trigonal bipyramidal, au octahedral (Kielelezo\(\PageIndex{7}\), safu ya kwanza).
- Tumia idadi ya jozi moja ili kuamua muundo wa Masi (Kielelezo\(\PageIndex{7}\)). Ikiwa mpangilio zaidi ya moja wa jozi pekee na vifungo vya kemikali inawezekana, chagua moja ambayo itapunguza repulsions, kukumbuka kwamba jozi pekee huchukua nafasi zaidi kuliko vifungo vingi, ambavyo huchukua nafasi zaidi kuliko vifungo moja. Katika mipangilio ya bipyramidal ya trigonal, kupinduliwa kunapungua wakati kila jozi pekee iko katika nafasi ya usawa. Katika mpangilio wa octahedral na jozi mbili za pekee, kupinduliwa kunapungua wakati jozi pekee ziko kwenye pande tofauti za atomi kuu.
Mifano zifuatazo zinaonyesha matumizi ya nadharia ya VSEPR kutabiri muundo wa masi ya molekuli au ioni ambazo hazina jozi pekee za elektroni. Katika kesi hiyo, muundo wa Masi ni sawa na jiometri ya jozi ya elektroni.
Kutabiri elektroni-jozi jiometri na muundo Masi kwa kila moja ya yafuatayo:
- dioksidi kaboni, CO 2, molekuli zinazozalishwa na mwako wa mafuta
- boron trichloride, BCl 3, muhimu viwanda kemikali
Suluhisho
(a) Tunaandika muundo wa Lewis wa CO 2 kama:

Hii inatuonyesha mikoa miwili ya wiani wa juu wa elektroni karibu na atomi ya kaboni-kila dhamana mbili huhesabu kama kanda moja, na hakuna jozi pekee kwenye atomu ya kaboni. Kwa kutumia nadharia ya VSEPR, tunatabiri kwamba mikoa miwili ya wiani wa elektroni hujipanga kwa pande tofauti za atomu ya kati yenye angle ya dhamana ya 180°. Jiometri ya jozi ya elektroni na muundo wa Masi ni sawa, na molekuli za CO 2 ni linear.
(b) Tunaandika muundo wa Lewis wa BCl 3 kama:
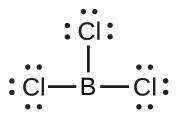
Hivyo tunaona kwamba BCl 3 ina vifungo vitatu, na hakuna jozi moja ya elektroni kwenye boroni. Mpangilio wa mikoa mitatu ya wiani wa juu wa elektroni hutoa jiometri ya elektroni-jozi ya trigonal. Vifungo vya B—Cl viko katika ndege yenye pembe 120° kati yao. BCl 3 pia ina muundo wa Masi ya trigonal.
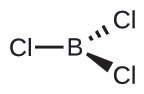
Jiometri ya jozi ya elektroni na muundo wa Masi ya BCl 3 ni mpango wa trigonal. Kumbuka kuwa jiometri ya VSEPR inaonyesha pembe sahihi za dhamana (120°), tofauti na muundo wa Lewis ulioonyeshwa hapo juu.
Carbonate\(\ce{CO3^2-}\), ni ioni ya kawaida ya polyatomiki inayopatikana katika vifaa mbalimbali kutoka kwa mazao ya yai hadi antacids. Jiometri ya jozi ya elektroni na muundo wa Masi ya ioni hii ya polyatomiki ni nini?
- Jibu
-
Jiometri ya jozi ya elektroni ni mpango wa trigonal na muundo wa Masi ni mpango wa trigonal. Kutokana na resonance, vifungo vyote vitatu vya C - O vinafanana. Ikiwa ni moja, mara mbili, au wastani wa mbili, kila dhamana huhesabu kama eneo moja la wiani wa elektroni.
Mbili ya kemikali 50 za juu zinazozalishwa nchini Marekani, nitrati ya amonia na sulfate ya amonia, zote mbili zinazotumiwa kama mbolea, zina ion ya amonia. Kutabiri elektroni-jozi jiometri na muundo Masi ya\(\ce{NH4+}\) cation.
Suluhisho
Tunaandika muundo wa Lewis wa\(\ce{NH4+}\) kama:
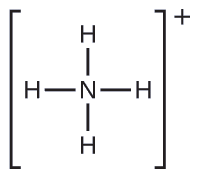
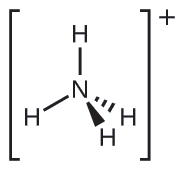
Tambua molekuli na muundo wa molekuli ya trigonal bipyramidal.
- Jibu
-
Molekuli yoyote yenye jozi tano za elektroni karibu na atomi za kati ikiwa ni pamoja na hakuna jozi lone itakuwa trigonal bipyramidal. \(\ce{PF5}\)ni mfano wa kawaida
Mifano kadhaa inayofuata inaonyesha athari za jozi moja za elektroni kwenye muundo wa Masi.
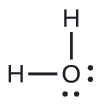
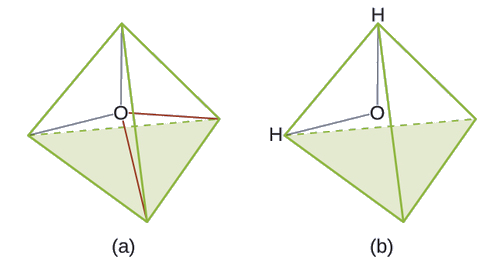
Kutabiri jiometri ya jozi ya elektroni na muundo wa Masi ya molekuli ya maji.
Suluhisho
Muundo wa Lewis wa H 2 O unaonyesha kuwa kuna mikoa minne ya wiani wa juu wa elektroni karibu na atomi ya oksijeni: jozi mbili pekee na vifungo viwili vya kemikali:
Ioni ya hydronium, H 3 O +, huunda wakati asidi hupasuka katika maji. Kutabiri elektroni-jozi jiometri na muundo Masi ya cation hii.
- Jibu
-
jozi ya elektroni jiometri: tetrahedral; Masi muundo: trigonal piramidi
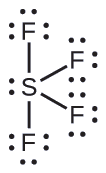
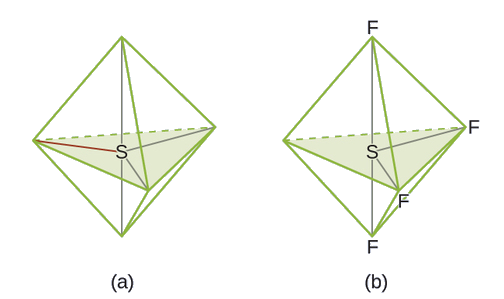
Utabiri wa jozi ya elektroni Jiometri na Muundo wa Masi: SF 4, ni muhimu sana kwa ajili ya maandalizi ya misombo ya fluorini iliyo na kutumika kama dawa za kuulia wadudu (yaani, SF 4 hutumiwa kama wakala wa fluorinating). Kutabiri jiometri ya jozi ya elektroni na muundo wa Masi ya molekuli ya SF 4.
Suluhisho
Muundo wa Lewis wa SF 4 unaonyesha mikoa mitano ya wiani wa elektroni karibu na atomi ya sulfuri: jozi moja pekee na jozi nne za kuunganisha:
Kutabiri jozi elektroni jiometri na muundo Masi kwa molekuli ya xEF 2.
- Jibu
-
Jiometri ya jozi ya elektroni ni bipyramidal ya trigonal. Muundo wa Masi ni mstari.
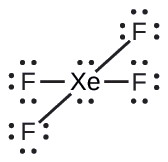
Kati ya gesi zote nzuri, xenon ni tendaji zaidi, mara nyingi hujibu na mambo kama vile oksijeni na fluorine. Kutabiri jiometri ya jozi ya elektroni na muundo wa Masi ya molekuli ya xEF 4.
Suluhisho
Muundo wa Lewis wa xEF 4 unaonyesha mikoa sita ya wiani wa juu wa elektroni karibu na atomi ya xenon: jozi mbili pekee na vifungo vinne:
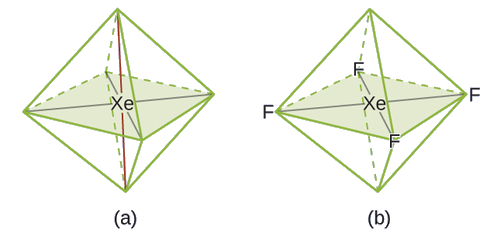
Katika molekuli fulani, atomi ya kati ina jozi tatu pekee na vifungo viwili. Je, jiometri ya jozi ya elektroni na muundo wa Masi itakuwa nini?
- Jibu
-
jiometri ya jozi ya elektroni: bipyramidal trigonal; muundo wa Masi:
Muundo wa Masi kwa Molekuli nyingi
Wakati molekuli au ioni ya polyatomiki ina atomu moja tu ya kati, muundo wa Masi huelezea kabisa umbo la molekuli. Molekuli kubwa hazina atomi moja ya kati, lakini zinaunganishwa na mlolongo wa atomi za ndani ambazo kila mmoja huwa na jiometri ya “ndani”. Njia hizi miundo ya mitaa zinaelekezwa kwa heshima kwa kila mmoja pia huathiri sura ya Masi, lakini masuala hayo kwa kiasi kikubwa ni zaidi ya upeo wa majadiliano haya ya utangulizi. Kwa madhumuni yetu, tutazingatia tu kuamua miundo ya ndani.
Muundo wa Lewis kwa asidi rahisi ya amino, glycine, H 2 NCH 2 CO 2 H, inavyoonyeshwa hapa. Kutabiri jiometri ya ndani kwa atomi ya nitrojeni, atomi mbili za kaboni, na atomi ya oksijeni yenye atomi ya hidrojeni iliyounganishwa:
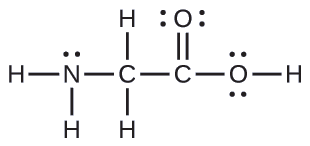
Suluhisho
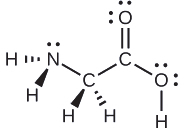
Fikiria kila atomi kuu kwa kujitegemea. Jiometri ya jozi ya elektroni:
- nitrojeni-mikoa minne ya wiani wa elektroni; tetrahedral
- kaboni (C H 2) —mikoa minne ya wiani wa elektroni; tetrahedral
- kaboni (C O 2) -mikoa mitatu ya wiani wa elektroni; mpango wa trigonal
- oksijeni (O H) -mikoa minne ya wiani wa elektroni; tetrahedral
Miundo ya ndani:
- nitrojeni - vifungo vitatu, jozi moja moja; piramidi ya trigonal
- kaboni (C H 2) - vifungo vinne, hakuna jozi pekee; tetrahedral
- kaboni (C O 2) - vifungo vitatu (dhamana mbili huhesabu kama dhamana moja), hakuna jozi pekee; mpango wa trigonal
- oksijeni (O H) —vifungo viwili, jozi mbili pekee; bent (109°)
Asidi nyingine ya amino ni alanine, ambayo ina muundo wa Lewis umeonyeshwa hapa. Kutabiri elektroni-jozi jiometri na muundo wa ndani wa atomi nitrojeni, atomi tatu kaboni, na atomi oksijeni na hidrojeni masharti:
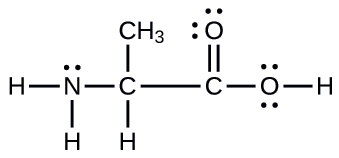
- Jibu
-
jiometri ya jozi ya elektroni: nitrojeni - tetrahedral; kaboni (C H) -tetrahedral; kaboni (C H 3) -tetrahedral; kaboni (C O 2) -planar ya trigonal; oksijeni (O H) -tetrahedral; miundo ya ndani: piramidi ya nitrojeni-trigonal; kaboni (C H) — tetrahedral; kaboni (C H 3) —tetrahedral; kaboni (C O 2) —planar ya trigonal; oksijeni (O H) -bent (109°)
Kutumia simulator hii ya sura ya Masi inatuwezesha kudhibiti kama pembe za dhamana na/au jozi za pekee zinaonyeshwa kwa kuangalia au kufuta masanduku chini ya “Chaguzi” upande wa kulia. Tunaweza pia kutumia lebo ya “Jina” chini kushoto ili kuonyesha au kujificha jiometri ya jozi ya elektroni (inayoitwa “elektroni jiometri” katika simulator) na/au muundo wa molekuli (inayoitwa “umbo la Masi” katika simulator).
Kujenga HCN molekuli katika simulator kulingana na muundo zifuatazo Lewis:
Bonyeza juu ya kila aina dhamana au jozi lone katika haki ya kuongeza kwamba kundi chembe ya kati. Mara baada ya kuwa na molekuli kamili, mzunguko ni kuchunguza muundo alitabiri Masi. Ni muundo gani wa Masi hii?
Suluhisho
Muundo wa Masi ni mstari.
Kujenga molekuli ngumu zaidi katika simulator. Tambua jiometri ya kikundi cha elektroni, muundo wa Masi, na pembe za dhamana. Kisha jaribu kupata formula ya kemikali ambayo inafanana na muundo uliyochora.
- Jibu
-
Majibu yatatofautiana. Kwa mfano, atomi yenye vifungo vinne, dhamana mbili, na jozi moja ina jiometri ya kikundi cha elektroni-kikundi cha octahedral na muundo wa mraba wa pyramidal Masi. XeOf 4 ni molekuli ambayo inachukua muundo huu.
Masi Polarity na Dipole Moment
Kama ilivyojadiliwa hapo awali, vifungo vya covalent vya polar huunganisha atomi mbili na electronegativities tofauti, na kuacha atomi moja na malipo ya sehemu chanya (δ+) na atomi nyingine na malipo ya sehemu hasi (δ—), kama elektroni zinavutwa kuelekea atomi zaidi ya electronegative. Utengano huu wa malipo hutoa wakati wa dhamana ya dipole. Ukubwa wa dhamana ya dhamana ya dhamana inawakilishwa na barua ya Kigiriki mu (μ) na hutolewa na
\[μ=Qr \label{7.6.X} \]
wapi
- \(Q\)ni ukubwa wa mashtaka ya sehemu (kuamua na tofauti ya electronegativity) na
- \(r\)ni umbali kati ya mashtaka:
Wakati huu wa dhamana unaweza kuwakilishwa kama vector, kiasi kilicho na mwelekeo na ukubwa (Kielelezo\(\PageIndex{12}\)). Dipole wadudu ni umeonyesha kama mishale akizungumzia pamoja dhamana kutoka chini electronegative atomi kuelekea chembe zaidi electronegative. Ishara ndogo pamoja hutolewa kwenye mwisho wa chini ya electronegative ili kuonyesha mwisho wa sehemu nzuri ya dhamana. Urefu wa mshale ni sawia na ukubwa wa tofauti ya electronegativity kati ya atomi mbili.
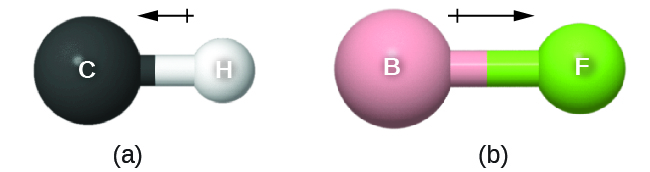
Molekuli nzima inaweza pia kuwa na mgawanyo wa malipo, kulingana na muundo wake wa Masi na polarity ya kila moja ya vifungo vyake. Ikiwa kujitenga kwa malipo hiyo ipo, molekuli inasemekana kuwa molekuli ya polar (au dipole); vinginevyo molekuli inasemekana kuwa isiyo ya kawaida. Wakati wa dipole hupima kiwango cha kujitenga kwa malipo ya wavu katika molekuli kwa ujumla. Tunaamua wakati wa dipole kwa kuongeza muda wa dhamana katika nafasi tatu-dimensional, kwa kuzingatia muundo wa Masi.
Kwa molekuli ya diatomic, kuna dhamana moja tu, hivyo dhamana yake ya dipole wakati huamua polarity ya Masi. Molekuli za diatomiki za homonuclear kama vile Br 2 na N 2 hazina tofauti katika electronegativity, hivyo wakati wao wa dipole ni sifuri. Kwa molekuli za heteronuclear kama CO, kuna wakati mdogo wa dipole. Kwa HF, kuna wakati mkubwa wa dipole kwa sababu kuna tofauti kubwa katika electronegativity.
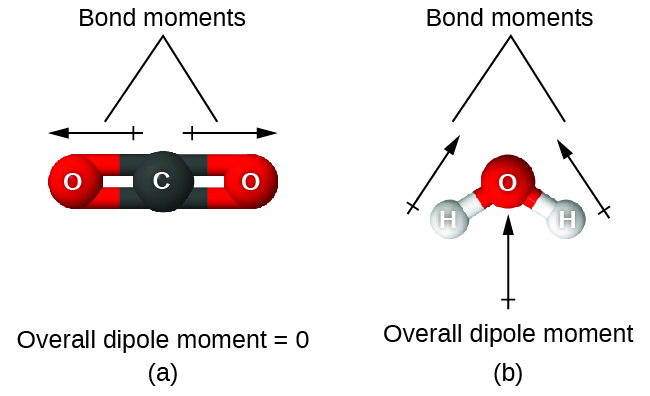
Wakati molekuli ina dhamana zaidi ya moja, jiometri lazima izingatiwe. Ikiwa vifungo katika molekuli vinapangwa kama vile wakati wao wa dhamana kufuta (jumla ya vector sawa na sifuri), basi molekuli ni nonpolar. Hii ni hali katika CO 2 (Kielelezo\(\PageIndex{13A}\)). Kila moja ya vifungo ni polar, lakini molekuli kwa ujumla ni nonpolar. Kutoka kwa muundo wa Lewis, na kutumia nadharia ya VSEPR, tunaamua kwamba molekuli ya CO 2 ni sawa na vifungo vya polar C =O kwenye pande tofauti za atomi ya kaboni. Wakati dhamana kufuta kwa sababu wao ni alisema katika mwelekeo kinyume. Katika kesi ya molekuli ya maji (Kielelezo\(\PageIndex{13B}\)), muundo wa Lewis unaonyesha tena kwamba kuna vifungo viwili kwa atomi ya kati, na tofauti ya electronegativity inaonyesha tena kwamba kila moja ya vifungo hivi ina wakati wa dhamana isiyo ya kawaida. Katika kesi hiyo, hata hivyo, muundo wa Masi ni bent kwa sababu ya jozi lone juu ya O, na mbili dhamana wakati wala kufuta. Kwa hiyo, maji yana wakati wa dipole wavu na ni molekuli ya polar (dipole).
Molekuli ya OCS ina muundo sawa na CO 2, lakini atomi ya sulfuri imechukua nafasi moja ya atomi za oksijeni. Kuamua kama molekuli hii ni polar, tunapata muundo wa Masi. Nadharia ya VSEPR inabiri molekuli linear:
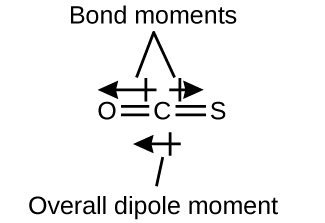
Dhamana ya C—O ni polar mno. Ingawa C na S zina maadili sawa ya electronegativity, S ni electronegative kidogo zaidi kuliko C, na hivyo dhamana ya C-S ni polar kidogo tu. Kwa sababu oksijeni ni electronegative zaidi kuliko sulfuri, mwisho wa oksijeni wa molekuli ni mwisho hasi.
Chloromethane, CH 3 Cl, ni mfano mwingine wa molekuli ya polar. Ingawa vifungo vya C—Cl na C-H vya polar vinapangwa katika jiometri ya tetrahedral, vifungo vya C—Cl vina muda mkubwa wa dhamana kuliko dhamana ya C—H, na wakati wa dhamana hauwezi kufuta kabisa. Dipoles zote zina sehemu ya juu katika mwelekeo unaoonyeshwa, kwani kaboni ni electronegative zaidi kuliko hidrojeni na chini ya electronegative kuliko klorini:
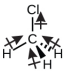
Tunapochunguza molekuli yenye ulinganifu BF 3 (trigonal planar), CH 4 (tetrahedral), PF 5 (trigonal bipyramidal), na SF 6 (octahedral), ambapo vifungo vyote vya polar vinafanana, molekuli ni nonpolar. Vifungo katika molekuli hizi hupangwa kama vile dipoles zao hufuta. Hata hivyo, kwa sababu tu molekuli ina vifungo sawa haimaanishi kwamba dipoles daima kufuta. Molekuli nyingi ambazo zina vifungo vinavyofanana na jozi pekee kwenye atomi za kati zina dipoles za dhamana ambazo hazighairi. Mifano ni pamoja na H 2 S na NH 3. Atomi ya hidrojeni iko mwisho mzuri na atomi ya nitrojeni au sulfuri iko mwisho wa vifungo vya polar katika molekuli hizi:
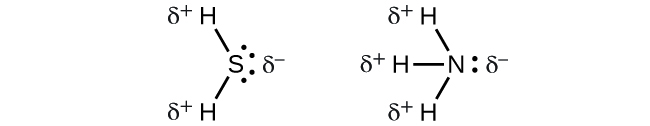
Kwa muhtasari, kuwa polar, molekuli lazima:
- Jumuisha angalau dhamana moja ya covalent ya polar.
- Kuwa na muundo wa Masi kama vile jumla ya vectors ya kila dhamana dipole wakati haina kufuta.
Mali ya Molekuli za Polar
Polar molekuli huwa na align wakati kuwekwa katika uwanja wa umeme na mwisho chanya ya molekuli oriented kuelekea sahani hasi na mwisho hasi kuelekea sahani chanya (Kielelezo\(\PageIndex{14}\)). Tunaweza kutumia kitu cha kushtakiwa kwa umeme ili kuvutia molekuli za polar, lakini molekuli zisizo za polar hazivutiwa. Pia, vimumunyisho vya polar ni bora katika kufuta vitu vya polar, na vimumunyisho vya nonpolar ni bora katika kufuta vitu visivyo na nonpolar.
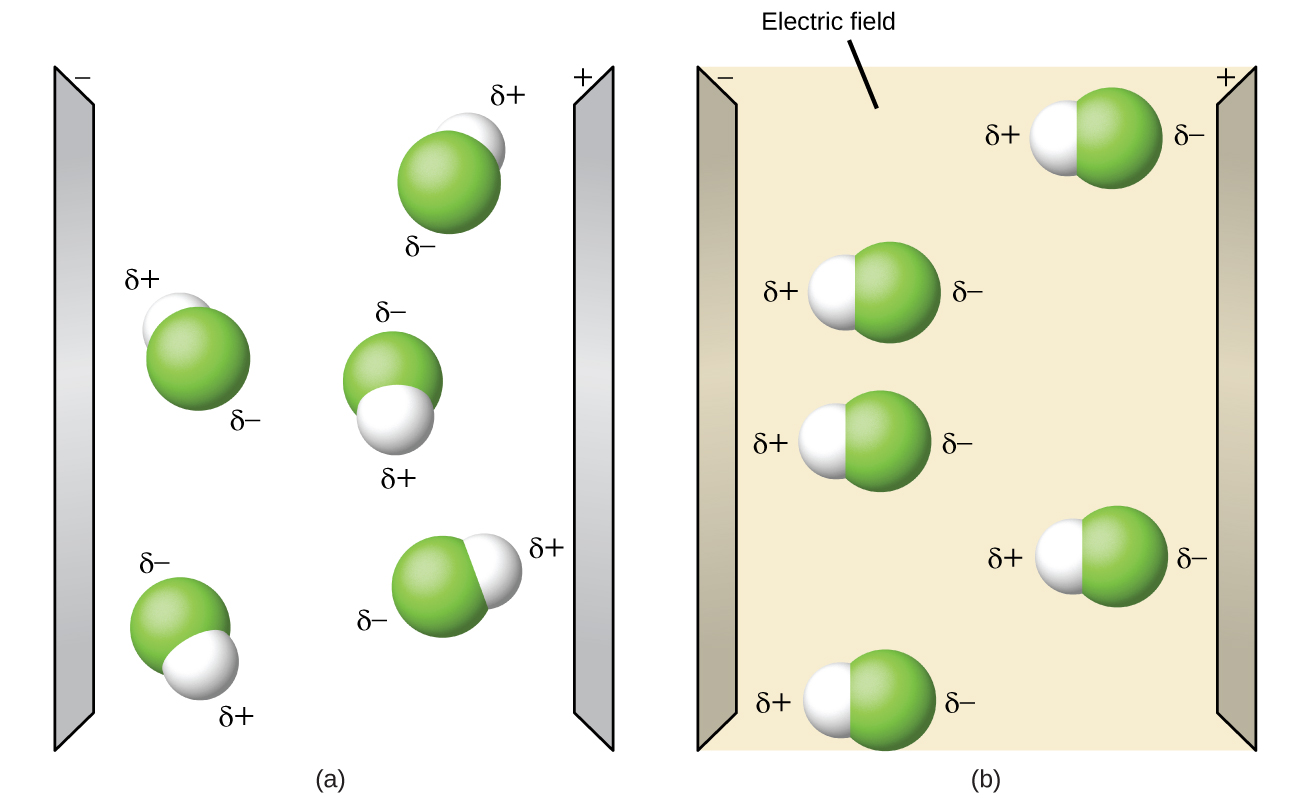
Fungua simulation ya polarity ya molekuli na uchague kichupo cha “Atomi tatu” hapo juu. Hii inapaswa kuonyesha ABC ya molekuli na adjustors tatu za electronegativity. Unaweza kuonyesha au kujificha wakati wa dhamana, dipoles za Masi, na mashtaka ya sehemu upande wa kulia. Kugeuka kwenye Uwanja wa Umeme utaonyesha kama molekuli inakwenda wakati unavyoonekana kwenye shamba, sawa na Kielelezo\(\PageIndex{14}\).
Matumizi ya udhibiti electronegativity kuamua jinsi dipole Masi kuangalia kwa molekuli kuanzia bent kama:
- A na C ni electronegative sana na B iko katikati ya upeo.
- A ni electronegative sana, na B na C si.
Suluhisho
- Masi dipole pointi wakati mara moja kati ya A na C.
- Masi dipole pointi wakati pamoja A-B dhamana, kuelekea A.
Kuamua mashtaka ya sehemu ambayo itatoa dipoles kubwa zaidi ya dhamana.
- Jibu
-
Wakati mkubwa wa dhamana utatokea kwa mashtaka makubwa ya sehemu. Ufumbuzi wawili hapo juu unawakilisha jinsi elektroni zisizo sawa zinashirikiwa katika dhamana. Wakati wa dhamana utaongezeka wakati tofauti ya electronegativity ni kubwa zaidi. Udhibiti wa A na C unapaswa kuweka kwa moja uliokithiri, na B inapaswa kuweka kinyume chake. Ingawa ukubwa wa muda wa dhamana hautabadilika kulingana na kama B ni electronegative zaidi au mdogo, mwelekeo wa wakati wa dhamana itakuwa.
Muhtasari
Nadharia ya VSEPR inabiri mpangilio wa tatu wa atomi katika molekuli. Inasema kwamba elektroni za valence zitachukua jiometri ya jozi ya elektroni ambayo inapunguza repulsions kati ya maeneo ya wiani wa juu wa elektroni (vifungo na/au jozi pekee). Muundo wa molekuli, ambayo inahusu tu kuwekwa kwa atomi katika molekuli na si elektroni, ni sawa na jiometri ya jozi ya elektroni tu wakati hakuna jozi za elektroni pekee kuzunguka atomu ya kati. Muda wa dipole hupima mgawanyo wa malipo. Kwa dhamana moja, dhamana ya dipole wakati imedhamiriwa na tofauti katika electronegativity kati ya atomi mbili. Kwa molekuli, wakati wa jumla wa dipole unatambuliwa na wakati wa dhamana ya mtu binafsi na jinsi dipoles hizi zinapangwa katika muundo wa Masi. Molekuli za polar (wale walio na wakati wa thamani ya dipole) huingiliana na mashamba ya umeme, wakati molekuli zisizo za polar hazipaswi.
faharasa
- nafasi ya axial
- eneo katika jiometri ya trigonal bipyramidal ambamo kuna atomi nyingine kwenye angle ya 180° na nafasi za ikweta ziko kwenye angle ya 90°
- dhamana angle
- angle kati ya vifungo yoyote mbili covalent kwamba kushiriki chembe ya kawaida
- umbali wa dhamana
- (pia, urefu wa dhamana) umbali kati ya nuclei ya atomi mbili zilizounganishwa
- dhamana dipole wakati
- kujitenga kwa malipo katika dhamana ambayo inategemea tofauti katika electronegativity na umbali wa dhamana unaowakilishwa na mashtaka ya sehemu au vector
- wakati wa dipole
- mali ya molekuli inayoelezea kujitenga kwa malipo kuamua na jumla ya wakati wa dhamana ya mtu binafsi kulingana na muundo wa Masi
- elektroni-jozi jiometri
- mpangilio karibu na atomi ya kati ya mikoa yote ya wiani wa elektroni (vifungo, jozi lone, au elektroni zisizo na nguvu)
- nafasi ya ikweta
- moja ya nafasi tatu katika jiometri ya bipyramidal ya trigonal yenye pembe 120° kati yao; nafasi za axial ziko kwenye angle ya 90°
- ya mistari
- sura ambayo makundi mawili nje ni kuwekwa kwenye pande tofauti ya atomi ya kati
- muundo wa molekuli
- muundo kuwa ni pamoja na tu uwekaji wa atomi katika molekuli
- octahedral
- sura ambayo makundi sita ya nje huwekwa karibu na atomi ya kati kama vile sura tatu-dimensional huzalishwa na makundi manne kutengeneza mraba na wengine wawili kutengeneza kilele cha piramidi mbili, moja juu na moja chini ya ndege mraba
- molekuli ya polar
- (pia, dipole) molekuli na wakati wa jumla wa dipole
- tetrahedral
- umbo ambalo vikundi vinne vya nje vinawekwa karibu na atomi ya kati kama vile umbo la tatu-dimensional linazalishwa kwa pembe nne na pembe 109.5° kati ya kila jozi na atomu ya kati
- bipyramidal ya trigonal
- umbo ambalo makundi matano ya nje yanawekwa karibu na atomi ya kati kama vile tatu huunda pembetatu gorofa yenye pembe 120° kati ya kila jozi na atomi ya kati, na nyingine mbili huunda kilele cha piramidi mbili, moja juu na moja chini ya ndege ya pembetatu
- mpango wa trigonal
- umbo ambalo vikundi vitatu vya nje vinawekwa katika pembetatu bapa kuzunguka atomu ya kati yenye pembe 120° kati ya kila jozi na atomu ya kati
- valence shell elektroni-jozi repulsion nadharia (VSEPR)
- nadharia kutumika kutabiri pembe dhamana katika molekuli kulingana na mikoa positioning ya wiani high elektroni mbali mbali iwezekanavyo ili kupunguza repulsion umeme
- kiambukizi
- wingi kuwa na ukubwa na mwelekeo


