2.7: Nomenclature ya kemikali
- Page ID
- 182453
- Pata majina kwa aina ya kawaida ya misombo ya isokaboni kwa kutumia mbinu ya utaratibu.
- Eleza jinsi ya kutaja misombo ya covalent binary ikiwa ni pamoja na asidi na oxyacids.
Nomenclature, mkusanyiko wa sheria za kutaja mambo, ni muhimu katika sayansi na katika hali nyingine nyingi. Moduli hii inaelezea mbinu ambayo hutumiwa kutaja misombo rahisi ya ioniki na Masi, kama vile NaCl, CaCO 3, na N 2 O 4. Rahisi ya haya ni misombo ya binary, wale walio na vipengele viwili tu, lakini pia tutazingatia jinsi ya kutaja misombo ionic iliyo na ions polyatomic, na moja maalum, muhimu sana darasa la misombo inayojulikana kama asidi (sura zifuatazo katika maandishi haya zitazingatia haya misombo kwa undani zaidi). Sisi kikomo mawazo yetu hapa kwa misombo isokaboni, misombo ambayo ni linajumuisha hasa ya mambo mengine isipokuwa kaboni, na kufuata miongozo nomenclature mapendekezo na IUPAC. Sheria za misombo ya kikaboni, ambayo kaboni ni kipengele cha kanuni, itatendewa katika sura ya baadaye juu ya kemia ya kikaboni.
Ionic misombo
Ili kutaja kiwanja cha kawaida, tunahitaji kufikiria majibu ya maswali kadhaa. Kwanza, ni ionic kiwanja au Masi? Ikiwa kiwanja ni ionic, je, fomu ya chuma ya aina moja tu (malipo ya kudumu) au zaidi ya aina moja (malipo ya kutofautiana)? Je! Ions ni monatomic au polyatomic? Ikiwa kiwanja ni Masi, je, kina hidrojeni? Ikiwa ndivyo, je, pia ina oksijeni? Kutoka kwa majibu tunayopata, tunaweka kiwanja katika jamii inayofaa na kisha jina hilo ipasavyo. Tutaanza na sheria za majina ya misombo ya ionic.
Misombo yenye Ions Monatomic tu
Jina la kiwanja cha binary kilicho na ioni za monatomiki lina jina la kationi (jina la metali) likifuatiwa na jina la anioni (jina la elementi isiyo na metali na mwisho wake kubadilishwa na suffix — ide). Mifano fulani hutolewa katika Jedwali\(\PageIndex{2}\).
| NaCl, kloridi sodiamu | Na 2 O, oksidi ya sodiamu |
|---|---|
| KBr, bromidi ya potasi | CD, cadmium sulfidi |
| CaI 2, iodidi kalsiamu | Mg 3 N 2, nitridi ya magnesiamu |
| CSF, fluoride ya cesiamu | Ca 3 P 2, phosphide ya kalsiamu |
| LiCl, kloridi ya lithiamu | Al 4 C 3, carbudi ya alumini |
Misombo yenye Ions Polyatomic
Misombo iliyo na ioni za polyatomiki huitwa sawa na yale yaliyo na ioni monatomiki tu, isipokuwa hakuna haja ya kubadili hadi mwisho wa — ide, kwani suffix iko tayari kwa jina la anioni. Mifano ni inavyoonekana katika Jedwali\(\PageIndex{2}\).
CL, kloridi amonia, C a S O subscript 4 calcium sulfate, na M g subscript 3 (P O subscript 4) subscript 2 magnesium phosphate.” data-quail-id="54" data-mt-width="1246">
| KC 2 H 3 O 2, acetate ya potasiamu | (NH 4) Cl, kloridi ya amonia |
|---|---|
| NaHCO 3, bicarbonate ya sodiamu | CaSO 4, sulfate ya kalsiamu |
| Al 2 (CO 3) 3, alumini carbonate | Mg 3 (PO 4) 2, phosphate ya magnesiamu |
Kila siku unakutana na kutumia idadi kubwa ya misombo ya ionic. Baadhi ya misombo hii, wapi hupatikana, na kile kinachotumiwa ni waliotajwa katika Jedwali\(\PageIndex{3}\). Angalia studio au viungo orodha ya bidhaa mbalimbali kwamba matumizi katika siku chache zijazo, na kuona kama wewe kukimbia katika yoyote ya wale katika meza hii, au kupata misombo nyingine ionic kwamba unaweza sasa jina au kuandika kama formula.
| Kiwanja cha Ionic | Jina | Tumia |
|---|---|---|
| NaCl | sodium chloride | chumvi ya kawaida ya meza |
| KI | iodidi ya potasiamu | aliongeza kwa chumvi “iodized” kwa afya ya tezi |
| NaF | sodiamu fluoride | viungo katika dawa ya meno |
| NaHCO 3 | sodium bicarbonate | kuoka soda; kutumika katika kupikia (na katika antacids) |
| Na 2 CO 3 | sodium carbonate | kuosha soda; kutumika katika mawakala kusafisha |
| NaOCl | hypochlorite ya sodiamu | viungo vilivyotumika katika bleach ya kaya |
| caco 3 | calcium carbonate | viungo katika antacids |
| Mg (OH) 2 | hidroksidi magnes | viungo katika antacids |
| Al (OH) 3 | hidroksidi alum | viungo katika antacids |
| NaOH | hidroksidi ya s | lye; kutumika kama safi ya kukimbia |
| K 3 PO 4 | phosphate pot | vidonge vya chakula (madhumuni mengi) |
| MGSO 4 | magnesium sulfate | aliongeza kwa maji yaliyotakaswa |
| Na 2 HPO 4 | hidrojeni phosphate | wakala wa kupambana na caking; kutumika katika bidhaa za unga |
| Na 2 ASA 3 | sulfite ya sodiamu | kihifadhi |
Misombo Zilizo na Ioni ya Chuma na Malipo ya kutofautiana
Wengi wa metali ya mpito inaweza kuunda cations mbili au zaidi na mashtaka tofauti. Misombo ya metali hizi zilizo na nonmetali zinaitwa kwa njia sawa na misombo katika jamii ya kwanza, isipokuwa malipo ya ioni ya chuma huelezwa na namba ya Kirumi katika mabano baada ya jina la chuma. Malipo ya ion ya chuma yanatambuliwa kutoka kwa fomu ya kiwanja na malipo ya anion. Kwa mfano, fikiria misombo ya ionic ya binary ya chuma na klorini. Iron kawaida huonyesha malipo ya aidha 2+au 3+, na kanuni mbili zinazofanana za kiwanja ni FeCl 2 na FeCl 3. Jina rahisi zaidi, “kloridi ya chuma,” litakuwa, katika kesi hii, litakuwa lisilo na maana, kwani halitofautisha kati ya misombo hii miwili. Katika hali kama hii, malipo ya ion ya chuma yanajumuishwa kama namba ya Kirumi katika mabano mara moja kufuatia jina la chuma. Misombo hii miwili ni kisha isiyojulikana kwa jina la chuma (II) kloridi na chuma (III) kloridi, kwa mtiririko huo. Mifano nyingine hutolewa katika Jedwali\(\PageIndex{4}\).
| Transition Metal Ionic Kiwanja | Jina |
|---|---|
| FeCl 3 | chuma (III) kloridi |
| Hg 2 O | zebaki (I) oksidi |
| Go | zebaki (II) oksidi |
| Cu 3 (PO 4) 2 | shaba (II) phosphate |
Nje ya tarehe nomenclature kutumika viambishi — ic na — ous kuteua metali na mashtaka ya juu na chini, kwa mtiririko huo: Iron (III) kloridi, FeCl 3, awali ilikuwa inaitwa feri chloride, na chuma (II) kloridi, FeCl 2, ilikuwa inajulikana kama feri chloride. Ingawa mkataba huu wa kumtaja umetelekezwa kwa kiasi kikubwa na jumuiya ya kisayansi, inabakia kutumika na baadhi ya makundi ya sekta. Kwa mfano, unaweza kuona maneno ya fluoride ya stannous kwenye tube ya dawa ya meno. Hii inawakilisha formula SnF 2, ambayo inaitwa vizuri zaidi ya bati (II) fluoride. Fluoridi nyingine ya bati ni SNF 4, ambayo hapo awali iliitwa fluoride ya stannic lakini sasa inaitwa bati (IV) fluoride.
Jina la misombo ya ionic ifuatayo, ambayo ina chuma ambacho kinaweza kuwa na malipo zaidi ya moja ya ionic:
- Fe 2 S 3
- CuCE
- GaN
- CrCl 3
- Ti 2 (SO 43)
Suluhisho
Anions katika misombo hii zina malipo mabaya ya kudumu (S 2-, Se 2 -, N 3-, Cl -, na\(\ce{SO4^2-}\)), na misombo lazima iwe neutral. Kwa sababu idadi ya mashtaka mazuri katika kila kiwanja lazima iwe sawa na idadi ya mashtaka hasi, ions chanya lazima Fe 3 +, Cu 2 +, Ga 3 +, Cr 3 +, na Ti 3 + . Mashtaka haya hutumiwa katika majina ya ions za chuma:
- chuma (III) sulfidi
- shaba (II) selenide
- nitridi ya galliamu (III)
- chromium (III) kloridi
- titanium (III) sulfate
Andika kanuni za misombo ya ionic ifuatayo:
- chromium (III) phosphide
- zebaki (II) sulfidi
- manganese (II) phosphate
- shaba (I) oksidi
- chromium (VI) fluoride
- Jibu
-
CrP
- Jibu b
-
HGs
- Jibu c
-
Mtu 3 (PRO 24) 2
- Jibu d
-
Cu 2 O
- Jibu e
-
cRF 6
Mwanzoni mwa miaka ya 1990, karani wa faili wa kisheria Erin Brockovich (Kielelezo\(\PageIndex{2}\)) aligundua kiwango cha juu cha magonjwa makubwa katika mji mdogo wa Hinckley, California. Uchunguzi wake hatimaye uliunganisha magonjwa hayo na maji ya chini yaliyochafuliwa na Cr (VI) iliyotumiwa na Pacific Gas & Electric (PG&E) kupambana na kutu katika bomba la gesi asilia jirani. Kama ilivyoigizwa katika filamu Erin Brokovich (ambayo Julia Roberts alishinda Oscar), Erin na mwanasheria Edward Masry walimshtaki PG&E kwa kuchafua maji karibu na Hinckley mwaka 1993. Makazi waliyoyashinda mwaka 1996—$ milioni 333—ilikuwa kiasi kikubwa zaidi kilichowahi tuzo kwa kesi ya hatua ya moja kwa moja nchini Marekani wakati huo.
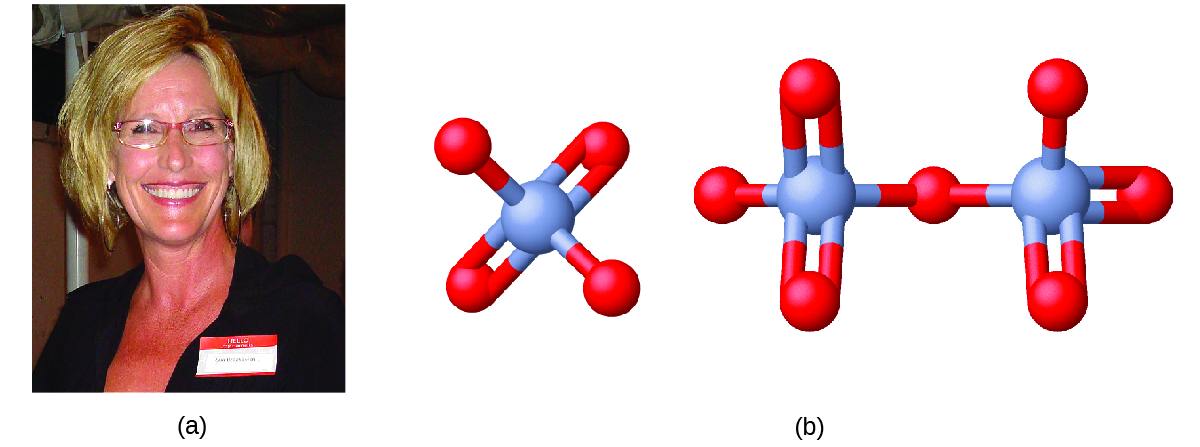
Misombo ya Chromium hutumiwa sana katika sekta, kama vile mipako ya chrome, katika kutengeneza rangi, kama vihifadhi, na kuzuia kutu katika maji ya baridi ya mnara, kama ilivyotokea karibu na Hinckley. Katika mazingira, chromium ipo hasa katika fomu za Cr (III) au Cr (VI). Cr (III), kiungo cha virutubisho vingi vya vitamini na lishe, huunda misombo ambayo haipatikani sana katika maji, na ina sumu kali. Cr (VI), kwa upande mwingine, ni sumu zaidi na hufanya misombo ambayo ni sababu ya mumunyifu katika maji. Mfiduo wa kiasi kidogo cha Cr (VI) unaweza kusababisha uharibifu wa mifumo ya kupumua, utumbo, na kinga, pamoja na figo, ini, damu, na ngozi.
Licha ya jitihada za kusafishwa, uchafuzi wa maji ya chini ya ardhi ya Cr (VI) bado ni tatizo katika Hinckley na maeneo mengine duniani kote. Utafiti wa mwaka 2010 uliofanywa na Kundi la Kazi la Mazingira uligundua kuwa kati ya miji 35 ya Marekani iliyojaribiwa, 31 ilikuwa na viwango vya juu vya Cr (VI) katika maji yao ya bomba kuliko lengo la afya ya umma la sehemu 0.02 kwa bilioni iliyowekwa na Shirika la Ulinzi wa Mazingira la California.
Misombo ya Masi (Covalent)
Tabia za kuunganisha za misombo ya molekuli isiyo ya kawaida ni tofauti na misombo ya ioniki, na huitwa kwa kutumia mfumo tofauti pia. Mashtaka ya cations na anions kulazimisha uwiano wao katika misombo ionic, hivyo kubainisha majina ya ions hutoa taarifa za kutosha kuamua formula kemikali. Hata hivyo, kwa sababu covalent bonding inaruhusu tofauti kubwa katika uwiano mchanganyiko wa atomi katika molekuli, majina ya misombo ya Masi lazima wazi kutambua uwiano huu.
Misombo Inajumuisha Vipengele viwili
Wakati vipengele viwili vya nonmetallic vinaunda kiwanja cha Masi, uwiano wa mchanganyiko kadhaa huwezekana mara nyingi. Kwa mfano, kaboni na oksijeni zinaweza kuunda misombo CO na CO 2. Kwa kuwa hizi ni dutu tofauti zenye tabia tofauti, haziwezi zote mbili kuwa na jina moja (haziwezi kuitwa oksidi kaboni). Ili kukabiliana na hali hii, tunatumia njia ya kumtaja ambayo ni sawa na ile iliyotumiwa kwa misombo ya ioniki, lakini kwa viambishi awali vilivyoongezwa kutaja idadi ya atomi za kila elementi. Jina la elementi ya metali zaidi (moja mbali zaidi upande wa kushoto na/au chini ya meza ya mara kwa mara) ni ya kwanza, ikifuatiwa na jina la elementi isiyo na metali zaidi (moja mbali zaidi kuelekea kulia na/au juu) huku mwisho wake umebadilishwa kuwa kiambishi cha kiambishi — ide. Idadi ya atomi za kila elementi huteuliwa na viambishi awali vya Kigiriki vinavyoonyeshwa katika Jedwali\(\PageIndex{5}\).
| Idadi | Kiambishi awali | Idadi | Kiambishi awali | |
|---|---|---|---|---|
| 1 (wakati mwingine hutolewa) | mono- | 6 | hexa- | |
| 2 | di- | 7 | hepta- | |
| 3 | tri- | 8 | octa- | |
| 4 | tetra- | 9 | nona- | |
| 5 | penta- | 10 | deca- |
Wakati atomi moja tu ya kipengele cha kwanza iko, kiambishi awali mono - kawaida hufutwa kutoka sehemu hiyo. Hivyo,\(\ce{CO}\) inaitwa monoxide kaboni, na\(\ce{CO2}\) inaitwa kaboni dioksidi. Wakati vowels mbili ziko karibu, a katika kiambishi awali cha Kigiriki ni kawaida imeshuka. Baadhi ya mifano mingine ni inavyoonekana katika Jedwali\(\PageIndex{6}\).
| Kiwanja | Jina | Kiwanja | Jina | |
|---|---|---|---|---|
| HIVYO 2 | svaveldioxid | bCl 3 | boroni trichloride | |
| HIVYO 3 | sulfuri trioxide | SF 6 | sulfuri hexafluoride | |
| NO 2 | kaboni ya nitrojeni | PF 5 | fosforasi pentafluoride | |
| KATIKA 2 YA 4 | tetroksidi ya ditrojeni | P 4 HADI 10 | decaoxide ya tetrafosforasi | |
| JUU YA 2 YA 5 | pentoksidi ya dinitrojeni | KAMA 7 | iodini heptafluoride |
Kuna majina machache ya kawaida ambayo utakutana unapoendelea kujifunza kemia yako. Kwa mfano, ingawa NO mara nyingi huitwa oksidi ya nitriki, jina lake sahihi ni monoxide ya nitrojeni. Vilevile, N 2 O inajulikana kama oksidi ya nitrojeni ingawa sheria zetu zingetaja jina la monoksidi ya dinitrojeni. (Na H 2 O kawaida huitwa maji, si monoxide ya dihidrojeni.) Unapaswa kufanya kumbukumbu majina ya kawaida ya misombo unapokutana nao.
Jina la misombo ya covalent ifuatayo:
- SF 6
- KATIKA 2 YA 3
- Cl 2 O 7
- P 4 HADI 6
Suluhisho
Kwa sababu misombo hii inajumuisha tu ya nonmetali, tunatumia viambishi awali kutaja idadi ya atomi za kila elementi:
- sulfuri hexafluoride
- trioksidi ya dinitrojeni
- hepoksidi ya diklorini
- hexoxide ya tetraphosphorus
Andika formula kwa misombo ifuatayo:
- fosforasi pentakloridi
- monoksidi ya dinitrojeni
- iodini heptafluoride
- tetrakloridi kaboni
- Jibu
-
PCL 5
- Jibu b
-
KATIKA 2 YA
- Jibu c
-
KAMA 7
- Jibu d
-
cCl 4
asidi binary
Baadhi ya misombo yenye hidrojeni ni wanachama wa darasa muhimu la vitu vinavyojulikana kama asidi. Kemia ya misombo hii inachunguzwa kwa undani zaidi katika sura za baadaye za maandiko haya, lakini kwa sasa, itatosha kutambua kwamba asidi nyingi hutoa ions hidrojeni, H +, wakati wa kufutwa katika maji. Ili kutaja mali hii ya kemikali tofauti, mchanganyiko wa maji na asidi hupewa jina linalotokana na jina la kiwanja. Ikiwa kiwanja ni asidi ya binary (ikiwemo ya hidrojeni na kipengele kingine cha nonmetallic):
- Neno “hidrojeni” linabadilishwa kuwa kiambishi awali hydro-
- Jina lingine la kipengele lisilo la metali linabadilishwa kwa kuongeza kiambishi - ic
- Neno “asidi” linaongezwa kama neno la pili
Kwa mfano, wakati gesi\(\ce{HCl}\) (hidrojeni hidrojeni) hupasuka katika maji, suluhisho huitwa asidi hidrokloric. Mifano mingine kadhaa ya nomenclature hii inavyoonekana katika Jedwali\(\PageIndex{7}\).
| Jina la Gesi | Jina la Acid |
|---|---|
| HF (g), fluoride ya hidrojeni | HF (aq), asidi hidrofluoriki |
| HCl (g), kloridi hidrojeni | HCl (aq), asidi hidrokloriki |
| HbR (g), bromidi ya hidrojeni | HbR (aq), asidi hydrobromic |
| HI (g), iodidi ya hidrojeni | HI (aq), asidi hidrojeni |
| H 2 S (g), sulfidi hidrojeni | H 2 S (aq), asidi hydrosulfuriki |
Oxyacids
Misombo mingi iliyo na vipengele vitatu au zaidi (kama vile misombo ya kikaboni au misombo ya uratibu) inakabiliwa na sheria maalumu za majina ambazo utajifunza baadaye. Hata hivyo, tutajadili kwa ufupi misombo muhimu inayojulikana kama oxyacids, misombo iliyo na hidrojeni, oksijeni, na angalau kipengele kingine, na imefungwa kwa njia ya kutoa mali tindikali kwa kiwanja (utajifunza maelezo haya katika sura ya baadaye). Oxyacids ya kawaida hujumuisha hidrojeni pamoja na ioni ya polyatomiki, yenye oksijeni. Ili jina la oxyacids:
- Omit “hidrojeni”
- Anza na jina la mizizi ya anion
- Badilisha — tarehe na — barafu, au — tovuti na — yetu
- Ongeza “asidi”
Kwa mfano, fikiria H 2 CO 3 (ambayo unaweza kujaribiwa kuiita “carbonate hidrojeni”). Kwa jina hili kwa usahihi, “hidrojeni” imeachwa; the — wakala wa carbonate hubadilishwa na — ic; na asidi imeongezwa—hivyo jina lake ni asidi kaboni. Mifano mingine hutolewa katika Jedwali\(\PageIndex{8}\). Kuna baadhi ya tofauti kwa njia ya kumtaja kwa ujumla (kwa mfano, H 2 SO 4 inaitwa asidi sulfuriki, si asidi sulfiki, na H 2 SO 3 ni sulfuri, si sulfasi, asidi).
| Mfumo | Jina Anion | Jina la Acid |
|---|---|---|
| HC 2 H 3 O 2 | asetiki | asidi asetiki |
| NO 3 | nitreti | asidi nitriki |
| NO 2 | nitriti | asidi ya nitrous |
| chlo 4 | perchlorate | asidi perchloric |
| H 2 CO 3 | kaboni | asidi kaboni |
| H 2 HIVYO 4 | sulfate | asidi sulfuriki |
| H 2 HIVYO 3 | sulfiti | asidi sulfurasi |
| H 3 PO 4 | fosfati | asidi fosforasi |
Muhtasari
Wataalamu wa dawa hutumia sheria za majina ili kutaja wazi misombo. Misombo ya Ionic na Masi hutajwa kwa kutumia mbinu tofauti-tofauti. Misombo ya ioniki ya binary kawaida hujumuisha chuma na nonmetal. Jina la chuma limeandikwa kwanza, ikifuatiwa na jina la nonmetali na mwisho wake kubadilishwa kuwa — ide. Kwa mfano, K 2 O inaitwa oksidi ya potasiamu. Ikiwa chuma kinaweza kuunda ions na mashtaka tofauti, namba ya Kirumi katika mabano ifuatavyo jina la chuma ili kutaja malipo yake. Hivyo, FeCl 2 ni chuma (II) kloridi na FeCl 3 ni chuma (III) kloridi. Baadhi ya misombo yana ions polyatomic; majina ya ions ya kawaida ya polyatomic yanapaswa kukumbukwa. Misombo ya molekuli inaweza kuunda misombo na uwiano tofauti wa elementi zao, hivyo viambishi awali hutumiwa kutaja idadi ya atomi za kila elementi katika molekuli ya kiwanja. Mifano ni pamoja na SF 6, hexafluoride ya sulfuri, na N 2 O 4, tetroksidi ya dinitrojeni. Acids ni darasa muhimu la misombo iliyo na hidrojeni na kuwa na sheria maalum za majina. Asidi ya binary ni jina kwa kutumia kiambishi awali hydro-, kubadilisha — ide suffix kwa — ic, na kuongeza “asidi;” HCl ni asidi hidrokloriki. Oxyasidi huitwa kwa kubadilisha mwisho wa anioni (-ate kwa — ic, na -ite kwa -ous) na kuongeza “asidi;” H 2 CO 3 ni asidi kaboniki.
faharasa
- asidi binary
- kiwanja kilicho na hidrojeni na kipengele kingine kimoja, kilichounganishwa kwa njia ambayo hutoa mali tindikali kwa kiwanja (uwezo wa kutolewa H + ions wakati kufutwa katika maji)
- binary kiwanja
- kiwanja kilicho na vipengele viwili tofauti.
- oxyacid
- kiwanja kilicho na hidrojeni, oksijeni, na kipengele kingine kimoja, kilichounganishwa kwa njia ambayo hutoa mali tindikali kwa kiwanja (uwezo wa kutolewa H + ions wakati kufutwa katika maji)
- majina
- mfumo wa sheria kwa kumtaja vitu vya riba


