2.6: Misombo ya Masi na Ionic
- Page ID
- 182454
- Eleza misombo ya ionic na Masi (covalent)
- Kutabiri aina ya kiwanja kilichoundwa kutoka kwa vipengele kulingana na eneo lao ndani ya meza ya mara kwa mara
- Kuamua formula kwa misombo rahisi ya ionic
Katika athari za kawaida za kemikali, kiini cha kila atomi (na hivyo utambulisho wa elementi) bado haubadilika. Electroni, hata hivyo, zinaweza kuongezwa kwa atomi kwa uhamisho kutoka atomi nyingine, kupotea kwa uhamisho wa atomi nyingine, au kushirikiana na atomi nyingine. Uhamisho na ugawaji wa elektroni kati ya atomi hutawala kemia ya elementi. Wakati wa malezi ya misombo fulani, atomi hupata au kupoteza elektroni, na huunda chembe za kushtakiwa kwa umeme zinazoitwa ions (Kielelezo\(\PageIndex{1}\)).
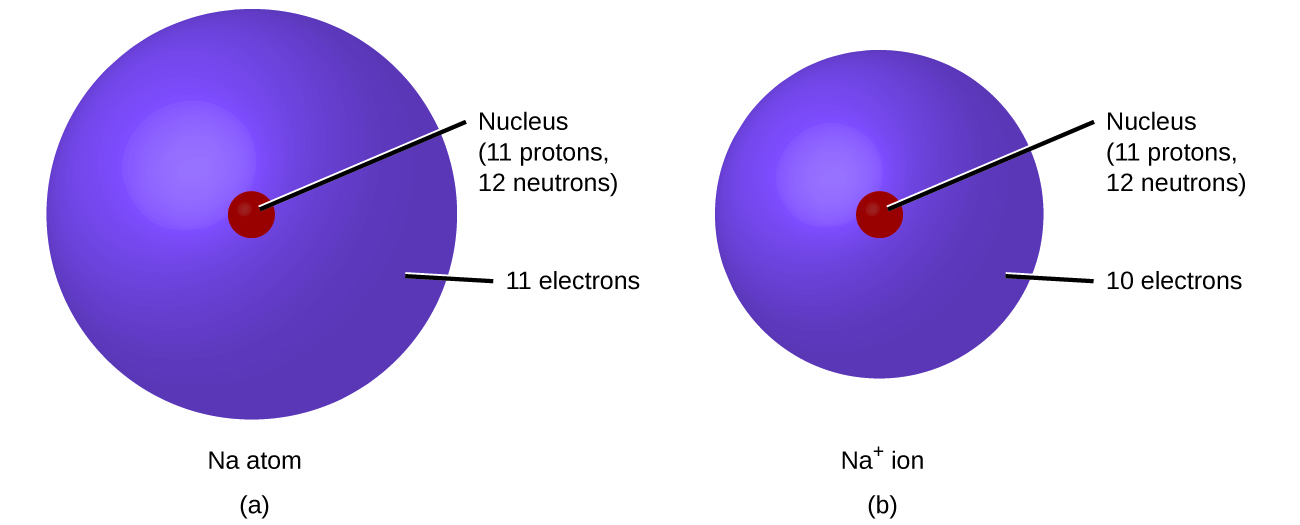
Unaweza kutumia meza ya mara kwa mara kutabiri kama atomu itaunda anion au cation, na unaweza mara nyingi kutabiri malipo ya ion kusababisha. Atomi za metali nyingi za kundinyota kuu hupoteza elektroni za kutosha kuziacha na idadi sawa ya elektroni kama atomu ya gesi yenye heshima iliyotangulia. Kwa mfano, atomi ya chuma cha alkali (kikundi 1) inapoteza elektroni moja na huunda cation na malipo ya 1+; chuma cha alkali cha ardhi (kikundi cha 2) kinapoteza elektroni mbili na huunda cation yenye malipo ya 2+, na kadhalika. Kwa mfano, atomi ya kalsiamu ya neutral, yenye protoni 20 na elektroni 20, hupoteza elektroni mbili kwa urahisi. Hii inasababisha mawasiliano yenye protoni 20, elektroni 18, na malipo ya 2+. Ina idadi sawa ya elektroni kama atomi za gesi yenye heshima iliyotangulia, argoni, na inaashiria Ca 2 +. Jina la ion ya chuma ni sawa na jina la atomi ya chuma ambayo hutengeneza, hivyo Ca 2 + inaitwa ion ya kalsiamu.
Wakati atomi za elementi zisizo za metali zinaunda ioni, kwa ujumla hupata elektroni za kutosha kuwapa idadi sawa ya elektroni kama atomu ya gesi inayofuata yenye heshima katika meza ya mara kwa mara. Atomi za kikundi 17 hupata elektroni moja na huunda anioni kwa chaji 1-; atomi za kikundi 16 hupata elektroni mbili na kuunda ioni zenye chaji 2- na kadhalika. Kwa mfano, atomu ya bromini isiyo na upande wowote, yenye protoni 35 na elektroni 35, inaweza kupata elektroni moja ili kuipatia elektroni 36. Hii inasababisha anion yenye protoni 35, elektroni 36, na malipo ya 1. Ina idadi sawa ya elektroni kama atomi za gesi inayofuata yenye heshima, kryptoni, na inaashiria Br -. (Mjadala wa nadharia inayounga mkono hadhi ya Maria ya namba za elektroni za gesi yenye heshima yalijitokeza katika sheria hizi za uingizaji kwa ajili ya malezi ya ioni hutolewa katika sura ya baadaye ya maandishi haya.)
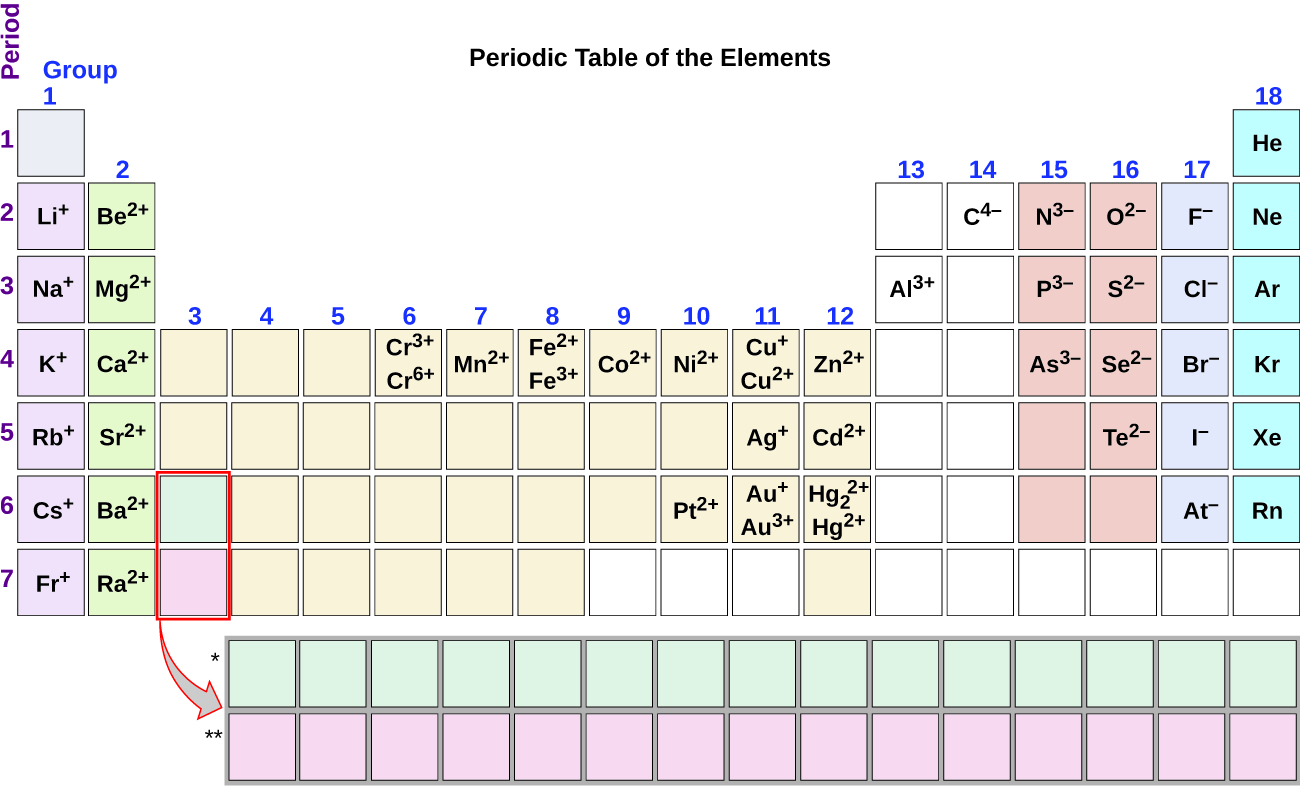
Kumbuka manufaa ya meza ya mara kwa mara katika kutabiri uwezekano wa malezi ya ion na malipo (Kielelezo\(\PageIndex{2}\)). Kuhamia kutoka upande wa kushoto kwenda kulia kwenye meza ya mara kwa mara, vipengele vya kikundi kuu huwa na kuunda cations na malipo sawa na nambari ya kikundi. Hiyo ni, vipengele vya kikundi 1 huunda ions 1+; vipengele vya kikundi 2 huunda ions 2+, na kadhalika. Kuhamia kutoka upande wa kulia kwenda kushoto kwenye meza ya mara kwa mara, vipengele mara nyingi huunda anions na malipo mabaya sawa na idadi ya vikundi vilivyohamia kushoto kutoka gesi nzuri. Kwa mfano, elementi za kikundi 17 (kikundi kimoja kilichoachwa na gesi nzuri) huunda ions 1; elementi za kikundi 16 (makundi mawili kushoto) huunda ions 2, na kadhalika. Mwelekeo huu unaweza kutumika kama mwongozo katika matukio mengi, lakini thamani yake ya uingizaji hupungua wakati wa kusonga kuelekea katikati ya meza ya mara kwa mara. Kwa kweli, metali ya mpito na metali nyingine mara nyingi huonyesha mashtaka ya kutofautiana ambayo hayatabiriki na eneo lao katika meza. Kwa mfano, shaba inaweza kuunda ions na malipo ya 1+ au 2+, na chuma inaweza kuunda ions na malipo ya 2+ au 3+.
Ioni inayopatikana katika baadhi ya misombo inayotumiwa kama antiperspirants ina protoni 13 na elektroni 10. Ishara yake ni nini?
Suluhisho
Kwa sababu idadi ya protoni bado haibadilika wakati atomu inaunda ioni, namba atomia ya elementi lazima iwe 13. Kujua hii inatuwezesha kutumia meza ya mara kwa mara kutambua kipengele kama Al (alumini). Atomu ya Al imepoteza elektroni tatu na hivyo ina mashtaka matatu mazuri zaidi (13) kuliko iliyo na elektroni (10). Hii ni cation alumini, Al 3 +.
Kutoa ishara na jina kwa ion na protoni 34 na elektroni 36.
- Jibu
-
Se 2 -, ioni ya selenide
Magnesiamu na nitrojeni huguswa ili kuunda kiwanja cha ionic. Kutabiri ambayo huunda anion, ambayo huunda cation, na mashtaka ya kila ion. Andika ishara kwa kila ion na uwaita jina.
Suluhisho
Msimamo wa magnesiamu katika meza ya mara kwa mara (kikundi 2) inatuambia kuwa ni chuma. Vyuma huunda ions chanya (cations). Atomu ya magnesiamu lazima ipoteze elektroni mbili ili kuwa na elektroni za namba sawa kama atomu ya gesi yenye heshima iliyotangulia, neon. Hivyo, atomi ya magnesiamu itaunda cation na elektroni mbili chache kuliko protoni na malipo ya 2+. Ishara ya ion ni Mg 2 +, na inaitwa ioni ya magnesiamu.
Msimamo wa Nitrogen katika meza ya mara kwa mara (kikundi 15) inaonyesha kuwa ni nonmetal. Nonmetals huunda ions hasi (anions). Atomu ya nitrojeni inapaswa kupata elektroni tatu kuwa na idadi sawa ya elektroni kama atomu ya gesi yenye heshima inayofuata, neon. Hivyo, atomu ya nitrojeni itaunda anioni yenye elektroni tatu zaidi kuliko protoni na chaji ya 3-. Ishara ya ioni ni N 3-, na inaitwa ioni ya nitridi.
Aluminium na kaboni huguswa ili kuunda kiwanja cha ionic. Kutabiri ambayo huunda anion, ambayo huunda cation, na mashtaka ya kila ion. Andika ishara kwa kila ion na uwaita jina.
- Jibu
-
Wote wataunda cation na malipo ya 3+: Al 3 +, chuma cha alumini. Carbon itaunda anion yenye malipo ya 4 - C 4 -, ioni ya CARBIDE.
Ions ambazo tumejadiliwa hadi sasa zinaitwa ions za monatomiki, yaani, ni ions zilizoundwa kutoka atomi moja tu. Pia tunapata ions nyingi za polyatomiki. Ions hizi, ambazo hufanya kama vitengo vya kipekee, ni molekuli za kushtakiwa kwa umeme (kikundi cha atomi zilizounganishwa na malipo ya jumla). Baadhi ya ions muhimu zaidi ya polyatomic zimeorodheshwa katika Jedwali\(\PageIndex{1}\). Oxyanions ni ioni za polyatomiki ambazo zina atomi moja au zaidi ya oksijeni. Kwa hatua hii katika utafiti wako wa kemia, unapaswa kukariri majina, formula, na mashtaka ya ions ya kawaida ya polyatomic. Kwa sababu utatumia mara kwa mara, hivi karibuni watafahamu.
| Jina | Mfumo | Asidi zinazohusiana | Mfumo |
|---|---|---|---|
| amonia | \(\ce{NH4+}\) | ||
| hidroniamu | \(\ce{H_3O^+}\) | ||
| oksidi | \(\ce{O^{2-}}\) | ||
| peroksidi | \(\ce{O_2^{2-}}\) | ||
| hydroxide | \(\ce{OH^-}\) | ||
| asetiki | \(\ce{CH_3COO^-}\) | asidi asetiki | \(\ce{CH_3COOH}\) |
| sianidi | \(\ce{CN^-}\) | asidi hydrocyanic | \(\ce{HCN}\) |
| azide | \(\ce{N_3^-}\) | asidi hydrazoic | \(\ce{HN_3}\) |
| kaboni | \(\ce{CO_3^{2-}}\) | asidi kaboni | \(\ce{H_2CO_3}\) |
| bikabonati | \(\ce{HCO_3^-}\) | ||
| nitreti | \(\ce{NO_3^-}\) | asidi ya nitriki | \(\ce{HNO_3}\) |
| nitriti | \(\ce{NO_2^-}\) | asidi ya nitrous | \(\ce{HNO_2}\) |
| sulfate | \(\ce{SO_4^{2-}}\) | asidi sulfuriki | \(\ce{H_2SO_4}\) |
| sulfate ya hid | \(\ce{HSO_4^-}\) | ||
| sulfiti | \(\ce{SO_3^{2-}}\) | asidi sulfurasi | \(\ce{H_2SO_3}\) |
| sulfite hidrojeni | \(\ce{HSO_3^-}\) | ||
| fosfati | \(\ce{PO_4^{3-}}\) | asidi fosforasi | \(\ce{H_3PO_4}\) |
| phosphate hid | \(\ce{HPO_4^{2-}}\) | ||
| dihidrojeni phosphat | \(\ce{H_2PO_4^-}\) | ||
| perchlorate | \(\ce{ClO_4^-}\) | asidi perchloric | \(\ce{HClO_4}\) |
| kloreti | \(\ce{ClO_3^-}\) | asidi ya kloriki | \(\ce{HClO_3}\) |
| kloriti | \(\ce{ClO_2^-}\) | asidi ya kloroni | \(\ce{HClO_2}\) |
| haipokloraiti | \(\ce{ClO^-}\) | asidi hypochlorous | \(\ce{HClO}\) |
| chromate | \(\ce{CrO_4^{2-}}\) | asidi ya chromic | \(\ce{H_2CrO_4}\) |
| dikromati | \(\ce{Cr_2O_7^{2-}}\) | asidi dichromic | \(\ce{H_2Cr_2O7}\) |
| permanganate | \(\ce{MnO_4^-}\) | asidi ya permanganiki | \(\ce{HMnO_4}\) |
Kumbuka kuwa kuna mfumo wa kumtaja baadhi ioni za polyatomiki; -ate na -ite ni viambishi vinavyotaja ioni za polyatomiki zenye atomi zaidi au chache za oksijeni. Kwa - (fupi kwa “mfumuko”) na hypo- (maana yake “chini”) ni viambishi awali vinavyomaanisha atomi za oksijeni zaidi kuliko -ate na atomi chache za oksijeni kuliko -ite, mtawalia. Kwa mfano, perchlorate ni\(\ce{ClO4-}\), kloreti ni\(\ce{ClO3-}\), chlorite ni\(\ce{ClO2-}\) na hypochlorite ni ClO -. Kwa bahati mbaya, idadi ya atomi oksijeni sambamba na suffix fulani au kiambishi awali si thabiti; kwa mfano, nitrati ni\(\ce{NO3-}\) wakati sulfate ni\(\ce{SO4^{2-}}\). Hii itafunikwa kwa undani zaidi katika moduli inayofuata kwenye utaratibu wa majina.
Hali ya vikosi vya kuvutia vinavyoshikilia atomi au ioni pamoja ndani ya kiwanja ni msingi wa kuainisha ushirikiano wa kemikali. Wakati elektroni zinahamishwa na ions huunda, vifungo vya ionic husababisha. Vifungo vya Ionic ni nguvu za umeme za kivutio, yaani, nguvu za kuvutia zinazopatikana kati ya vitu vya malipo ya kinyume cha umeme (katika kesi hii, cations na anions). Wakati elektroni ni “pamoja” na molekuli fomu, covalent vifungo matokeo. Vifungo vyema ni vikosi vya kuvutia kati ya viini vyenye kushtakiwa vyema vya atomi zilizounganishwa na jozi moja au zaidi ya elektroni ambazo ziko kati ya atomi. Misombo huwekwa kama ionic au Masi (covalent) kwa misingi ya vifungo vilivyopo ndani yao.
Ionic misombo
Wakati elementi linajumuisha atomi zinazopoteza elektroni kwa urahisi (metali) humenyuka na elementi linajumuisha atomi zinazopata elektroni kwa urahisi (nonmetali), uhamisho wa elektroni hutokea kwa kawaida, huzalisha ions. Kiwanja kilichoundwa na uhamisho huu kimetulia na vivutio vya umeme (vifungo vya ionic) kati ya ions ya malipo kinyume yaliyopo katika kiwanja. Kwa mfano, wakati kila atomu ya sodiamu katika sampuli ya chuma cha sodiamu (kikundi 1) hutoa elektroni moja ili kuunda cation ya sodiamu, Na +, na kila chembe ya klorini katika sampuli ya gesi ya klorini (kikundi 17) hukubali elektroni moja kuunda anion ya kloridi, Cl -, kiwanja kinachosababisha, NaCl, kinaundwa na ions ya sodiamu na ions ya kloridi katika uwiano wa ioni moja Na + kwa kila Cl - ion. Vilevile, kila atomu ya kalsiamu (kikundi cha 2) inaweza kutoa elektroni mbili na kuhamisha moja kwa kila moja ya atomi mbili za klorini ili kuunda CaCl 2, ambayo inajumuisha Ca 2 + na Cl -ions katika uwiano wa ioni moja ya Ca 2 + hadi ioni mbili za Cl - ioni.
Kiwanja kilicho na ions na kinafanyika pamoja na vifungo vya ionic huitwa kiwanja cha ionic. Jedwali la mara kwa mara linaweza kutusaidia kutambua misombo mingi ambayo ni ionic: Wakati chuma kinajumuishwa na nonmetali moja au zaidi, kiwanja ni kawaida ionic. Mwongozo huu kazi vizuri kwa ajili ya utabiri ionic kiwanja malezi kwa zaidi ya misombo kawaida wamekutana katika utangulizi kemia shaka. Hata hivyo, si kweli kila wakati (kwa mfano, kloridi ya alumini, AlCl 3, si ionic).
Unaweza mara nyingi kutambua misombo ya ionic kwa sababu ya mali zao. Misombo ya ioniki ni yabisi ambayo kwa kawaida huyeyuka kwenye joto la juu na kuchemsha kwenye joto la juu zaidi. Kwa mfano, kloridi ya sodiamu inyayeyuka saa 801 °C na majipu saa 1413 °C. (Kwa kulinganisha, maji ya kiwanja cha Masi yanayeyuka saa 0 °C na majipu kwenye 100 °C.) Katika fomu imara, kiwanja cha ioniki hakitumiki umeme kwa sababu ions zake haziwezi kuzunguka (“umeme” ni mtiririko wa chembe za kushtakiwa). Wakati wa kuyeyuka, hata hivyo, inaweza kufanya umeme kwa sababu ions zake zinaweza kuhamia kwa uhuru kupitia kioevu (Kielelezo\(\PageIndex{3}\)).

Katika kila kiwanja cha ionic, idadi ya mashtaka mazuri ya cations sawa na idadi ya mashtaka hasi ya anions. Hivyo, misombo ya ionic ni umeme wa neutral kwa ujumla, ingawa yana ions chanya na hasi. Tunaweza kutumia uchunguzi huu kutusaidia kuandika fomu ya kiwanja cha ionic. Fomu ya kiwanja cha ionic lazima iwe na uwiano wa ions kama idadi ya mashtaka mazuri na hasi ni sawa.
Gemstone samafi (Kielelezo\(\PageIndex{4}\)) ni zaidi kiwanja cha alumini na oksijeni ambayo ina cations alumini, Al 3 +, na anions oksijeni, O 2-. Nini formula ya kiwanja hiki?

Suluhisho Kwa sababu kiwanja cha ionic lazima kiwe na neutral umeme, lazima iwe na idadi sawa ya mashtaka mazuri na hasi. Ioni mbili za alumini, kila mmoja na malipo ya 3+, zitatupa mashtaka sita mazuri, na ioni tatu za oksidi, kila mmoja na malipo ya 2-, zitatupa mashtaka sita hasi. Fomu itakuwa Al 2 O 3.
Kutabiri formula ya kiwanja ionic sumu kati ya cation sodiamu, Na +, na sulfidi anion, S 2-.
- Jibu
-
Na 2 S
Misombo nyingi za ioniki zina ioni za polyatomiki (Jedwali\(\PageIndex{1}\)) kama cation, anion, au vyote viwili. Kama ilivyo kwa misombo rahisi ya ionic, misombo hii lazima pia kuwa umeme neutral, hivyo kanuni zao zinaweza kutabiriwa kwa kutibu ions polyatomic kama vitengo vya kipekee. Tunatumia mabano katika formula kuonyesha kundi la atomi zinazoishi kama kitengo. Kwa mfano, formula ya phosphate ya kalsiamu, moja ya madini katika mifupa yetu, ni Ca 3 (PO 4) 2. Fomu hii inaonyesha kwamba kuna ions tatu za kalsiamu (Ca 2 +) kwa kila\(\left(\ce{PO4^{3-}}\right)\) vikundi viwili vya phosphate. \(\ce{PO4^{3-}}\)Makundi hayo ni vitengo vya kipekee, kila vilivyo na atomi moja ya fosforasi na atomi nne za oksijeni, na kuwa na malipo ya jumla ya 3-. Kiwanja ni umeme neutral, na formula yake inaonyesha jumla ya hesabu ya tatu Ca, P mbili, na nane O atomi.
Poda ya kuoka ina kalsiamu dihidrojeni phosphate, kiwanja ionic linajumuisha ions Ca 2 + na\(\ce{H2PO4-}\). Nini formula ya kiwanja hiki?
Suluhisho
Mashtaka mazuri na mabaya yanapaswa kusawazisha, na kiwanja hiki cha ionic lazima kiwe cha umeme. Kwa hiyo, tunapaswa kuwa na mashtaka mawili hasi ili kusawazisha malipo ya 2+ya ion ya kalsiamu. Hii inahitaji uwiano wa Ca 2 + ioni moja kwa\(\ce{H2PO4-}\) ions mbili. Sisi kuteua hii kwa enclosing formula ya dihydrogen phosphate ion katika mabano na kuongeza subscript 2. Fomu ni Ca (H 2 PO 4) 2.
Kutabiri formula ya kiwanja ionic sumu kati ya ion lithiamu na peroksidi ion,\(\ce{O2^2-}\) (Kidokezo: Tumia meza ya mara kwa mara kutabiri ishara na malipo ya ion lithiamu.)
- Jibu
-
Li 2 O 2
Kwa sababu kiwanja cha ioniki hakijumuishwa na molekuli moja, isiyo ya kawaida, haiwezi kuonyeshwa vizuri kwa kutumia formula ya Masi. Badala yake, misombo ya ionic lazima ionyeshe na formula inayoonyesha idadi ya jamaa ya ions zake zilizojitokeza. Kwa misombo iliyo na ioni za monatomiki tu (kama NaCl) na kwa misombo mingi iliyo na ioni za polyatomiki (kama vile CaSO 4), fomula hizi ni fomula tu za upimaji zilizoanzishwa mapema katika sura hii. Hata hivyo, formula kwa baadhi ya misombo ionic zenye ions polyatomic si formula empirical. Kwa mfano, kiwanja ioniki oxalate sodiamu inajumuisha Na + na\(\ce{C2O4^2-}\) ions pamoja katika uwiano wa 2:1, na formula yake imeandikwa kama Na 2 C 2 O 4. Subscripts katika formula hii sio nambari ndogo zaidi iwezekanavyo, kwa kuwa kila mmoja anaweza kugawanywa na 2 ili kutoa formula ya empirical, NaCO 2. Hii sio formula iliyokubaliwa kwa oxalate ya sodiamu, hata hivyo, kwa kuwa haiwakilishi kwa usahihi anion ya polyatomic ya kiwanja,\(\ce{C2O4^2-}\).
Misombo ya Masi
Misombo mingi haina ions lakini badala yake inajumuisha tu ya molekuli za kipekee, zisizo na neutral. Misombo hii ya Masi (misombo ya covalent) husababisha wakati atomi zinashiriki, badala ya kuhamisha (kupata au kupoteza), elektroni. Bonding covalent ni dhana muhimu na ya kina katika kemia, na itakuwa kutibiwa kwa undani zaidi katika sura ya baadaye ya maandishi haya. Mara nyingi tunaweza kutambua misombo ya Masi kwa misingi ya mali zao za kimwili. Katika hali ya kawaida, misombo ya molekuli mara nyingi huwepo kama gesi, majimaji ya chini ya kuchemsha, na yabisi ya kiwango cha chini, ingawa tofauti nyingi muhimu zipo.
Wakati misombo ya ionic kawaida hutengenezwa wakati chuma na nonmetal kuchanganya, misombo ya covalent kawaida huundwa na mchanganyiko wa nonmetals. Hivyo, meza ya mara kwa mara inaweza kutusaidia kutambua mengi ya misombo ambayo ni covalent. Wakati tunaweza kutumia nafasi za vipengele vya kiwanja katika meza ya mara kwa mara ili kutabiri kama ni ionic au covalent katika hatua hii katika utafiti wetu wa kemia, unapaswa kuwa na ufahamu kwamba hii ni mbinu rahisi sana ambayo haina akaunti kwa idadi ya tofauti ya kuvutia. Shades ya kijivu ipo kati ya misombo ya ionic na Masi, na utajifunza zaidi kuhusu wale baadaye.
Kutabiri kama misombo ifuatayo ni ionic au Masi:
- KI, kiwanja kutumika kama chanzo cha iodini katika chumvi meza
- H 2 O 2, bleach na disinfectant peroxide hidrojeni
- ChCl 3, chloroform ya anesthetic
- Li 2 CO 3, chanzo cha lithiamu katika antidepressants
Suluhisho
- Potasiamu (kikundi 1) ni metali, na iodini (kikundi 17) ni nonmetali; KI inatabiriwa kuwa ioniki.
- Hidrojeni (kikundi 1) ni nonmetali, na oksijeni (kundi 16) ni nonmetali; H 2 O 2 inatabiriwa kuwa masi.
- Kaboni (kundi 14) ni nonmetali, hidrojeni (kundi 1) ni nonmetali, na klorini (kundi 17) ni nonmetali; ChCl 3 inatabiriwa kuwa Masi.
- Lithiamu (kikundi 1) ni chuma, na carbonate ni ioni ya polyatomiki; Li 2 CO 3 inatabiriwa kuwa ioniki.
Kutumia meza ya mara kwa mara, kutabiri kama misombo ifuatayo ni ionic au covalent:
- HIVYO 2
- CaF 2
- N 2 H 4
- Al 2 (SO 4) 3
- Jibu
-
molekuli
- Jibu b
-
ioniki
- Jibu c
-
molekuli
- Jibu d
-
ioniki
Muhtasari
Vyuma (hasa zile katika vikundi 1 na 2) huwa na kupoteza idadi ya elektroni ambazo zitawaacha na idadi sawa ya elektroni kama katika gesi yenye heshima iliyotangulia katika jedwali la mara kwa mara. Kwa njia hii, ion yenye kushtakiwa vizuri huundwa. Vilevile, nonmetali (hasa zile zilizo katika makundi 16 na 17, na kwa kiwango kidogo, zile zilizo katika Kundi la 15) zinaweza kupata idadi ya elektroni zinazohitajika ili kutoa atomi na idadi sawa ya elektroni kama katika gesi inayofuata yenye heshima katika jedwali la mara kwa mara. Hivyo, nonmetals huwa na kuunda ions hasi. Ions kushtakiwa vyema huitwa cations, na ions kushtakiwa vibaya huitwa anions. Ions zinaweza kuwa ama monatomiki (zenye atomi moja tu) au polyatomiki (zenye atomi zaidi ya moja).
Misombo iliyo na ions huitwa misombo ya ionic. Misombo ya ioniki kwa ujumla huunda kutoka kwa metali na nonmetali. Misombo isiyo na ions, lakini badala yake inajumuisha atomi zilizounganishwa kwa pamoja katika molekuli (makundi yasiyochajwa ya atomi ambayo hufanya kama kitengo kimoja), huitwa misombo ya covalent. Misombo ya kawaida huunda kutoka kwa nonmetals mbili au zaidi.
faharasa
- dhamana ya covalent
- nguvu ya kuvutia kati ya nuclei ya atomi ya molekuli na jozi ya elektroni kati ya atomi
- kiwanja covalent
- (pia, kiwanja cha Masi) linajumuisha molekuli zinazoundwa na atomi za vipengele viwili au zaidi tofauti
- ionic dhamana
- nguvu ya umeme ya mvuto kati ya ions oppositely kushtakiwa ya kiwanja ionic
- kiwanja cha ionic
- kiwanja linajumuisha cations na anions pamoja katika uwiano, kutoa dutu umeme neutral
- kiwanja cha Masi
- (pia, kiwanja cha covalent) linajumuisha molekuli zilizoundwa na atomi za vipengele viwili au zaidi tofauti
- ioni ya monatomiki
- ion linajumuisha atomi moja
- ioni ya polyatomiki
- ion linajumuisha atomi zaidi ya moja
- oksijeni
- polyatomic anion linajumuisha atomi ya kati Bonded na atomi oksijeni


